福建沿海巨蛎属(Crassostrea)牡蛎的种类及其分布*
2023-12-06于诗奇韩自强陈燕婷郭团玉阙华勇
于诗奇 韩自强 陈燕婷 郭团玉 阙华勇
福建沿海巨蛎属()牡蛎的种类及其分布*
于诗奇1韩自强1陈燕婷2郭团玉3阙华勇1①
(1. 集美大学水产学院 农业农村部东海海水健康养殖重点实验室 福建省水产生物育种与健康养殖工程研究中心 福建厦门 361021; 2. 福建省水产技术推广总站 福建福州 350002; 3. 厦门海洋职业技术学院海洋生物学院 福建厦门 361100)
福建省位于我国东南沿海, 海岸线曲折, 港湾众多, 有多条河流入海, 适宜牡蛎栖息繁衍, 是我国牡蛎资源最丰富的地区之一。迄今关于福建沿海牡蛎种类组成及分布情况的研究报道尚少, 鉴于近20余年福建主要海湾经历了高强度的牡蛎养殖, 有必要了解福建沿海牡蛎自然群体的物种组成和数量占比等自然种质资源状况。基于现场调查取样, 结合采用多重种特异性PCR、ITS2杂交种鉴定和CO I测序共同鉴定福建沿海巨蛎属()牡蛎种类及其分布情况。研究结果表明, 从福建沿海由北至南牡蛎野生种苗海区的19个采样点共960个样品中发现3种巨蛎属牡蛎, 分别是福建牡蛎()、熊本牡蛎()和香港牡蛎(), 并未发现以往报道的近江牡蛎()。其中福建牡蛎(607个)占63.23%、熊本牡蛎(343个)占35.73%、香港牡蛎(10个)占1.04%。除个别采样点外, 福建牡蛎和熊本牡蛎在各采样海区均有分布。香港牡蛎仅在泉州湾河口湿地自然保护区(新发现群体)有少量分布。研究结果揭示的福建沿海地区巨蛎属的物种种类及其分布为后续开展牡蛎遗传多样性分析和遗传分化等种群遗传研究提供了关键基础资料, 为牡蛎种质资源的保护和利用打下重要基础。
牡蛎种类; 巨蛎属; 福建沿海; 多重种特异性PCR; 基于ITS2序列的杂交种鉴定; COI测序
牡蛎属于软体动物门(Mollusca)、双壳纲(Bivalvia)、珍珠贝目(Pterioida)、牡蛎科(Ostreidae), 在我国从北到南沿海均有分布, 其肉味鲜美且具有很高的营养价值。目前在我国得到规模化养殖的牡蛎均来自巨蛎属(), 包括长牡蛎()、福建牡蛎()、香港牡蛎()和熊本牡蛎() (Peng, 2021)。2022中国渔业统计年鉴中福建省牡蛎养殖为211万t, 占全国总产量的36.29%, 位居全国第一(农业农村部渔业渔政管理局等, 2022)。
对物种进行准确鉴定是开展生物学研究和种质资源保护的基础(李琪等, 2021)。由于牡蛎具有广栖性和表型高可塑性等特点, 仅依靠形态学和解剖学手段无法对其进行有效的鉴定(李孝绪等, 1994; 阙华勇等, 2003)。目前应用于牡蛎物种鉴定的分子手段包括: PCR-RFLP鉴定(Cordes, 2008; Li, 2015)、线粒体CO I基因测序(Wang, 2004; Xia, 2009; Liu, 2011; Liu, 2021)、多重种特异性PCR (multiplex species-specific PCR) (Wang, 2008a)和HRM (Wang, 2014; Xu, 2014)等。其中, 线粒体CO I测序是目前牡蛎鉴定最为准确且运用较为广泛的方法, 但需要具备测序条件和一定费用; 多重种特异性PCR方法可通过凝胶电泳快速准确地鉴定出巨蛎属牡蛎的物种, 适用于数量较多的牡蛎样本的鉴定(Wang, 2008b)。此外, Xu等(2014)研究表明熊本牡蛎(♀)和福建牡蛎(♂)存在单向杂交的可能, 而线粒体CO I基因遵循母系遗传, 不能鉴定杂交种, 但核基因ITS2不仅能够用于福建牡蛎和熊本牡蛎杂交种的鉴定, 也可以通过其片段长度多态性对福建牡蛎、熊本牡蛎、香港牡蛎和近江牡蛎()进行物种鉴定(Wang, 2008b; 苏家齐, 2015; Yan, 2018)。相对而言, 针对大批量牡蛎样品, 多重种特异性PCR是兼具准确性和经济性的物种鉴定方法, 而核基因ITS2也是目前鉴定福建牡蛎和熊本牡蛎杂交种最有效的方法。
迄今关于福建沿海牡蛎种类及其分布的研究报道还不多。王海艳(2004)在形态学基础上采用线粒体16S、CO I和核基因28S序列测序的方法对南方牡蛎物种进行了鉴定和聚类分析, 发现福州、莆田和厦门潮下带浅水区为福建牡蛎, 厦门礁石上分布为熊本牡蛎。杜玄等(2009)通过多重种特异性PCR对福建沿海11个地点共327个牡蛎样本鉴定, 发现福建沿海巨蛎属有4种牡蛎分布, 分别是福建牡蛎、熊本牡蛎、香港牡蛎和近江牡蛎。总体上, 以往有关福建省牡蛎种类和分布的研究存在样本量少或者采样点仅涉及福建沿海部分地区(宁德、莆田或厦门) (Wang, 2010, 2013; Li, 2013; Li, 2020), 尚未见到全省沿海大量系统取样进行牡蛎鉴定的研究报道。
近年来随着福建沿海牡蛎养殖产业的迅速发展, 牡蛎苗种的异地迁移养殖愈来愈频繁, 对各海区野生牡蛎资源造成冲击, 而野生种质资源是保障产业特别是种业发展的重要物质基础。目前尚未系统深入地开展福建沿海牡蛎种质资源评估、保护和利用, 为此, 有必要厘清福建沿海地区巨蛎属牡蛎物种组成及其分布规律, 深化对当前巨蛎属牡蛎种质资源认知。本研究在福建沿海系统采集野生苗种的牡蛎, 采用多重种特异性PCR方法进行物种鉴定, 并利用ITS2序列排查牡蛎杂交种。此外, 鉴于在利用多重种特异性PCR方法鉴定牡蛎发现部分福建牡蛎个体出现额外条带, 在各采样点随机挑选30个牡蛎个体进行线粒体CO I序列分析以进一步确认多重种特异性PCR的物种鉴定结果。本研究为后续开展牡蛎群体遗传分析提供了关键基础资料, 为牡蛎种质资源的保护和利用打下重要基础。
1 材料与方法
1.1 样品的采集与固定
在福建沿海由北至南野生苗种栖息区共设置19个牡蛎采样点, 采样位点、采样日期等详细信息见图1和表1。采样时避开大量人工育苗牡蛎养殖区, 经调查选择采集本海区自然附苗生长的牡蛎, 采集随机且不分大小。从每个采样点样品中随机选取50个牡蛎解剖取其闭壳肌, 用95%乙醇固定, 置于–20 °C条件下保存。
1.2 样品形态特征鉴定
观察并记录牡蛎贝壳的各部分特征, 包括壳型、壳硬度、壳厚度、壳表面的颜色、放射肋分布、壳内面颜色、闭壳肌痕颜色等。通过形态特征对牡蛎进行初步鉴定。
1.3 DNA提取与检测
取10~20 mg牡蛎闭壳肌, 使用北京天根生物技术有限公司的海洋动物DNA提取试剂盒提取基因组DNA, 使用超微量分光光度计进行DNA浓度和纯度的检测。DNA产物在–20 °C保存, 用于后续的PCR的扩增。
1.4 PCR扩增与物种鉴定
1.4.1 多重种特异性PCR扩增 利用Wang等(2008a)基于线粒体CO I基因开发的多重种特异性PCR鉴定方法可以快速鉴定巨蛎属牡蛎。多重种特异性PCR共7条引物, 其中两条外引物即CO I基因通用引物LCO1490与HCO2198 (Folmer, 1994), 牡蛎均能扩增出片段在697 bp左右的条带; 5条内引物分别为巨蛎属5种牡蛎的特异性引物(Wang, 2008a), 只有在其目标物种中才能扩增出相应的特异性条带(表2)。使用的PCR反应总体系为25 μL, 两种外引物分别均为0.5 μL, 5种内引物各为0.4 μL, DNA模板为1.5 μL, 2×Taq Master Mix (Vazyme)为12.5 μL, ddH2O补足至25 μL。循环参数设置: 预变性: 95 °C, 5 min; 30个循环(变性: 95 °C, 30 s, 退火: 48 °C, 1 min, 延伸: 70 °C, 1 min); 终延伸: 72 °C, 10 min。PCR产物经1.5%琼脂糖凝胶电泳, 使用凝胶成像仪进行观察PCR产物长度将牡蛎鉴定到种, 拍照并记录分析。
1.4.2 ITS2扩增与杂交种鉴定 ITS2序列扩增所需要的引物序列为5′-TCTCGCCTGATCTGAGGTCG (5.8S forward)和5′-GCAGGACACATTGAACATCG (18S reverse) (Wang, 2008b)。PCR反应体系总体积为20 μL, 其中模板DNA 1 μL, 2×Taq PCR Master Mix (TIANGEN) 10 μL, 正反引物(F/R)各0.5 μL, ddH2O 8 μL。PCR扩增条件为: 95 °C预变性2 min, 之后进行30个循环(95 °C变性1 min, 51 °C复性1 min, 72 °C延伸1 min), 72 °C延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测, 根据ITS2片段长度多态性排查是否存在杂交种。
表1 福建沿海牡蛎样本采样信息

Tab.1 Information of oyster sampling along Fujian coast
表2 5种巨蛎属牡蛎的特异性引物与2种通用外引物序列

Tab.2 Sequences of specific primers and two universal primers of five Crassotrea oysters
1.4.3 CO I序列扩增测序 用CO I通用引物LCO1490和HCO2198进行PCR扩增, PCR反应体系总体积为20 μL, 其中模板DNA 1 μL, 2×Taq PCR Master Mix (TIANGEN) 10 μL, 正反引物(F/R)各0.5 μL, ddH2O为8 μL。反应条件为: 94 °C预变性3 min, 之后进行35个循环(94 °C变性45 s, 48 °C复性45 s, 72 °C延伸45 s), 72 °C延伸10 min。PCR产物经1%的琼脂糖凝胶电泳检测后送至上海生工生物工程有限公司进行测序。利用美国国家生物技术信息中心(National Center for Biotechnology In-formation, NCBI)中的BLAST在线分析比对鉴定牡蛎物种。
1.5 福建牡蛎非特异性条带分析
将多重种特异性PCR鉴定中具有非特异性条福建牡蛎、正常条带的福建牡蛎(ZJ群体)和熊本牡蛎(ZJ群体的牡蛎取样于竹江汐露桥附近海区, 为在名称上清晰区分两种牡蛎, 故将ZJ群体熊本牡蛎简称为XLQ)共30个牡蛎的线粒体CO I基因测序序列, 采用UGENE42.0软件(Okonechnikov, 2012)中Align with Clustalw进行多序列比对, 对线粒体CO I基因中熊本牡蛎种特异性引物设计区域的碱基序列进行分析, 并再次进行多重种特异性PCR和琼脂糖凝胶电泳验证。
2 结果
2.1 形态特征结果
福建沿海巨蛎属牡蛎有3种, 分别为福建牡蛎、熊本牡蛎和香港牡蛎, 其主要形态学特征: 福建牡蛎壳为长型, 壳薄而脆, 左壳凹陷且附着面小, 右壳具有轻微突起, 壳表面呈黄色并带有明显褐色放射肋条纹分布, 壳内面呈白色, 闭壳肌痕褐色或无色; 熊本牡蛎为壳长型, 壳形较福建牡蛎厚且扁, 在右壳表面的边缘有少量的褐色放射褶, 壳内面呈白色, 闭壳肌痕为褐色; 香港牡蛎壳为卵圆形或长型, 壳重而厚, 左壳凹陷呈杯状, 右壳突起, 壳表面无明显放射肋条纹, 右壳边缘具有褐色薄且脆的鳞片, 壳内面呈瓷白色, 闭壳肌痕呈紫色或褐色(图2)。
2.2 PCR扩增与物种鉴定结果
在多重种特异性PCR产物琼脂糖凝胶电泳结果中, PCR产物扩增条带大小697 bp是共有的外引物条带, 其中扩增片段长度为222 bp是福建牡蛎特异性条带; 扩增片段长度为546 bp是熊本牡蛎特异性条带; 扩增片段大小为387 bp是香港牡蛎特异性条带。而本研究在牡蛎鉴定过程中大部分(约75%)的福建牡蛎均出现三条带, 多出一条与熊本牡蛎的特异性条带(546 bp)大小相同条带(图3)。
ITS2序列扩增后经琼脂糖凝胶电泳显示, 福建牡蛎、熊本牡蛎、香港牡蛎的特征性片段分别为670、640、620 bp (图4)。在本研究中960个牡蛎样品均是一条清晰明亮的条带, 未发现熊本牡蛎和福建牡蛎的单向杂交种。
牡蛎线粒体CO I基因测序BLAST比对鉴定结果与多重种特异性PCR结果和ITS2物种鉴定是一致的。
2.3 福建沿海巨蛎属牡蛎种类及分布
对19个采样点共960个牡蛎样品的鉴定结果进行统计分析表明, 福建牡蛎(607个)占63.23%和熊本牡蛎(343个)占35.73% (表3), 香港牡蛎(10)占1.04%。其中福建牡蛎除九龙江角美(JM)采样点外均有分布, 熊本牡蛎除莆田东沃村(DWC)采样点外均有分布, 香港牡蛎仅在泉州湿地保护区洛阳桥(LYQ)采样点具有自然分布。福建沿海19个采样点牡蛎种类及数量统计分析表明, 福鼎市至罗源湾海区福建牡蛎和熊本牡蛎均为优势种。从福清湾到厦门市10个群体中, 泉州市湿地保护区洛阳江(LYQ)熊本牡蛎为优势种, 其他9个群体优势种均为福建牡蛎。漳州市漳浦县北江村(BJ)和沙西(SX)福建牡蛎为优势种外, 其他群体优势种均为熊本牡蛎(图5)。
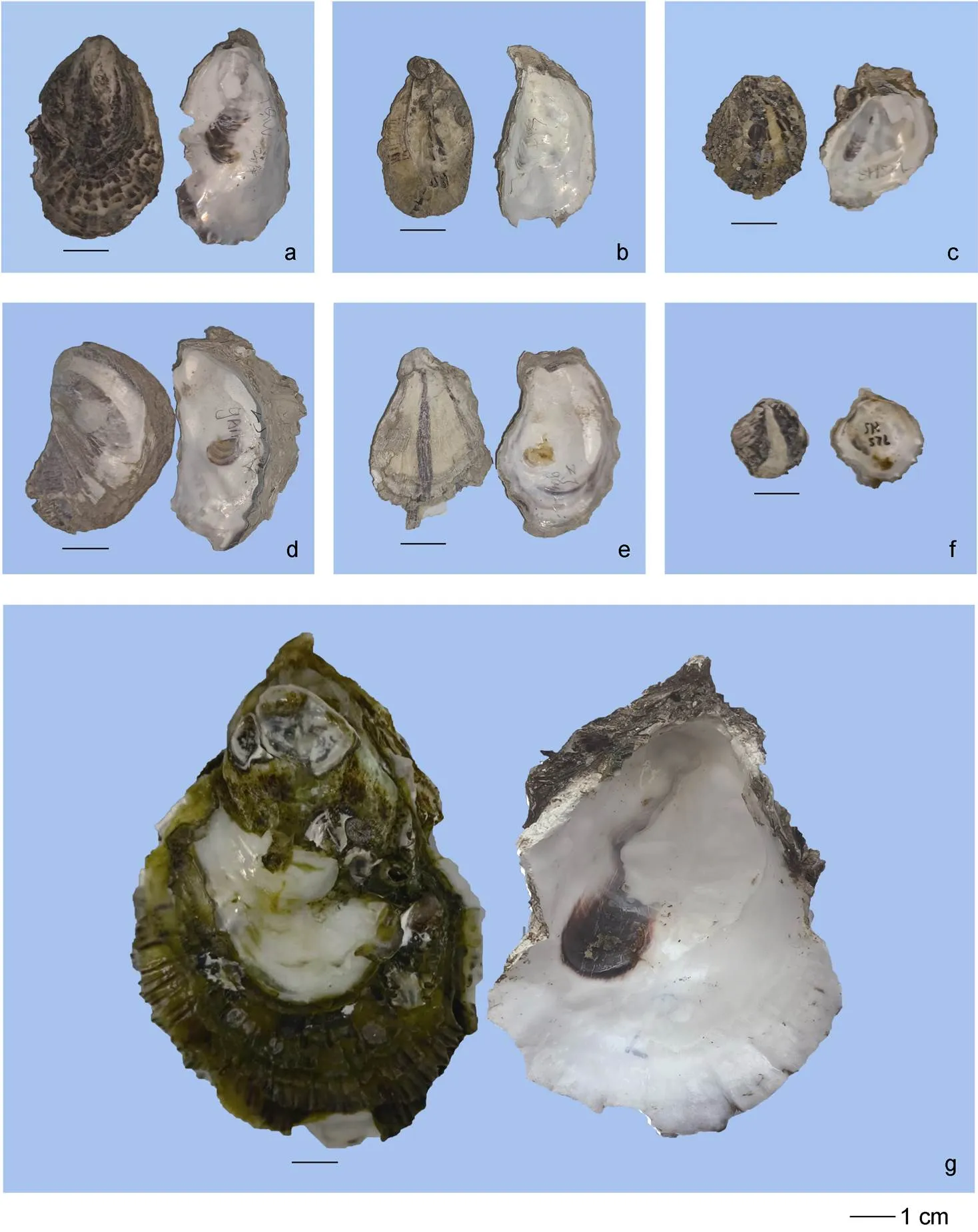
图2 福建沿海3种巨蛎属牡蛎形态特征
注: a~c. 福建牡蛎; d~f. 熊本牡蛎; g. 香港牡蛎

图3 福建沿海巨蛎属牡蛎多重种特异性PCR产物电泳图
注: M. 2000 marker; BC. 空白对照; 1, 4~7. 福建牡蛎; 2, 8~11: 香港牡蛎; 3. 熊本牡蛎
2.4 福建牡蛎多重种特异性PCR出现非特异性条带原因
5种巨蛎属牡蛎线粒体CO I引物设计序列图中, 在熊本牡蛎CO I基因特异性引物设计区(图6a红色虚线框), 福建牡蛎和熊本牡蛎CO I基因序列仅在第1位(A/G)和第7位碱基(T/C)两处碱基不同。图6b是福建宁德竹江群体(ZJ)牡蛎线粒体CO I基因多序列比对图, 发现福建牡蛎线粒体CO Ⅰ片段在熊本牡蛎引物设计区段第7位碱基处具有T和C两种碱基(图6b红色框)。在图6b中随机挑选福建牡蛎个体再次进行多重种特异性PCR扩增验证, 福建牡蛎第7位碱基为C的牡蛎个体具有三条带(ZJ18、ZJ19和ZJ31), 而第7位碱基为T的牡蛎个体仅有两条带(ZJ0、ZJ15) (图6c)。

图4 福建省泉州市LYQ部分样品ITS2的电泳图
注: M. 2000bp marker; 1~6. 香港牡蛎; 7~9, 12. 熊本牡蛎; 10~11. 福建牡蛎
表3 福建沿海19个采样点巨蛎属牡蛎种类及其数量
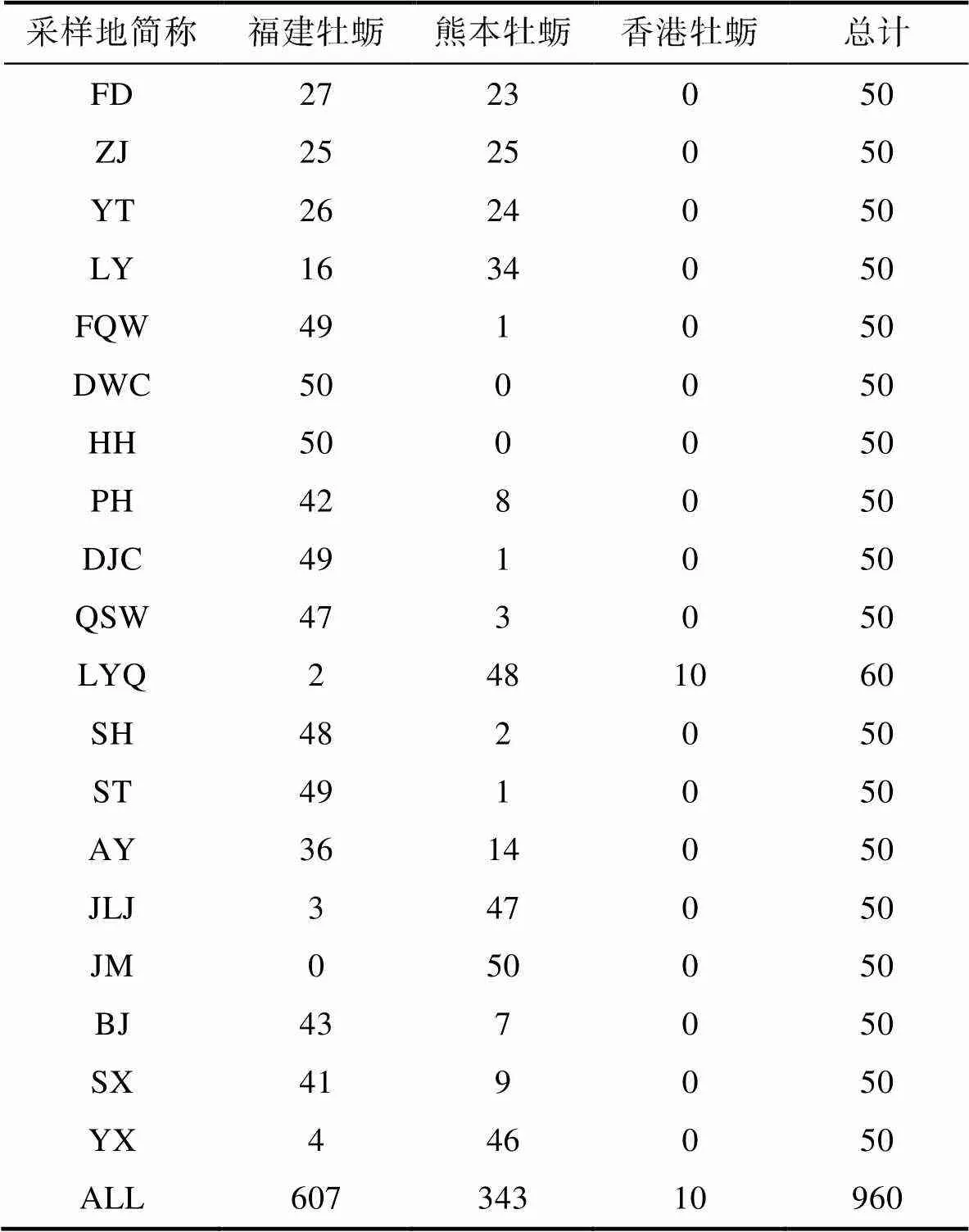
Tab.3 Species identification and the quantity of Crassostrea oysters in 19 sampling sites along Fujian coast

图5 福建沿海各采样点物种丰度图
注: a. 五种巨蛎属牡蛎线粒体CO I引物设计序列图(Wang, 2008a); b. 福建沿海宁德竹江(ZJ)群体部分福建牡蛎和熊本牡蛎CO I序列比对图; c. 福建沿海福建牡蛎宁德竹江群体(ZJ)多重种特异性PCR验证图
3 讨论
3.1 福建沿海巨蛎属牡蛎的种类及分布
本研究通过形态学特征、多重种特异性PCR、ITS2杂交种鉴定和CO I测序发现福建沿海巨蛎属牡蛎有3种, 分别是福建牡蛎、熊本牡蛎和香港牡蛎, 其中福建牡蛎和熊本牡蛎为优势种, 除个别采样点外, 2个物种在各采样海区均有分布。以往研究表明熊本牡蛎常与福建牡蛎在潮间带呈同域分布且规模有限(Peng, 2021), 仅在江苏南通市和浙江沿海发现大量分布的熊本牡蛎(Wang, 2013; Liu, 2021)。本研究在福建沿海泉州市湿地保护区洛阳桥海区(LYQ)、漳州市龙海区角美(JM)和漳州市云霄县漳江长洋村海区(YX)采样点发现了大规模自然分布的熊本牡蛎群体。此外, 在泉州湿地保护区洛阳桥海区(LYQ)发现了香港牡蛎, 而已有研究报道仅在福建沿海九龙江海区发现过香港牡蛎(Li, 2013, 2020), 本研究却仅在九龙江海区发现人工养殖香港牡蛎。经我们实地调研发现LYQ的香港牡蛎是以“插石养殖”的方式, 苗种来自本海区的牡蛎群体, 排除人为“异地苗种”养殖因素, 因此泉州洛阳江海区(LYQ)的香港牡蛎很可能是本地种。
本次研究并未在福建沿海发现自然分布的近江牡蛎。杜玄等(2009)发现在漳州市九龙江海区海门岛和白礁有近江牡蛎的自然分布, 但本研究在九龙江海区相近的2个采样点及其他海区采样点中均未发现近江牡蛎。近江牡蛎曾经在我国有较广泛的分布(张玺等, 1956; Zhou, 2003), 但近年来近江牡蛎野生资源量急剧减少, 仅在北方有零星发现。据报道在我国南方近江牡蛎与香港牡蛎同域分布, 自然采苗的香港牡蛎苗种往往掺杂较多的近江牡蛎苗种, 而养殖户排斥这种含高比例的近江牡蛎的香港牡蛎苗种, 造成对近江牡蛎自然苗种的负向选择(Guo, 1999); 加上过度捕捞、径流减少、环境污染和栖息地破坏等因素, 在过去的几十年里, 野生资源急剧下降, 只在北方有少量局部分布(Li, 2020)。为抢救该种牡蛎资源, 在山东潍坊和江苏省南通市已经建立了2个近江牡蛎种群保护区(Guo, 2009)。我们在福建沿海九龙江海区未发现自然分布的近江牡蛎, 推测一方面可能是由于近年来海区因栖息地的破坏、环境的污染、淡水径流量减少等因素的影响造成九龙江口海区不适宜近江牡蛎的生存(Li, 2020, 2021; Qin, 2022); 另一方面可能是目前福建沿海近江牡蛎数量较少且呈零星分布, 需要更全面细致的采样才能发现近江牡蛎。
3.2 影响福建沿海巨蛎属牡蛎分布的生态与人为因素
本研究发现福建沿海巨牡蛎的分布符合其生态位分布, 其中福建牡蛎位于潮间带及潮下带浅水区, 熊本牡蛎位于潮间带中上层, 香港牡蛎位于潮间带的下层(Quan, 2012; Xu, 2014; Wang, 2020); 但其分布也同时受河流冲淡水和人为因素的影响(Wang, 2015; Moreira, 2016; Pinsky, 2020)。
内陆河流冲淡水是影响物种分布的因素之一。Dong等(2012)研究表明长江冲淡水在潮间带生物之间形成隔离屏障, 提出长江冲淡水隔离假说。Ni等(2012)对蛤蜊的历史冰川作用和长江流出假说的有效性研究表明, 冲淡水对物种的影响取决于生物特征(如盐度和温度耐受性)或栖息地特异性。牡蛎生活在环境变化剧烈河口潮间带区, 而盐度是直接影响牡蛎生存、生长和生理功能的环境因素之一(Yan, 2012)。福建沿海按平均年流量大小的内陆河流冲淡水主要有3条河流, 分别为闽江(1 707 m3/s)、九龙江(368 m3/s)和晋江(184 m3/s), 而内流冲淡水使其河口盐度变化剧烈从而影响牡蛎的分布。研究表明在闽江、九龙江和晋江的河口存在较强的表层盐度锋, 其河口表层多呈明显低盐特性。盐度锋的位置受河流径流量、潮汐和上升流等影响, 闽江和九龙江比晋江对周围海域盐度影响范围广(王伟强等, 2000; 邳青岭等, 2008; 陈小红等, 2009)。据以往研究可知不同牡蛎对盐度的耐受性范围不同, 福建牡蛎存活盐度在10~35, 幼虫适宜存活和生长盐度在25~30 (巫旗生等, 2015; Moreira, 2016); 熊本牡蛎存活盐度在7~35, 幼虫适宜活和生长盐度在20以下(Sekino, 2009; 吕晓燕, 2013); 香港牡蛎存活盐度在5~25, 幼虫适宜活和生长盐度在15~30 (Huo, 2014; Xiao, 2018)。由此可以看出, 熊本牡蛎和香港牡蛎对低盐有较强的适应能力, 适合栖息在与河流径流相关的盐度较低的水域(Hedgecock, 1999)。本研究的泉州湿地保护区洛阳桥海区(LYQ)、漳州九龙江口海区(JLJ)、漳州角美海区(JM)和漳州云霄县漳江口(YX)等3个采样点熊本牡蛎占比均在92%以上, 反映了这3个海区分别受晋江、九龙江和漳江冲淡水的影响, 其表层水域呈明显低盐特性, 有利于耐低盐的熊本牡蛎栖息繁衍。
人为因素也是影响牡蛎分布的原因之一, 福建沿海牡蛎养殖历史悠久, 早在宋朝时即在闽东北以“插竹养蛎”, 闽中以投石等方式养殖牡蛎, 因此福建沿海具备牡蛎自然海区采苗场这一特点。福建沿海牡蛎自然海区采苗场主要分布在闽中沿海地区, 主要有福州市福清湾、莆田市兴化湾、惠安县大港湾、石狮市深沪湾和南安县围头湾(林丹等, 2019)。这些自然海区通常在每年立夏前后开始采苗(5~6月), 而福建牡蛎在自然海区繁殖季节为每年的4~9月, 5月上旬到6月下旬最盛(林丹等, 2019); 熊本牡蛎繁殖期在每年7~10月(邓亚平, 2020)。福建沿海中部主要为福建牡蛎, 究其原因可能是受长期人工自然采苗影响。由于福建沿海中部地区具有自然海区采苗场的特点, 其采苗时间与福建牡蛎繁殖期较为一致, 在长期人工自然选择情况下, 福建牡蛎在福建中部海区对环境和资源的竞争力比熊本牡蛎更具有优势, 成为中部地区优势种。此外, 临近漳江湾的长洋村海区采样点(YX)牡蛎优势种为熊本牡蛎, 位于同一海区临近台湾海峡的沙西群体(SX)优势种却为福建牡蛎, 一方面可能因为沙西群体位于漳江下游且临近外海, 其海区盐度高于漳江上游长洋村采样点, 适宜福建牡蛎生存; 另一方面可能与沙西当地渔民长期采集自然海区福建牡蛎苗种有关。
3.3 多重种特异性PCR鉴定方法的优化
本次研究发现大部分福建牡蛎多重种特异性PCR分析结果产生三条带, 与Wang等(2008a)巨蛎属牡蛎分析鉴定结果不同, 而多出的一条与熊本牡蛎种特异性条带一致, 这与Liu等(2021)在对浙江沿海牡蛎分类鉴定中发现三条带的现象一致, 对福建牡蛎鉴定可能会产生干扰。本研究通过福建牡蛎和熊本牡蛎CO I序列比对发现, 福建牡蛎CO I基因序列在熊本牡蛎特异性引物设计区中位于引物3′末端第7位碱基处存在T和C两种碱基, 虽然Wang等(2008a)在设计熊本牡蛎特异性引物时, 为了提高其引物的特异性在引物3′末端的第2位碱基处加入C替代A的错配(表2), 但由于该引物3′末端(C/T)和加入错配(C/A)均是弱的错配(Newton, 1989; Wangkumhang, 2007), 所以福建牡蛎在熊本牡蛎引物设计序列处3′末端第7位为C时, 在PCR扩增过程中, 由于DNA聚合酶受多种因素影响, 当引物错配未达一定程度是可以扩增的, 其扩增的效率低于与引物完全互补的序列。这与本研究中福建牡蛎产生弱的非特异性条带现象一致。因此, 福建牡蛎在熊本牡蛎设计引物处对应引物3′端第7位碱基的不同, 很可能是福建牡蛎额外产生与熊本牡蛎特异性条带一致的原因。因此, 我们在使用多重种特异性PCR对牡蛎鉴定时, 可以适当调整其引物序列(在3′末端引入强的错配, 如G/A)提高其引物的特异性或优化PCR反应参数抑制非特异性扩增, 以提高该方法鉴定牡蛎物种的准确性。
4 结论与展望
本研究发现福建沿海地区巨蛎属牡蛎共3种, 分别是福建牡蛎、熊本牡蛎和香港牡蛎, 其中福建牡蛎与熊本牡蛎为优势种。本研究在泉州湿地保护区洛阳江(LYQ)发现自然分布的香港牡蛎, 但在九龙江口并未发现自然分布的香港牡蛎。此外, 本研究在福建沿海未发现自然分布的近江牡蛎。牡蛎分布的影响不仅与其生态习性有关, 也受到河流冲淡水和海区人工采苗等因素影响。未来开展福建沿海野生牡蛎分布规律的研究, 牡蛎采样点的系统设置是至关重要的一点, 必须考虑到潮位等垂直分布因素、冲淡水影响范围以及海区人工采苗的历史与现状等。未来的研究应关注主要经济物种在福建沿海分布的各野生群体的遗传多样性与遗传分化, 评估高强度人工养殖是否对野生种质资源多样性造成负面影响, 为开展福建省牡蛎野生种质资源的规划和保护提供基础资料。
王伟强, 张远辉, 黄自强, 2000. 九龙江口-厦门港河口盐度锋面的特征[J]. 台湾海峡, 19(1): 82-88.
王海艳, 2004. 中国近海常见牡蛎分子系统演化和分类的研究[D]. 青岛: 中国科学院研究生院(海洋研究所): 94-95.
邓亚平, 2020. 熊本牡蛎()微卫星标记开发, 野生及养殖群体遗传多样性分析[D]. 重庆: 重庆师范大学: 1-2.
吕晓燕, 2013. 熊本牡蛎人工繁育与长牡蛎单体苗种培育技术研究[D]. 青岛: 中国海洋大学: 33-34.
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2022. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社: 27.
苏家齐, 2015. 葡萄牙牡蛎与熊本牡蛎、僧帽牡蛎的种间杂交研究[D]. 青岛: 中国海洋大学: 50-51.
杜玄, 郭希明, 钱鲁闽, 2009. 福建沿海巨蛎属牡蛎的主要种类及其分布[J]. 台湾海峡, 28(3): 399-404.
巫旗生, 曾志南, 宁岳, 等, 2015. 葡萄牙牡蛎工厂化人工育苗技术[J]. 福建水产, 37(5): 399-405.
李孝绪, 齐钟彦, 1994. 中国牡蛎的比较解剖学及系统分类和演化的研究[J]. 海洋科学集刊(35): 143-178.
李琪, 冉轲, 孔令锋, 2021. DNA条形码技术及其在海洋贝类种质资源保护中的应用[J]. 中国海洋大学学报, 51(5): 18-23.
邳青岭, 胡建宇, 陈照章, 等, 2008. 2006年8月下旬福建沿海表层温、盐度分析[J]. 台湾海峡, 27(4): 515-520.
张玺, 楼子康, 1956. 中国牡蛎的研究[J]. 动物学报, 5(1): 65-94.
陈小红, 胡建宇, 邳青岭, 等, 2009. 厦门—泉州近岸海域海表温、盐度密集走航观测[J]. 地球科学进展, 24(6): 629-635.
林丹, 孙敏秋, 张克烽, 等, 2019. 福建牡蛎产业发展形势分析[J]. 中国水产(3): 53-57.
阙华勇, 刘晓, 王海艳, 等, 2003. 中国近海牡蛎系统分类研究的现状和对策[J]. 动物学杂志, 38(4): 110-113.
CORDES J F, XIAO J, REECE K S, 2008. Discrimination of nineoyster species based upon restriction fragment- length polymorphism analysis of nuclear and mitochondrial DNA markers [J]. Journal of Shellfish Research, 27(5): 1155-1161.
DONG Y W, WANG H S, HAN G D,, 2012. The impact of Yangtze River discharge, ocean currents and historical events on the biogeographic pattern ofalong the China coast [J]. PLoS One, 7(4): e36178.
FOLMER O, BLACK M, HOEH W,, 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates [J]. Molecular Marine Biology and Biotechnology, 3(5): 294-299.
GUO X M, 2009. Use and exchange of genetic resources in molluscan aquaculture [J]. Reviews in Aquaculture, 1(3/4): 251-259.
GUO X M, FORD S E, ZHANG F S, 1999. Molluscan aquaculture in China [J]. Journal of Shellfish Research, 18(1): 19-31.
HEDGECOCK D, LI G, BANKS M A,, 1999. Occurrence of the Kumamoto oysterin the Ariake Sea, Japan [J]. Marine Biology, 133(1): 65-68.
HUO Z M, WANG Z P, LIANG J,, 2014. Effects of salinity on embryonic development, survival, and growth of[J]. Journal of Ocean University of China, 13(4): 666-670.
LI A, DAI H, GUO X M,, 2021. Genome of the estuarine oyster provides insights into climate impact and adaptive plasticity [J]. Communications Biology, 4(1): 1287.
LI A, WANG C G, WANG W,, 2020. Molecular and fitness data reveal local adaptation of southern and northern estuarine oysters () [J]. Frontiers in Marine Science, 7: 589099.
LI S, LI Q, YU H,, 2015. Genetic variation and population structure of the Pacific oysterin the northwestern Pacific inferred from mitochondrial COI sequences [J]. Fisheries Science, 81(6): 1071-1082.
LI L, WU X Y, YU Z N, 2013. Genetic diversity and substantial population differentiation inrevealed by mitochondrial DNA [J]. Marine Genomics, 11: 31-37.
LIU J, LI Q, KONG L F,, 2011. Identifying the true oysters (Bivalvia: Ostreidae) with mitochondrial phylogeny and distance‐based DNA barcoding [J]. Molecular Ecology Resources, 11(5): 820-830.
LIU S, XUE Q G, XU H Q,, 2021. Identification of main oyster species and comparison of their genetic diversity in Zhejiang coast, south of Yangtze river estuary [J]. Frontiers in Marine Science, 8: 662515.
MOREIRA A, FIGUEIRA E, SOARES A M VM,, 2016. Salinity influences the biochemical response ofto Arsenic [J]. Environmental Pollution, 214: 756-766.
NEWTON C R, GRAHAM A, HEPTINSTALL L F,, 1989. Analysis of any point mutation in DNA. The amplification refractory mutation system (ARMS) [J]. Nucleic Acids Research, 17(7): 2503-2516.
NI G, LI Q, KONG L F,, 2012. Phylogeography of bivalve: testing the historical glaciations and Changjiang River outflow hypotheses in northwestern Pacific [J]. PLoS One, 7(11): e49487.
OKONECHNIKOV K, GOLOSOVA O, FURSOV M,2012. Unipro UGENE: a unified bioinformatics toolkit [J]. Bioinformatics, 28(8): 1166-1167.
PENG D M, ZHANG S C, ZHANG H Z,, 2021. The oyster fishery in China: Trend, concerns and solutions [J]. Marine Policy, 129: 104524.
PINSKY M L, SELDEN R L, KITCHEL Z J, 2020. Climate-driven shifts in marine species ranges: Scaling from organisms to communities [J]. Annual Review of Marine Science, 12: 153-179.
QIN Y P, LIAO Q L, SHI G P Y,, 2022. Comparison of growth, survival and fertility of the southern and northern populations ofand their hybrids in southern China [J]. Aquaculture, 549: 737-744.
QUAN W M, HUMPHRIES A T, SHEN X Q,, 2012. Oyster and associated benthic macrofaunal development on a created intertidal oyster () reef in the Yangtze River estuary, China [J]. Journal of Shellfish Research, 31(3): 599-610.
SEKINO M, 2009. In search of the Kumamoto oyster(Amemiya, 1928) based on molecular markers: is the natural resource at stake? [J]. Fisheries Science, 75(4): 819-831.
WANG T N, FAN R L, CHENG Q Q,, 2020. Intertidal zonation of the suminoe oysterand the Kumamoto Oysteron the coast of the Northern East China Sea [J]. Journal of Shellfish Research, 39(1): 31-41.
WANG H Y, GUO X M, 2008a. Identification ofand related oysters by multiplex species-specific PCR [J]. Journal of Shellfish Research, 27(3): 481-487.
WANG Y P, GUO X M, 2008b. ITS length polymorphism in oysters and its use in species identification [J]. Journal of Shellfish Research, 27(3): 489-493.
WANG H Y, GUO X M, ZHANG G F,, 2004. Classification of jinjiang oysters(Gould, 1861) from China, based on morphology and phylogenetic analysis [J]. Aquaculture, 242(1/2/3/4): 137-155.
WANG H Y, QIAN L M, LIU X,, 2010. Classification of a common cupped oyster from southern China [J]. Journal of Shellfish Research, 29(4): 857-866.
WANG H Y, QIAN L M, WANG A M,, 2013. Occurrence and distribution of(Amemiya 1928) in China [J]. Journal of Shellfish Research, 32(2): 439-446.
WANG J, TSANG L M, DONG Y W, 2015. Causations of phylogeographic barrier of some rocky shore species along the Chinese coastline [J]. BMC Evolutionary Biology, 15: 114.
WANG J F, XU F, LI L,, 2014. A new identification method for five species of oysters in genusfrom China based on high-resolution melting analysis [J]. Chinese Journal of Oceanology and Limnology, 32(2): 419-425.
WANGKUMHANG P, CHAICHOOMPU K, NGAMPHIW C,, 2007. WASP: a Web-based Allele-Specific PCR assay designing tool for detecting SNPs and mutations [J]. BMC Genomics, 8: 275.
XIA J, YU Z, KONG X J, 2009. Identification of sevenoysters from the South China Sea using PCR-RFLP analysis [J]. Journal of Molluscan Studies, 75(2): 139-146.
XIAO S, WONG N K, LI J,, 2018. Analysis oftranscriptomes reveals divergent adaptive response to hyper-and hypo-salinity in the Hong Kong oyster,[J]. Frontiers in Physiology, 9: 1491.
XU F, LI L, WANG J F,, 2014. Use of high-resolution melting analysis for detecting hybrids between the oystersandreveals bidirectional gametic compatibility [J]. Journal of Molluscan Studies, 80(4): 435-443.
YAN L L, SU J Q, WANG Z P,, 2018. Growth performance and biochemical composition of the oysters,and their hybrids in southern China[J]. Aquaculture Research, 49(2): 1020-1028.
YAN X L, ZHAI W D, HONG H S,, 2012. Distribution, fluxes and decadal changes of nutrients in the Jiulong River Estuary, Southwest Taiwan Strait [J]. Chinese Science Bulletin, 57(18): 2307-2318.
ZHOU M F, ALLEN JR S K, 2003. A review of published work on[J]. Journal of Shellfish Research, 22(1): 1-20.
THE SPECIES AND DISTRIBUTION OFOYSTER IN FUJIAN COAST
YU Shi-Qi1, HAN Zi-Qiang1, CHEN Yan-Ting2, GUO Tuan-Yu3, QUE Hua-Yong1
(1. Fisheries College, Jimei University, Key Laboratory of Mariculture for the East China Sea, Ministry of Agriculture and Rural Affairs, Fujian Engineering Research Center of Aquatic Breeding and Healthy Aquaculture, Xiamen 361021, China; 2. Fujian Fisheries Technology Extension Center, Fuzhou 350002, China; 3. College of Marine Biology, Xiamen Ocean Vocational College, Xiamen 361100, China)
Fujian Province is located on the southeast of China facing the East China Sea. The irregular coastline forms numerous bays with several sea-going rivers, which is suitable for living and reproduction of oysters. It is one of the regions with the most abundant natural oysters in China. At present, there are few reports on the composition and distribution of oyster species along the coast of Fujian Province. Given that the main bays of Fujian Province have experienced high-intensity oyster culture in the past 20 years, it is necessary to understand the natural species diversity along the coast of Fujian Province. Therefore, based on field surveys and sampling, we used multiplex species-specific PCR, identification of ITS2 nuclear gene hybrids, and CO I sequencing to identifyoyster species from the coastal region of Fujian Province and to determine the distribution of specific species. Results show that three species of, namely,, and, were found in a total of 960 samples collected from 19 sites of typical natural oyster seed-production areas along the coast of Fujian Province. Nowas found as previously reported. Among them,(607) accounted for 63.23%,(343) for 35.73%, and(10) for 1.04%.andwere the dominant species and distributed in the majority sampling areas. However,was merely found in the Quanzhou Bay Estuary Wetland Nature Reserve, which was newly discovered natural population. The species and distribution of oysters in the Fujian coastal area revealed in this study provide key basic data for the analysis of genetic diversity and the genetic differentiation of oyster populations, which pave the road for protection and utilization of oyster germplasm resources.
oyster species;; Fujian coast; multiplex species-specific PCR; hybrid identification based on ITS2 sequence; CO I sequence analysis
* 国家自然科学基金项目, 32172979号; 福建省自然科学基金项目, 2021J05159号。于诗奇, 硕士研究生, E-mail: 942571813@qq.com
阙华勇, 教授, 博士生导师, E-mail: hque@jmu.edu.cn
2023-04-19,
2023-07-23
Q789; S931; S968.3
10.11693/hyhz20230400088
