2021年度碱性磷酸酶测定试剂盒北京市监督抽验质量分析
2023-12-05宋伟朱晋升彭絮代蕾颖北京市医疗器械检验研究院北京市医用生物防护装备检验研究中心北京101111
宋伟,朱晋升,彭絮,代蕾颖(北京市医疗器械检验研究院(北京市医用生物防护装备检验研究中心),北京 101111)
碱性磷酸酶(alkaline phosphatase,ALP)是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶。临床上测定碱性磷酸酶主要用于骨骼、肝胆系统疾病的诊断和鉴别诊断,尤其是黄疸的鉴别诊断。为了加强对碱性磷酸酶测定试剂盒(以下简称ALP试剂盒)的监督管理,规范市场秩序,保障产品使用的安全性及有效性,我单位根据《北京市2021年药品、医疗器械、化妆品质量抽查检验工作实施方案》,对ALP试剂盒进行抽查检验,并通过对不符合项目探索性研究,以期发现质量安全风险点,为质量安全保障提供建议。
1 质量抽查检验情况
1.1 仪器与试剂 仪器:全自动生化分析仪(型号7180,日立公司)。
试剂:本次抽验,我单位共收到来自10家受检单位的11批次试剂(双试剂,NPP底物-AMP缓冲液法),试剂说明书声称均可适用于7180生化分析仪平台。
样品:受检单位提供此次抽验活动所需的配套校准品、质控品、重复性样品及比对试剂系统、标准物质、回收试验样品、临床样品。
1.2 检验依据与方法 按照受检单位提供的技术要求、上机参数,对ALP试剂盒进行检验,检验项目包括准确度及重复性。试验中操作步骤严格按照试剂说明书进行。
1.3 检验结果
1.3.1 重复性 评价试剂在测量条件相同的情况下,短时间内重复测量同一样本所得结果一致性的水平。结果用变异系数CV表示,CV越小,表示一致性水平越好。此次抽验,11批次试剂CV结果在0.3%-1.5%范围内,满足“CV小于5%”的技术要求,符合要求率100%。
1.3.2 准确度 评价试剂测量样本所得结果与真值间的一致程度。受检单位提供的技术要求中准确度评价方法有以下3种:①相对偏差法:测试有证标准物质,计算所得结果与标准物质认定值之间的相对偏差。要求相对偏差不超过±10%。11批次抽验试剂中,有3批次试剂采用相对偏差法进行试验,其中2批次满足要求,1批次相对偏差20%,判定不符合要求。
②比对试验法:抽验试剂与比对试剂同时测试40份临床样本,用线性回归方法计算两组结果的相关系数及每个浓度点的偏差。有3批次试剂采用比对试验法进行试验,其中2批次符合要求,1批次最大相对偏差19%,超过±10%的要求,判定为不符合要求。
③回收法:将已知高浓度样本加入临床低浓度样本(基础样本)中,计算混合后样本浓度减去基础样本浓度的差值与高浓度样本浓度的百分比。有1批次采用回收试验的方法,符合技术要求的规定。
此次抽验准确度评价中,抽样11批次试剂,检验7批次,另4批次因未提供准确度试验样品而未进行检验。检验7批次中,2批次不符合要求,首次检验符合要求率71.4%。不符合要求项目均进行复验,结果仍判定为不符合要求。
1.4 准确度不符合要求原因探索 此次抽验,不合格项目集中在准确度评价上。采用相对偏差法试验1批次及比对试验法试验1批次。
1.4.1 相对偏差法 本次试验采用国家二级标准物质进行测试,计算相对偏差。所抽验不符合要求试剂,配套采用朗道校准品进行校准。结果不符合要求的原因分析,一般考虑存在以下几点的可能性大:①校准问题:量值传递过程中出现偏差,校准品定值不准确。②样品问题:所选择的标准物质量值超出测试系统线性范围;标准物质在此平台上与参考方法之间的互换性较差;标准物质在运输和储存中环境温度未达到标准物质说明书中规定的要求,导致标准物质本身量值发生变化。
1.4.2 比对试验法 本次试验采用受检单位提供的已上市碱性磷酸酶试剂系统与抽验试剂系统,分别测试40例人血清样本,计算两个试剂系统测试结果的相关系数及偏差。结果不符合要求的原因分析:主要为两个试剂系统存在偏差,为进一步寻找原因,本文选择符合要求的抽验试剂A及比对试剂Ac和不符合要求的抽验试剂B及比对试剂Bc测试同一批临床血清40份,比较四个试剂系统的偏差情况。
2 抽验试剂A及Ac和抽验试剂B及Bc比对试验结果
抽验试剂A、B及比对试剂(试剂Ac和试剂Bc)所用校准品均为朗道校准品,校准后测试朗道质控品,均在其质控范围内,且呈现出较好的一致性,质控结果见图1。而测试40例临床样本,抽验试剂A与比对试剂Ac相关系数(r)0.9998,绝对偏差(-1.8-1.2)U/L,相对偏差(-1.1-0.8)%,结果符合要求。抽验试剂B与比对试剂Bc相关系数(r)0.9974,绝对偏差(4.3-15.3)U/L,相对偏差(8.2-19.1)%,见图2、图3,偏差结果仍不符合要求。按照抽验试剂A所测数据进行降序排列后做折线图,见图4,试剂A、Ac及B一致性较好,而试剂Bc偏差较大。A、Ac、B及Bc试剂校准品均使用朗道校准品及其说明书提供的靶值进行校准,测试朗道质控品在靶值范围内,但是测试临床样本结果偏差较大,本文考虑与校准品是否在多系统间具有互换性有关。本文针对朗道校准品是否具有互换性进行了进一步的探索试验。
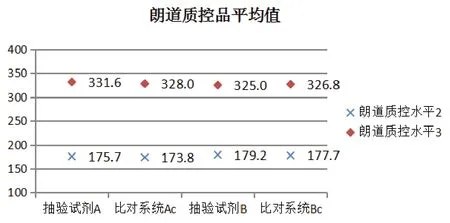
图1 抽验试剂A、B及比对试剂测试朗道质控品平均值

图2 试剂B及比对试剂Bc绝对偏差图
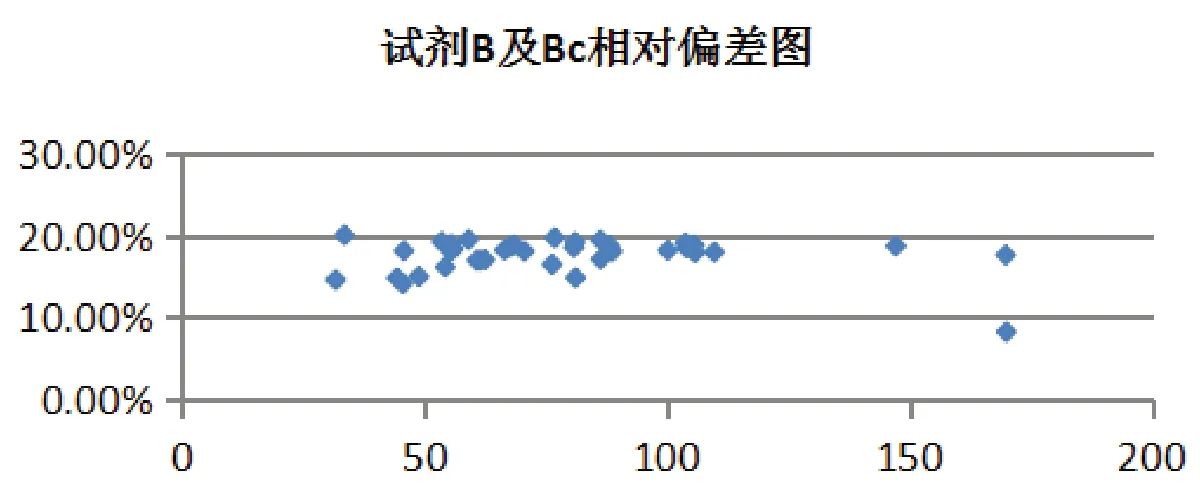
图3 试剂B及比对试剂Bc相对偏差图
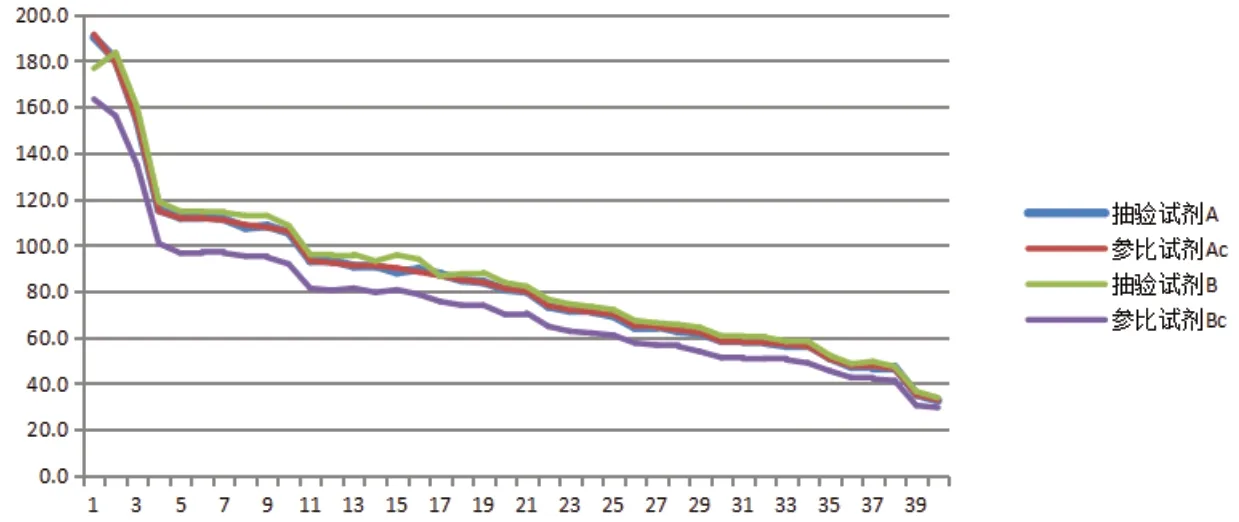
图4 试剂A/Ac/B/Bc比对结果图
3 朗道校准品互换性评价试验
3.1 试验方案 采用美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)发布的EP30-A[1]及EP14-A3[2]文件中介绍的标准物质互换性评价方案,对标准物质及朗道血清校准品进行互换性评价。
3.2 参考方法及常规方法主要仪器与试剂 仪器:全自动生化分析仪(型号7180,日立公司);Carry 100紫外可见风光光度计(美国Agilent 公司)。
试剂:选择WAKO、利德曼、中生、九强、安图、美康、迈瑞、世纪沃德及泰康9家品牌试剂及其配套校准品,其中,世纪沃德及泰康试剂使用朗道校准品,其余均为同生产厂商校准品。
3.3 试验样本来源 待评价样品:日本标准物质(JCCLS CRM-001d),标准值:(153±6)U/L;国家二级标准物质(GBW(E)090920),标准值:(222.6±5.6)U/L;血清校准水平2:CAL2350(批号:1528UN,朗道);水平3:CAL2351(批号:1225UE,朗道),靶值分别是184U/L和362U/L(IFCC推荐AMP方法37℃)。
血清样本:人源血清样本21例,无溶血、乳糜,每份血清分为2份,避光-80℃保存,用于参考测量程序和常规方法测量。
3.4 测量方法
3.4.1 参考测量程序测量ALP 采用IFCC推荐的37℃碱性磷酸酶参考测量程序,测试前测试2020 RELA样本,结果在控,测试21份新鲜单人份血清样本和各待测标准物质、校准品,每个样本重复测量2次。
3.4.2 常规方法测量ALP 在日立全自动生化分析仪(型号:7180)上,按照厂家说明书要求校准测量系统后,测试配套质控品,结果在控后,分别测量21份新鲜单人份血清样本和各待测标准物质、校准品,每个样本重复测量3次。
3.5 数据收集与处理 收集全部测量结果,进行离群值判定,未发现有离群值。计算参考方法、常规方法测量结果的均值,见表1。

表1 标准物质、校准品和21份人血清ALP测量结果平均值
3.5.1 按照EP30-A方法评价标准物质及校准品互换性,以参考方法测量结果为X轴、常规方法测量结果为Y轴,采用Deming回归法,计算临床样本对于相应的X值,其Y值的预测值及双侧95%的预测区间,判断标准物质及校准品在ALP参考方法和常规测量系统间是否具有互换性。
3.5.2 按照EP14-A3的方法,判断标准物质及校准品在两个常规测量系统间是否具有互换性。以一个测量系统测量结果为X轴,另一个测量系统为Y轴,采用Deming回归法,计算临床样本对于相应的X值,其Y值的预测值及双侧95%的预测区间,判断标准物质及校准品在ALP常规测量系统间是否具有互换性。
3.6 试验结果 4个待测物在两个不同方法间的互换性结果,参考测量程序与常规测量程序(共9组)见表2,具有互换性方法组合数:JCCLS CRM-001d占88.9%,GBW(E)090920占77.8%,而血清校准品(朗道)都不具有互换性;两个常规测量系统间(共36组)互换性结果见表3,具有互换性的常规系统组合数:CCLS CRM-001d占77.8%,GBW(E)090920占80.6%,血清校准水平2(朗道)占5.6%,血清校准水平3(朗道)占8.3%。
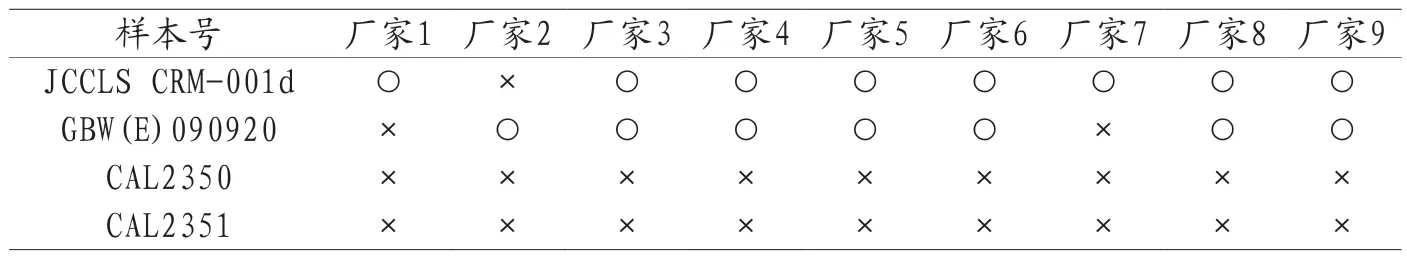
表2 标准物质、校准品在参考测量程序与常规测量程序间的互换性结果
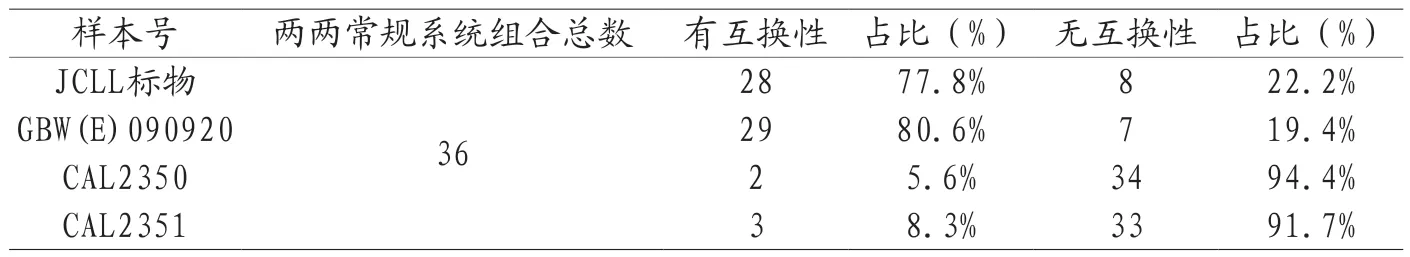
表3 标准物质、校准品在两个常规测量系统间的互换性结果
4 讨论
本次监督抽验,评价ALP试剂盒的两项重要性能指标——重复性和准确度。检验结果显示,ALP试剂盒的重复性都能达到厂家提供的技术要求的规定,也符合行业标准YY/T 1234-2014《碱性磷酸酶测定试剂(盒)(NPP底物-AMP缓冲液法)》[3]中重复性的要求,符合要求率100%。而准确度首次检验符合要求率71.4%。测量结果不准确的原因中,保证样本结果的计量溯源性是保证检测结果准确的首要因素,为指导临床实验室和诊断试剂厂家进行计量溯源,2003年国际标准化组织(ISO)发布了第1版ISO 17511:2003,旨在为临床实验室校准品的赋值提供计量溯源性策略,2020年,ISO发布了第2版ISO 17511:2020[4],与第1版相比,新版标准将赋值的溯源性要求扩展到患者样本,明确了患者检测结果应能追溯到目前可获得的最高级别标准,进一步确保患者样本测量准确性;针对酶学测量项目,新版标准规定了酶催化活性浓度可溯源到SI单位,提供了催化活性和催化活性浓度的计量溯源路径[5];同时,新版标准强调了校准等级中的二级校准品、体外诊断医疗器械工作校准品、产品校准品互通性的重要性,标准中规定,如果使用不具有互换性的物质作为产品校准品,则在量值传递过程中应使用具有互换性的物质(比如人血清盘)对产品校准品赋值结果进行校正。在本文试验中,朗道血清校准品在参考测量程序与常规测量程序之间以及两个常规测量系统之间大部分情况不具有互换性,而朗道血清校准品说明书所提供的靶值为所有仪器的均值,并不是针对某个系统的靶值,因此,本文认为直接使用第三方校准品说明书提供的靶值进行校准,测量临床样本可能存在偏倚,有一定风险性。即便是国际或国内标准物质,在两个测量程序或系统之间也不都具有互换性,因此,对于校准品溯源至碱性磷酸酶参考测量程序的厂家进行准确度评价时,也应对所选标准物质在参考测量程序与厂家常规测量程序之间进行互换性评价,从而选择适合的标准物质进行准确度评价。
