模式生物斑马鱼在神经退行性疾病中的研究进展
2023-12-04黄孔丽苏世杰王玉婷刘壮壮曹丹丹汪沛陈冠林王
黄孔丽苏世杰王玉婷刘壮壮曹丹丹汪 沛陈冠林王 奇*
(1.广州中医药大学科技创新中心,广州 510405;2.广州中医药大学针灸康复临床医学院,广州 510006;3.广州中医药大学第三附属医院,广州 510378)
斑马鱼,因体侧有像斑马一样纵向的蓝色与银色相间的条纹而得名。 斑马鱼作为一种脊椎动物模型,具有物种稳定、个体差异小、发育周期短、繁殖能力强、神经系统发育迅速等特点。 大约82%的人类疾病基因在斑马鱼中有同源基因[1],基因组信号调控也与人类有很高的相似性,可应用于高通量筛选[2]。 斑马鱼的大脑拥有哺乳动物大脑中的所有主要结构,斑马鱼的主要神经递质系统,包括去甲肾上腺素能、5-羟色胺能、多巴胺能和组胺能系统,显示出与哺乳动物系统的许多相似性[3]。 此外,斑马鱼具有与人类相似的血脑屏障功能[4]。 这些都说明了斑马鱼与人类具有高度保守的大脑组织,可用于研究神经退行性疾病,这使得斑马鱼在神经退行性疾病研究中有独特的优势,是理想的模式动物(图1),应用前景广阔,弥补了啮齿动物的不足(表1)。
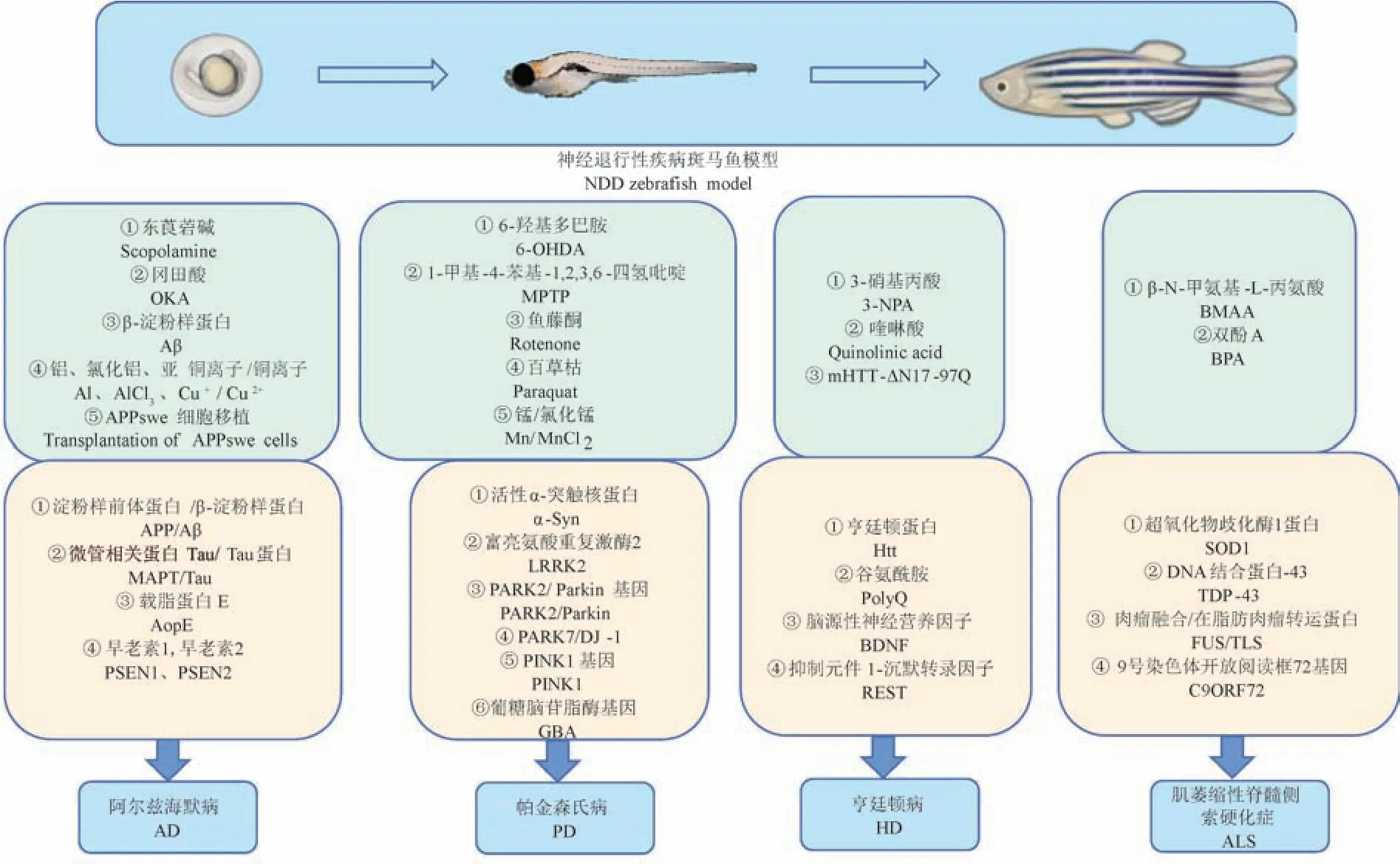
图1 斑马鱼构建神经退行性疾病模型Figure 1 Neurodegenerative disease models of zebrafish
1 斑马鱼在神经退行性疾病中的研究进展
1.1 阿尔茨海默病(Alzheimer’s disease,AD)
AD 是一种慢性进行性神经退化性疾病,以进行性记忆减退、认知障碍、人格改变为主要临床特征,是痴呆最常见的类型[5]。 随着社会老龄化的加剧,AD 的发病率也迅速增长。 大脑神经细胞外不溶性淀粉样蛋白β 斑块(amyloid-beta,Aβ)、细胞内Tau 蛋白过度磷酸化所致神经纤维缠结形成(neurofibrillary tangles,NFTs)[6]以及突触和神经元丢失是AD 的主要病理特征[5]。 AD 的发病机制复杂,至今尚无完全明确,关于其致病假说主要有Aβ毒性学说,微管相关蛋白Tau(microtubule-associated protein Tau,MAPT)异常学假说等[7]。
研究表明,应用于研究AD 的斑马鱼模型包括突 变 型APPswe、 突 变 型PSEN1 或PSEN2、 Tau-P301L-Tg 斑马鱼,东莨菪碱、蛋白磷酸酶2A 抑制剂冈田酸(okadaic acid,OKA)、Aβ1-42、铝(Al)、氯化铝(AlCl3)和氯化铜(CuCl2)等物质诱导的AD 模型等。 研究者们基于此类模型探究了部分物质抗AD的药理作用。
通过斑马鱼细胞移植技术构建可调控突变型APPswe表达的AD 动物模型,探究Aβ 沉积对脑血管系统的损伤及动物行为学的影响,为研究AD 的治疗构建一个具有时空可控性的动物模型,这项研究建立的APPswe斑马鱼表现为脑内神经元数量减少[8]。 编码基因PSEN1 和PSEN2 的突变在早发型家族性AD 患者中被发现,突变型PSEN1 或PSEN2已被证实可增加大脑中长时间的高纤维原性Aβ 形成,从而诱发AD 的发生[9]。 斑马鱼PSEN1 剪接干扰可诱导早发性AD 表型,如认知障碍、Aβ1-42聚集和突触减少[10]。 人类Tau-P301 L 突变体已被广泛用于建立转基因动物模型[11-12],此类模型因仿效了AD 患者Tau 蛋白异常修饰而被广泛应用[13]。 Tau-P301 L 过表达会导致成年斑马鱼脑内Tau 过度磷酸化[14]。 Alavi Naini 等[15]在Tau-P301 L-Tg 斑马鱼中使用硫酸肝素拮抗剂和草酰硫酸肝素拮抗剂可以减少p-Tau、减轻神经元丢失。 Barbereau 等[14]利用Tau-P301 L-Tg 斑马鱼研究了早期Tau 诱导的神经毒性如何改变脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号,结果表明Tau 神经毒性引起BDNF 系统的改变。
东莨菪碱为胆碱能拮抗剂,腹腔注射后可出现胆碱功能障碍和氧化应激,此模型可以造成动物学习记忆障碍。 Capatina 等[16]用东莨菪碱诱导的斑马鱼记忆损伤模型探讨百里香精油对胆碱能神经元的作用,证实了百里香精油可以降低AChE 活性和大脑抗氧化能力。 Boiangiu 等[17]等用可替宁和6-羟基-l-尼古丁治疗东莨菪碱诱导的AD 斑马鱼模型,发现二者均能减弱东莨菪碱诱导的焦虑样行为和记忆障碍,并降低斑马鱼大脑中的ROS 水平和AChE 活性。 研究报道,OKA 作为斑马鱼AD 疾病模型的诱导物,可以诱导斑马鱼氧化应激、胶质细胞激活、神经炎症、胆碱功能障碍、谷氨酸兴奋性毒性和线粒体功能障碍[18-19],表现出AD 的大部分症状[20]。 Koehler 等[21]利用OKA 建立了斑马鱼AD模型,研究4-苄基-2-甲基-1,2,4-噻二唑烷-3,5-二酮(TDZD-8)对AD 模型GSK3β 的抑制作用,发现注射OKA 后能够重现与AD 相关的大部分神经病理,降低p-Tau、Pp2A 和GSK-3β 活性/失活比。研究发现,AD 患者脑组织内Aβ 明显增多,并形成大量的老年斑[5]。 人体内Aβ 最常见的亚型是Aβ1-40和Aβ1-42。 其中Aβ1-42更容易聚集且更强的毒性,从而形成Aβ 沉淀的核心,引发神经毒性作用[5]。 Reinhardt 等[22]选 用Aβ1-42来 诱导 斑 马鱼AD 模型,发现细胞周期蛋白依赖性激酶5(CDK5)抑制剂LDC8 在斑马鱼AD 模型中起到保护神经元的作用。 Sang 等[23]研究发现阿魏酸衍生物TM-10对Aβ1-42诱导的斑马鱼血管损伤具有有效的神经保护作用, 可以抑制人类丁酰胆碱酯酶( butyrylcholinesterase, BuChE )、 单 胺 氧 化 酶(monoamineoxidase,MAO)活性,减少Aβ 聚集。 Al是一种已知会导致大脑神经毒性的金属,它会促进神经退化,影响记忆和认知能力,诱发AD 的发病[24]。 Gao 等[25]通过建立Al 诱导的斑马鱼AD 模型探讨其特异性坏死抑制剂Necrostatin-1 是否能有效缓解斑马鱼AD 模型的学习记忆障碍,结果表明Necrostatin-1 可以逆转Al 诱导的学习记忆损伤、提高Ach 水平和神经细胞数量。 钟绮媚等[26]用Al 诱导的斑马鱼AD 模型来研究不同ω-3 多不饱和脂肪酸二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳五烯酸(docosapentaenoic acid,DPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)对斑马鱼AD模型记忆损伤和神经病理学变化影响,结果显示Al显著激活斑马鱼幼鱼脑内的小胶质细胞;EPA、DPA和DHA 均显著降低Aβ 蛋白浓度和GFAP 的mRNA表达。 AlCl3是一种用于诱导啮齿类AD 模型的标准化学品[27]。 Kaur 等[27]用AlCl3处理斑马鱼,发现斑马鱼体内还原型谷胱甘肽和超氧化物歧化酶水平显著降低,而丙二醛水平升高。 汪雪雁等[28]利用CRISPR/Cas9 技术敲除斑马鱼ucp2 基因,研究ucp2 基因在AlCl3致斑马鱼痴呆中的作用,研究发现鱼体内ROS 水平显著升高;psen1、psen2、tnf-α和il-1βmRNA 转录水平显著上调。 夏乐旋[29]用选用AlCl3诱导AD 斑马鱼模型,研究生慧汤抗AD 的作用机制,结果显示生慧汤能改善AD 斑马鱼模型的学习记忆能力和认知功能障碍、减少AD 斑马鱼模型脑部异常Aβ 的积累,抑制Aβ 的毒性损伤,促进神经元的修复和再生。 用AlCl3诱导6 月龄斑马鱼,发现补肾益智方[30]能有效改善AD 斑马鱼的学习记忆能力,减少Aβ 生成,减轻ROS。 黄连解毒汤[31]、钩藤碱[32]以及黄精多糖[33]作用于AlCl3诱导的AD 斑马鱼模型可以通过下调p-P38/P38 的比值,上调Ncadherin 蛋白水平,进而改善AD 模型斑马鱼的学习记忆能力。 Cu+/Cu2+离子是人体必需的,严重的神经和代谢紊乱与Cu+/Cu2+稳态的异常相关,如AD。 Rakshit 等[34]使用CuCl2处理斑马鱼模型来评估化合物2c 和3c 在体内的功效,实验表明,用CuCl2处理的野生型斑马鱼幼鱼表现出氧化应激增强。 表2 总结了近几年使用斑马鱼来构建AD 模型的建立方式、治疗药物及其作用机制。
1.2 帕金森病(Parkinson’s disease,PD)
PD 是一种伴有为震颤、肌强直、进行性运动徐缓及姿势异常等典型症状的神经退行性疾病。 病理特征主要表现为中脑黑质纹状体多巴胺能(dopaminergic,DA)神经元变性缺失和α-突触核蛋白(α-synuclein,α-Syn) 组 成 的 路 易 小 体(Lewy bodies,LBs)形成[35]。 PD 的确切病因至今未明。神经毒物和遗传因素均可能参与PD 中DA 神经元的变性死亡过程。 斑马鱼具有腹侧间脑,这与哺乳动物的黑质是同源的[36]。 一些神经毒素如6-羟多巴胺(6-hydroxydopamine,6-OHDA)、1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6 tetrahydropyridine,MPTP)、百草枯(Paraquat)和鱼藤酮(Rotenone)是现今常被用于复制PD 的斑马鱼模型,均会不同程度地影响斑马鱼模型的多巴胺神经系统并出现PD 的主要症状[37]。
6-OHDA 暴露于斑马鱼会导致DA 神经元的丧失和运动活动的降低[36]。 Abidar 等[38]探究长角豆叶水提物对6-OHDA 诱导的斑马鱼PD 模型的认知影响和抗氧化活性,结果表明,长角豆叶水提物具有抗氧化和抗乙酰胆碱酯酶活性。 Wu 等[39]采用6-OHDA 诱导的斑马鱼PD 模型评价岩藻黄质的神经保护作用,发现岩藻黄质预处理显著增加了斑马鱼幼虫的总游动距离,改善了脑组织损伤。 Kesh等[40-41]检测柚皮素和橙皮苷对6-OHDA 毒性的神经保护作用,发现二者均降低了ROS 水平,改善斑马鱼幼鱼的运动能力。 MPTP 是一种能够引起动物类PD 症状和病理的神经毒素,可用作构建PD 模型[42]。 Selvaraj 等[43]利用MPTP 构建了斑马鱼的PD 模型,发现其体内DA 神经元及转运体显著减少,并表现出焦虑、运动迟缓、运动范围受限的症状。 Ren 等[44]用MPTP 诱导斑马鱼幼鱼做PD 模型评价甘草酸素对斑马鱼PD 的治疗效果,结果证明甘草酸素可以缓解细胞凋亡和自噬,抑制炎症反应。 Zhao 等[45]探讨迷迭香酸对MPTP 诱导的斑马鱼胚胎多巴胺能神经毒性的影响,发现迷迭香酸具有神经保护作用。 Duan 等[46]研究苦茶碱在MPTP诱导的斑马鱼PD 模型中的作用,苦茶碱被证明可以恢复DA 神经元的损失和行为表现的损害。 牟蕾等[47]用MPTP 诱导斑马鱼PD 模型,发现MPTP 造模组的斑马鱼DA 神经元出现不同程度的损伤,出现运动迟缓、焦虑、与PD 相关的基因表达异常等。百草枯是一种能引起多巴胺能神经元死亡并影响多巴胺生物合成的农药[48]。 斑马鱼幼鱼暴露于百草枯会引起DA 神经元的氧化损伤,导致行为障碍[49]。 Mohamad Najib 等[50]研究人金属硫蛋白2肽(human metallothionein 2 peptide,hMT2)在百草枯诱导的斑马鱼脑损伤中的作用,结果发现百草枯处理导致DA 神经元减少,而hMT2 处理后DA 神经元数量增加。 鱼藤酮诱导斑马鱼可以产生PD 症状,经过鱼藤酮处理的斑马鱼,表现出运动能力下降、焦虑、抑郁、记忆力下降等症状[51]。 Santo 等[52]用鱼藤酮诱导的斑马鱼PD 模型为实验模型,评价正己烷提取物对PD 的神经保护作用。 Yurtsever等[53]评价利福平在鱼藤酮诱导斑马鱼PD 实验模型中的作用,将成年斑马鱼暴露鱼藤酮和利福平3周,研究结果表明利福平有效地减轻神经炎症。 氰戊菊酯是一种广谱、高效的杀虫剂,具有干扰人类神经 功 能 的 潜 力。 Zhu 等[54]利 用 氰 戊 菊 酯(fenvalerate,FEN)来诱导斑马鱼PD 模型,结果产生了典型的PD 症状,并伴有泛素和路易体相关基因的增加,产生PD 相关症状。 斑马鱼也成为评估金属离子、纳米材料和污染物等对PD 发病机制影响的比较流行的动物模型。 过多接触锰(Mn)会损害精神,认知和运动功能。 有报道称成年斑马鱼慢性暴露于氯化锰(MnCl2)21 d 会产生PD 样症状,表现出运动功能的缺陷[55]。 将斑马鱼胚胎暴露于石墨烯家族纳米材料中可诱导神经毒性并改变PD 相关基因的表达[56]。 用氧化锌纳米材料破坏斑马鱼的运动活动,可诱导细胞凋亡和神经元损失[57]。 长期接触来自广泛污染物的杂环胺,会增加患PD 的潜在风险[58]。
近年来,基于PD 相关基因的斑马鱼Tg 模型也得到了广泛的应用。 研究表明,PD 的发病与α-Syn、Parkin、DJ-1、PINK-1、LRRK2 等基因突变有关[59],而PD 的相关致病基因在斑马鱼中均有直系同源。 对上述转基因或基因敲减斑马鱼模型的研究揭示了这些基因在DA 神经元的发育和存活过程中具有保守功能[60]。 α-Syn 的积累和聚集是PD 的一个重要特征,表达人类野生型或A53T 突变体α-Syn 的模型可用于研究α-Syn 聚集动力学,研究控制可溶α-Syn 和聚集α-Syn 清除的机制和潜在的新靶点[61]。 与人类Parkin 相似,斑马鱼中Parkin 活性降低会导致多巴胺能神经元数量显著减少,Parkin活性增加可以保护转基因斑马鱼免受蛋白质毒性应激引起的细胞死亡[62]。DJ-1 由Park7 编码,在保护神经元免受氧化应激方面具有多重作用,斑马鱼敲除Park7 会产生PD 表型[63]。Pink1 是与早发性PD 相关的线粒体相关基因,单独敲除Pink1 会导致斑马鱼的DA 神经元减少。LRRK2 基因突变与家族性和散发性PD 病例有关,LRRK2-g2019 s 突变是最常见的[64]。 斑马鱼中LRRK2 的破坏会导致严重的发育缺陷和神经元丢失[65]。PARLA基因的功能缺失使主要位于嗅球的DA 神经元减少[66]。Vps41 基因敲除会导致溶酶体异常以及小胶质细胞和小脑功能障碍[67]。Nus1 基因的变异可能是PD 发病机制的诱因。 斑马鱼敲除Nus1 基因会表现出运动障碍[68]。 表3 总结了化学诱导和基因编辑方式建立的PD 斑马鱼模型。
1.3 亨廷顿病(Huntington’s disease,HD)
HD 是一种病变累及纹状体、大脑皮层为主的中枢神经系统退行性变性疾病,呈常染色体显性遗传,是由致病蛋白的异常积聚和细胞自身清除异常蛋白能力失调造成的[77]。 HD 的发病机制主要是亨廷 顿 蛋 白(huntingtin, HTT) 上 的 多 谷 氨 酰 胺(PolyQ)束上的CAG 三联体异常扩增[78]。 有研究发现抑制元件1-沉默转录因子(repressor element-1-silencing transcription factor, REST) 是HTT 调 节BDNF 表达的分子靶点,并且HTT mRNA 和蛋白的可溶性突变形式是导致细胞死亡的有毒成分[79]。病理学上,HD 患者主要在纹状体和大脑皮层内出现大量神经元死亡,大脑皮层萎缩,脑室系统扩大。
化学物质3-硝基丙酸(3-nitropropionic acid,3-NPA)、喹啉酸(quinolinic acid)和mHTT-ΔN17-97Q过表达实验模型被用来探索HD 确切的致病机制和寻找新的药物靶点,以开发新的治疗方法[78]。
3-NPA 是一种毒素,斑马鱼幼鱼暴露于3-NPA会导致形态和心率发生改变,对成年斑马鱼进行3-NPA 腹腔注射,其体重、运动和攻击行为均有所下降,表现出长期厌恶记忆受损[80]。 Kumar 等[81]用3-NPA 处理成年斑马鱼,发现斑马鱼体重、认知和运动活动显著降低,并伴有渐进性神经元损伤。 喹啉酸是一种兴奋毒素,已被用于诱发啮齿类动物的脑损伤,以建立HD 模型。 Skaggs 等[82]用喹啉酸损伤成年斑马鱼的端脑来研究神经修复过程。 HTTN 末端17 个氨基酸(N17)结构域在大脑纹状体区高度表达。 Kumar 等[83]认为HD 中的N17 结构域可能是开发治疗亨廷顿病的新治疗策略的潜在治疗靶点。 mHtt-ΔN17-97Q 转基因斑马鱼是第一个概括HD 病理特征之一的转基因斑马鱼[84],其显示出快速进展的运动障碍[79]。
1.4 肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)
ALS 是一种在脊髓、脑干和运动皮层中运动神经元选择性丢失的神经退行性疾病。 ALS 的病理学特征是运动神经损伤,但运动神经元缺失的机制尚不清 楚。 β - N - 甲 氨 基- L - 丙 氨 酸(β-Nmethylamino-L-alanine,BMAA)和双酚A(bisphenol A,BPA)等环境因素已被证实与ALS 的病因有关[85-87]。 但绝大多数家族性ALS 病例与基因改变有关,基因改变 主要 与SOD1、 TDP-43、 FUS 和C9ORF72 有关[87],通过研究ALS 相关致病基因,构建了ALS 斑马鱼模型,研究疾病发生的分子机制,并最终开发出具有治疗前景的方案。
ALS 疾病多是由SOD1 突变引起的,Soll 等[88]使用SOD1-G93R 突变斑马鱼ALS 模型来评估1-Fe是否在体内显示治疗优点,结果表明1-Fe 通过特异性靶向SOD1 ALS 机制提高了幼鱼的运动能力。 在斑马鱼中敲除TDP43 直系同源物TDP-43 会导致运动表型的早期缺陷和NMJ 的分解,降低AChE 的表达[89]。 FUS 是FUS 相关的ALS 和额颞叶痴呆的标志,Salam 等[90]证明了过表达突变FUS 改变了原始神经元和斑马鱼模型的突触数量和神经元复杂性。C9orf72 基因内的六核苷酸重复扩张是ALS 最常见的遗传原因。 Fortier 等[91]总结了斑马鱼模型已被用于研究C9orf72 相关ALS 的病理,探讨它们在提供机制方面的价值和它们在药物发现方面的潜在用途。
1.5 其他神经退行性病
多发性硬化(multiple sclerosis,MS)是一种慢性自身免疫性疾病,其组织学特征是中枢神经系统中出现脱髓鞘和再髓鞘斑块。 Neely 等[92]为了确定成熟少突胶质细胞是否参与髓鞘再生,利用转基因品系Tg(mbp:TRPV1-tagRFPt)和成年斑马鱼的视神经髓鞘再生模型,通过在成年斑马鱼中的实时体内成像研究了成熟少突胶质细胞增殖。
脊髓性肌萎缩症(spinal Musclar Atrophy,SMA)是儿童最常见的遗传性疾病,由生存运动神经元(survival Motor Neuron,SMN)蛋白缺失导致运动神经元丢失。 Koh 等[93]在转基因hb9:mCherry-linker-Smn 斑马鱼胚胎中使用了一种体内荧光相关光谱方法来评估SMN 在运动神经元细胞体和轴突中的细胞动力学。
2 斑马鱼作为神经退行性疾病模型的局限性
动物模型与人类神经退行性疾病症状相似,但目前尚没有一种模型能够完全模拟人类神经退行性疾病的发病机制。 尽管但斑马鱼的神经传导系统、神经元和神经胶质细胞类型及疾病相关基因同源性与人类都十分相似,但斑马鱼对人类来说仍然是一种不同的脊椎动物,所以斑马鱼神经退行性疾病模型存在一些局限性:第一,目前对斑马鱼脑组织的研究报道甚少[94]。 斑马鱼的端脑区功能与人类动物的海马区功能相似,与学习记忆等行为有关,但由于斑马鱼体形较小,取材定位和制样较困难。 此外,星形胶质细胞的一些生理、细胞和分子方面可能在斑马鱼和人类之间有所不同[95]。 第二,斑马鱼模型需要克服的重要的问题之一是控制和量化药物暴露的挑战,很难预测药物吸收率[96]。 第三,作为模式动物,斑马鱼缺乏详细的解剖和组织学参考。 斑马鱼除了能提供无特定病原体动物外,与机体重要组织脏器相关的形态标准亟需建立,斑马鱼的神经系统及其组织形态结构特征与人类相比,组织细胞学数据的匿乏,阻滞了斑马鱼作为模式动物的进一步应用[97]。
3 总结与展望
神经退行性疾病大部分是不可治愈的疾病,这给全世界造成了巨大的健康和社会负担。 基于该现状,在世界范围内的掌握神经退行性疾病的发病机制及治疗方法迫在眉睫。 近年来在神经退行性病变研究领域,斑马鱼的关注度越来越高,斑马鱼模型虽然与人类中枢神经系统有区别,但是斑马鱼在基本的神经传导系统、神经元和神经胶质细胞类型以及与疾病相关基因同源性上与人类都很相似,所以目前斑马鱼模型在神经退行性疾病生理、病理以及相关药物的研究中发挥着重要作用,并且选用斑马鱼可进行多方面的实验,包括活体检测、多靶点研究、药物的代谢过程、药物前期检测、高通量筛选、行为检测等,这些优点都可以为人类深入研究神经退行性疾病提供一个极具研究意义的方向。随着未来科技的不断发展,相信其不足之处将被人类妥善解决,并能发挥更为重要的作用。
