高原对线粒体功能及能量代谢影响研究进展
2023-12-04李勃深张宇轩范容晖李茂星刘天龙
李勃深张宇轩范容晖李茂星*刘天龙*
(1.甘肃中医药大学药学院,兰州 730000;2.中国人民解放军联勤保障部队第九四〇医院全军高原医学实验室,兰州 730050;3.军事科学院军事医学研究院辐射医学研究所,北京 100850;4.甘肃省高原药学行业技术中心,兰州 730050)
自2010 年以来线粒体相关研究的发文量逐年增加[1],线粒体损伤作为近年来备受关注的研究领域,得到了广泛关注。 不同诱因造成的损伤将通过不同机制表达,目前对于高原环境下线粒体损伤的具体机制了解仍不充分。 高原对能量代谢和线粒体的负面影响,在机体中可能引发易疲劳、高血脂症、组织修复受阻等问题。 此前的研究表明,高原缺氧会降低生化供能反应关键酶活性,导致线粒体功能异常及细胞凋亡等现象。 在高原,为适应环境,供能反应关键酶活性与线粒体会发生一系列的适应性改变,这对于高原供能与运动效能存在负面影响[2]。 迄今为止,关于高原环境对能量代谢与线粒体损伤的相关报道相对较少。 通过深入研究高原环境对线粒体代谢和功能的影响,我们可以更好地理解高原疾病的发生机制,并为其预防和治疗提供理论依和更多药物防治靶点。 本文旨在综述高原能量代谢和线粒体损伤机制,推进高原损伤模型和防治药物的研究。
1 高原对能量来源物质代谢的影响
1.1 高原作业所需大分子能量物质
糖、蛋白质、脂肪是运动所需的三大能量来源。糖作为人体能量的主要来源,运动作业时通过线粒体有氧氧化产生三磷酸腺苷 ( adenosine triphosphate,ATP)为机体供给能量;蛋白质作为能量来源发挥的作用并不大,但在保持运动状态或长时间运动作业时间接为身体供给能量有重要作用,如血红蛋白及肌红蛋白具有携带、运输和贮藏氧的能力[3],蛋白质是保证运动作业的基石;脂肪是体内最丰富的酯类物质,不仅是机体产能最多的营养物质,也是机体最有效的储能形式,在运动过程中脂肪参与糖酵解过程,在进入身体活化之后通过线粒体的β-氧化过程生成乙酰辅酶A,从而进入三羧酸循环(tricarboxylic acid cycle,TCA cycle),释放大量能量。
1.2 缺氧与大分子能量物质代谢关系
缺氧环境下,肝、心肌、骨骼肌等脏器中糖类含量均有降低趋势,以肝糖原、肌糖原的减少尤为明显[4]。 肝、肌糖原减少,人体容易出现疲劳感、无力感及运动能力下降等问题,且体内的蛋白质分解量多于合成量,将出现消化率下降和负氮平衡,同时血红蛋白、肌红蛋白等一系列关键蛋白的合成发生障碍,人体的运动能力和损伤修复受到负面影响[5-6]。 脂肪的消耗需要氧气的直接参与,缺氧导致了体内脂肪酸的含量升高,超过了体内脏器的转运能力,同时缺氧又导致本来脂肪动员下加速生产的磷脂代谢出现障碍,加重了脂肪在脏器内的堆积,并可能引起高血脂症[7]。
机体运动时,糖原作为人体内糖类成分的储存形式会分解释放产生能量,但高原环境下糖原释放和反应供能受阻。 研究表明,在高原环境中开展运动训练会导致肝糖原的含量降低[8],而肌糖原含量的减少又将无法保证肌肉活动的能量供给,从而影响高原作业。 陶文迪等[9]对Wistar 大鼠进行模拟急进高原运动,发现与对照组大鼠相比,缺氧组大鼠的肝糖原、肌糖原含量显著降低,游泳力竭时间显著缩短。 另有研究称,大鼠在6000 m 模拟海拔高度下血糖降低,胰岛素水平升高,肝糖原含量增加,肌糖原含量减少,糖脂代谢出现功能紊乱,运动过程中无法维持机体稳态[10]。 倪倩等[11]发现,在进入高原早期肝糖异生环节的限速酶葡萄糖-6-磷酸酶以及肝糖原含量显著增高,这是机体习服高原环境的机制之一。 氧气在合成ATP 中起着重要作用,在常氧条件下维持蛋白质合成的生产速率。 在缺氧状态下,各类生化反应所需的蛋白质合成速率由于ATP 有限而显著减慢和受损[12]。 在高原缺氧环境下作业消耗大量能量时,糖原含量减少、脂质代谢减慢和蛋白质合成受损将直接导致高原运动效降低能甚至是高原疾病的发生。 高原环境从来源上抑制了整个能量代谢途径,通过合理调整饮食结构,增加能量供给和营养物质摄入,有助于缓解代谢异常和提高适应能力。
2 高原缺氧与能量代谢及相关酶
高原缺氧条件对线粒体内关键的生化供能反应关键酶的抑制作用将导致机体作业的易疲劳、运动效能降低和一系列的代谢性疾病(图1)。
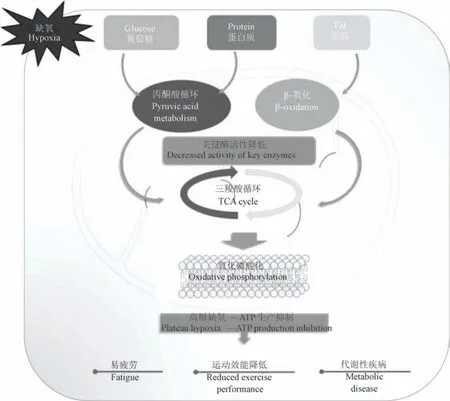
图1 高原缺氧环境下线粒体内的生化供能反应Figure 1 Biochemical energy supply responses in mitochondria under hypoxic conditions at altitude
2.1 丙酮酸代谢过程相关酶
丙酮酸是天然存在于体内的小分子物质,是机体整个生命活动的中间产物,丙酮酸通过生成乙酰辅酶A 参与三大营养物质代谢过程,起着重要的枢纽作用,为三羧酸循环奠定物质基础,通过保护糖酵解过程改善乳酸堆积,提高机体在缺氧状态下的耐受性并减少自由基形成和缺氧损伤[13-14]。 线粒体中丙酮酸的代谢受多种酶调控,包括线粒体丙酮酸载体酶复合物(mitochondrial pyruvate carrier,MPC)、 丙 酮 酸 脱 氢 酶 复 合 物 ( pyruvate dehydrogenase complex,PDHC)决定了丙酮酸参与供能的反应速率,间接调节能量供给[15]。 研究称,丙酮酸作为糖酵解的终末产物,慢性缺氧时将导致糖酵解水平提高,线粒体丙酮酸代谢过程受PDHC 的调节。 急性缺氧时人骨骼肌和小鼠胚胎细胞中PDHC 活性显著降低,激活PDHC 将有效改善慢性缺氧期间的丙酮酸代谢阻滞[16]。 Wang 等[17]发现缺氧状态下人脐静脉内皮细胞糖酵解水平升高,乳酸分泌增加,MPC1 和MPC2 水平降低。 高原缺氧将抑制丙酮酸代谢过程中的关键酶活性,导致代谢过程受阻从而导致运动产物堆积、氧化应激、糖类代谢不完整并影响三羧酸循环及运动效能。
2.2 三羧酸循环相关酶
TCA cycle 是物质氧化而获得能量的最有效方式。 高原缺氧将导致TCA cycle 中有氧呼吸相关酶含量与活性降低,导致高原作业因供能不足而效能下降。 长期暴露于缺氧环境可能引起参与TCA cycle 的柠檬酸合酶(citrate synthase,CS)、乌头酸酶、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)、α-酮戊二酸脱氢酶、 琥珀酸脱氢酶(succinate dehydrogenase,SDH) 和 苹 果 酸 脱 氢 酶 (malate dehydrogenase,MDH)活性降低[18-19]。
研究表明,柠檬酸合酶活性与细胞呼吸能力呈线性关系[20],缺氧将导致细胞呼吸能力的降低,从而影响线粒体代谢[21]。 Peng 等[22]发现,缺氧将抑制氧化型共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)活性,从而降低磷酸果糖激酶和柠檬酸合酶水平,这是两种葡萄糖代谢相关的关键酶。 Tsui 等[23]对缺氧人体前列腺细胞中乌头酸酶的基因表达影响进行实验发现,缺氧将上调人体前列腺细胞中缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)的水平而减少乌头酸酶的表达。 Carvalho 等[24]对常氧与慢性缺氧大鼠脑血管和突触体进行氧化状态研究,检测线粒体乌头酸酶活性、 过氧化氢和谷胱甘肽(glutathione,GSH)水平等,发现缺氧后大鼠脑血管与突触体中乌头酸酶活性显著降低;过氧化氢水平在脑血管中呈升高,突触体中降低;GSH 水平在脑血管中无显著性差异,在突触体中降低。 徐建方等[25]发现大鼠比目鱼肌中IDH 因缺氧而表达抑制,但由于时间的延长而有显著缓解;α-酮戊二酸脱氢酶的表达在缺氧运动第一周开始显著下降,然后以较低表达量至实验结束。 IDH 在低氧存活的细胞中表达抑制[26]。 在线粒体中,缺氧将导致谷氨酰胺转化α-酮戊二酸的速率因IDH 的抑制而降低[27]。 徐玉明等[28]发现SD 大鼠在进入模拟海拔4300 m 后MDH 水平均显著降低,运动后降低趋势更加明显。李茂星等[29]发现balb/c 小鼠在模拟海拔4000 m 负重游泳后肝、肌肉与血清中MDH、SDH 活性显著降低。 缺氧细胞将依靠有氧氧化通路代偿性升高相关酶活性来补偿缺氧导致的能量供应不足,有报道称,人体肝癌细胞缺氧后出现了SDH 与MDH 的活性代偿性升高,但在持续缺氧后活性出现显著下降[30]。 高原缺氧通过抑制关键酶活性降低三羧酸供能效率,直接导致高原疾病或运动效能的降低。
2.3 β-氧化相关酶
β-氧化是脂肪酸在线粒体内由一系列酶催化转化为乙酰辅酶A 继而为机体供给能量的过程。 肉碱脂酰转运酶(carnitine palmitoyl transferase,CPT)是β-氧化过程中的关键酶,在缺氧状况下,脂酰辅酶A 数量增多,同时CPT 也被急剧消耗,导致线粒体β-氧化速率降低[31]。 Kennedy 等[32]发现SD 大鼠在模拟海拔4300 m 处,急、慢性暴露后心脏与指伸长肌中CPT-I 活性以及心脏组织中β-羟脂酰辅酶A 脱氢酶(β-hydroxyacyl CoA dehydrogenas,β-HAD)活性对比平原对照组显著降低;慢性暴露后心脏组织中β-HAD 活性显著降低,急性暴露时无显著差异。 Dutta 等[33]发现缺氧和冷缺氧暴露1 d 会显著降低SD 大鼠肌肉和肝中CPT-I 活性,而单纯的冷暴露则显著提高CPT-I 活性;缺氧和冷缺氧暴露7 d 会导致肌肉和肝的CPT-I 活性显著降低,而冷暴露虽显著降低肌肉的CPT-I 活性,但却显著提高肝的CPT-I 活性。 此外,缺氧、冷暴露和冷缺氧暴露1 d 和7 d 会显著降低肌肉和肝的β-HAD 活性。
2.4 氧化磷酸化相关酶
氧化磷酸化是一个复杂生物化学过程,氧化磷酸化过程在线粒体中发生,线粒体内膜上的线粒体复合酶是该过程的关键酶,由五个复合物组成:线粒体复合物I(NADH-CoQ 还原酶或NADH 脱氢酶)、Ⅱ(琥珀酸脱氢酶)、Ⅲ(细胞色素C 还原酶)、Ⅳ(细胞色素C 氧化酶)和Ⅴ(F1F0-ATP 合成酶)构成呼吸链,也称电子传递链,其功能是进行电子传递、H+传递及将TCA cycle 产生的辅酶通过氧化呼吸链产生H2O 和ATP。 研究表明,将A549 细胞在5 mmol 葡萄糖、25 mmol 葡萄糖和10 mmol 半乳糖代谢环境中培养72 h 后,发现,葡萄糖基细胞在常氧时产生的ATP 量显著高于低氧培养时;半乳糖基细胞在低氧时能产生更多ATP[34]。 低氧导致线粒体能量代谢障碍,这与线粒体呼吸链酶活性下降有关。 靳婉君等[35]对雄性BALB/c 小鼠进行模拟海拔8000 m 缺氧72 h 处理后发现,缺氧模型组对比空白对照组线粒体膜电位、线粒体复合物Ⅰ、Ⅱ出现显著降低。 研究表明,在线粒体能量代谢障碍时,出现认知损伤患者的脑组织线粒体复合物Ⅱ、Ⅲ、Ⅳ均有不同程度的下降[36-37]。 另有报道称,对SD 大鼠进行低氧处理7 h 后发现,缺氧模型组对比正常组大鼠脑、心、肾组织中线粒体复合物Ⅰ、Ⅳ均显著下降[38]。
F1F0-ATP 合成酶又称线粒体ATP 合酶,参与催化氧化磷酸化;同时在电子传递链产生的跨膜质子动力势的推动下合成ATP。 有研究称,缺氧将导致Wistar 大鼠肺组织线粒体ATP 合酶缺氧4 周时活性显著下调[39]。 另有研究称,雄性SD 大鼠于模拟11.3%氧浓度(等效海拔5000 m)的环境中持续暴露4 周发现,与常氧对照组比较,常氧运动组和低氧运动组的ATP 合酶的活性显著升高,低氧对照组线粒体复合物Ⅰ、Ⅱ、Ⅳ和ATP 合酶的活性和膜电位显著降低;低氧运动组和对照组比较,线粒体复合物Ⅰ、Ⅱ、Ⅳ和ATP 合酶的活性和膜电位显著升高[40]。 低氧运动对ATP 需求更大,更加考验线粒体中各环节生化供能相关酶的活性及协调转运能力。
3 高原环境下线粒体形态结构及数目变化
总的来说,缺氧对于线粒体内、外各生化反应环节都存在抑制作用,这极大程度影响了细胞活力和正常代谢。 除此之外,线粒体数目的减少与超微结构的变化对于线粒体合成ATP 的效率也有直接影响(图2)。
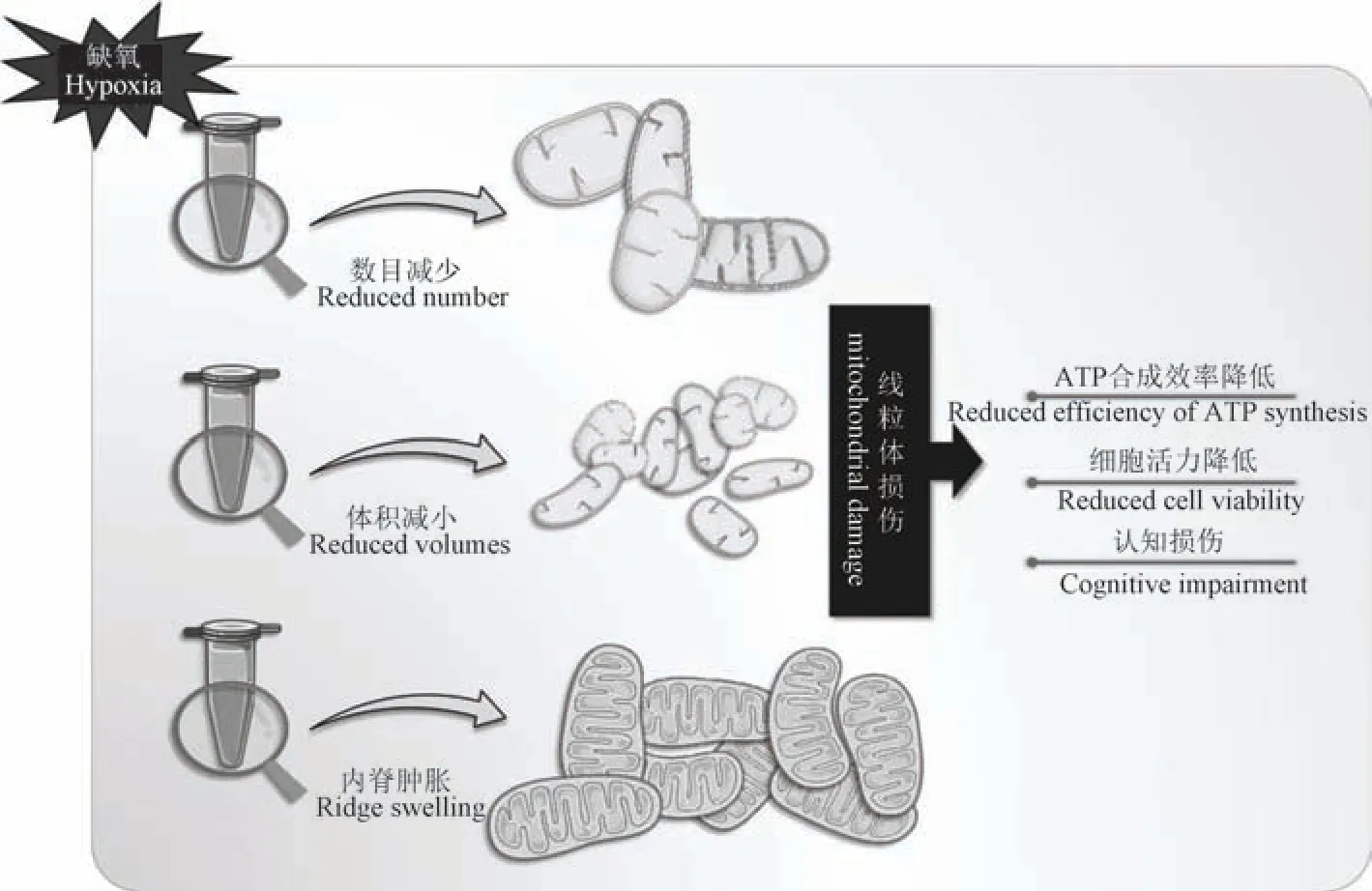
图2 高原缺氧后线粒体形态结构及数目的变化Figure 2 Changes in the morphological structure and number of mitochondria after hypoxia in the highlands
3.1 高原使线粒体数目减少
Levett 等[41]选取CXE 探险队为实验对象,在平原(海拔75 m)和尼泊尔珠穆朗玛峰大本营(海拔5300 m)对所有受试者进行活检取样,通过电镜观察肌肉形态(包括线粒体密度和分布)后发现,在暴露于海拔高度19 d 后,大本营的人肌肉活检中线粒体密度无显著变化,登山队在暴露于低压缺氧66 d后,总线粒体密度降低21%,线粒体体积变小。 肌原纤维间线粒体降低了14%,而肌膜下线粒体丢失73%。 肌膜下线粒体被认为在为细胞膜上的离子泵提供ATP 方面很重要。 Hoppeler 等[42]以在5200 m大本营停留至少6 周并部分暴露于海拔超过8000 m 环境下的人群为研究对象,进行肌肉活检并利用透射电镜进行形态学分析。 结果表明,与低海拔相比,暴露于高海拔下的肌肉线粒体体积密度降低了近20%。 此外,该研究还发现,线粒体体积密度的降低主要是由于肌膜下线粒体减少导致的,而纤维间线粒体的降低比例相对较小。
线粒体密度与功能和缺氧暴露时间及海拔直接相关,高原环境将导致活性氧(reactive oxygen species,ROS)加速生成,损害蛋白质、脂质、线粒体DNA 及ATP 的合成,从而影响细胞正常功能[43-44]。有研究称,ROS 的产生伴随着海拔的上升而增加,在7000 m 以上将迅速生成[45],迅速生成的ROS 将造成缺氧细胞的凋亡和线粒体的主动减少。 线粒体膜电位(mitochondrial membrane potential,MMP)的稳定是维持氧化磷酸化过程合成ATP 的先决条件MMP 的稳定利于细胞正常生理功能,研究称MMP 将随缺氧时间的延长出现下降(称MMP 耗散),MMP 的耗散影响了ATP 合成且加速了缺氧细胞的凋亡,造成了线粒体密度的降低[46]。
3.2 高原使线粒体体积与内脊形态改变
Lukyanova 等[47]选择在极高海拔(11 000 m)存活时间在2 min 以下的近交系大鼠为低缺氧耐性组(low resistance,LR),存活时间在6~8 min 为高缺氧耐性组(high resistance,HR),观察不同海拔高度下大鼠大脑皮层线粒体的超微型态变化,以常氧空白组作为对照组,结果发现,常氧时HR 的小体积、长、超长线粒体(长度:0.14~0.25、0.5~3、>4 μm)和总线粒体数分别为LR 的1.15、1.31、3.67 以及1.18倍。 这种常氧下线粒体的“拉长”是线粒体中ATP增加生成、MMP 升高和ROS 生产减少的典型特征[48];与此同时,在模拟海拔5000 m 时,LR 组小体积线粒体数目对比对照组大鼠提高3.6 倍;同时,长线粒体与超长线粒体数目明显减少,线粒体脊形状与密度无变化;在HR 中小线粒体数目对比对照组几乎不变,长线粒体与超长线粒体数目明显减少,但线粒体脊排列更加紧密;在模拟海拔7000 m 时,LR 中小线粒体、长线粒体、超长线粒体对比对照组均显著增加,分别为对照组的1.8、1.4 和2.1 倍,线粒体排列杂乱、基质浓缩、脊肿胀[47];增多的小线粒体中出现了“球状”特征,这可能是线粒体MMP 降低、钙代谢紊乱和ROS 增加的信号[49]。
蔡明春等[50]在一项研究中比较了平原与急、慢性缺氧(模拟海拔4000 m,40 d)后Wistar 大鼠脑线粒体超微结构。 结果发现,急性缺氧后大鼠脑线粒体体积增大、膜结构不清、脊紊乱、脊肿胀等病理形态;此外,脑线粒体平均直径和截面积增大,比表面积减小。 慢性缺氧后大鼠脑线粒体形态参数与平原大鼠相比无显著差异,说明在40 d 模拟4000 m海拔的低压缺氧暴露后,脑线粒体形态结构已经恢复正常,这可能是对缺氧适应性的表现。 低压低氧会导致部分线粒体肿胀和扩张,体现为内部脊结构缺失,线粒体形态与脊的数目决定了线粒体复合物和F1F0-ATP 合酶的分布区域和活性[51-52]。
4 小结
缺氧是高原地区能量物质利用与线粒体功能受影响的最直接因素。 在高原缺氧时,食欲下降、机体代谢效率降低、内分泌水平失调等现象使得机体出现能量供给不平衡、细胞活力低下,导致细胞凋亡与组织损伤。 此外,高原缺氧条件下,线粒体的氧化磷酸化功能减弱,进而对糖代谢产生负面影响。 作为重要的能量来源之一,糖需要通过酵解来满足机体在缺氧环境下的能量需求。 然而,由于线粒体功能受限,糖酵解效率降低,导致能量供应不足,多脏器组织内糖原加速消耗。 缺氧后,机体可能更倾向于利用脂肪作为能量储存形式。 然而,受损的线粒体功能与生化过程导致脂肪的氧化代谢能力下降,使其难以有效转化为能量,发生脂类代谢障碍,加重组织与脏器的脂肪堆积。 此外,缺氧将增加体内蛋白质分解,以提供必要的氮源,用于新蛋白质的合成。 这种失衡状况可能导致肌肉组织的损失和一众生化反应的停滞,从而影响高原作业效能。
线粒体作为细胞的“动力工厂”,是细胞与组织能量代谢和有氧氧化的重要场所。 高原环境中,丙酮酸代谢、三羧酸循环、β-氧化、氧化磷酸化过程等生化反应途径因关键酶的低缺氧耐性受到抑制,这影响了组织的有氧代谢与线粒体ATP 的合成,与此同时,线粒体超微结构也会根据海拔高度升高而发生改变,高海拔时线粒体总密度、总数目、线粒体内膜脊的形态与线粒体大小等均出现不同程度的负效应。 线粒体呼吸链复合物及F1F0-ATP 合酶的分布和活性受到影响、MMP 缺氧耗散、ROS 含量激增,线粒体数目减少;与此同时,线粒体的内脊肿胀将影响线粒体内部的物质运输和能量转换效率,这阻碍了ATP 的合成并加速了缺氧细胞的凋亡。 有报道称,低氧线粒体的丢失可能是一种适应性反应,其目的是减少有害的ROS 的产生,延缓缺氧细胞凋亡速度[53];也有可能是细胞内有氧代谢水平降低,机体做出的适应性调整,而有高负荷的供能需求时线粒体又能做出“拉长”这样增加供能的形态改变。在进行高原作业时机体易疲劳、易出现运动损伤和高血脂症,可通过增加能量摄入和高碳水化合物配给、药物干预、高原习服训练等方式改善作业效能与机体损伤修复功能。
总之,高原缺氧对于能量代谢、生化供能反应和线粒体超微结构的负效应会导致线粒体损伤甚至是高原作业效能的降低,高原条件下的缺氧、氧化应激、能量代谢紊乱等因素可能共同作用,导致线粒体损伤的发生。 然而,相关机制的深入探究仍待开展。 不完善的损伤机制意味着在筛选符合机制的防治药物时选择面更为狭窄。 因此,对于这种影响机制的深入研究将极大推动多药物、多靶点防治高原损伤的发展。
近年来,线粒体损伤新机制的发现造就了线粒体研究热,如“铁死亡”这一新兴的研究领域;研究称,缺氧会促进铁死亡[54]。 铁死亡是一种新型细胞程序性死亡方式,铁死亡对于线粒体功能及形态特征有直接的调节作用[55];缺氧细胞中ROS 和氧化应激水平升高,线粒体体积减小、内脊数目减少,加剧细胞在缺氧状态下的损伤[54,56]。 高原铁死亡还可能导致机体脑损伤与神经行为损伤,出现高原认知障碍,影响精细工作能力[57-58]。 未来,铁死亡的发生水平可能作为高原线粒体损伤或高原细胞损伤的验证标准,对于高原损伤疾病、动物模型和高原损伤防治药物的研究有重大意义[59]。 线粒体损伤机制的完善有助于寻找新的治疗策略和药物靶点,从而提高进入高原人群的适应能力和健康水平。
