HDAC6 抑制剂通过保护肾小球内皮细胞线粒体稳态和EMT 改善糖尿病肾病
2023-12-04陈小丽罗富里童梦瑶
陈小丽,罗富里,童梦瑶
(1.井冈山大学附属医院肾病风湿免疫科,江西 吉安 343000;2.江西中医药大学附属医院肾病科,南昌 330006;3.江西中医药大学第二附属医院呼吸科,南昌 330006)
糖尿病肾病(diabetic nephropathy,DN)是全球终末期肾病的主要原因,因为一半以上需要透析的患者患有糖尿病[1]。 尽管目前建议对DN 治疗进行早期干预,以最佳血糖和血压控制来预防主要不良肾结果,但不良肾和心血管结果的残余风险仍然很高[2]。 因此,理解DN 的发病分子机制、识别可靠的生物标志物,是开发新的治疗方法来阻止或逆转DN 进展的必要途径。
肾小球内皮细胞由于其持续高水平的能量消耗而含有丰富的线粒体[3]。 肾疾病的早期阶段通常发生代谢改变,它们会破坏线粒体稳态,如线粒体功能障碍和能量代谢受损[4],并伴随着线粒体的一系列变化,包括破碎的形态、活性氧的产生升高和线粒体膜电位的丧失,导致足细胞丢失和脱离以及足突消失,最终出现肾小球滤过屏障破坏和蛋白尿[5]。 最近的研究证明组蛋白去乙酰化酶(histone deacetylases,HDAC)在维持足细胞功能平衡方面发挥着至关重要的作用[6]。 在人类鉴定的18 种HDAC 中,HDAC6 是特异性的HDAC,因为它有两个活性去乙酰化酶结构域和一个锌指基序,可优先定位于细胞质[7]。 HDAC6 的亚细胞定位使其与影响细胞迁移、增殖和错误折叠蛋白分解代谢的其他细胞质蛋白和多泛素链相互作用[8-9]。 最近研究证实,HDAC6 可能是DN 治疗的有希望的治疗靶点[7]。 此外,HDAC6 抑制通过抑制上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)减轻梗阻性肾病的肾纤维化[8]。 还有研究发现HDAC6是线粒体动力学多种机制中的关键调节因子,其抑制与减轻线粒体功能障碍密切相关[10]。 然而,目前尚不清楚HDAC6 是否通过破坏肾小球内皮细胞线粒体稳态参与DN 的病理机制。
在本研究中,我们从EMT 以及线粒体介导的细胞凋亡等方面检测了HDAC6 特异性小分子抑制剂Tubastatin A 对DN 小鼠肾损伤的保护作用。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
30 只SPF 级8 周龄雄性C57BL/6J 小鼠(体重18~22 g)购自南京君科生物科技有限公司[SCXK(苏)2019-0046]。 小鼠喂养于江西中医药大学实验动物中心[SYXK(赣)2019-0002],在标准SPF级动物房饲养,湿度为40% ~70%,温度为20 ~22℃,12 h/12 h 光/暗循环。 动物实验经井冈山大学附属医院动物实验伦理委员会审核批准(JGSH2020016),并严格遵循3R 原则。
1.1.2 细胞
小鼠肾小球内皮细胞(mice glomerular endothelial cell,mGEC)购自美国ATCC,维持在含有10% FBS 和1%青霉素/链霉素的RPMI-1640 中。
1.2 主要试剂与仪器
Tubastatin A、STZ 购自美国Sigma-Aldrich 公司;尿蛋白、血清尿素氮和血清肌酐商业试剂盒购自南京建成生物工程研究所;DHE 染色剂、RIPA 缓冲液、BCA 蛋白质定量试剂盒购自上海Beyotime 公司;5%白蛋白牛V 购自北京Solarbio 公司;HDAC6、KIM1 兔一抗购自英国Abcam 公司;N-cadherin、Ecadherin、Vimentin、α-SMA、β-actin 兔一抗、抗兔IgG二抗均购自美国Proteintech 公司。
BX-51 光学显微镜购自日本Olympus 公司;H7650 显微镜购自日本日立公司;蛋白质印迹检测系统购自美国Bio-Rad Laboratories;CytoFLEX S 流式细胞仪购自美国Beckman 公司。
1.3 实验方法
1.3.1 动物分组
C57BL/6J 小鼠随机分为3 组(n=10):对照组、DN 组和Tubastatin A 组。 参照文献方法[11],对DN组和Tubastatin A 组小鼠进行DN 诱导,具体操作为:在异氟醚麻醉下,小鼠进行包膜下肾切除术以切除右肾。 每天对小鼠腹膜内注射STZ(80 mg/kg),持续3 d。 在STZ 注射后,Tubastatin A 组腹膜内注射Tubastatin A,剂量为30 mg/kg[12],每3 d 注射1 次,连续治疗8 周。 对照组和DN 组在相同时间注射等体积DMSO。 对照组接受剖腹手术,但不进行肾切除和腹膜内注射STZ。
1.3.2 生化测量
使用商业试剂盒测量小鼠24 h 尿蛋白、血清尿素氮和血清肌酐。
1.3.3 组织病理学分析
对于苏木精和伊红(hematoxylin-eosin,HE)染色,肾组织用10%中性甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋并切片(5 μm)。 然后将切片分别用苏木精和伊红染色15 min 和5 min。 对于PAS分析,肾切片首先用高碘酸孵育15 min,然后用希夫溶液染色10 min。 洗涤后,切片用苏木精复染3 min。 对于Masson 测定,在对肾石蜡切片进行常规脱蜡后,用Masson 三原色染料对切片进行染色。 在BX-51 光学显微镜下观察组织学变化。 从每个肾中随机选择20 个肾小球,使用Image J 软件量化系膜面积和Masson 染色的阳性区域。
1.3.4 RNA 测序分析
8 周后,从DN 组和Tubastatin A 组各取3 只小鼠的肾组织中提取总RNA。 RNA 测序由北京基因组研究所按照标准方案进行。 使用BGISEQ-500 平台对文库进行测序。
1.3.5 透射电子显微镜(transmission electron microscope,TEM)
对小鼠的肾组织进行TEM 分析。 将肾组织切成1 mm3块并浸入2.5%戊二醛中。 用0.1 mol/L磷酸冲洗肾组织并用锇酸固定30 min。 然后将切片脱水并包埋在丙酮中。 50 ~60 nm 切片用3%醋酸铀-柠檬酸铅钠染色,并安装在铜网格上,在H7650显微镜下拍照。 将底片数字化,获得最终放大倍数约为×23 000 的图像。 畸形线粒体被定义为具有可见嵴的局灶性丧失、在外周线粒体膜处残留嵴聚集和碎片化(长度<2 μm)的线粒体。
1.3.6 细胞处理
对于高葡萄糖(high glucose,HG) 处理,将mGEC 细胞暴露于补充有20 mmol/L 和40 mmol/L d-葡萄糖的完全培养基48 h[13]。 用5.5 mmol/L d-葡萄糖或40 mmol/L 甘露醇培养的细胞用作对照。为了考察Tubastatin A 对HG 环境下的mGEC 细胞损伤的改善作用,将细胞以5×104/孔接种于6 孔板中,并分为以下4 组:对照+DMSO 组、对照+Tubastatin A 组、HG +DMSO 组和HG +Tubastatin A组。 对照+DMSO 组加 入40 mmol/L 甘 露 醇 和DMSO 处理细胞48 h;对照+Tubastatin A 组加入40 mmol/L 甘露醇和500 nmol/L Tubastatin A 处理细胞48 h;HG +DMSO 组加入40 mmol/L d-葡萄糖和DMSO 处理细胞48 h;HG+Tubastatin A 组加入40 mmol/L d-葡萄糖和500 nmol/L Tubastatin A 处理细胞48 h。 所有分组一式三份。
1.3.7 ROS 水平检测
使用线粒体超氧化物指示剂测量mGEC 细胞中的线粒体ROS。 细胞用PBS 洗涤两次以去除培养基,随后在5 μmol/L MitoSOX Red 中于37℃孵育10 min,用PBS 洗涤3 次。 然后通过流式细胞术检测细胞。 使用DHE 染色估计肾组织中的ROS 水平。 将冷冻肾切片在丙酮中浸泡30 min,并在37℃下与DHE(5 μmol/L)一起孵育30 min。 使用BX-51 光学显微镜捕获图像。
1.3.8 蛋白质印迹分析
使用RIPA 裂解缓冲液提取细胞或肾组织中的总蛋白。 使用BCA 蛋白质定量试剂盒测量蛋白质浓度。 通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质并转移到聚偏二氟乙烯膜上。 在室温下用含5%牛血清白蛋白PBS 液封闭1 h 后,将膜与兔一抗(HDAC6,1 ∶800;N-cadherin、E-cadherin、Vimentin、α-SMA,1 ∶500;KIM1,1 ∶500)在4℃孵育过夜。 然后洗涤膜并与二抗(抗兔IgG,1 ∶3000)在室温下孵育1.5 h。 抗β-actin 抗体(1 ∶1000)作为对照。 用增强的化学发光试剂观察蛋白质条带,并使用蛋白质印迹检测系统量化信号密度。
1.3.9 流式细胞仪检测细胞凋亡
通过流式细胞术估计培养细胞的凋亡。 将处理后的细胞加入5 μL Annexin V-FITC,在室温下避光孵育10 min。 然后加入10 μL 碘化丙啶染色液,冰浴避光放置15 min,随后使用CytoFLEX S 流式细胞仪进行分析。
1.4 统计学方法
所有数据均使用SPSS 18.0 软件进行分析,并表示为平均数±标准误差(±s¯x)。t检验用于两组之间的比较,单因素方差分析(ANOVA)和Tukey 多重比较后检验用于3 组或更多组的比较。 以P<0.05 为差异具有统计学意义。
2 结果
2.1 HDAC6 在DN 小鼠的肾组织中上调
为了初步评估HDAC6 在DN 中的潜在参与,首先使用免疫印迹分析显示DN 小鼠肾组织中HDAC6 的上调,这与肾损伤标志物KIM1 水平升高一致(图1A、1B)。 在不同浓度葡萄糖(20 mmol/L和40 mmol/L)的mGEC 细胞中,HDAC6 表达也上调,伴随着KIM1 的表达增加(图1C、1D)。 这些结果表明HDAC6 表达在DN 肾组织中增加,提示HDAC6 可能参与DN 的发病机制。
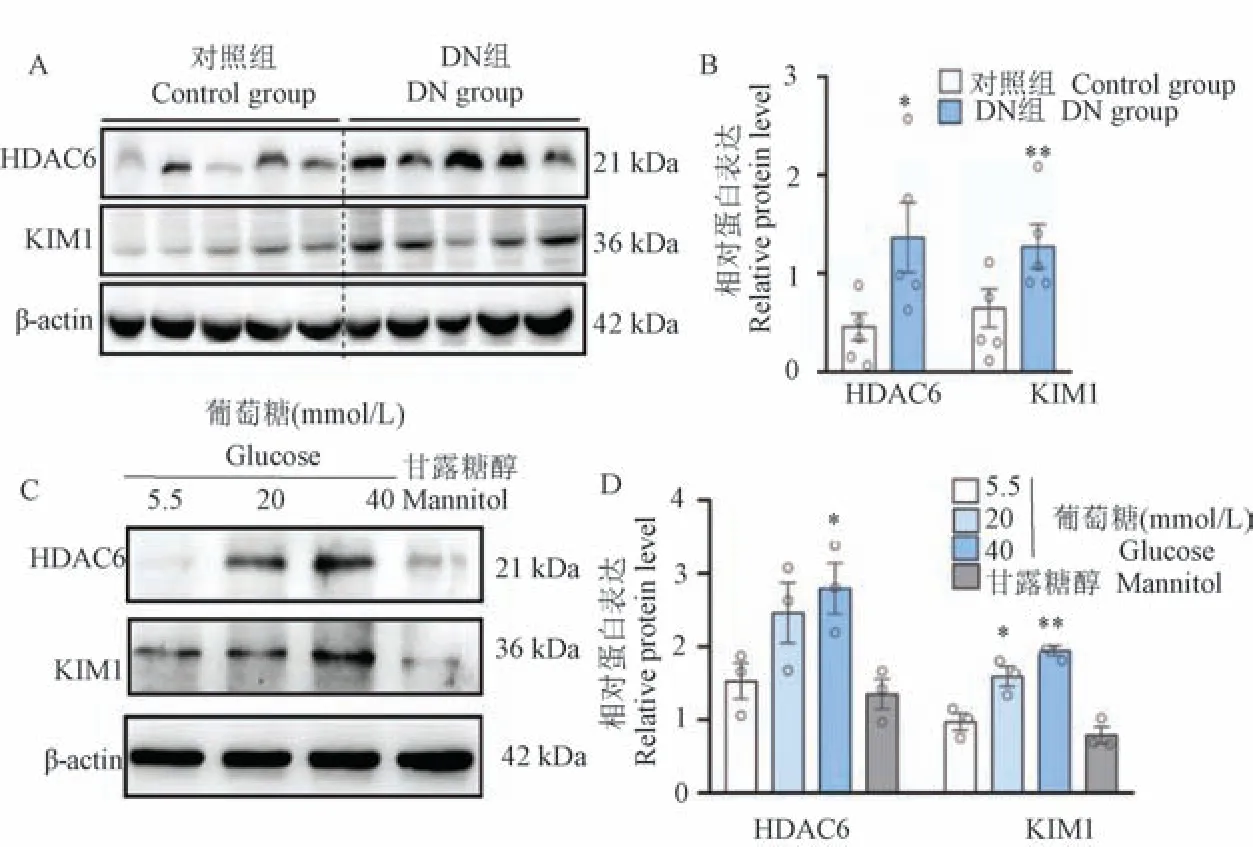
注:A、B:对照组小鼠(n =5)和DN 组小鼠(n =5)肾组织中HDAC6 和KIM-1 表达的蛋白质印迹分析和蛋白相对量。 C、D:用高葡萄糖处理的mGEC 细胞中HDAC6 和KIM-1 的蛋白质印迹分析和蛋白相对量。 与对照组相比, *P<0.05, **P<0.01。图1 HDAC6 在DN 小鼠的肾组织和高葡萄糖处理的mGEC 细胞中上调Note.A/B, Western blot analysis and optical density quantification of HDAC6 and KIM-1 expression in the kidney tissue of control mice (n=5)and DN group mice (n =5).C/D, Western blot analysis and optical density quantification of HDAC6 and KIM-1 in mGEC cells treated with high glucose quantification.Compared with control group, *P<0.05, **P<0.01.Figure 1 Upregulation of HDAC6 in renal tissue and high glucose treated mGEC cells of DN mice
2.2 Tubastatin A 可减轻DN 中的肾损伤和纤维化
为了进一步评估HDAC6 在DN 进展中的作用,我们向小鼠腹腔注射Tubastatin A 有效降低了肾组织中HDAC6 表达(图2A、2C)。 HE 和PAS 染色显示DN 小鼠发生显著形态学变化,包括肾小球肥大、肾小球系膜基质积聚、肾小球基底膜增厚和肾小管基底膜增厚。 Tubastatin A 治疗缓解了这些不良改变(图2B、2D)。 Masson 染色显示DN 小鼠出现肾小球和肾小管间质纤维化,Tubastatin A 治疗后纤维化程度得到缓解(P<0.05)(图2E)。 此外,与对照组相比,DN 组肾功能标志物尿蛋白/24 h、血清尿素氮和血清肌酐显著升高,而Tubastatin A 治疗降低了它们的水平(P<0.05)(图2F ~2H)。 这些数据表明,Tubastatin A 改善了DN 小鼠的肾功能。
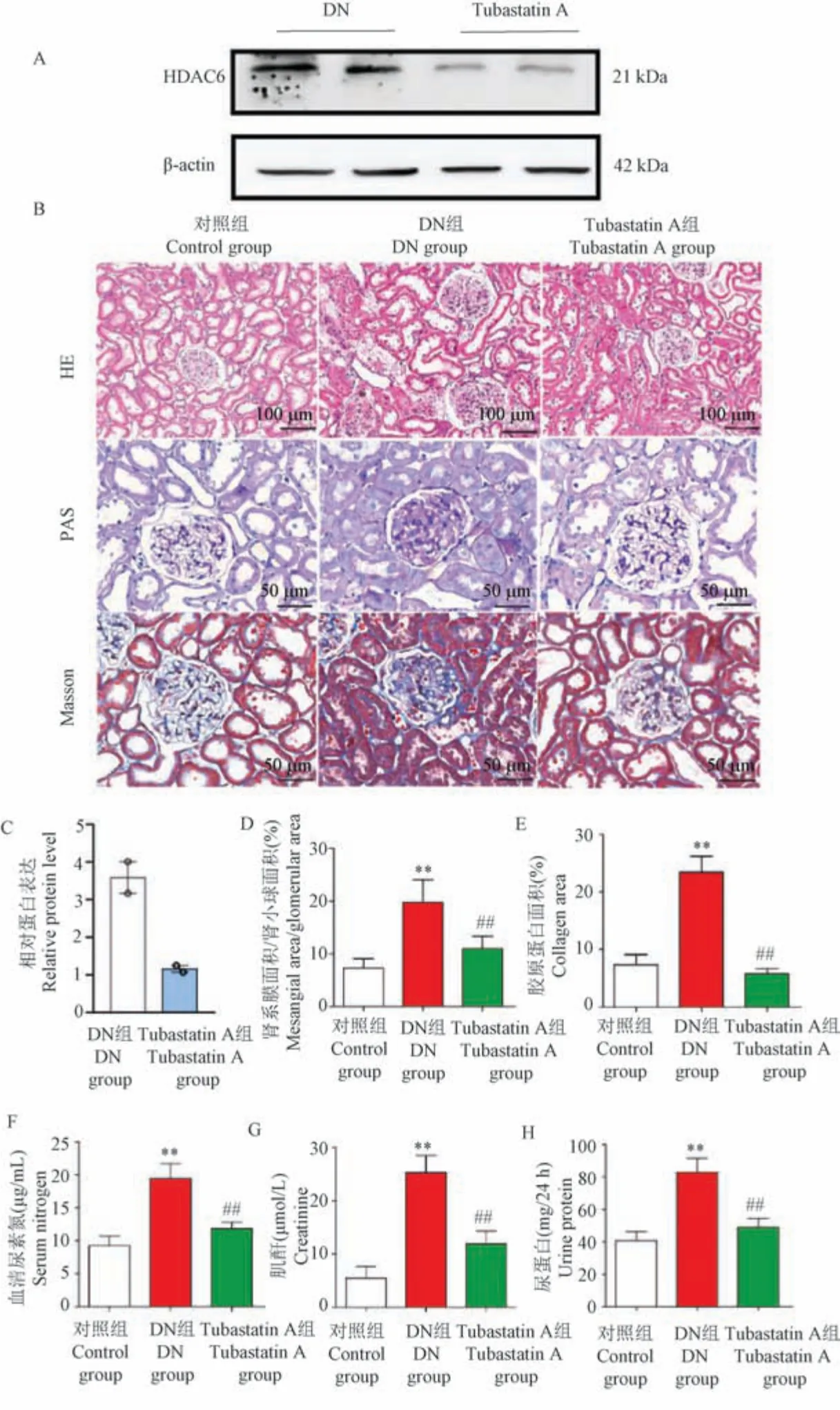
注:A、C:DN 组小鼠(n =5)和Tubastatin A 组小鼠(n =5)肾组织中HDAC6 和KIM-1 表达的蛋白质印迹分析和相对蛋白量;B:对照组小鼠(n =5)、DN 组小鼠(n =5)和Tubastatin A 组小鼠(n =5)肾的HE、PAS 和Masson 染色;D:肾系膜面积/肾小球面积的量化;E:肾胶原蛋白面积的量化;F:血清尿素氮;G:血清肌酐;H:24 h 的尿蛋白。 与对照组相比, **P<0.01;与DN 组相比, ##P<0.01。图2 Tubastatin A 减轻肾的形态变化并改善肾功能Note.A/C, Protein blot analysis and optical density quantification of HDAC6 and KIM-1 expression in renal tissue kidney tissues of DN group (n =5) and Tubastatin A group (n=5).B, HE, PAS and Masson staining of the kidney in control group (n=5), DN group (n =5) and Tubastatin A group (n =5).D, Quantification of renal tract area/glomerular area.E, Quantification of renal collagen area.F, Serum urea nitrogen.G, Serum creatinine.H, Urine protein at 24 h.Compared with control group, **P<0.01.Compared with DN group, ##P<0.01.Figure 2 Tubastatin A attenuates morphological changes in the kidney and improves renal function
2.3 Tubastatin A 改善HG 环境下的mGEC 细胞损伤和EMT
使用mGEC 进一步证实了HDAC6 参与HG 诱导的肾小球内皮细胞。 与体内数据一致,与对照DMSO 相比,Tubastatin A 在HG 处理下显著降低了mGEC 细胞中KIM1、HDAC6、α-SMA、N-钙粘蛋白、波形蛋白表达(P<0.05),并上调E-钙粘蛋白表达(P<0.05)(图3)。
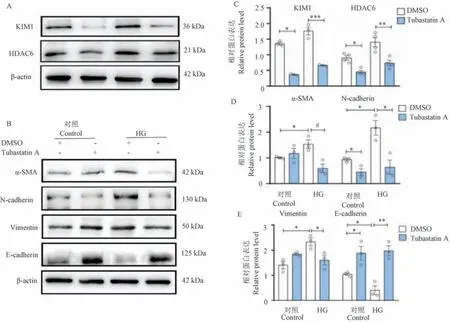
注:A、C:KIM1 和HDAC6 表达的蛋白质印迹分析和相对蛋白量;B、D、E:α-SMA、N-钙粘蛋白、波形蛋白和E-钙粘蛋白的蛋白质印迹分析和相对蛋白量。 与Control+DMSO 组相比, #P<0.05;与HG+DMSO 组相比, *P<0.05, **P<0.01, ***P<0.001。图3 Tubastatin A 改善HG 环境下的mGEC 细胞损伤和EMTNote.A/C, Protein blot analysis and optical density quantification of KIM1 and HDAC6 expression.B/D/E, Protein blot analysis and optical density quantification of α-SMA, N-calcineurin, waveform protein and E-calcineurin.Compared with Control+DMSO group, #P<0.05.Compared with HG+DMSO group, *P<0.05, **P<0.01, ***P<0.001.Figure 3 Tubastatin A ameliorates mGEC cell injury and EMT in HG environment
2.4 Tubastatin A 改善线粒体稳态并减少HG 环境下mGEC 凋亡
TEM 显示Tubastatin A 组小鼠的肾小球内皮细胞受损线粒体的比例较DN 组显著降低(P<0.01),表现为线粒体肿胀、内膜和/或外膜断裂以及线粒体嵴破裂(图4A、4B)。 此外,DHE 染色显示Tubastatin A 组小鼠肾组织中ROS 水平较DN 组降低(P<0.01)(图4C、4D),为了进一步研究HDAC6如何调节HG 诱导的肾小球内皮细胞损伤和EMT进展,我们对DN 组和Tubastatin A 组小鼠的肾进行了转录组学分析。 RNA 测序(RNA-seq)揭示了总共1294 个差异表达基因(DEG),包括821 个下调基因和473 个上调基因,I 定义为倍数变化≥2.00,调整后P≤0.001(图5A)。 基因集富集分析(GSEA)揭示了与DN 组小鼠相比,Tubastatin A 组小鼠肾组织中与ECM-受体相互作用和与三羧酸(TCA)循环相关的基因富集(图5B、5C),证实了HDAC6 的调节在EMT 过程和线粒体受损中的作用。 在mGEC细胞中,Tubastatin A 处理下调了HG 诱导的mGEC细胞中的线粒体ROS 水平(P<0.01)(图5D、5E),以及减少了细胞凋亡(P<0.05)(图5F、5G)。
3 讨论
越来越多的研究证实,Tubastatin A 通过抑制HDAC6 表达在许多疾病中发挥保护作用[14],如Chi等[15]报道Tubastatin A 可有效减轻血管紧张素II 诱导的高血压;Zheng 等[16]发现Tubastatin A 通过改善线粒体功能减轻骨关节炎的进展。 近年来,有学者发现,Tubastatin A 能够阻止了错误折叠的蛋白质聚集体在慢性肾病大鼠模型肾小管上皮细胞中的积累,减轻了蛋白尿的进展,限制了肾小管细胞的死亡和减少了肾小管间质胶原基质的沉积[12]。 此外,最近研究证实,Tubastatin A 抑制肾小管上皮细胞-间充质转化及肾间质成纤维细胞活化,表明其有希望成为防治肾间质纤维化的新型药物靶点[17]。 与先前的研究一致,本研究确定了Tubastatin A 对DN小鼠肾损伤的保护作用,提示HDAC6 在调节DN 进展中的关键作用。 在HG 条件下,HDAC6 破坏肾小球内皮细胞中的线粒体稳态和诱导了EMT 发生。我们的数据表明,HDAC6 上调是肾小球内皮细胞损伤和EMT 的催化剂,通过Tubastatin A 抑制HDAC6上调,最终减缓了DN 的发展。
近年来肾小球损伤在糖尿病肾病发病机制中的重要性得到强调[18-19]。 据报道,肾小球损伤是DN 进展的独立预测因子,并且EMT 是肾小球损伤的始动因素之一[20]。 我们的数据表明,HDAC6 表达在DN 小鼠模型的肾组织中显著上调。 重要的是,通过腹腔注射Tubastatin A 抑制肾组织中HDAC6 表达显著减弱了STZ 诱导的糖尿病小鼠的肾损伤和纤维化,而且还改善了肾功能(即尿蛋白/24 h、血清尿素氮和血清肌酐显著降低)。 与体内数据一致,体外结果证实了Tubastatin A 抑制了HG 诱导的mGEC 细胞的EMT 发生,表明Tubastatin A 可能通过减轻EMT 的发生减缓DNDN 的发展。 因此,HDAC6 是DN 肾小球细胞损伤的关键调节因子。
肾小球内皮细胞富含线粒体以满足高代谢能量需求,因此,它们容易受到线粒体生物能量学紊乱的影响[21]。 肾小球内皮细胞线粒体中ATP 产生不足与各种肾疾病有关,包括DN[22]。 越来越多的证据表明,线粒体动力学缺陷和线粒体过度氧化应激是DN 肾小管损伤的主要原因[23]。 因此,目前正在开发许多新的线粒体靶向策略来治疗肾疾病[24]。在这项研究中,我们发现Tubastatin A 显著改善了线粒体形态,同时在HG 条件下降低了线粒体ROS 水平。 因此,HDAC6 的抑制降低了肾小球内皮细胞的凋亡率。 这些数据表明,HDAC6 通过破坏线粒体稳态导致HG 诱导的肾小球内皮细胞凋亡。 先前研究将HDAC6 确定为参与坏死性凋亡和细胞凋亡的候选分子[7]。 据报道HDAC6 通过作用于多种信号通路来调节细胞死亡,例如Rac1 和p53 通路[25]。 本研究扩展了先前的发现,证明了HDAC6 破坏线粒体稳态并导致细胞凋亡,突出了HDAC6 在操纵细胞命运中的多种调节机制。
总之,这项研究表明,Tubastatin A 改善了HG诱导的肾小球内皮细胞损伤和DN 进展,其作用机制与保护线粒体稳态和抑制EMT 发生相关。 这些发现为DN 的治疗策略提供新的启示。 然而,Tubastatin A 通过何种途径调节线粒体稳态和EMT有待于进一步研究。
