角蛋白17 基因敲除加剧糖尿病小鼠的创面愈合障碍
2023-12-04侯道荣
鲍 丹,郭 蕊,侯道荣
(1.中国医学科学院皮肤病医院(中国医学科学院皮肤病研究所),北京协和医学院,南京 210000;2.南京医科大学,南京 210000)
糖尿病(diabetes mellitus,DM)是一种由于胰岛素分泌缺陷和/或胰岛素生物作用受损所致的,以高血糖为特征的代谢性疾病。 国际糖尿病联合会最新数据统计显示,2021 年,全球20 ~79 岁的人群DM 患病率为10.5%(5.366 亿人),预计到2045 年将上升至12.2%(7.832 亿人)[1]。 据报道,全球30%~97%DM 患者可能有皮肤病变或并发皮肤病[2]。 在中国大庆糖尿病研究中,DM 患者皮肤病的患病率为93.7%,75.7%的DM 患者有两种或两种以上的皮肤病[3],且DM 患者的皮肤病变多发生在DM 诊断之前[4],因此,皮肤的病理性改变对DM的初步识别和诊断具有重要意义。
创面愈合障碍是DM 最常见、最严重的皮肤并发症之一,也是当前DM 治疗中的一个重要医学问题。 DM 患者更容易出现慢性伤口,如糖尿病腿和足溃疡。 研究报道,DM 患者慢性伤口的终生患病风险为12%~25%[5]。 DM 患者的慢性创伤已成为非创伤性下肢截肢的主要原因(在美国,每年约有65 700 例),并造成严重的经济负担[6]。 现阶段,关于DM 创面愈合障碍发生发展的分子机制仍不完全清楚。
本实验室的前期研究发现,当皮肤受到损伤时,创面近端的角质形成细胞中角蛋白17(keratin 17,KRT17)的表达显著升高;而T2DM 小鼠创面中KRT17 的表达较对照组小鼠显著下调。 KRT17 是一种I 型角蛋白,在正常生理情况下,KRT17 主要表达于皮肤的附属物中;在某些疾病,如银屑病、乳腺癌、口腔鳞状细胞癌、胃癌等恶性肿瘤中,KRT17 异常过表达[7-8]。 现阶段,关于KRT17 的研究主要集中在其对银屑病的调控作用和潜在的临床治疗方面。 在银屑病的皮肤中,上调的KRT17 与T 细胞及细胞因子形成一个自身免疫环路[9];下调KRT17 的表达可减轻银屑病模型小鼠皮损的严重程度[10]。然而,KRT17 在T2DM 创面愈合中的研究仍较少,因此,本文旨在结合前期研究结果通过Krt17 基因敲除小鼠(Krt17-/-)分析Krt17 基因敲除对T2DM小鼠的创面愈合的影响。
1 材料和方法
1.1 实验动物
本实验所使用的实验动物为野生型(wild type,WT)C57BL/6J(雄性30 只)SPF 级小鼠和Krt17-/-(雄性30 只)SPF 级小鼠,5~6 周龄,体重18 ~20 g,由南京医科大学医药实验动物中心提供[SCXK(苏)2021-0001],小鼠饲养于中国医学科学院皮肤病医院(中国医学科学院皮肤病研究所)实验动物中心SPF 级屏障设施的饲养间[SYXK(苏)2022-0017],饲养间温度(23±2)℃,12 h/12 h 明/暗灯照,动物自由饮水和摄食。 实验中涉及动物操作程序均遵循3R 原则并已取得中国医学科学院皮肤病医院(中国医学科学院皮肤病研究所)实验动物福利伦理审查委员会的批准(2022-DW-026)。
1.2 主要试剂与仪器
链脲佐菌素(streptozotocin,STZ)(S0130)购自美国Sigma-Aldrich 公司;柠檬酸钠(#C12931024)和柠檬酸(#C13056322)购自上海麦克林生化科技有限公司;KRT17 抗体(#4543)购自美国Cell Signaling Technology 公司;60%高脂饲料购自江苏省协同医药生物工程有限责任公司。 电泳仪和电泳槽购自Bio-Rad 公司;组织脱水机、石蜡包埋机、石蜡切片机和荧光显微镜均购自德国Leica 公司。
1.3 实验方法
1.3.1 高脂饮食和STZ 联合诱导T2DM 小鼠模型并建立创面模型
选用5 周龄雄性WT 小鼠和Krt17-/-小鼠普通饲料饲养1 周适应环境后,随机分成6 组:WT 空白组、Krt17-/-空白组、WT 对照组、Krt17-/-对照组、WTT2DM 组和Krt17-/--T2DM 组(n=10)。 空白组小鼠普通饮料喂养且不制造任何伤口;对照组小鼠继续普通饲料喂养,T2DM 组小鼠60%高脂饲养喂养;4周后,T2DM 组小鼠腹腔注射STZ,剂量为40 mg/(kg·d),连续注射5 d,对照组小鼠腹腔注射同等量的生理盐水;STZ 注射1 周后,对照组和T2DM 组小鼠禁食12 h 后检测血糖,空腹血糖值≥11.1 mmol/L 视为T2DM 造模成功[11-13]。 T2DM 造模成功后1 周,小鼠异氟烷全身麻醉,背部剃毛,用6 mm环钻制造在体的皮肤圆形损伤,T2DM 组分为T2DM空白组(未制造创面)和T2DM 对照组(制造创面)。
1.3.2 免疫荧光染色和Western blot 检测KRT17在创面愈合中的定位和表达
于制造创面后第8 天,安乐死牺牲小鼠,取对照组和T2DM 组小鼠创面周围2 mm 的皮肤组织,一部分进行4%多聚甲醛固定24 h 后进行修块、脱水、包埋和切片;一部分进行RIPA 裂解液裂解、匀浆提取皮肤总蛋白。 免疫荧光染色和Western blot 检测KRT17 的定位和表达。
1.3.3 创面愈合速率的计算
于制造创面后的第0、2、4、6 和8 天拍照记录,运用ImageJ 软件定量分析创面愈合速率,创面愈合速率=(基线创面面积-第n天创面面积)/基线创面面积×100%。
1.3.4 创面愈合近端皮肤的病理组织学观察
于制造创面后第8 天,安乐死牺牲小鼠,取对照组和T2DM 组小鼠创面周围2 mm 的组织,进行4%多聚甲醛固定24 h 后进行修块、脱水、包埋、切片和苏木素-伊红(haematoxylin-eosin,HE)染色。
1.4 统计学方法
2 结果
2.1 高脂饮食和STZ 联合诱导T2DM 小鼠和创面愈合模型的建立
本研究采用高脂饮食和STZ 联合诱导的方法建立T2DM 小鼠模型,T2DM 造模成功后,再进行创面愈合模型的建立(图1A)。 STZ 注射前,与正常饮食的对照组小鼠相比,WT-T2DM 和Krt17-/--T2DM组小鼠60%高脂饮食4 周后,均表现出体重显著升高的表型(P<0.001,图1B);STZ 注射后1 周,与STZ 注射前相比,WT-T2DM 和Krt17-/--T2DM 组小鼠的体重均显著下降(P<0.001,图1B),呈现临床上T2DM 患者体重减轻的表型。 于STZ 注射1 周后,对4 组小鼠禁食12 h 后的空腹血糖检测发现,与WT 对 照 组和Krt17-/-对 照 组 小 鼠 相比,WTT2DM 组和Krt17-/--T2DM 组小鼠的空腹血糖值均显著升高,且均≥11.1 mmol/L(P<0.001,图1C),表明高脂饮食和STZ 联合诱导T2DM 小鼠造模成功。
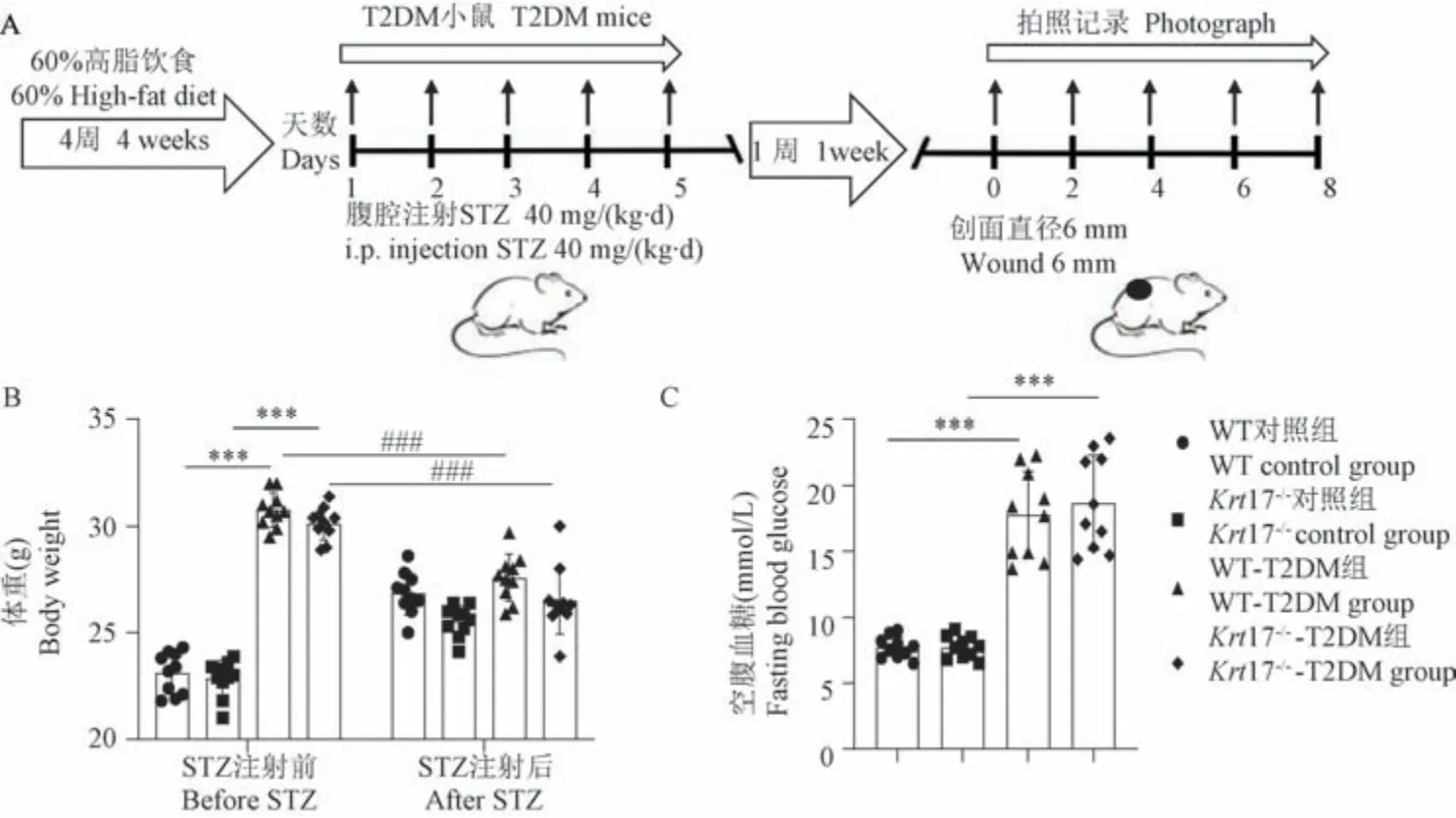
注:A:高脂饮食和STZ 联合诱导T2DM 小鼠和创面愈合模型的实验设计;B:STZ 注射前后的体重;C:STZ 注射1 周后的空腹血糖。 与WT 对照组和Krt17-/-对照组相比, ***P<0.001;与处理前后相比, ###P<0.001。图1 高脂饮食和STZ 联合诱导T2DM 小鼠和创面愈合模型的建立Note.A, Experimental design of high-fat diet combined with STZ to induce T2DM mice and wound healing models.B, Body weight before and after STZ injection.C, Fasting blood glucose after STZ injection 1 week.Compared with WT control group and Krt17-/- control group, ***P<0.001.Compared with before and after treatment, ###P<0.001.Figure 1 Establishment of T2DM and wound healing mice model induced by high-fat diet combined with STZ
2.2 KRT17 在T2DM 小鼠创面皮肤组织中的表达显著下调
高脂饮食和STZ 联合诱导T2DM 小鼠造模成功后,对WT 和T2DM 组小鼠在背部制造6 mm 在体的皮肤圆形损伤,于制造创面后第8 天,取WT 空白组和T2DM 空白组小鼠的皮肤及WT 对照组和T2DM对照组小鼠创面周围2 mm 的皮肤组织,检测KRT17 的表达水平。 结果显示,在未制造创面的情况下,WT 和T2DM 小鼠皮肤组织中KRT17 的表达水平无显著差别;制造在体皮肤创面后,WT 和T2DM 小鼠创面周围皮肤组织中KRT17 的表达水平均显著升高(P<0.001,P<0.01,图2);但与WT对照组小鼠相比,T2DM 小鼠创面周围皮肤组织中KRT17 的表达显著降低(P<0.001,图2)。 IF 染色的检测结果与Western blot 结果趋势一致,即在未制造创面情况下,KRT17 主要定位在毛囊中,WT 和T2DM 小鼠无显著差异;制造在体皮肤创面后,WT和T2DM 小鼠创面近端的角质形成细胞中KRT17的表达均显著升高,但与WT 小鼠相比,T2DM 小鼠创面近端的角质形成细胞中KRT17 的表达水平较低(图2C)。

注:A:Western blot 检测KRT17 在WT 空白组和T2DM 空白组(未制造创面)皮肤组织及WT 对照组和T2DM 对照组小鼠创面周围皮肤组织中的表达,内参:GAPDH;B:运用ImageJ 软件分析密度定量KRT17 的相对表达水平;C:IF 检测KRT17 在WT 和T2DM 空白组及WT 和T2DM 对照组小鼠创面周围皮肤组织中的表达。 蓝色:DAPI,细胞核;绿色:KRT17。 与WT 空白组和T2DM 空白组相比, ##P<0.01, ###P<0.001;与WT 对照组相比, ***P<0.001。图2 KRT17 在正常小鼠和T2DM 小鼠创面愈合皮肤中的表达Note.A, Expression of KRT17 in skin tissue of WT blank group, T2DM blank group, WT control group and T2DM control group mice detected by Western blot, using GAPDH as normalization.B, Relative expression level of KRT17 quantified by densitometric analysis using ImageJ software.C,Expression of KRT17 in skin tissue of WT blank group, T2DM blank group, WT control group and T2DM control group mice detected by IF.Blue,DAPI, cell nucleus.Green, KRT17.Compared with WT blank group and T2DM blank group, ##P<0.01, ###P<0.001.Compared with WT control group, ***P<0.001.Figure 2 Expression of KRT17 in wound healing skin tissue of normal and T2DM mice
2.3 Krt17 基因敲除减慢T2DM 小鼠的创面愈合速率
于制造创面后的第0、2、4、6 和8 天分别对4 组小鼠的创面拍照记录,运用ImageJ 软件定量分析创面愈合速率发现,在正常生理情况下,与WT 组小鼠相比,Krt17-/-组小鼠的创面愈合速率显著减慢,制造创面后的第8 天,WT 组小鼠创面愈合率达到88.94%,而Krt17-/-组 小 鼠 仅 为 78.06% (P<0.001),表明在正常生理情况下,Krt17 基因敲除对正常的创面愈合产生一定的影响。 在糖尿病病理情况下,与同一品系的对照组小鼠创面愈合率相比,WT-T2DM 和Krt17-/--T2DM 模型小鼠的创面愈合速率分别显著减慢37.65%和49.83%(P<0.01,P<0.001),表明T2DM 存在创面愈合障碍;此外,与WT-T2DM 组小鼠相比,Krt17-/--T2DM 组小鼠的创面愈合速率显著减慢,表明Krt17 基因敲除加剧了T2DM 创面愈合障碍的表型(图3)。
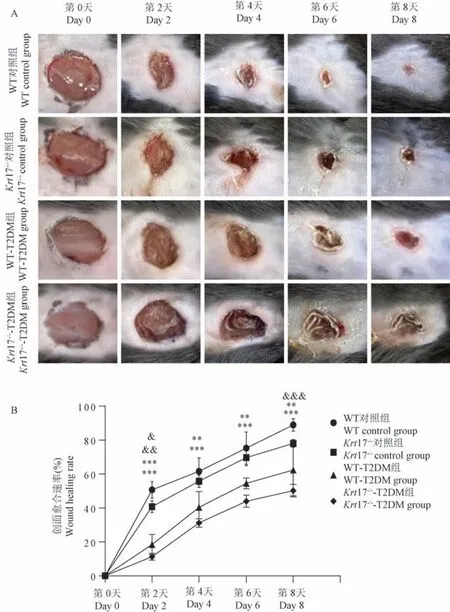
注:A:制造创面后的第0、2、4、6 和8 天的照片;B:运用ImageJ 软件定量分析创面愈合速率。 与WT 对照组和Krt17-/-对照组相比, **P<0.01, ***P<0.001;与WT 对照组和WT-T2DM 组相比, &P<0.05, &&P<0.01, &&&P<0.001。图3 WT 和Krt17-/-小鼠在正常生理和糖尿病病理情况下的创面愈合速率Note.A, Photos taken on days 0, 2, 4, 6 and 8 after wound made.B, Wound healing rate quantified by ImageJ software.Compared with WT control group and Krt17-/- control group, **P<0.01, ***P<0.001; Compared with WT control group and WT-T2DM group, &P<0.05, &&P<0.01, &&&P<0.001.Figure 3 Wound healing rate in WT and Krt17-/- mice under normal physiology and diabetic pathology
2.4 Krt17 基因敲除小鼠创面病理组织学变化
于制造创面后第8 天,分别取4 组小鼠创面周围2 mm 的皮肤组织,进行病理组织学表型分析(图4)。 结果显示,对照组:WT 小鼠创面几乎完全愈合,新生表皮较周围组织无显著差别;Krt17-/-组小鼠仍可见明显的创面床,且创面新生表皮较周围组织显著增厚。 T2DM 组:与对照组小鼠相比,WTT2DM 组和Krt17-/--T2DM 组小鼠创面愈合均显著延迟,且Krt17-/--T2DM 组小鼠创面近端有较多的炎性细胞浸润,创面局部仍处于持续的炎症状态。
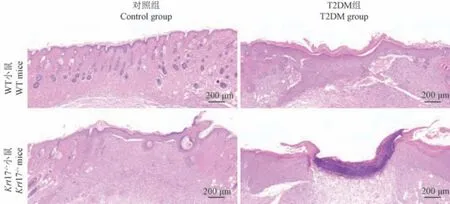
注:创面周围2 mm 的皮肤HE 染色观察。图4 WT 和Krt17-/-小鼠在正常生理和糖尿病病理情况下的皮肤病理组织学表型分析Note.Magnification of HE-stain sections of skin tissue around wound 2 mm.Figure 4 Histopathological phenotyping analysis of WT and Krt17-/- mice under normal physiology and diabetic pathology
3 讨论
本研究发现,在T2DM 小鼠创面近端皮肤组织中,KRT17 的表达水平较WT 对照组小鼠显著降低;Charles 等[14]利用互补的DNA 微阵列技术比较愈合的和未愈合的腿慢性伤口的差异表达基因时也发现,与正常皮肤创面愈合相比,在未愈合的慢性伤口中,Krt17 是前15 个表达下调的基因之一;提示KRT17 表达水平的下调可能阻碍了T2DM 慢性伤口的创面愈合。 随后,在对WT 和Krt17-/-小鼠进行T2DM 创面造模后的观察中发现,与WT 小鼠相比,Krt17-/-小鼠表现出明显的创面愈合延迟和炎症反应持续的表型,说明Krt17 基因敲除加剧了T2DM小鼠的创面愈合障碍。
创面愈合由4 个高度整合和重叠的阶段组成:止血、炎症、增殖和组织重构[15],表皮层的角质形成细胞、真皮层的成纤维细胞和微血管内皮细胞[16]以及各种炎症免疫细胞共同参与一系列的细胞和分子创面愈合过程。 当皮肤发生损伤时,角质形成细胞能迅速被激活并产生各种重要的皮肤屏障损伤相关分子,吸引和/或激活免疫细胞对损伤信号提供及时和长期的保护。 同时,创面近端的角质形成细胞也暂时中止末端分化,细胞大小形状、细胞之间的联系和细胞与基质间的黏附等方面的蛋白翻译也发生巨大变化,为创面愈合的迁移和增殖做准备[17]。
研究证实,KRT17 是关键的皮肤屏障损伤相关的重要分子之一[17],皮肤损伤时,角质形成细胞中的KRT17 迅速被激活,持续表达至创面愈合的重构阶段,直至皮肤屏障功能恢复。 激活的磷酸化的KRT17 与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,Mtor)通路的正调控因子14-3-3σ蛋白特异性相互作用[18],通过激活Mtor—蛋白激酶B(protein kinases B,AKT)通路促进蛋白质的合成和角质形成细胞的增殖,促进创面愈合[19]。 本研究中Krt17-/--T2DM 小鼠表现出明显的创面愈合延迟,可能与Krt17 基因缺失后,Mtor-AKT 信号下调有关;此外,Krt17-/--T2DM 小鼠创面局部持续的炎症状态也是导致其创面愈合障碍的一个重要因素[20]。
如前所述,角蛋白是创面愈合过程中角质形成细胞产生的第一波重要的皮肤屏障损伤相关的分子,为细胞提供锚定骨架、调节角质形成细胞增殖/分化和炎症反应[21],在创面愈合中发挥重要作用。研究发现,角蛋白敷料可通过增强小鼠角质形成细胞的活化从而加速创面愈合和再上皮化[22-23]。 由此可见,角蛋白的补充在促进创面愈合方面有很大的前景。 本研究发现KRT17 在T2DM 小鼠创面中表达下调,且敲除Krt17 加剧了T2DM 小鼠的创面愈合,这一发现为角蛋白在临床上治疗T2DM 创面愈合障碍的应用研发提供了一定的理论和实验依据。
