黄芩素介导自噬经由miR-449a/HDAC1 轴抑制喉癌细胞增殖及迁移的机制研究
2023-12-04剑孙永东周兴玮刘雷童兴科陈龙何
王 剑孙永东周兴玮刘 雷童兴科陈 龙何 娴*
(1.西南医科大学附属中医院,耳鼻咽喉头颈外科,四川 泸州 646000;2.西南医科大学中西医结合学院,四川 泸州 646000)
喉癌起源于喉黏液上皮组织的恶性肿瘤,多为鳞状细胞癌。 发病率占全身性癌症的1.5%[1]。 尽管对早期喉部鳞状细胞癌进行手术干预有很好的治疗效果,但对晚期和转移性肿瘤患者来说临床治疗效果较差,放疗和化疗是晚期病例的主要治疗方法,但有许多患者对放疗敏感或耐药[2],导致晚期喉癌5 年生存率仅有51%左右[3]。 喉癌具有易复发、易转移等特点,严重危害着人类的生命健康,因此确定喉癌的进展和分子调控机制,寻找新型治疗药物,并为喉癌患者制定新的治疗策略迫在眉睫。
自噬是一种溶酶体降解的途径,可以阻碍早期癌症的发生,又可以促进晚期肿瘤的发展[4]。 当细胞自噬发生异常的时候,会打破平衡导致癌症的发生,将自噬抑制剂与已建立的癌症治疗相结合可以提高癌症细胞的耐受性,起到更好的治疗作用[5]。microRNAs(miRNAs)是一类内源性非蛋白质编码小分子RNA,长度约为20 ~24 个核苷酸,通过与mRNA 互补结合,在转录后水平抑制靶基因的表达[3]。 由于miRNA 发挥着类似于癌基因或抑癌基因的作用,因此通过外源补充miRNA 或miRNA 抑制物可以调控mRNA 及其蛋白的表达,从而控制肿瘤恶性增殖和促进细胞凋亡[6]。 其中miR-499 被检测出有多重靶标,可以通过调控基因表达对多种恶性肿瘤发挥抑癌作用[7]。 根据生物信息学在线软件预测发现,HDAC1 与miR-449a 有靶向结合位点。最新研究发现,miR-449a 能够通过靶向抑制HDAC1的表达,抑制肺癌细胞的增殖、侵袭和转移[8]。 多项研究表明,HDAC 可以调节各种癌症的晚期恶性肿瘤和化疗耐药性,其在喉癌细胞中表达上调[9]。
黄芩素是我国传统中药黄芩的主要有效成分。黄芩素对多种恶性肿瘤有抑制作用,包括肝癌、结肠癌等[10-12]。 同时,近年来的多项研究发现,黄芩素对喉癌细胞的增殖、迁移和侵袭也具有明显的抑制作用,且可以诱导其发生凋亡和自噬[13-15]。 基于上述研究背景,本实验将miR-449a 的表达情况与黄芩素抑制喉癌细胞的作用联系起来,探究了miR-449a 的靶点,以此深入探究黄芩素的抑癌机制。 即探究黄芩素是否能通过介导自噬经由miR-449a/HDAC1 轴抑制喉癌细胞增殖及迁移,为临床喉癌治疗提供充分实验依据和理论基础。
1 材料和方法
1.1 细胞
人喉癌细胞(Hep-2)(货号:HTX2247)购于深圳豪地华拓生物科技有限公司。
1.2 主要试剂与仪器
黄芩素(C12455217)、6-氨基-3 甲基嘌呤(C12621613)购自上海麦克林生化科技有限公司;DMEM 高糖培养基(G4510)购自武汉赛维尔生物科技有限公司;胰酶(+EDTA)(SH30042.01)购自美国HyClone;胰酶(-EDTA)(0420A21)、RNA TRIzol Reagent(BM1144)购自合肥博美生物科技有限责任公司;胎牛血清(P20522)购自北京鼎国生物技术公司;MTT(1334GR001)购自德国BioFRoxx;二甲基亚砜(DMSO,A610163) 购自美国Sigma;AnnexinVAPC/PE 凋亡试剂盒(KGF003-20 T)购自江苏凯基生物技术股份有限公司;micrON hsa-miR-125b-5p mimic(miR10000423-1-5)、micrOFF hsa-miR-125b-5p inhibitor (miR20000423 - 1 - 5)、 Bulge-LoopTMmiRNA qRT-PCR Primer(R10031.7)、Bulge-LoopTMmiRNA qRT-PCR Starter Kit(R11067.2)购买于中国锐博生物;Beclin-1 抗体(A7353)、HDAC1 抗体(A19571)、 LC3B 抗 体( A19665)、 P62 抗 体(A11250)、β-actin 抗体(AC026)及生物素化山羊抗兔IgG(ab6721)均购自武汉爱博泰克生物科技有限公司。
实时荧光定量(RT-PCR)仪(PIKORed 96,美国ThermoFisher 仪器有限公司);电泳仪(JY200C,北京君意东方电泳设备有限公司);倒置生物显微镜(DMI1,上海徕卡显微系统贸易有限公司);台式低速离心机(TDZ4-WS,长沙湘仪离心机仪器有限公司);流式分析仪(cytoflex,美国Beckman);化学发光凝胶成像仪(5200,上海天能科技有限公司);透射电子显微镜(JEM-1400FLASH,日本电子JEOL)。
1.3 实验方法
1.3.1 细胞培养
HEP-2 细胞接种于含有10% 胎牛血清的DMEM 高糖培养基中,放入37℃,含5% CO2的孵箱培养。 选取状态良好的对数生长期的Hep-2 细胞进行传代,加入胰蛋白酶体积3 倍的新鲜培养基终止消化,消化后的细胞加入新鲜培养基,以1 ∶3 传代培养。 进行细胞计数并按要求稀释细胞悬液,胰蛋白酶消化收集细胞,吸取上清液后丢弃并加入1 mL冻存液(55% FBS+40% FBS+5% DMSO),混匀后转移至冻存管中密封。
1.3.2 MTT 法检测细胞增殖抑制率
取对数生长期的Hep-2 细胞,进行细胞计数后调节细胞密度为5×104/mL,每孔100 μL 接种于96孔板中,37℃、5% CO2条件下进行恒温培养。 待细胞贴壁后,设置组别:正常组、黄芩素组(200 μmol/L)、黄芩素(200 μmol/L)+3-MA(4 mmol/L)组、3-MA 组(4 mmol/L),加入相对应浓度的药物。 药物作用24 h 后,吸弃上清,每孔加入200 μL 终浓度为0.5 mg/mL 的MTT 溶液,37℃、5%CO2恒温继续培养4 h。 使用酶标仪在570 nm 波长处测定各孔的吸光值。
1.3.3 细胞划痕实验
取对数生长期的Hep-2 细胞,进行细胞计数后调节细胞密度为1×105/mL,每孔2 mL 接种于6 孔板中,37℃、5% CO2条件下恒温培养。 待细胞贴壁后,设置组别同1.3,培养24 h。 待细胞长满至单层,吸除上清液,移液枪取200 μL 枪头垂直于背后横线划痕。 PBS 轻轻洗涤2 次以去除划下细胞,放入37℃、5% CO2培养箱培养。 在0 h 及24 h 时间点分别取样,50 倍镜下在各水平直线标记处跟踪拍摄细胞划痕状态。 测量划痕距离,计算0 h 和24 h内迁移距离的平均值与标准差。
1.3.4 流式细胞仪检测细胞凋亡率
取对数生长期的Hep-2 细胞,每孔2 mL 接种于6 孔板中,37℃、5% CO2恒温培养。 待细胞贴壁后,按1.3 所述方法设置组别加入不同浓度药物培养。根据闫婷婷[5]的试验方法处理细胞并获得细胞沉淀。 用500 μL 的Binding Buffer 重悬细胞后,加入5 μL Annexin V APC 轻轻吹匀,再加入5 μL 的PE 混匀;室温避光反应15 min,上机检测分析。
1.3.5 Western blot 实验
收集黄芩素或3-MA 处理过或经miR-449a mimic 转染的喉癌细胞Hep-2,加入预冷的RIPA 裂解缓冲液200 μL,碎冰上裂解10 min,收集裂解液,在4℃、12 000 r/min 下离心15 min。 取出上清液,用BCA 蛋白检测试剂盒对蛋白质进行定量。 样品加载到10%聚丙烯酰胺进行SDS-PAGE 电泳,并转移到硝酸纤维素薄膜上(PVDF 膜)。 将PVDF 膜放入用TBST Buffer 稀释的5%脱脂奶粉并在室温下摇晃并孵化2 h,加入一抗(Beclin-1 1 ∶2000;HDAC1 1 ∶2000;LC3B 1 ∶2000;p62 1 ∶2000;β-actin 1 ∶100 000)。 在4℃下孵育过夜后,TBST 将膜洗涤3次,每次5 min。 然后加入相应的二抗(1 ∶5000),在室温下孵育2 ~3 h,TBST 膜洗3 次共30 min,进行化学发光反应显色。 用Image-J 图像分析软件分析目标蛋白的表达水平,以同一泳道的目标蛋白与β-actin 的灰度值比作为测量结果进行比较分析。
1.3.6 RT-PCR 检测
按照试剂盒的说明,分别用TRIzol 试剂提取转染、黄芩素或3-MA 处理后的Hep-2 细胞的总RNA。取5 μg 的总RNA,通过反转录反应合成cDNA。 纯化的RNA 作为模板,使用试剂盒合成cDNA。 用cDNA、Mir-X miRNA qRT-PCR TB Green®试剂盒和miR-449a 的基因特异引物进行RT-qPCR。 所有引物都是由生工生物技术(上海)有限公司合成。miR-449a 的 引 物 序 列, 正 向: 5 ’-ACTTTTATTGGTCTCAAGTCAGTGTACAG-3’, 反 向由Mir-X miRNA qRT-PCR TB Green®Kit 提供。 U6的引物序列由Mir-X miRNA qRT-PCR TB Green®Kit 提供。 反应结束后,计算机自动分析每个样品的Ct 值,miR-449a 以U6 为内参对照,通过2-△△Ct计算相对mRNA 表达量。
1.3.7 生物信息学分析及双荧光素酶试验
为了确定miR-449a 与HDAC1 之间的调节关系,本研究使用专门设计的荧光素酶载体进行了荧光素酶试验。 含有miR-449a 结合位点的HDAC1 的完整3’UTR 序列被扩增并亚克隆到pSI-Check2 载体中,生成HDAC1 的野生型载体(h-HDAC1-3UTRwt)。 设计不含有miR-449a 结合位点的HDAC1 的3’UTR 序列被扩增并亚克隆到pSI-Check2 载体中,生成HDAC1 的突变型载体(h-HDAC1-3UTR-mut)。根据涂友慧[16]的试验方法,准备好用于转染的细胞和目的质粒h-HDAC1-3UTR,将细胞转染后分为四组:NC mimics+h-HDAC1-3UTR-wt、hsa-miR-449a+h-HDAC1-3UTR-wt、NC mimics +h-HDAC1-3-UTR-mu及hsa-miR-449a+h-HDAC1-3UTR-mu。 细胞转染后于37℃,5% CO2条件下培养。 转染6 h 后换取新鲜培养基,48 h 后收集细胞,使用Promega Dual-Luciferase system 试剂盒检测。
1.3.8 透射电子显微镜观察自噬小体
Hep-2 人喉癌细胞共分为5 组,包括NC 组、黄芩素组、miR-449a mimic 组、黄芩素+mimic NC 组及黄芩素+miR-449a mimic 组。 样品经3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,Ep812 包埋,半薄切片用甲苯胺蓝染色作光学定位,用钻石刀作超薄切片,醋酸铀和枸橼酸铅染色,切片使用JEM-1400FLASH 透射电镜观察,每张铜网先于6000倍下观察,选择要观察的区域采集图片,观察具体病变。
1.4 统计学方法
2 结果
2.1 黄芩素对喉癌细胞增殖、迁移的影响
MTT 实验用于检测细胞存活和生长。 结果观察到, 黄芩素组细胞增殖抑制率为(27.69 ±5.66)%,正常组增值抑制率为(0.00±0.00)%,黄芩素组对比正常组细胞增殖抑制率增加极为明显(P<0.001)。 仅加入3-MA 处理的细胞增殖抑制率为(-3.23±4.03)%,低于正常组,即抑制喉癌细胞自噬后会诱导增加细胞的增殖。 同时加入黄芩素后,黄芩素+3-MA 组细胞增殖抑制率为(14.97±4.71)%,相较于3-MA 组细胞极显著增加(P<0.001)。 以上结果说明黄芩素可以抑制喉癌细胞增殖,且黄芩素联合3-MA 处理喉癌细胞后可逆转3-MA 抑制自噬引起的细胞增殖。
细胞划痕实验可用来检测细胞的迁移能力变化。 实验分别观察了细胞在0 h、24 h 的划痕愈合情况,结果如图1A,各组细胞0~24 h 平均迁移距离如图1B,其中经黄芩素处理后的细胞迁移距离为(168.91±9.78)μm,极显著小于正常组迁移距离(284.26±9.66)μm(P<0.001)。 3-MA 组细胞迁移距离较大为(279.32±19.390)μm,而黄芩素+3-MA组细胞迁移距离显著小于3-MA 组为(214.18±16.33)μm(P<0.001)。 以上结果证明黄芩素可使喉癌细胞迁移能力减弱,加入细胞自噬抑制剂3-MA时同时加入黄芩素处理可以恢复细胞自噬能力,减弱迁移能力。

注:A:细胞划痕实验观察细胞24 h 内迁移情况;B:各组细胞平均迁移距离。 a:正常组;b:黄芩组;c:黄芩组+3-MA 组;d:3-MA 组。 与正常组相比,***P<0.001;与3-MA 组相比, ###P<0.001。图1 黄芩素抑制喉癌细胞的迁移Note.A, Wound healing test to observe cell migration within 24h.B, Mean migration distance of cells in each group.a, Control group.b, Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, ***P<0.001.Compared with 3-MA group, ###P<0.001.Figure 1 Baicalein inhibits the migration of laryngeal cancer cells
2.2 黄芩素对喉癌细胞凋亡的影响
进一步采用流式细胞仪检测经3-MA 或黄芩素处理后Hep-2 细胞的凋亡率变化。 在图2A 的流式细胞图中,I 象限呈现晚期凋亡细胞,IV 象限呈现早期凋亡细胞,细胞凋亡率即第一象限和第四象限百分率的和。 细胞凋亡率统计结果详见图2B。 结果显示,与正常组相比,黄芩素处理后的喉癌细胞Hep-2 在I 和IV 象限出现了晚期凋亡和早期凋亡,凋亡率为(17.93±1.5)%,高于正常组细胞的凋亡率(3.71±0.36)%(P<0.05),具有统计学意义,表明黄芩素具有诱导喉癌细胞Hep-2 凋亡的作用。 3-MA 组细胞凋亡率为(3.25±0.15)%,与之相比,黄芩素+3-MA 组细胞在I 象限及IV 象限的凋亡率有显著增加(P<0.01),为(9.96±0.57)%。 说明加入黄芩素可以逆转3-MA 对细胞自噬的抑制作用,从而诱导细胞凋亡。

注:A:细胞凋亡率(流式细胞术);B:流式细胞图。 a:正常组;b:黄芩组;c:黄芩组+3-MA 组;d:3-MA 组。 与正常组相比, *P<0.05;与3-MA组相比, ##P<0.01。图2 黄芩素诱导细胞凋亡Note.A, Apoptosis rate (flow cytometry).B, Flow cytogram.a, Control group.b, Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, *P<0.05.Compared with 3-MA group, ##P<0.01.Figure 2 Baicalein induces apoptosis
2.3 黄芩素对喉癌细胞自噬流调控的影响
为探究黄芩素对喉癌细胞自噬的影响,检测了各组喉癌细胞中自噬相关蛋白的表达水平。 其中,Beclin-1 蛋白是参与自噬的特异性基因之一,在自噬的溶酶体降解途径中发挥抑制肿瘤的作用。 LC3是自噬体形成过程中的特异性标记蛋白,包括LC3I及LC3II。 LC3II 与LC3I 的比值与自噬体形成的数量和自噬发生的程度成正比[17]。 另外,p62 会通过与LC3 的直接结合并选择性地结合到自噬体中,最终在自噬溶酶体内有效降解。 因此,LC3II 升高联合p62 降低可以被认为是自噬水平提高的指标[18]。Western blot 结果如图3 所示,黄芩素组细胞的Beclin-1 蛋白表达显著高于正常组(P<0.01),LC3II/LC3I 比值极显著高于正常组(P<0.001),而p62 蛋白表达水平则显著低于正常组(P<0.01)。结果表明,黄芩素可以调控喉癌细胞Hep-2 的自噬相关基因表达,诱导喉癌细胞自噬。 经自噬抑制剂3-MA 处理后的细胞,自噬相关基因蛋白表达水平变化显著,但当黄芩素与3-MA 联合作用于Hep-2细胞后,其中Beclin-1 蛋白表达高于3-MA 组(P<0.05)和正常组,LC3II/LC3I 比值极显著高于3-MA组(P<0.001)和正常组,而p62 表达水平显著低于3-MA 组(P<0.01)和正常组,说明黄芩素可以逆转3-MA 的细胞自噬抑制作用并诱导细胞自噬。

注:A:Hep-2 细胞中Beclin-1、LC3I、LC3II、p62 蛋白的表达水平;B:Beclin-1 蛋白表达统计;C:p62 蛋白表达统计;D:LC3II/LC3I 蛋白表达比值大小;a:正常组;b:黄芩组;c:黄芩组+3-MA 组;d:3-MA 组。 与正常组相比,**P<0.01, ***P<0.001;与3-MA 组相比, #P<0.05,##P<0.01,###P<0.001。图3 黄芩素调控自噬相关基因表达Note.A, Expression levels of Beclin-1, LC3I, LC3II, and p62 proteins in Hep-2 cells.B, Statistical graph of Beclin-1 protein expression in Hep-2 cells.C, Statistical graph of p62 protein expression in Hep-2 cells.D, Size of LC3II/LC3I protein expression ratio in Hep-2 cells.a,Control group.b, Baicalein group.c, Baicalein +3-MA group.d, 3-MA group.Compared with control group, **P <0.01, ***P <0.001.Compared with 3-MA group, #P<0.05,##P<0.01,###P<0.001.Figure 3 Baicalein regulates autophagy-related gene expression
2.4 黄芩素对喉癌miR-449a/HDAC1 轴的影响
miR-449a 被发现在多种癌症中发挥肿瘤抑制作用[8],但在喉癌细胞中的作用尚不清楚。 PCR 结果如图4A 所示,黄芩素作用下喉癌细胞Hep-2 的miR-449a 表达相比正常组细胞有一定增加(P<0.05),自噬抑制剂3-MA 作用下喉癌细胞Hep-2 的miR-449amRNA 表达减少,但3-MA 与黄芩素联合处理后,miR-449a mRNA 表达对比正常组细胞和3-MA 组细胞均显著增加(P<0.01),说明黄芩素可以上调miR-449a 表达,并且可以逆转3-MA 抑制细胞自噬后引起的miR-449a 表达下调。
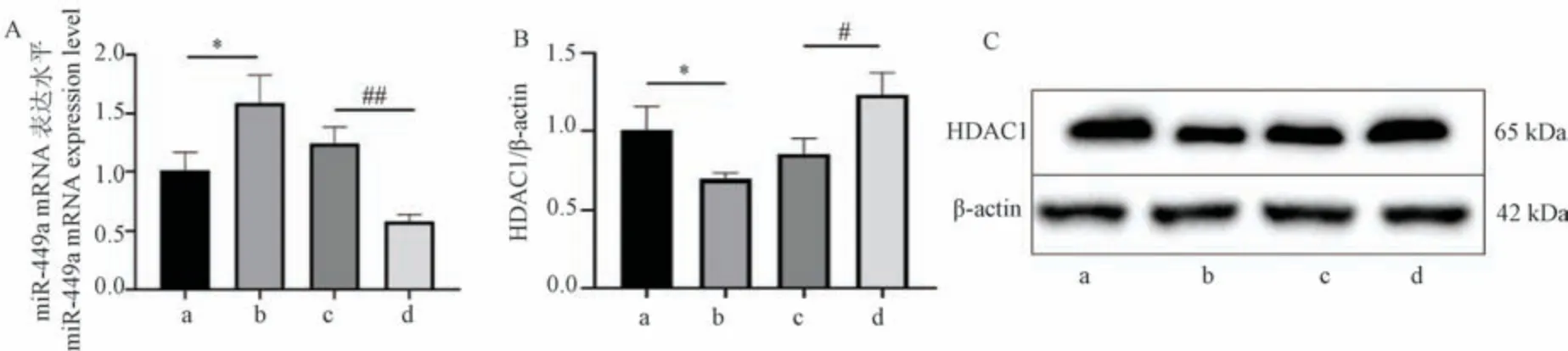
注:A:miR-449a 表达水平;B:HDAC1 蛋白表达统计;C:HDAC1 蛋白表达结果。 a:正常组;b:黄芩组;c:黄芩组+3-MA 组;d:3-MA 组。 与正常组相比, *P<0.05;与3-MA 组相比, #P<0.05,##P<0.01。图4 黄芩素上调miR-449a 表达水平和下调HDACI 蛋白表达Note.A, miR-449a expression level.B, Statistical plot of HDAC1 protein expression.C, HDAC1 protein expression results.a, Control group.b,Baicalein group.c, Baicalein+3-MA group.d, 3-MA group.Compared with control group, *P <0.05.Compared with 3-MA group, #P <0.05,##P<0.01.Figure 4 Baicalein up-regulates miR-449a expression level and down-regulates HDACI protein expression
HDAC1 经研究发现在喉癌细胞中表达上调[19],而Western blot 结果显示(图4B、4C),黄芩素组HDAC1 蛋白表达量低于正常组(P<0.05),黄芩素联合3-MA 组低于3-MA 组(P<0.05)。 这说明黄芩素可以下调喉癌细胞中HDAC1 表达。
2.5 miR-449a 与HDAC1 的靶向关系验证
经生物信息学在线软件预测,发现HDAC1 与miR-449a 的靶位点结合示意图如图5A。 双荧光素酶报告结果如图5B,与NC 组相比,hsa-miR-449a 能够显著下调h-HDAC1-3UTR-WT 的荧光素酶的表达(P<0.001),说明本实验中两者间存在结合作用。
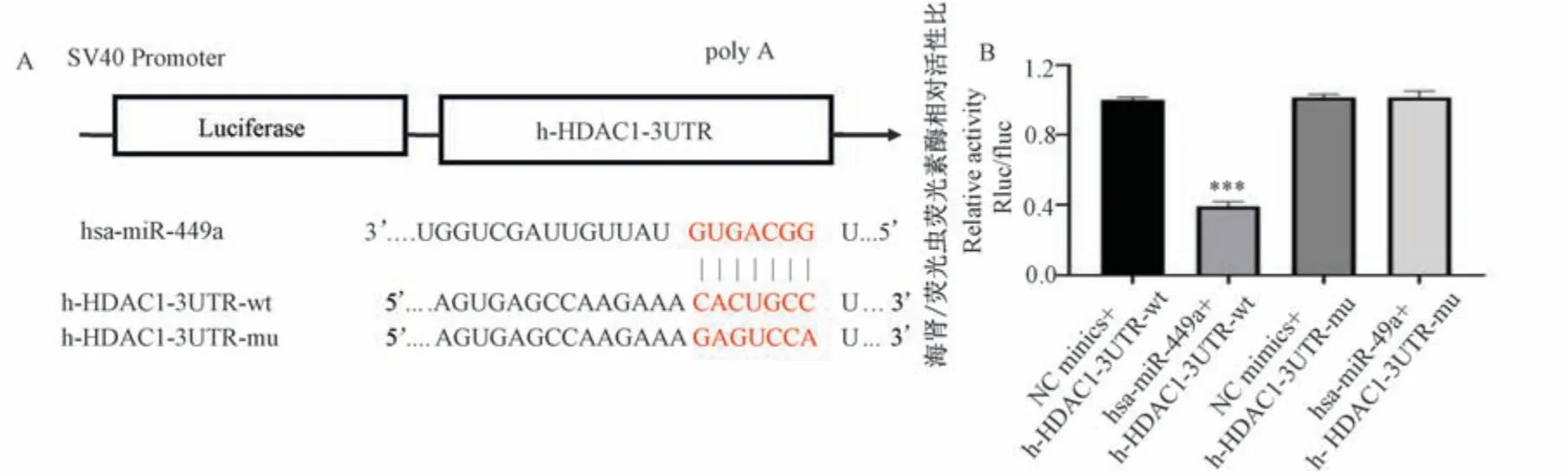
注:A:生物信息学分析hsa-miR-449a 与h-HDAC1-3UTR 靶位点结合示意图;B:双荧光素酶报告基因检测hsa-miR-449a 与h-HDAC1-3UTR相互作用。 与NC minics+h-HDAC1-3UTR-wt 组相比, ***P<0.001。图5 双荧光素酶报告基因检测荧光素酶活性Note.A, Schematic diagram of bioinformatics analysis of hsa-miR-449a binding to h-HDAC1-3UTR target site.B, Results of dual luciferase reporter gene assay for hsa-miR-449a interaction with h-HDAC1-3UTR.Compared with NC minics+h-HDAC1-3UTR-wt group, ***P<0.001.Figure 5 Luciferase activity was detected by Dual-luciferase reporter gene assay
2.6 黄芩素抑制喉癌细胞增殖及迁移的机制研究
MTT 法检测各组细胞增殖活力,结果如图6A所示,黄芩素组细胞增殖抑制率相比NC 组显著增加(P<0.01),Hep-2 细胞转染miR-449a mimic 后,细胞的增殖抑制率极显著增加(P<0.001),说明细胞可以通过黄芩素处理或miR-449a 上调抑制喉癌细胞的增殖;黄芩素组与黄芩素+mimic 组结果相近,说明mimic NC 对黄芩素的抑制作用没有影响;若黄芩素联合miR-449a mimic 转染,其增殖抑制率不仅比黄芩素+mimic NC 组细胞显著增加(P<0.01),同时比仅转染组的细胞极显著增高(P<0.001),说明黄芩素联合miR-449a mimic 处理细胞可以更显著地抑制喉癌细胞的增殖。
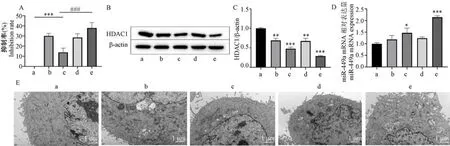
注:A:MTT 法检测细胞增殖抑制率;B:HDAC1 蛋白表达情况;C:HDAC1 蛋白表达统计图;D:miR-449a 表达水平;E:透射电镜(JEM-1400FLASH)观察细胞自噬小体。 a: NC 组;b: 黄芩素组c: miR-449a mimic 组;d: 黄芩素+mimic NC 组;e: 黄芩素+miR-449a mimic 组。 与NC 组相比, *P<0.05, **P<0.01, ***P<0.001;与miR-449a mimic 组相比,###P<0.001。图6 黄芩素诱导细胞自噬,经由miR-449a/HDAC1 轴作用喉癌细胞Note.A, Results of cell proliferation inhibition rate by MTT assay.B, HDAC1 protein expression.C, HDAC1 protein expression statistics.D, miR-449a expression level.E, Results of cellular autophagy vesicles observed by transmission electron microscopy (JEM-1400FLASH).a, NC group.b,Baicalein group.c, miR-449a mimic group.d, Baicalein+mimic NC group.e, Baicalein+miR-449a mimic group.Compared with NC group, *P<0.05, **P<0.01, ***P<0.001.Compared with miR-449a mimic group, ###P<0.001.Figure 6 Baicalein induces autophagy and acts on laryngeal cancer cells via the miR-449a/HDAC1 axis
Western blot 结果如图6B、6C,黄芩素联合miR-449a mimic 转染时,喉癌细胞HDAC1 表达水平最低,黄芩素组和miR-449a mimic 组均显著低于NC组(P<0.01)。 说明细胞通过黄芩素处理或上调miR-449a 表达均可以降低HDAC1 蛋白表达从而抑制喉癌细胞。 PCR 结果如图6D,黄芩素组相比NC组,细胞miR-449a 表达水平有一定升高但不显著,联合miR-449a mimic 转染后则有极显著增加(P<0.001)。
为了更直观地证明黄芩素能够诱导Hep-2 细胞的自噬,通过透射电子显微镜观察自噬小体数量的变化,结果如图6E,NC 组细胞内细胞质均匀,经黄芩素处理后的Hep-2 细胞,细胞质中出现囊泡状双膜结构,即自噬小体,当自噬发展到后期则形成自噬溶酶体,当黄芩素与miR-449a mimic 联合作用于细胞,喉癌细胞中自噬溶酶体数量明显增加,细胞核开始出现皱缩和裂解,细胞状态变差,更进一步证明了黄芩素可以诱导喉癌细胞Hep-2 自噬。
3 讨论
喉癌是最常见的头颈部恶性肿瘤之一,其病因主要有吸烟、慢性喉炎及空气污染等,发病率极高且容易复发,这也是其预后效果较差的主要原因[20]。 最近几年来,有关中药抗喉癌的研究取得一定进展。 郭俊宇等[21]研究发现,丹酚酸B 能够抑制喉癌细胞Hep-2 增殖并诱导细胞凋亡;周华群等[22]研究发现姜黄素与白藜芦醇联合处理会抑制Hep-2细胞集落的形成并促进凋亡。 实验前期通过MTT实验及细胞划痕实验,证明了黄芩素对Hep-2 细胞增殖及迁移的抑制作用。
细胞凋亡是程序性细胞死亡的一种表现形态,主要负责移除机体多余的以及受损的细胞[23]。 癌细胞的凋亡在癌症的恶性进展和转移中起着关键作用[24]。 诱导肿瘤细胞凋亡可用于治疗癌症[25],但由于凋亡的诱发和调节机制不同,各种肿瘤药物诱发细胞凋亡的机制也不同。 有许多天然化合物被证明可以诱导肿瘤细胞中被阻断的细胞凋亡通路[26],其中包括黄酮类化合物。 本研究通过流式细胞仪检测细胞凋亡率发现,黄芩素可以诱导喉癌细胞Hep-2 的凋亡。 并且,黄芩素与3-MA 共同作用于细胞时,可以逆转由3-MA 抑制自噬引起的凋亡抑制作用。
细胞自噬是一种高度保守的自我降解过程,在细胞应激中起关键作用,自噬可以调节肿瘤的形成、增殖、转移及能量代谢等[27]。 凋亡与自噬之间的关系错综复杂,当细胞处于应激条件下,自噬被诱导发生,细胞凋亡被激活,两者之间可以互相转换[28]。 自噬和凋亡过程中涉及到的关键调节蛋白具有双重调节作用。 例如,Beclin-1 作为自噬过程中的调节蛋白,同时可以调控凋亡过程。
Beclin-1 是III 类PI3K 复合物的亚基,其与自噬前体的结合启动自噬体的形成,该蛋白是自噬体形成所必需[29]。 LC3I 会在自噬形成时被酶解,使其与磷脂酰乙醇胺结合转变为LC3II,因此检测LC3II 与LC3I 的比值可用来评估自噬水平的高低[30]。 p62 是一种泛素结合蛋白,参与多种细胞信号转导调控及自噬调控,p62 表达水平高低与自噬负相关[31]。 为进一步确定黄芩素对喉癌细胞自噬的影响,通过Western blot 实验检测以上四种自噬相关基因蛋白表达的水平。 结果发现黄芩素在作用于Hep-2 细胞时,同样可以诱导细胞自噬现象。 并且实验通过透射电子显微镜观察发现,上调miR-449a 表达与黄芩素处理均可诱导细胞自噬增加细胞内自噬小体数量。
大量实验证明,miRNA 可以通过多个相关基因调控喉癌的发展和转移[32],虽然黄芩素对喉癌细胞的作用研究较多,但黄芩素调控miRNAs 在喉癌中扮演何种的角色,这方面的研究仍然未见报道。miRNA 可以通过多种细胞调节通路调节细胞发育、分化、增殖和凋亡[33],其中miR-499a 是miR-499 家族中最常见的亚型,可以调节多种癌症中的细胞增殖、凋亡、迁移及细胞侵袭[34-35]。 miR-449a 下调会促进乳腺癌细胞迁移和侵袭[36],抑制NCCLC(非小细胞肺癌)细胞的增殖、迁移和侵袭[37],且miR-449a 在喉癌细胞中表达下调[38]。 本研究通过PCR实验检测确定,黄芩素可以上调喉癌细胞miR-449a的表达水平,从而达到抑制喉癌细胞增殖等作用。
miR-449 作用机制包括三种,最常见的途径即通过下调组蛋白去乙酰化酶(HDAC1)和沉默调节蛋白1(SIRT1),诱导肿瘤蛋白p53 依赖性细胞凋亡。 有研究发现HDAC1 促进了喉癌的形成和发展[39],但HDAC1 在喉癌细胞增殖和迁移中的作用尚不明确。 本实验经过生物信息学软件预测分析推测miR-449a 与HDAC1 靶向结合参与了喉癌的发生发展,通过双荧光素酶报告基因实验鉴定验证,hsa-miR-449a 能够显著下调h-HDAC1-3UTR-WT 的荧光素酶的表达,两者间的确存在结合作用。 接着通过Western blot 和PCR 实验检测发现黄芩素处理或上调miR-449a 均可以下调HDAC1 在喉癌细胞中的表达水平,说明黄芩素作用下过表达的miR-449a抑制了HDAC1 的表达,与软件预测结果一致。
综上所述,黄芩素可以介导喉癌细胞Hep-2 自噬,通过上调miR-449a 表达达到下调HDAC1 表达的作用,进而抑制喉癌细胞的增殖及迁移,并诱导细胞凋亡。 中药单体可以通过调控多条信号通路来影响喉癌的发展,但对于这些通路如何相互影响的研究不多,本研究结果证明miR-449a 与HDAC1在喉癌细胞发展中的结合作用,可对黄芩素成为临床潜在的新的化疗药物,从而辅助治疗喉癌提供理论及实验依据,黄芩素对于喉癌细胞的作用还需要更加深入研究分子机制,为后期临床试验补充依据。
