獐牙菜苦苷通过调控miR-351-5p 表达对6-羟基多巴胺诱导PC12 细胞帕金森模型损伤的影响
2023-11-23周喜燕马晓维张鑫鑫
周喜燕,马晓维,李 彬,张鑫鑫,郭 联,于 淼,王 群
[青岛市中医医院(市海慈医院) 神经内科,山东 青岛 266033]
帕金森病又称震颤麻痹,是第二常见的神经退行性疾病,主要发生于中老年人[1]。帕金森病临床表现包括静止性震颤、运动迟缓、肌肉僵硬、平衡障碍和姿势不稳; 非运动症状包括嗅觉功能障碍、疼痛、疲劳、睡眠障碍、自主神经功能障碍和认知功能障碍等,严重影响患者生活质量[2]。大量证据表明,中脑黑质部位发生多巴胺能神经元凋亡是帕金森病的主要病因和症结[3]。因此,探索帕金森病发病机制,寻找新的治疗策略已迫在眉睫。
獐牙菜苦苷是一种从龙胆科药用植物中分离出的裂环烯醚萜苷[4],可预防多种炎症相关疾病。研究报道,獐牙菜苦苷可通过增强α-synuclein 抑制基因和MAPK 通路激活SKN-1/NRF-2 抑制帕金森病相关神经毒性[5]。但獐牙菜苦苷治疗帕金森病的药理分子机制尚不清楚。微小RNA(microRNA) 是一类长度仅为18~25 bp 的非编码RNA,研究表明,miR-351-5p 可通过靶向MAPK13 和sirtuin-6 促进肠黏膜氧化应激、炎症和凋亡,从而加重肠缺血/再灌注损伤[6]。在脂多糖(LPS) 诱导的急性肺损伤中,miR-351-5p表达升高,抑制miR-351-5p表达可减轻肺氧化应激和炎症,过表达miR-351-5p则相反[7]。然而,miR-351-5p在帕金森病中的作用尚未可知。因此,本实验旨在研究獐牙菜苦苷对6-羟基多巴(6-OHDA) 诱导PC12 细胞损伤的影响,探究其对miR-351-5p 的调控作用,为帕金森病的治疗提供新方向。
1 材料
PC12 细胞购自无锡欣润生物科技有限公司。獐牙菜苦苷(纯度>98%,货号110785-201904,中国食品药品检定研究院)。6-OHDA (美国Sigma 公司); 胎牛血清、RPMI-1640 培养基(美国Gibco 公司); MTT 试剂盒(上海美轩生物科技有限公司); LDH、SOD 和MDA 检测试剂盒(南京建成生物工程研究所); Annexin V-FITC / PI 法试剂盒(上海瓦兰生物科技有限公司); RIPA 蛋白裂解液、二辛可宁酸(BCA) 试剂盒(北京百奥莱博科技有限公司);TRIzol 试剂、反转录试剂盒、荧光定量试剂盒 (日本TaKaRa 公司); Lipofectamine2000 转染试剂 ( 美国Invitrogen 公司)。
2 方法
2.1 细胞分组与处理 以含100 μmol/L 6-OHDA 的细胞培养液处理PC12 细胞24 h,记为6-OHDA 组[8]; 未经6-OHDA 处理的记为对照组; 用30、60、120 μmol/L 獐牙菜苦苷[9]处理PC12 细胞24 h,再经6-OHDA 处理,分别记为獐牙菜苦苷低、中、高剂量组; 分别将anti-miR-NC、antimiR-351-5p 转染至PC12 细胞,再经6-OHDA 处理,记为anti-miR-NC 组、anti-miR-351-5p 组; 分别将miR-NC、miR-351-5p 转染至PC12 细胞,再经120 μmol/L 獐牙菜苦苷和6-OHDA 处理,记为獐牙菜苦苷+miR-NC 组、獐牙菜苦苷+miR-351-5p 组。各组转染操作按照Lipofectamine2000 试剂盒说明书进行。
2.2 MTT 法检测细胞存活率 将各组PC12 细胞以2×105/mL 密度接种于96 孔板,每孔100 μL,培养24 h 后,每孔加入20 μL MTT 溶液,室温孵育4 h,弃上清,每孔加入150 μL DMSO,室温振荡5 min,酶标仪检测490 nm 波长处的吸光度(OD) 值,并计算细胞存活率,公式为细胞存活率= (OD实验组/OD对照组) ×100%。
2.3 LDH、SOD 活性和MDA 水平检测 取各组PC12 细胞,加入细胞裂解液,冰上裂解30 min,离心后收集上清液,按照试剂盒说明检测LDH、SOD 活性和MDA 水平。
2.4 流式细胞术检测细胞凋亡情况 按照Annexin VFITC/PI 凋亡检测试剂盒说明书检测PC12 细胞凋亡,收集各组细胞并用PBS 漂洗,0.25%胰蛋白酶消化液消化,用完全培养基制成细胞悬液,1 000 r/min 离心5 min,弃上清,PBS 漂洗2 次,离心后收集细胞,195 μL 结合缓冲液重悬,加入5 μL Annexin V-FITC 和10 μL 碘化丙啶(PI),37 ℃孵育15 min 后,通过流式细胞仪检测细胞凋亡率。
2.5 Western blot 法检测细胞Bax、Bcl-2 蛋白表达 收集各组PC12 细胞,加入细胞裂解液200 μL,于冰上裂解,离心收集上清蛋白样品,采用BCA 试剂盒检测蛋白浓度,将Loading buffer 与蛋白样品充分混匀,沸水浴加热5 min致蛋白变性。取60 μg 变性蛋白样品进行SDS-PAGE 电泳,而后转移至PVDF 膜上,5% 脱脂牛奶室温封闭1.5 h,加入Bcl-2、Bax 一抗(1 ∶1 000) 4 ℃孵育过夜,PBS 洗涤3次,加入二抗(1 ∶2 000) 室温孵育2 h,PBS 洗涤3 次,滴加ECL 显色液,暗室中曝光显影,定影,Image J 软件分析蛋白条带灰度值,目的蛋白表达量以其与内参的灰度值比值表示。
2.6 RT-qPCR 法检测miR-351-5p表达 采用TRIzol 试剂提取各组PC12 细胞总RNA,按照反转录试剂盒反转录成cDNA,以U6 为内参,用cDNA 作为模板进行RT-qPCR 反应,反应条件为95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40 次。采用2-ΔΔCT法计算miR-351-5p相对表达量。引物由生工生物工程(上海)股份有限公司合成。
2.7 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以(±s) 表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
3 结果
3.1 獐牙菜苦苷对6-OHDA 诱导PC12 细胞存活率的影响 如表1 所示,与对照组比较,6-OHDA 组PC12 细胞存活率降低(P<0.05); 与6-OHDA 组比较,獐牙菜苦苷各剂量组PC12 细胞存活率升高(P<0.05),且呈剂量依赖性。
表1 獐牙菜苦苷对6-OHDA 诱导PC12 细胞存活率的影响(±s,n=9)
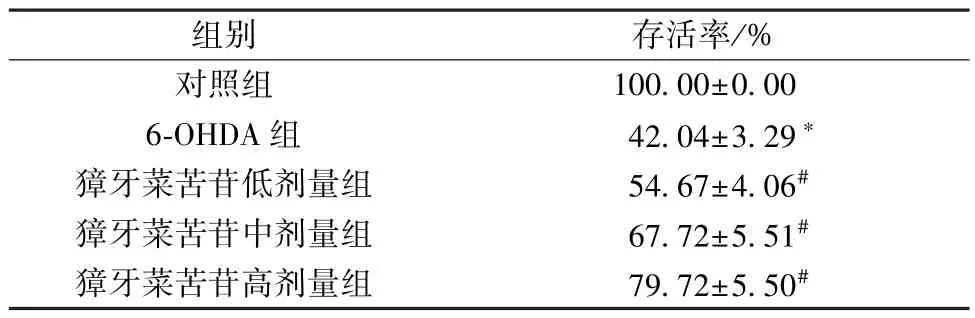
表1 獐牙菜苦苷对6-OHDA 诱导PC12 细胞存活率的影响(±s,n=9)
注: 与对照组比较,*P<0.05; 与6-OHDA 组比较,#P<0.05。
组别存活率/%对照组100.00±0.00 6-OHDA 组42.04±3.29*獐牙菜苦苷低剂量组54.67±4.06#獐牙菜苦苷中剂量组67.72±5.51#獐牙菜苦苷高剂量组79.72±5.50#
3.2 獐牙菜苦苷对6-OHDA 诱导PC12 细胞氧化应激的影响 如表2 所示,与对照组比较,6-OHDA 组PC12 细胞LDH 活性和MDA 水平升高 (P<0.05),SOD 活性降低(P<0.05); 与6-OHDA 组比较,獐牙菜苦苷各剂量组PC12 细胞LDH 活性和MDA 水平降低(P<0.05),SOD 活性升高(P<0.05),且呈剂量依赖性。
表2 獐牙菜苦苷对6-OHDA 诱导PC12 细胞氧化应激的影响(±s,n=9)
注: 与对照组比较,*P<0.05; 与6-OHDA 组比较,#P<0.05。
组别LDH/(U·L-1) SOD/(U·mg-1)MDA/(nmol·mg-1)对照组24.57±2.3491.45±8.094.06±0.33 6-OHDA 组80.66±7.48* 32.57±3.17* 32.57±3.18*獐牙菜苦苷低剂量组 65.38±5.08#49.03±4.12# 24.33±2.28#獐牙菜苦苷中剂量组 50.02±4.86#64.72±5.46# 16.21±1.34#獐牙菜苦苷高剂量组 33.94±3.14#83.68±6.05# 7.74±0.68#
3.3 獐牙菜苦苷对6-OHDA 诱导PC12 细胞凋亡的影响如图1、表3 所示,与对照组比较,6-OHDA 组PC12 细胞凋亡率、Bax 蛋白表达升高(P<0.05),Bcl-2 蛋白表达降低(P<0.05); 与6-OHDA 组比较,獐牙菜苦苷各剂量组PC12 细胞凋亡率、Bax 蛋白表达降低(P<0.05),Bcl-2 蛋白表达升高(P<0.05),且呈剂量依赖性。
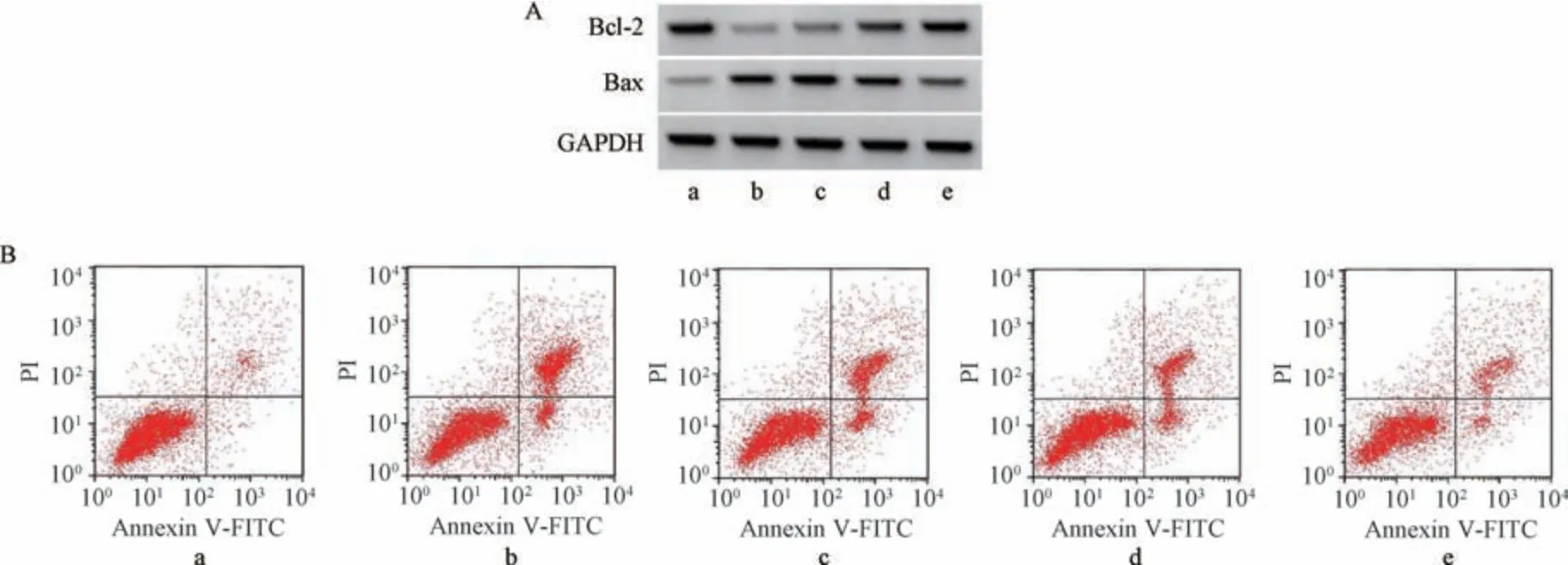
图1 獐牙菜苦苷对6-OHDA 诱导PC12 细胞凋亡的影响
表3 獐牙菜苦苷对6-OHDA 诱导PC12 细胞凋亡的影响(±s,n=9)
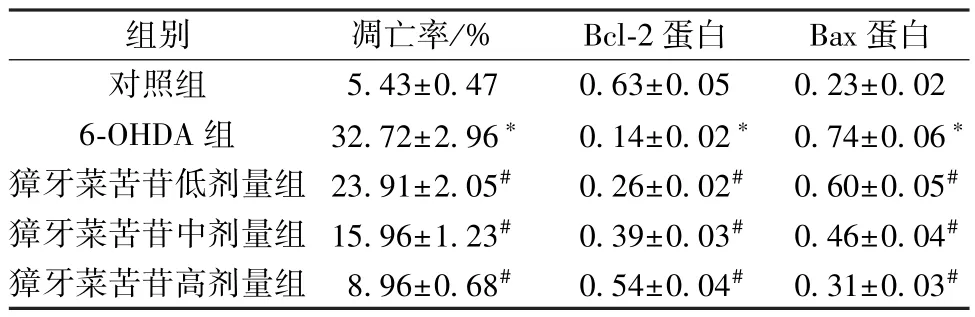
表3 獐牙菜苦苷对6-OHDA 诱导PC12 细胞凋亡的影响(±s,n=9)
注: 与对照组比较,*P<0.05; 与6-OHDA 组比较,#P<0.05。
组别凋亡率/%Bcl-2 蛋白Bax 蛋白对照组5.43±0.470.63±0.050.23±0.02 6-OHDA 组32.72±2.96*0.14±0.02* 0.74±0.06*獐牙菜苦苷低剂量组 23.91±2.05#0.26±0.02#0.60±0.05#獐牙菜苦苷中剂量组 15.96±1.23#0.39±0.03#0.46±0.04#獐牙菜苦苷高剂量组 8.96±0.68#0.54±0.04#0.31±0.03#
3.4 獐牙菜苦苷对6-OHDA 诱导PC12 细胞miR-351-5p表达的影响 如表4 所示,与对照组比较,6-OHDA 组PC12细胞miR-351-5p表达升高(P<0.05); 与6-OHDA 组比较,獐牙菜苦苷各剂量组PC12 细胞miR-351-5p表达降低(P<0.05),且呈剂量依赖性。
表4 獐牙菜苦苷对6-OHDA 诱导PC12 细胞miR-351-5p表达的影响(±s,n=9)

表4 獐牙菜苦苷对6-OHDA 诱导PC12 细胞miR-351-5p表达的影响(±s,n=9)
注: 与对照组比较,*P<0.05; 与6-OHDA 组比较,#P<0.05。
组别miR-351-5p对照组1.00±0.00 6-OHDA 组3.49±0.28*獐牙菜苦苷低剂量组2.55±0.22#獐牙菜苦苷中剂量组1.92±0.18#獐牙菜苦苷高剂量组1.31±0.12#
3.5 干扰miR-351-5p表达对6-OHDA 诱导PC12 细胞损伤的影响 如图2、表5 所示,与anti-miR-NC 组比较,antimiR-351-5p 组PC12 细胞miR-351-5p表达降低(P<0.05),存活率、SOD 活性、Bcl-2 蛋白表达升高(P<0.05),LDH活性、MDA 水平、凋亡率、Bax 蛋白表达降低(P<0.05)。
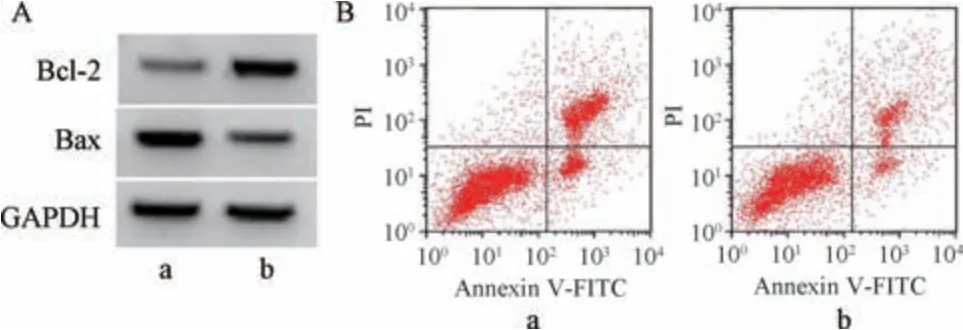
图2 干扰miR-351-5p 表达对6-OHDA 诱导PC12 细胞凋亡的影响
表5 干扰miR-351-5p 表达对6-OHDA 诱导PC12 细胞损伤的影响(±s,n=9)

表5 干扰miR-351-5p 表达对6-OHDA 诱导PC12 细胞损伤的影响(±s,n=9)
注: 与anti-miR-NC 组比较,*P<0.05。
组别miR-351-5p存活率/%LDH/(U·L-1) SOD/(U·mg-1) MDA/(nmol·mg-1)凋亡率/%Bcl-2 蛋白Bax 蛋白anti-miR-NC 组1.00±0.0040.05±4.0885.16±7.4331.17±3.1133.57±3.1733.19±2.380.13±0.020.77±0.05 anti-miR-351-5p 组0.38±0.03* 70.01±5.59* 40.96±4.02* 74.47±6.56*13.13±1.04*14.04±1.16* 0.46±0.04*0.37±0.03*
3.6 上调miR-351-5p表达对獐牙菜苦苷干预6-OHDA 诱导PC12 细胞损伤的影响 如图3、表6 所示,与6-OHDA+獐牙菜苦苷+miR-NC 组比较,6-OHDA+獐牙菜苦苷+miR-351-5p 组PC12 细胞中miR-351-5p 表达升高(P<0.05),细胞存活率、SOD 活性、Bcl-2 蛋白表达降低(P<0.05),LDH活性、MDA 水平、凋亡率、Bax 蛋白表达升高(P<0.05)。
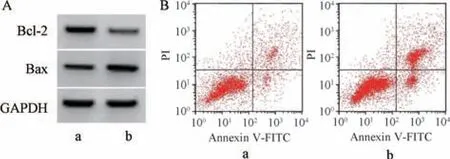
图3 上调miR-351-5p 表达对獐牙菜苦苷干预6-OHDA诱导PC12 细胞凋亡的影响
表6 上调miR-351-5p 表达对獐牙菜苦苷干预6-OHDA 诱导PC12 细胞损伤的影响(±s,n=9)

表6 上调miR-351-5p 表达对獐牙菜苦苷干预6-OHDA 诱导PC12 细胞损伤的影响(±s,n=9)
注: 与獐牙菜苦苷+miR-NC 组比较,*P<0.05。
组别miR-351-5p存活率/% LDH/(U·L-1) SOD/(U·mg-1) MDA/(nmol·mg-1) 凋亡率/%Bcl-2 蛋白Bax 蛋白獐牙菜苦苷+miR-NC 组1.00±0.00 81.48±6.41 31.68±3.0284.28±6.787.27±0.678.27±0.620.56±0.050.30±0.03獐牙菜苦苷+miR-351-5p 组 2.78±0.24* 51.06±4.23* 70.97±5.77* 45.23±4.09*23.16±2.26*21.75±2.13* 0.25±0.03*0.63±0.05*
4 讨论
为研究帕金森病细胞损伤分子机制,本实验用100 μmol/L 6-OHDA 处理PC12 细胞24 h,构建PC12 细胞损伤模型,结果显示,与对照组比较,6-OHDA 组PC12 细胞存活率、SOD 活性、Bcl-2 蛋白表达降低,LDH 活性、MDA水平、凋亡率、Bax 蛋白表达升高,提示6-OHDA 可诱导PC12 细胞凋亡和氧化应激。
传统疗法和草药疗法由于其副作用较低或无副作用的优势,越来越得到重视。獐牙菜苦苷是龙胆科植物的主要生物活性成分,具有抗菌、抗炎、抗糖尿病等多种药理作用。獐牙菜苦苷可通过降低肾细胞中阿格嘧啶、氧化应激和上皮间质转化水平来预防甲基乙二醛介导的糖尿病发病机制[10]。獐牙菜苦苷可减轻高脂饮食诱导的小鼠体质量、葡萄糖不耐受、氧化应激和胰岛素抵抗,增强胰岛素信号,预防肥胖相关的慢性炎症[11]。獐牙菜苦苷可改善香烟烟雾诱导的前列腺胶原沉积,减轻氧化应激和局部炎症,抑制香烟烟雾诱导的前列腺纤维化[12]。獐牙菜苦苷可通过TLR4/PARP1/NF-κB 途径减弱ROS 水平,抑制细胞凋亡,缓解氧糖剥夺/复氧诱导的人神经母细胞瘤细胞SH-SY5Y损伤[13]。獐牙菜苦苷可通过抑制氧化应激和炎症反应缓解四氯化碳引起的肝损伤[14]。与上述研究结果一致,本实验结果显示,与6-OHDA 组比较,獐牙菜苦苷以剂量依赖方式升高PC12 细胞存活率、SOD 活性、Bcl-2 蛋白表达,降低LDH 活性、MDA 水平、凋亡率、Bax 蛋白表达,提示獐牙菜苦苷可缓解6-OHDA 诱导的PC12 细胞损伤。
众多研究发现,microRNA 的异常表达与帕金森病发生和发展有关。在1-甲基-4-苯基吡啶 (MPP) 处理的SHSY5Y 细胞中,miR-29c-3p 表达下调,miR-29c-3p 可通过下调TET2 表达抑制SH-SY5Y 细胞自噬过程[15]。在帕金森病细胞模型中,miR-133b 表达降低,过表达miR-133b 可抑制MPP 诱导的PC12 细胞凋亡[16]。在MPP 处理的SH-SY5Y细胞中miR-497-5p 表达升高,下调miR-497-5p 可抑制MPP诱导的SH-SY5Y 细胞凋亡[17]。抑制miR-6862 表达可保护神经细胞免受MPP 诱导的细胞凋亡[18]。miR-421k 可通过直接靶向MEF2D 加重帕金森病模型神经毒性并促进细胞死亡[19]。与上述研究结果一致,本实验结果显示,与对照组比较,6-OHDA 组miR-351-5p表达升高,干扰miR-351-5p表达升高了PC12 细胞存活率、SOD 活性、Bcl-2 蛋白表达,降低了LDH 活性、MDA 水平、凋亡率、Bax 蛋白表达,提示干扰miR-351-5p表达可抑制6-OHDA 诱导的PC12 细胞凋亡和氧化应激。
研究表明,天然药物提取物可通过调控microRNA 表达缓解帕金森病细胞损伤。如虾青素可通过靶向miR-7/SNCA轴抑制内质网应激并保护帕金森病引起的神经元损伤[20]。迷迭香酸可通过调节miR-155-5p 减轻帕金森病小鼠模型中炎症、凋亡和氧化应激,上调miR-155-5p 可抑制迷迭香酸对帕金森病小鼠运动障碍的缓解作用[21]。与上述研究结果一致,本实验结果显示,獐牙菜苦苷以剂量依赖方式降低6-OHDA 组miR-351-5p表达,上调miR-351-5p表达逆转了獐牙菜苦苷处理对6-OHDA 诱导PC12 细胞损伤的作用,使PC12 细胞存活率、SOD 活性、Bcl-2 蛋白表达降低,LDH活性、MDA 水平、凋亡率、Bax 蛋白表达升高,提示獐牙菜苦苷可通过调控miR-351-5p表达影响6-OHDA 诱导的PC12 细胞损伤。
综上所述,miR-351-5p表达在6-OHDA 诱导的PC12 细胞损伤中上调,獐牙菜苦苷可通过下调miR-351-5p表达抑制6-OHDA 诱导的凋亡和氧化应激,为獐牙菜苦苷治疗帕金森病提供新思路。
