川芎对天麻中天麻素及其代谢产物体内药动学的影响
2023-11-23刘明妍冯梦晗刘力榕闫晓宁屈碧琼潘绮雪刘璐璐贾志鑫肖红斌
刘明妍,冯梦晗,刘 洁,刘力榕,闫晓宁,屈碧琼,潘绮雪,刘璐璐,贾志鑫,肖红斌,3*
(1.北京中医药大学中药学院,北京 102400; 2.北京中医药大学中药分析与转化研究中心,北京 102400; 3.北京中医药大学,北京中医药研究院,北京 102400)
药动学可阐释多成分之间的相互作用,是研究中药体内多组分物质基础、多靶点作用药效等方面的有力手段[1-2]。大川芎方由川芎、天麻以4 ∶1 比例组成,是治疗偏头痛的经典中药复方,方中川芎可延长天麻素、对羟基苯甲醇在血浆中的驻留时间和半衰期,增强两者吸收程度[3],减缓对羟基苯甲醇在大鼠脑内的消除速度[4-5],从而影响天麻素、对羟基苯甲醇在大鼠体内的吸收消除过程,并且天麻素在血浆中除了可代谢为对羟基苯甲醇外,还能代谢为对羟基苯甲酸、对羟基苯甲醛-O-β-D-吡喃葡萄糖苷[6],其中前者具有阻止细胞凋亡的作用[7-8],川芎如何影响上述2 种成分的药动学过程对于阐明该药材在大川芎方中的作用特性具有重要意义,并且它具有引药上行的作用[9],可作为药引来促进其他物质透过血脑屏障到达脑组织靶器官。另外,天麻素属于水溶性苷类成分,较难透过血脑屏障,研究川芎配伍前后该成分在脑组织中的含量变化可阐明大川芎方中川芎的引药上行作用,但目前尚无相关报道。因此,本实验对川芎配伍天麻前后天麻素及其代谢产物对羟基苯甲醇、对羟基苯甲酸、对羟基苯甲醛-O-β-D-吡喃葡萄糖苷在血浆中的吸收消除变化及天麻素在脑组织中的吸收消除变化进行考察,以期为相关研究提供依据。
1 材料
1.1 仪器 Agilent 1260 高效液相色谱仪、Agilent 6470 三重四极杆质谱仪,配置Agilent 1260 Bin Bump、Dual AJS ESI (美国Agilent 公司); HD-2500 多管涡旋混合仪(杭州佑宁仪器有限公司);24E2089 多样品研磨匀浆均质仪(美国OMNI 公司); 3K15 高速离心机(美国Sigma 公司); 22331 Hamburg 真空干燥仪(德国Eppendorf 公司); 旋转蒸发仪,配置N-1300 旋转支架、OSB-2200 水浴锅、WELCH 真空泵 ( 日本 EYELA 公司);Quintix65-1CN、Practum224-1CN 电子天平 [赛多利斯科学仪器(北京) 有限公司]。
1.2 试剂与药物 天麻(批号2101099)、川芎(批号2104040) 饮片均购自北京太洋树康有限公司,经北京中医药大学王学勇教授鉴定为正品。天麻素(批号M11GS148059)、对羟基苯甲醇(批号RFSD05911812016)、对羟基苯甲酸(批号D-063-161216) 对照品均购自成都瑞芬思生物科技有限公司; 对羟基苯甲醛-O-β-D-吡喃葡萄糖苷为实验室合成,其高分辨质谱、核磁共振波谱与前期报道一致,纯度>98%。甲醇、乙腈为色谱纯 (纯度99.9%),购自美国Fisher 公司; 甲酸、乙酸、甲酸铵、乙酸铵为分析纯(纯度99.9%),购自美国Sigma 公司。
1.3 动物 SD 雄性大鼠90 只,SPF 级,10 周龄,体质量200~230 g,购自北京斯贝福生物技术有限公司,实验动物生产许可证号SCXK (京) 2019-0010,饲养于屏障环境,12 h/12 h 光照/黑暗循环,温度20 ℃,相对湿度60%,正常进食,自由饮水。动物实验经北京中医药大学动物伦理委员会批准(伦理号BUCM-4-2022030701-1034)。
2 方法与结果
2.1 色谱条件 ZORBAX RRHD Eclipse Plus C18色谱柱(3.0 mm×50 mm,1.8 μm); 流动相(0.1%乙酸-10 mmol/L 乙酸铵-水) (A) -乙腈(B),梯度洗脱(血浆,0 ~10 min,3% ~95%B。脑组织,0~3 min,2% ~30% B; 3 ~4 min,30% ~95% B;4~6.5 min,95%B); 体积流量0.4 mL/min; 柱温35 ℃; 进样量5 μL。
2.2 质谱条件 电喷雾离子源(ESI); 负离子扫描; 多反应监测 (MRM) 模式; 干燥气温度150 ℃,体积流量9 L/min; 鞘气温度250 ℃,体积流量11 L/min; 毛细管电压-1 000 V,其他参数见表1。

表1 各成分质谱参数Tab.1 Mass spectrometry parameters for various constituents
2.3 对照品、内标溶液制备
2.3.1 混合对照品溶液 精密称取天麻素、对羟基苯甲醇、对羟基苯甲酸、对羟基苯甲醛-O-β-D-吡喃葡萄糖苷对照品各10 mg,置于10 mL 量瓶中,50%甲醇超声溶解并定容至刻度,得到贮备液,精密吸取适量,50%甲醇逐级稀释,即得。
2.3.2 质控对照品溶液 精密吸取“2.3.1” 项下贮备液适量,50%甲醇稀释,即得(血浆中各成分低、中、高质量浓度分别为天麻素7.8、1 200.0、2 400.0 ng/mL,对羟基苯甲醇7.8、100.0、200.0 ng/mL,对羟基苯甲酸4.5、60.0、120.0 ng/mL,对羟基苯甲醛-O-β-D-吡喃葡萄糖苷6.3、160.0、320.0 ng/mL; 脑组织中天麻素低、中、高质量浓度分别为15.6、200.0、400.0 ng/mL)。
2.3.3 内标溶液 精密称取尼莫地平对照品5 mg,置于5 mL 量瓶中,50%甲醇定容,超声溶解,得到贮备液,精密吸取适量,50%甲醇依次稀释成质量浓度为100、5 ng/mL 的溶液,即得。
2.4 灌胃药液制备 称取川芎、天麻适量,置于圆底烧瓶中,分别加12、10 倍量95%乙醇加热回流提取2 h,纱布过滤,滤渣加10 倍量水加热回流提取2 次,每次1 h,合并滤液,浓缩并定容,得到提取物(生药量1 g/mL)。将上述2 种药材提取物按4 : 1 比例混匀,生理盐水稀释,制成大川芎方溶液①(总生药量0.39 g/mL,其中川芎生药量0.312 g/mL,天麻生药量0.078 g/mL)、大川芎方溶液②(总生药量0.78 g/mL,其中川芎生药量0.624 g/mL,天麻生药量0.156 g/mL)。另取天麻提取物适量,生理盐水稀释,组成天麻溶液①(生药量0.078 g/mL)、天麻溶液② (生药量0.156 g/mL)。
2.5 分组、给药与采样
2.5.1 血浆 12 只大鼠随机分为大川芎方组(灌胃给予大川芎方溶液①,含量3.9 g/kg,3.5 倍临床剂量)、天麻组(灌胃给予天麻溶液①,含量0.78 g/kg,相当于大川芎方3.5 倍临床剂量),每组6 只,实验前禁食12 h,自由饮水,剂量10 mL/kg,于给药后 0、0.08、0.16、0.25、0.50、0.75、1、2、4、6、8、12、24 h 眼底静脉丛采血各200 ~400 μL,置于抗凝管中,4 ℃、4 000 r/min 离心10 min,取上清液,在-80 ℃下保存。
2.5.2 脑组织 72 只大鼠随机分为大川芎方组(灌胃给予大川芎方溶液②,含量7.8 g/kg,7 倍临床剂量)、天麻组(灌胃给予天麻溶液②,含量1.56 g/kg,相当于大川芎方7 倍临床剂量),每组36 只,实验前禁食 12 h,自由饮水,剂量10 mL/kg,于给药后0.25、0.50、0.75、1、2、4 h以10%水合氯醛麻醉,每个时间点6 只,生理盐水沿右心房-左心耳循环灌流至肺组织变白、肝组织无血色后开颅取脑,滤纸吸干组织表面水分,在-80 ℃下保存。
2.6 样品前处理
2.6.1 血浆 取大鼠血浆100 μL,加入100 ng/mL内标溶液50 μL、冷乙腈400 μL,涡旋10 min,4 ℃、12 000 r/min 离心10 min,取上清液,真空浓缩至干,残渣用100 μL 50%甲醇复溶后超声助溶,4 ℃、12 000 r/min 离心10 min,取上清液进样分析。
2.6.2 脑组织 取大鼠脑组织适量,称定质量,加入3 倍量生理盐水匀浆,取匀浆液2 mL,加入5 ng/mL内标溶液50 μL、冷乙腈8 mL,涡旋10 min,4 ℃、12 000 r/min 离心10 min,取上清液,真空浓缩至干,残渣用100 μL 20%甲醇复溶后超声助溶,4 ℃、12 000 r/min 离心10 min,取上清液进样分析。
2.7 方法学考察
2.7.1 专属性试验 取空白血浆、空白血浆+对照品、给药后血浆样品适量,按“2.6.1” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定,色谱图见图1; 取空白脑组织、空白脑组织+对照品、给药后脑组织样品适量,按“2.6.2” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定,色谱图见图2。由此可知,对羟基苯甲醇、对羟基苯甲酸、对羟基苯甲醛-O-β-D-吡喃葡萄糖苷在大鼠血浆中未见内源性物质干扰,但在大鼠脑组织中受到基质干扰; 天麻素在血浆、脑组织中均未受到干扰,故选择其作为脑组织定量成分。

图1 大鼠血浆中各成分MRM 色谱图Fig.1 MRM chromatograms of various constituents in rat plasma

图2 大鼠脑组织中各成分MRM 色谱图Fig.2 MRM chromatograms of various constituents in rat brain tissue
2.7.2 线性关系考察 取空白血浆100 μL,加入系列质量浓度混合对照品溶液、内标溶液(100 ng/mL)各50 μL,得到血浆基质标准曲线工作液,按“2.6.1” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定,以对照品质量浓度为横坐标(X),对照品、内标峰面积比值为纵坐标(Y) 进行回归; 取空白脑组织2 mL,加入天麻素对照品溶液、内标溶液(5 ng/mL) 各50 μL,得到脑基质标准曲线工作液,按“2.6.2” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定,以对照品质量浓度为横坐标(X),对照品、内标峰面积比值为纵坐标(Y) 进行回归,并将线性范围的最低点定义为定量限,信噪比(S/N) ≥3 时的质量浓度定义为检测限,结果见表2,可知各成分在各自范围内线性关系良好。
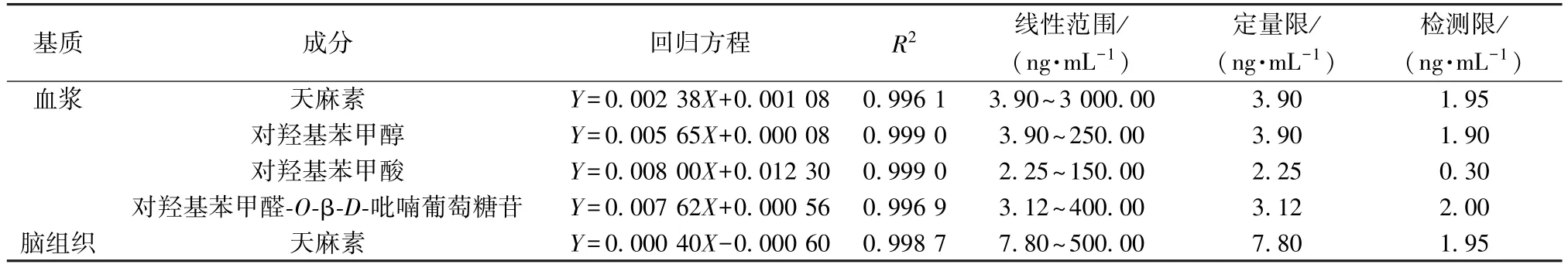
表2 各成分线性关系Tab.2 Linear relationships of various constituents
2.7.3 精密度、准确度试验 取低、中、高质量浓度血浆质控样品各6 批,按“2.6.1” 项下方法前处理,在“2.1” “2.2” 项条件下各进样测定3次,连续3 d; 取低、中、高质量浓度脑组织质控样品各6 批,按“2.6.2” 项下方法前处理,在“2.1” “2.2” 项条件下各进样测定3 次,连续3 d。结果,血浆质控样品中各成分日内准确度在93.34% ~112.37% 之间,日内精密度RSD 在2.76% ~13.5% 之间,日间准确度在91.82% ~112.7%之间,精密度RSD 在2.62% ~11.7%之间;脑组织质控样品中天麻素日内、日间准确度在88.96% ~101.45% 之间,日内、日间精密度在2.11% ~7.54%之间,表明仪器精密度、方法准确度良好。
2.7.4 稳定性试验 取血浆、脑组织质控样品各6 批,分别室温 (25 ℃) 放置 6 h、低温(-80 ℃) 贮存3 d、反复冻融3 次,按“2.6” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定。结果,血浆质控样品中各成分室温、低温、反复冻融稳定性相对误差在90.73% ~103.2% 之间,RSD 在1.13% ~10.3%之间; 脑组织质控样品中天麻素室温、低温、反复冻融稳定性相对误差在92.99% ~102.5% 之间,RSD 在1.92% ~9.98% 之间,表明样品在上述条件下稳定性良好。
2.7.5 基质效应、回收率试验 取低、中、高质量浓度血浆质控样品各6 批,按“2.6.1” 项下方法前处理,在“2.1” “2.2” 项条件下进样测定峰面积A1; 取空白血浆100 μL,按“2.6.1” 项下方法前处理,挥干残留物,用含低、中、高质量浓度各成分对照品的50%甲醇复溶,在“2.1” “2.2”项条件下进样测定峰面积B1; 取含低、中、高质量浓度各成分对照品的50%甲醇适量,在“2.1”“2.2” 项条件下进样测定峰面积C1,测定基质效应、提取回收率,公式分别为基质效应= (B1/C1) ×100%、提取回收率= (A1/B1) ×100%。
取低、中、高质量浓度脑组织质控样品各6批,按 “2.6.2” 项下方法前处理,在 “2.1”“2.2” 项条件下进样测定峰面积A2; 取空白脑组织2 mL,按“2.6.2” 项下方法前处理,挥干残留物,用含低、中、高质量浓度天麻素对照品的20%甲醇复溶,在“2.1” “2.2” 项条件下进样测定峰面积B2; 取含低、中、高质量浓度天麻素对照品的20%甲醇适量,在“2.1” “2.2” 项条件下进样测定峰面积C2,测定基质效应、提取回收率,公式分别为基质效应=(B2/C2) ×100%、提取回收率= (A2/B2) ×100%。
结果,血浆质控样品中各成分提取回收率在88.38% ~111.1% 之间,RSD 在2.59% ~13.3% 之间,而基质效应在88.67% ~111.3%之间,RSD 在3.50% ~12.4%之间; 脑组织质控样品中天麻素提取回收率在90.47% ~103.27% 之间,RSD 在3.98% ~11.2% 之间,而基质效应在99.98% ~109.4%之间,RSD 在7.78% ~11.3% 之间,表明无基质干扰,前处理方法可行,可用于相关成分定量检测。
2.8 数据处理 血浆中各成分的实际浓度等于定量分析样品的测定浓度; 每1 g 脑组织中各成分实际浓度需要折算,具体方法为测定浓度除以浓缩倍数(20 倍),再乘以相应匀浆液体积,最后除以脑重。再采用DAS 3.2.8 软件中的非房室模型计算各成分主要药动学参数,具体方法为数据输入界面输入血药浓度数据后以非房室模型拟合血药浓度-时间曲线,其中Cmax为血药浓度最高值,Tmax为给药后达峰浓度所需时间,两者均为实测值; AUC、T1/2、MRT、Vz/F、CLz/F为拟合得到的统计矩参数。最后采用SPSS 22.0 软件进行统计学分析。
2.9 结果分析 各成分血药浓度-时间曲线见图3,主要药动学参数见表3。由此可知,与天麻组比较,大川芎方组天麻素Tmax、MRT0~24h延长(P<0.01),AUC0~24h、AUC0~∞升高 (P<0.01),CLz/F降低(P<0.01); 对羟基苯甲醇、对羟基苯甲酸Cmax、AUC0~24h、AUC0~∞升高 (P<0.01),CLz/F降低(P<0.01),并且前者Vz/F降低(P<0.05); 对羟基苯甲醛-O-β-D-吡喃葡萄糖苷Cmax降低(P<0.01),CLz/F升高(P<0.05)。

图3 各成分血药浓度-时间曲线(n=6)Fig.3 Plasma concentration-time curves for various constituents (n=6)
表3 各成分在大鼠血浆中的主要药动学参数(±s,n=6)Tab.3 Main pharmacokinetic parameters for various constituents in rat plasma (±s,n=6)

表3 各成分在大鼠血浆中的主要药动学参数(±s,n=6)Tab.3 Main pharmacokinetic parameters for various constituents in rat plasma (±s,n=6)
注: 与天麻组比较,*P<0.05,**P<0.01。
参数单位天麻素对羟基苯甲酸天麻组大川芎方组天麻组大川芎方组Cmaxng·mL-12 164.08±438.241 969.41±355.8527.97±9.9948.1±14.94**T1/2h0.80±0.501.03±0.460.75±0.070.99±0.25 Tmaxh0.14±0.030.43±0.18**0.44±0.340.37±0.26 AUC0 ~24 hng·mL-1·h1 648.03±306.062 312.30±261.30**16.53±11.0943.30±15.93**AUC0 ~∞ng·mL-1·h1 712.82±351.742 320.50±266.40**25.91±3.7052.36±8.41**MRT0 ~24 hh0.56±0.111.03±0.12**1.10±0.171.20±0.43 Vz / FL·kg-15.19±2.853.24±1.54211.00±10.32218.14±143.39 CLz / FL·h-1·kg-14.66±0.632.18±0.25**194.92±27.8097.2±12.76**参数单位对羟基苯甲醇对羟基苯甲醛-O-β-D-吡喃葡萄糖苷天麻组大川芎方组天麻组大川芎方组Cmaxng·mL-112.25±3.0035.83±14.28**27.96±12.007.22±3.19**T1/2h1.65±0.751.67±0.581.51±0.760.89±0.75 Tmaxh0.33±0.220.32±0.280.31±0.270.58±0.61 AUC0 ~24 hng·mL-1·h14.12±3.7953.89±11.45**35.91±3.7026.83±10.97 AUC0 ~∞ng·mL-1·h15.55±3.0756.59±10.40**36.19±0.0827.70±9.56 MRT0 ~24 hh1.64±0.341.98±0.321.11±0.170.80±0.20 Vz / FL·kg-1756.58±361.23216.60±92.26**392.88±246.13422.82±261.41 CLz / FL·h-1·kg-1334.32±78.8291.29±18.08**194.92±27.80657.79±112.10*
天麻素脑组织含量-时间图见图4,主要药动学参数见表4。由此可知,给药后2 组在不同时间点均有不同含量天麻素透过血脑屏障到达脑组织;与天麻组比较,大川芎方组在给药后30、45 min能增加天麻素透过量,给药后1 h 可降低至天麻组同等水平,并且天麻素Cmax、AUC0~24h、AUC0~∞、Vz/F升高(P<0.05,P<0.01)。
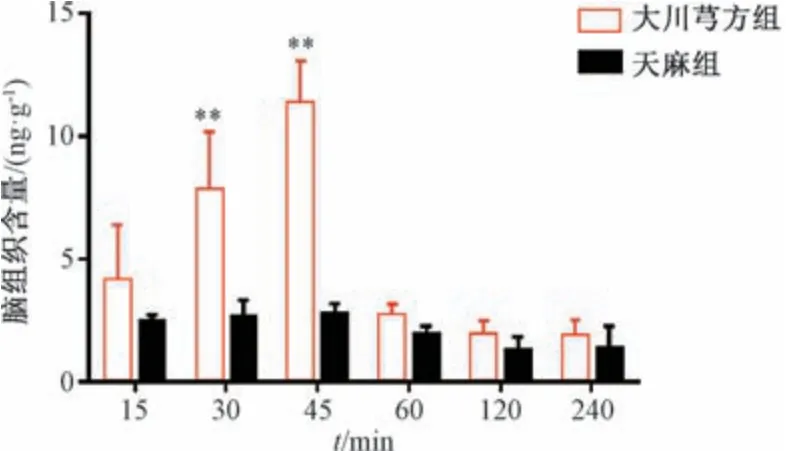
图4 天麻素脑组织含量-时间图(n=6)Fig.4 Brain tissue content-time histogram of gastrodin (n=6)
表4 天麻素在大鼠脑组织中的主要药动学参数(±s,n=6)Tab.4 Main pharmacokinetic parameters for gastrodin in rat brain tissue (±s,n=6)

表4 天麻素在大鼠脑组织中的主要药动学参数(±s,n=6)Tab.4 Main pharmacokinetic parameters for gastrodin in rat brain tissue (±s,n=6)
注: 与天麻组比较,*P<0.05,**P<0.01。
参数单位天麻素天麻组大川芎方组Cmaxng·mL-12.78±0.4011.95±4.48**T1/2h1.29±0.381.69±1.02 Tmaxh0.68±0.110.67±0.13 AUC0~24 hng·mL-1·h3.32±0.9615.17±2.24**AUC0~∞ng·mL-1·h3.34±2.4220.06±1.46**MRT0~24 hh1.18±0.611.56±0.14 Vz / FL·kg-1170.59±67.39597.19±331.56*CLz / FL·h-1·kg-1 210.01±25.01250.34±19.95
3 讨论与结论
天麻素口服后在肠腔内葡萄糖转运体的帮助下,能迅速吸收进入体内[10],并主要从尿中排泄[11]。川芎配伍天麻后,天麻素在血浆中的驻留时间延长,消除速率减慢,这可能因为川芎能升高天麻素血浆蛋白结合率,使其肾排泄率降低[12]。天麻苷元在肠道中主要以被动转运的方式进入体内[13],配伍川芎后对羟基苯甲醇的生物利用度提高,这可能与川芎能增强肠道膜的流动性[14]有关。药物代谢可显著改善药理活性,抑制或诱导药物代谢酶是其相互作用的主要机制[15-16],药物口服后各成分之间的作用与CYP450 酶活性的易感性有较大关联[17-18]。研究表明,川芎不同成分对CYP450不同亚型酶的活性影响程度不同,如洋川芎内酯A能抑制CYP1A2、CYP2C9、CYP2E1、CYP3A4 酶活性,丁烯基苯酞可诱导CYP1A2、CYP2C9、CYP3A4 酶活性[19],配伍川芎后天麻素Ⅰ相代谢产物对羟基苯甲醇、对羟基苯甲酸Cmax升高,对羟基苯甲醛-O-β-D-吡喃葡萄糖苷该参数降低,可能与川芎不同成分影响不同I 相代谢酶活性的作用有关。
为了避免测定物质在脑组织中的含量受到影响,在采集脑组织时选择灌流操作。由于对羟基苯甲醇、对羟基苯甲酸、对羟基苯甲醛-O-β-D-吡喃葡萄糖苷在血浆中的含量远低于天麻素,灌流后脑组织中未检测到,故本实验只涉及天麻素。结果显示,配伍川芎后天麻素在脑组织中的含量升高。
前期报道,血脑屏障中紧密连接蛋白、外排蛋白的高表达特性可阻挡大多数药物进入脑组织[20-21]。天麻素为血脑屏障外排蛋白P-糖蛋白、多药耐药相关蛋白的底物[22],而川芎能改变该成分在脑组织中的含量,可能是因为前者对血脑屏障中紧密连接蛋白、外排蛋白表达具有抑制作用,从而增加后者透过量、驻留时间。
综上所述,川芎配伍天麻后前者能在血浆中发挥协同作用,从而提高其他成分生物利用度,同时可发挥引药上行作用来促进其他物质到达脑组织。
