基于JAK/STAT3 信号通路探讨 “金汁” 粪菌移植对小鼠溃疡性结肠炎的改善作用
2023-11-23张全辉王万春邓永文陈教华安明伟张磊昌
张全辉,王万春,邓永文,陈教华,安明伟,张磊昌
(1.江西中医药大学研究生院,江西 南昌 330004; 2.江西中医药大学附属医院,江西 南昌 330006)
溃疡性结肠炎是一种反复发作的自发性炎症性肠道疾病,病因不明,且病情轻重不等[1]。大多数患者发病时多以腹泻、黏液脓血便、腹痛等为主要表现[2-3]。本病好发于青壮年人群,且大多反复发作,癌变的可能性十分高,所以治疗较为棘手。目前医学手段虽对溃疡性结肠炎的治疗有一定作用,但是预后较易复发,难以治愈,给患者造成巨大痛苦及身心疲惫,严重降低生活质量,加重了家庭经济负担,所以需寻找新的治疗方法。
近年来粪菌移植是研究的热点,是指将健康供者粪便中的菌群以特殊方式植入患者肠道,调节患者肠道菌群,恢复患者正常的肠道微生态系统,从而为治疗肠道菌群失调引起的各种内外肠疾病提供一种新的治疗方法[4]。中药“金汁” 不同于粪便细菌移植,后者可以说是对前者的继承和创新。古代金汁的制作方法为于冬月,取人粪便(11岁至12 岁健康男孩粪便最佳),加入上好的井水或山泉水搅拌后,将经过竹筛和纱布过滤后的粪汁装入新坛子,盖碗后用土密封,深埋在地下贮藏1 年至30 年不等,取出呈清澈如水。由于中药“金汁” 获取困难,现存量极少,目前的研究主要集中在新金汁,也就是粪菌移植。现代粪菌移植理论与金汁入药有不谋而合之妙[5-6]。有研究已证实,粪菌移植对溃疡性结肠炎有一定的治疗效果,且认为JAK/STAT3 信号通路在溃疡性结肠炎患者中的异常激活,从而导致肠道炎症瀑布式反应和持续加重,是探求溃疡性结肠炎发病机制和选择药物治疗靶点的热门研究之一[7]。因此,本研究以溃疡性结肠炎小鼠模型为研究对象深入探究“金汁” 粪菌移植对其的影响,初步探讨其作用机制,以期为中药治疗溃疡性结肠炎提供参考。
1 材料
1.1 动物 48 只BALB/c 小鼠,雌雄各半,6~8 周龄,体质量19~20 g,由江西中医药大学动物实验中心提供[实验动物生产许可证号SCXK (赣) 2018-0003],饲养于无菌环境中,温度27 ℃,相对湿度55%,自由进食,适应性喂养1 周后进行实验。本研究动物实验经江西中医药大学动物实验伦理委员会批准(伦理号JZLLSC20210073)。
1.2 药物 参考文献[8] 报道方法,取供体小鼠新鲜粪便标本,按7 ∶15 (g/mL) 比例溶于无菌PBS 溶液中,分别采用2.0、1.0、0.5、0.25 mm 不锈钢筛过滤,过滤后离心15 min,取菌体,无菌PBS 缓冲液冲洗3 次,重悬于25 mL PBS 溶液中制成粪菌液,即得“金汁”,其中约含11 g 粪便,放置在4 ℃冰箱中保存备用。
1.3 试剂 PBS 缓冲液(批号22059494,合肥白鲨生物科技有限公司); ELISA 试剂盒(批号202112,北京长惠恒远生物科技有限公司); BCA 蛋白浓度检测试剂盒(批号P0010S,上海碧云天生物技术有限公司); 总RNA 试剂盒[批号A6010,普洛麦格(北京) 生物技术有限公司]; 兔源JAK、STAT3、p-STAT3 抗体 (批号 3344S、9139T、4113S,美国Cell Signaling Technology 公司); Tofacitinib(JAK 抑制剂) (批号477600-75-2,美国MedChemExpress公司)。
1.4 仪器 离心机(长沙湘智离心机仪器有限公司);MB16-414 型酶标仪(上海皓庄仪器有限公司); A51685 型PCR 仪[赛默飞世尔科技(中国) 有限公司]; DYY-1C型电泳仪(北京六一生物科技有限公司)。
2 方法
2.1 分组、造模及给药 将小鼠随机分为正常组、模型组、“金汁” 组、“金汁” +Tofacitinib 组,每组12 只。参照参考文献[9] 报道的造模方法,正常组给予蒸馏水,其余各组给予含2% DSS 的蒸馏水,饮用8 d 诱导建立溃疡性结肠炎模型。第8 天开始全部换成蒸馏水。第9 天开始灌胃给药,正常组和模型组给予蒸馏水,“金汁” 组给予粪便滤液灌肠 (每次0.2 mL,每天2 次),“金汁” +Tofacitinib 组给予粪便滤液灌肠(每次0.2 mL,每天2 次) +Tofacitinib 腹腔注射(5 mg/kg,每天1 次),连续干预5 d。
2.2 小鼠DAI 评分、脾脏指数和结肠长度测定 采用盲法观察记录小鼠的体质量、腹泻和便血等临床特征,参照文献[10] 报道方法,计算疾病活动指数(disease activity index,DAI),评分标准见表1。给药结束后,麻醉小鼠,摘眼球取血,全血离心后取血清; 取血后处死,分离得到脾脏和结肠,测量结肠长度,计算脾脏指数,公式为脾脏指数=脾脏质量/小鼠体质量。

表1 DAI 评分标准
2.3 ELISA 法检测血清炎症因子水平 参照ELISA 试剂盒操作说明书检测血清IL-6、TNF-α、IL-4 水平。
2.4 结肠大体形态观察 取结肠末端的一部分于10%福尔马林中固定,根据粘连程度、炎症和溃疡形成情况进行结肠黏膜大体形态损伤评分。粘连情况评分标准为0 分,无粘连; 1 分,粘连(结肠与其他组织剥离较易); 2 分,重度粘连。炎症和溃疡形成情况评分标准为0 分,无炎症和溃疡; 1 分,局部充血无溃疡; 2 分,有1 处溃疡不伴充血或肠壁增厚; 3 分,有l 处溃疡伴炎症; 4 分,大于2 处溃疡伴炎症; 5 分,大于2 处溃疡和(或) 炎症大于l cm;6~8 分,溃疡和(或) 炎症大于2 cm,病变范围每增加1 cm,计分加1 分。
2.5 比色法检测结肠组织MPO 活性 取200 mg 结肠组织,以邻联茴香胺为底物,加2 g/L 十六烷基三甲基溴化胺(HTAB),于655 nm 波长处,用UV-200 型紫外分光光度计测定5 min 内样品的吸光度(A) 变化均值,计算髓过氧化物酶(myeloperoxidase,MPO) 活性。
2.6 结肠组织病理变化观察 取结肠末端的一部分于10%福尔马林中固定,经包埋、切片、脱蜡后,行苏木素-伊红(HE) 染色,树胶封片后于显微镜下观察组织形态,并随机拍摄图像评估组织形态变化。
2.7 免疫组化法检测结肠组织增殖及炎症相关蛋白表达取结肠组织切片,常规脱蜡至水,采用柠檬酸钠热修复抗原,3%过氧化氢室温处理灭活内源性酶,封闭后孵育一、二抗,采用链霉亲和素-POD 孵育组织,DAB 显色,苏木素复染封片后,于显微镜下观察分析Ki-67、PCNA 及IL-6、TNF-α、IL-4 表达情况。
2.8 Western blot 法检测结肠组织JAK、p-STAT3、STAT3蛋白表达 取适量结肠组织,用RIPA 蛋白裂解液裂解,抽提总蛋白,并进行蛋白浓度测定。蛋白样本变性后,进行SDS-PAGE 电泳、转膜、封闭,给予对应的一抗、二抗孵育后,采用化学发光法进行显影成像,分析JAK、p-STAT3、STAT3 蛋白表达情况。
2.9 RT-qPCR 法检测结肠组织JAK、STAT3 mRNA 表达取适量结肠组织,采用TRIzol 法提取组织总RNA,采用分光光度计测定RNA 浓度,并进行逆转录。参照试剂盒说明书配制反应体系,置于实时荧光定量PCR 仪内进行反应,以GAPDH作为内参,采用2-ΔΔCT法检测JAK、STAT3 mRNA表达。
2.10 统计学分析 通过SPSS 22.0 软件进行处理,计量资料以(±s) 表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 为差异具有统计学意义。
3 结果
3.1 “金汁” 对溃疡性结肠炎小鼠DAI 评分和脾脏指数的影响 与正常组比较,模型组小鼠DAI 评分和脾脏指数升高(P<0.05); 与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组小鼠DAI 评分和脾脏指数降低(P<0.05),且“金汁” +Tofacitinib 组效果更佳,见表2。
表2 各组小鼠DAI 评分和脾脏指数比较(±s,n=12)
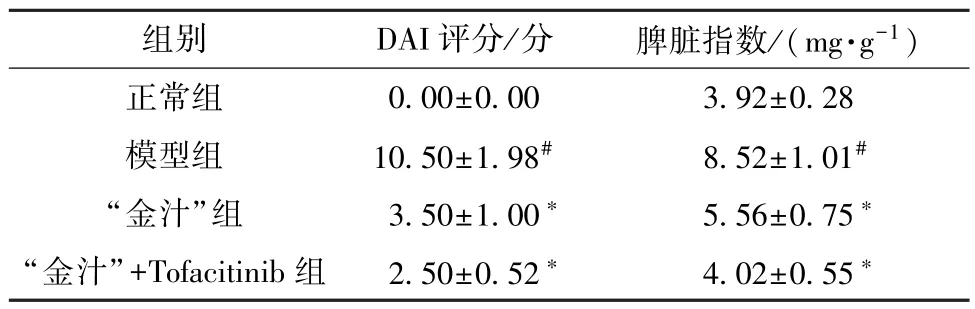
表2 各组小鼠DAI 评分和脾脏指数比较(±s,n=12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别DAI 评分/分脾脏指数/(mg·g-1)正常组0.00±0.003.92±0.28模型组10.50±1.98#8.52±1.01#“金汁”组3.50±1.00*5.56±0.75*“金汁”+Tofacitinib 组2.50±0.52*4.02±0.55*
3.2 “金汁” 对溃疡性结肠炎小鼠结肠组织病理形态的影响 正常组小鼠结肠组织结构清晰,形态完整; 与正常组比较,模型组小鼠结肠组织结构破坏,渗出大量炎性细胞,结肠长度缩短(P<0.05),形态损伤评分升高(P<0.05); “金汁” 组和“金汁” +Tofacitinib 组小鼠结肠组织浆膜层结构逐渐完整,组织形态逐渐改善,结肠长度增长(P<0.05),形态损伤评分降低(P<0.05),见表3、图1。

图1 各组小鼠结肠组织HE 染色(×100)
表3 各组小鼠结肠长度、形态损伤评分比较(±s,n =12)

表3 各组小鼠结肠长度、形态损伤评分比较(±s,n =12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别结肠长度/cm形态损伤评分/分正常组8.25±0.820.25±0.05模型组5.65±0.84#2.75±0.56#“金汁”组6.84±0.55*1.50±0.70*“金汁”+Tofacitinib 组7.69±0.48*0.75±0.20*
3.3 “金汁” 对溃疡性结肠炎小鼠血清炎症因子水平的影响 与正常组比较,模型组小鼠血清IL-6、TNF-α 水平升高(P<0.05),IL-4 水平降低(P<0.05); 与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组小鼠血清IL-6、TNF-α 水平降低(P<0.05),IL-4 水平升高(P<0.05),且“金汁” +Tofacitinib 组效果更佳,见表4。
表4 各组小鼠血清IL-6、TNF-α、IL-4 水平比较(pg/mL,±s,n=12)

表4 各组小鼠血清IL-6、TNF-α、IL-4 水平比较(pg/mL,±s,n=12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别IL-6TNF-αIL-4正常组12.25±2.2527.68±5.63145.36±20.36模型组105.25±20.65#130.25±15.69#30.05±8.02#“金汁”组68.09±14.36*50.32±10.36*75.36±12.08*“金汁”+Tofacitinib 组55.08±13.05*45.05±8.69*80.25±14.39*
3.4 “金汁” 对溃疡性结肠炎小鼠结肠组织MPO 活性的影响 与正常组比较,模型组小鼠结肠组织MPO 活性升高(P<0.05); 与模型组比较,“金汁” 组和 “金汁” +Tofacitinib 组小鼠结肠组织MPO 活性降低(P<0.05),且“金汁” +Tofacitinib 组效果更佳,见表5。
表5 各组小鼠结肠组织MPO 活性比较(±s,n=12)

表5 各组小鼠结肠组织MPO 活性比较(±s,n=12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别MPO/(U·mg-1)正常组0.25±0.06模型组0.96±0.15#“金汁”组0.54±0.12*“金汁”+Tofacitinib 组0.31±0.09*
3.5 “金汁” 对溃疡性结肠炎小鼠结肠组织增殖及炎症相关蛋白表达的影响 与正常组比较,模型组小鼠结肠组织Ki-67、IL-6、TNF-α 蛋白表达升高(P<0.05),PCNA、IL-4 蛋白表达降低(P<0.05); 与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组小鼠结肠组织Ki-67、IL-6、TNF-α蛋白表达降低(P<0.05),PCNA、IL-4 蛋白表达升高(P<0.05),见图2~3。

图2 各组小鼠结肠组织Ki-67、PCNA、IL-6、TNF-α、IL-4 蛋白免疫组化染色图(×200)
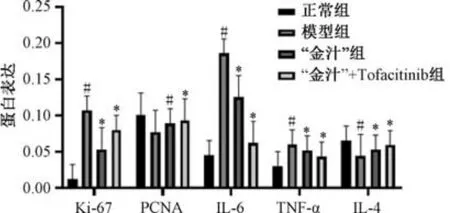
图3 各组小鼠结肠组织Ki-67、PCNA、IL-6、TNF-α、IL-4 蛋白表达(±s,n=12)
3.6 “金汁” 对溃疡性结肠炎小鼠结肠组织JAK/STAT3通路相关蛋白表达的影响 与正常组比较,模型组小鼠结肠组织JAK、p-STAT3、STAT3 蛋白表达升高(P<0.05);与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组小鼠结肠组织JAK、p-STAT3、STAT3 蛋白表达降低 (P<0.05),且 “金汁” +Tofacitinib 组效果更佳,见图4、表6。
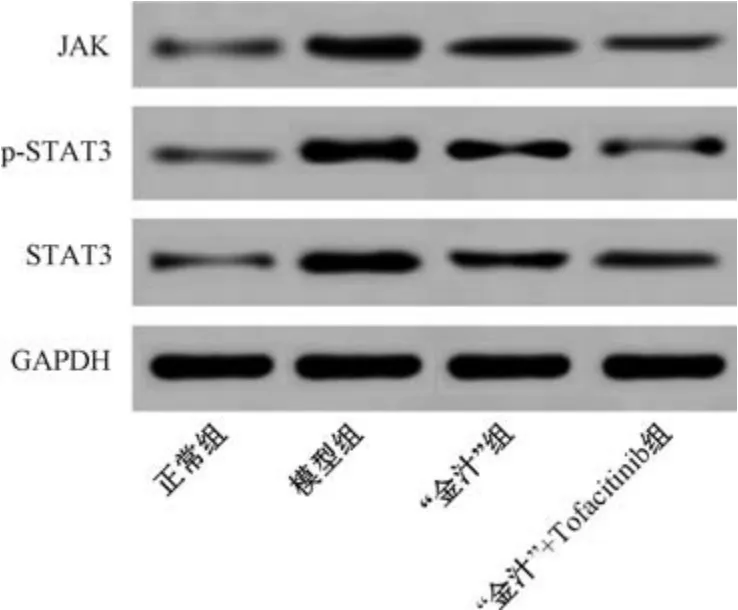
图4 各组小鼠结肠组织JAK/STAT3 通路相关蛋白条带图
表6 各组小鼠结肠组织JAK、p-STAT3、STAT3 蛋白表达比较(±s,n=12)
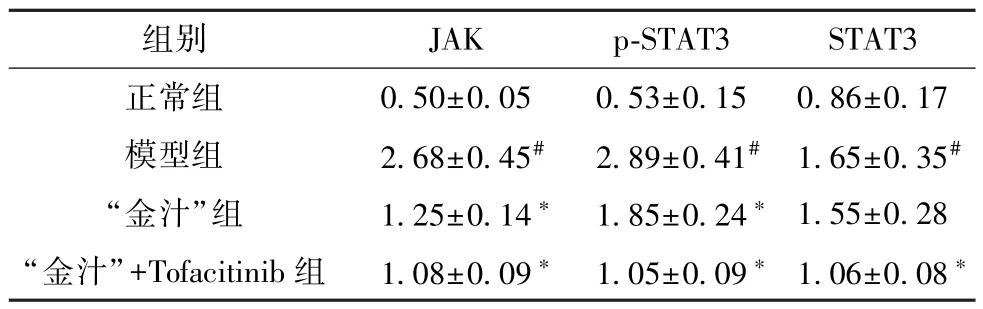
表6 各组小鼠结肠组织JAK、p-STAT3、STAT3 蛋白表达比较(±s,n=12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别JAKp-STAT3STAT3正常组0.50±0.050.53±0.150.86±0.17模型组2.68±0.45#2.89±0.41# 1.65±0.35#“金汁”组1.25±0.14* 1.85±0.24* 1.55±0.28“金汁”+Tofacitinib 组1.08±0.09* 1.05±0.09* 1.06±0.08*
3.7 “金汁” 对溃疡性结肠炎小鼠结肠组织JAK、STAT3 mRNA 表达的影响 与正常组比较,模型组小鼠结肠组织JAK、STAT3 mRNA 表达升高(P<0.05); 与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组小鼠结肠组织JAK、STAT3 mRNA 表达降低(P<0.05),且“金汁” +Tofacitinib组效果更佳,见表7。
表7 各组小鼠结肠组织JAK、STAT3 mRNA 表达比较(±s,n=12)
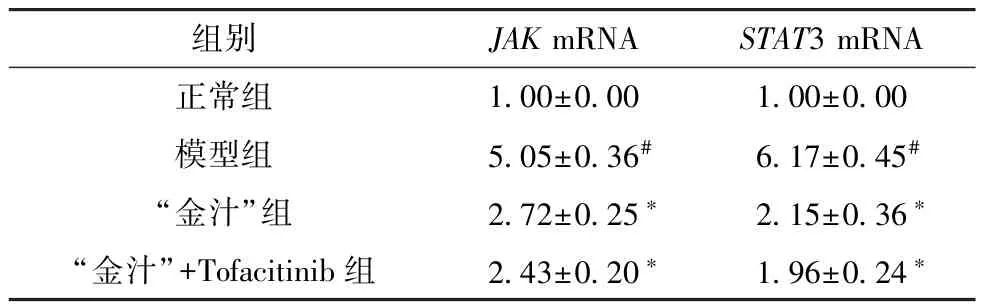
表7 各组小鼠结肠组织JAK、STAT3 mRNA 表达比较(±s,n=12)
注: 与正常组比较,#P<0.05; 与模型组比较,*P<0.05。
组别JAK mRNASTAT3 mRNA正常组1.00±0.001.00±0.00模型组5.05±0.36#6.17±0.45#“金汁”组2.72±0.25*2.15±0.36*“金汁”+Tofacitinib 组2.43±0.20*1.96±0.24*
4 讨论
有研究认为,溃疡性结肠炎的发病机制可能是由于肠道免疫系统失衡,引起肠道免疫反应从而引发疾病[11-12],所以近年来越来越多的学者转向对肠道微生态的研究[13]。“金汁” 为民间中药之一,在《本草纲目》 中也有利用粪便治疗疾病的记载。粪菌移植是近年来兴起的现代治疗方法,与中医中的“金汁” 有异曲同工之处[14]。因此,本研究使用“金汁” 对溃疡性结肠炎小鼠进行粪菌移植,并探讨其机制。
本研究结果显示,“金汁” 组和“金汁” +Tofacitinib组给药后DAI 评分均降低,表明“金汁” 粪菌移植可一定程度上改善溃疡性结肠炎小鼠的肠道损伤。HE 染色显示模型组小鼠正常细胞结构消失,渗出大量炎性细胞; 而“金汁” 组和“金汁” +Tofacitinib 组浆膜层结构逐渐完整,组织形态逐渐改善,表明“金汁” 粪菌移植可有效减轻结肠黏膜的局部炎症,修复组织。有研究表明,溃疡性结肠炎患者血清中IL-6 水平升高,且与病变程度及累及范围相关,病情缓解后IL-6 水平降低[15-16]。一方面,IL-6 本身具有广泛的促炎作用,可改变结肠上皮细胞电解质的分泌,使内皮细胞通透性增强,中性粒细胞大量涌出浸润,加重炎症反应; 另一方面,IL-6 的高水平还会引起JAK/STAT3 通路的异常激活。IL-4 属于抗炎性细胞因子,主要由激活的T淋巴细胞分泌,能有效抑制单核巨噬细胞合成的IL-1β、TNF-α 等促炎性因子分泌,且可降低单核巨噬细胞对氧自由基的分泌能力。此外,IL-4 还可以抑制促炎症因子IL-8及PGE2的合成与分泌,从而减轻和缓解炎症反应的程度[17-18]。本研究结果显示,与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组IL-6、TNF-α 水平降低,IL-4 水平升高,表明“金汁” 粪菌移植可以有效改善炎症反应。除此之外,与模型组比较,“金汁” 组和“金汁” +Tofacitinib组MPO 活性较低,这也进一步验证了粪菌移植可以减轻肠道的炎症反应。
有临床研究显示,Ki-67 是一种细胞核抗原,可反应细胞增殖,且发现在肠癌组织中的Ki-67 呈现高表达,而在癌旁组织中表达明显较低[19]。本研究结果显示,与模型组比较,“金汁” 组和 “金汁” +Tofacitinib 组Ki-67、IL-6、TNF-α 表达降低,PCNA、IL-4 表达升高,表明“金汁” 粪菌移植对肠道炎症反应有所改善。许话等[20]研究发现,细胞因子与生长因子是JAK/STAT3 信号通路重要的启动因子,其通过与JAK 激酶偶联的相应受体结合,介导信号蛋白的级联活化反应,从而在机体炎症反应及肿瘤形成过程中发挥重要的作用。STAT3 是信号传导通路家族的重要成员之一,其在人体免疫反应、炎症反应及肿瘤形成等病理过程中发挥着重要的调控作用。林丽艳等[21]研究发现,许多细胞因子和生长因子可通过JAK/STAT3 信号通路将细胞外信号传递到细胞核内。此外,吴成成等[8]认为该通路在人体免疫反应、炎症反应以及肿瘤形成的病理过程中有重要的调控作用,在此传导过程中,IL-6 持续过表达可以激活此通路从而引发炎症反应。本研究结果显示,与模型组比较,“金汁” 组和“金汁” +Tofacitinib 组JAK、p-STAT3、STAT3 蛋白及JAK、STAT3 mRNA 表达降低,表明“金汁”粪菌移植可通过调控JAK/STAT3 通路对溃疡性结肠炎有改善作用。
综上所述,“金汁” 粪菌移植可改善溃疡性结肠炎小鼠炎症和临床症状,保护结肠黏膜,可能是通过抑制JAK/STAT3 信号通路异常激活实现的,这为溃疡性结肠炎的临床治疗提供了新的思路。除此之外,还应保持对未知风险的警惕,需要大规模的实验来确定“金汁” 粪菌移植的安全性和可行性。
