苏州地区献血者血小板HPA基因分型与CD36表型的研究
2023-11-20王仪含何红红金一鸣段宝生王玉珏汤龙海
王仪含 何红红 金一鸣 段宝生 王玉珏 汤龙海
[摘 要] 目的:进一步研究苏州地区单采血小板献血者HPA基因分型及其CD36抗原表型,为建立本地区血小板资料库及提高临床血小板输注有效性提供依据。方法:采用多重荧光PCR法对564例单采血小板献血者抗凝全血标本进行HPA-1~6,10,15,21基因分型检测,酶联免疫吸附试验检测血小板CD36抗原表达,借助流式细胞术对CD36阴性标本进行确认和表型分型。结果:564份标本中HPA-3、15基因型的杂合程度最高,其等位基因频率分别为HPA-3a 0.594、3b 0.406、15a 0.5275、15b 0.4725。苏州地区HPA-1a基因频率与英国白人、美国黑人差异有统计学意义(P<0.05),与南京、广州、黑龙江差异无统计学意义(P>0.05);HPA-2基因频率与广州、美国黑人差异有统计学意义(P<0.05);HPA-3和HPA-15基因频率与广州、黑龙江差异有统计学意义(P<0.05)。HPA-5基因频率与南京、广州、黑龙江差异无统计学意义(P>0.05),与英国白人、美国黑人差异有统计学意义(P<0.05)。CD36阴性标本12例(2.13%),其中1例为Ⅰ型CD36缺失,11例为II型CD36缺失。结论:苏州地区单采血小板献血者HPA基因型分布具有高度多态性,并存在种族和区域差异。
[关键词] 单采血小板固定献血者;人类血小板特异性抗原;CD36抗原;血小板无效输注
[中图分类号] R446.11 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.03.017
血小板表面具有复杂的血型抗原,包括ABO系统抗原、人类白细胞抗原(human leukocyte antigen,HLA)、人类血小板特异性抗原(human platelet antigen,HPA)、CD36(glycoprotein Ⅳ,GP Ⅳ)抗原以及其它一些糖蛋白抗原[1]。HPA抗原由血小板特有抗原决定簇组成,是存在于血小板膜糖蛋白上具有独特遗传多态性的蛋白分子[2],它的多态性是由于单个碱基取代而导致相应氨基酸的改变而产生。利用HPA基因分型检测,可进行同种型别血小板个体输注,从而有效降低产生血小板抗体的几率。血小板表面另一种重要的糖蛋白分子是CD36抗原,又名NaKa抗原,在亚裔人群中缺失频率相对较高,而在高加索人群缺失率较低[3]。HPA和CD36抗原是除HLA外造成免疫性血小板输注无效的重要因素。由于HPA基因多态性及CD36抗原缺失,患者在输血、移植、妊娠等免疫刺激下,易发生同种免疫性反应,造成血小板输注无效、胎儿/新生儿同种免疫性血小板减少症、输血后紫癜等[4]。因此,本文随机选取2022年2—6月苏州市中心血站单采血小板固定献血者(捐献血小板次数≥3次/年)564例,对苏州地区HPA抗原基因分型和CD36抗原缺失频率进行分析,以期为建立本地区血小板资料库及提高临床血小板输注有效性提供重要依据。
1 材料与方法
1.1 研究对象 单采血小板固定献血者(捐献血小板次数≥3次/年)564例,男性541例,女性23例,年龄20~55周岁,平均34.7±7.5周岁。籍贯分布在江苏省内各地区,均为汉族,本实验获苏州市中心血站医学伦理委员会批准。采集献血者静脉血5 mL,EDTA抗凝,放置-40 ℃冰箱保存,于2022年7月一次性完成全部检测。
1.2 试剂与仪器 DNA提取试剂盒(批号:MYYTW
9901,北京天根生化科技有限公司);人类血小板特异性抗原基因分型检测试剂盒(批号:202110A,江苏伟禾生物科技有限公司);人类血小板CD36抗原检测试剂盒(ELISA法,中科院苏州生物医学工程技术研究惠赠);PE荧光标记抗人CD36单克隆抗体、FITC荧光标记抗人CD14單克隆抗体、PE标记的抗人IgG抗体(批号:336206、325604、403503,Biolegend,上海达科为生物技术有限公司);流式细胞仪(DxFlex,美国Beckman Coulter公司)。
1.3 方法
1.3.1 DNA提取:取献血者抗凝全血标本250 μL,按试剂盒说明书提取DNA,浓度为30~50 ng/mL,A260/A280值为1.6~2.0。
1.3.2 HPA基因分型:按照试剂盒说明书,配置混合母液,包含HPA主反应液3 μL、HPA酶混合液0.4 μL、灭菌水12.6 μL。于每个反应孔中加入16 μL混合母液和2 μL DNA,放入荧光定量PCR仪(CFX96,BIORAD)中检测。根据HPA亚型探针荧光标识表,如扩增曲线正常且Ct<32判断相应的HPA亚型为阳性,无扩增曲线升起或Ct≥32判断相应的HPA亚型为阴性,扩增曲线异常则需重新检测。
1.3.3 血小板CD36抗原检测:采用ELISA法,向反应微孔板中加入待检、阳性及阴性对照血小板悬液,按试剂盒说明书要求初筛献血员血小板CD36表达。将ELISA法初筛阴性标本采用流式细胞术进行确认:取血小板悬液标记PE抗人CD36单克隆抗体,室温避光孵育15~20 min,经洗涤、离心、重悬后用流式细胞仪检测血小板表面平均荧光强度(mean fluorescence intensity,MFI)。
1.3.4 单核细胞表面CD36抗原检测:对流式细胞术确认的血小板CD36阴性标本,进一步标记FITC抗人CD14单克隆抗体和PE抗人CD36单克隆抗体,检测单核细胞CD36的表达,确认CD36缺失表型。
1.4 统计学处理 HPA基因型频率=统计阳性数(aa/ab/bb)/统计总人数(n),a基因频率=(aa+ab/2)/n,b基因频率=(bb+ab/2)/n,并作Hardy-Weinberg(H-W)平衡吻合度验证;不配合率(MP)=2ab(1-ab)(a、b分别代表a和b的等位基因频率)。与国内其他地区汉族人群HPA-1~6和HPA-15等位基因频率比较采用χ2检验,P<0.05为差异有统计学意义。CD36的表达分析采用FlowJo V10软件。
2 结 果
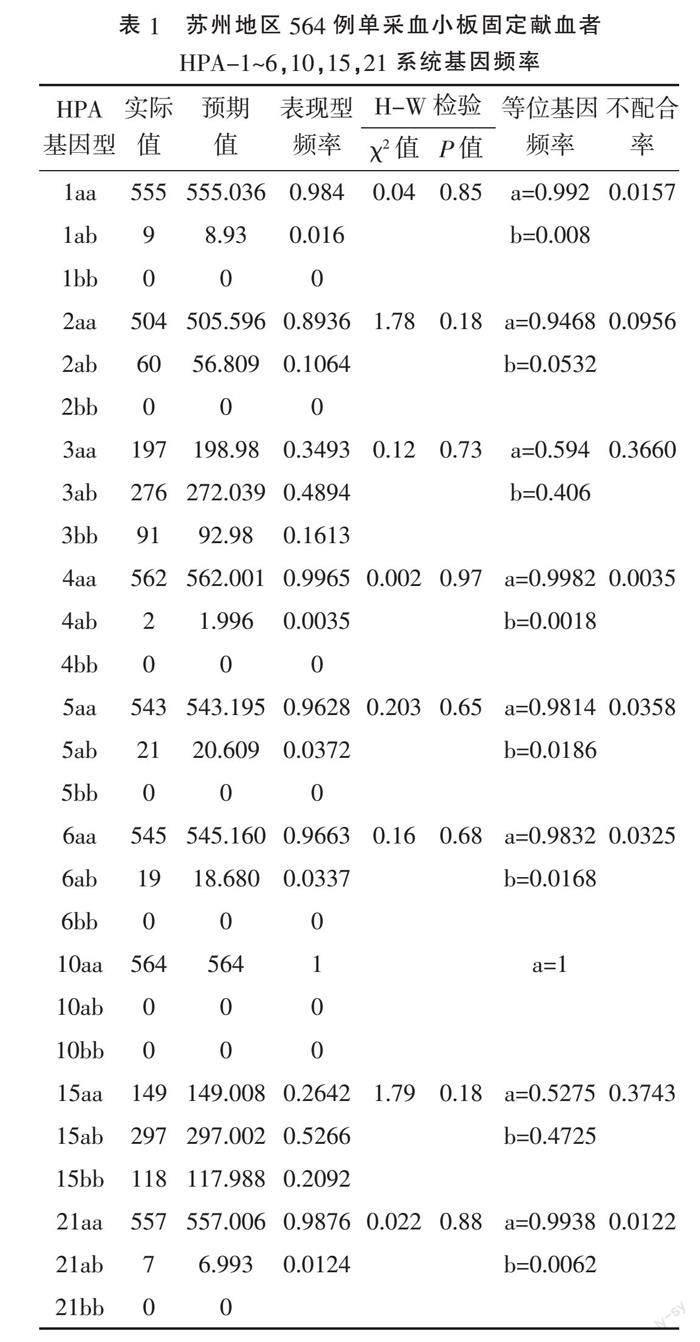
2.1 HPA-1~6、10、15、21系统基因型及等位基因频率 在564例标本中HPA-10未检出b等位基因,但发现HPA-3bb、HPA-15bb纯合基因型。经χ2检验,该系统基因型频率分布符合Hardy-Weinberg遗传平衡定律。见表1。
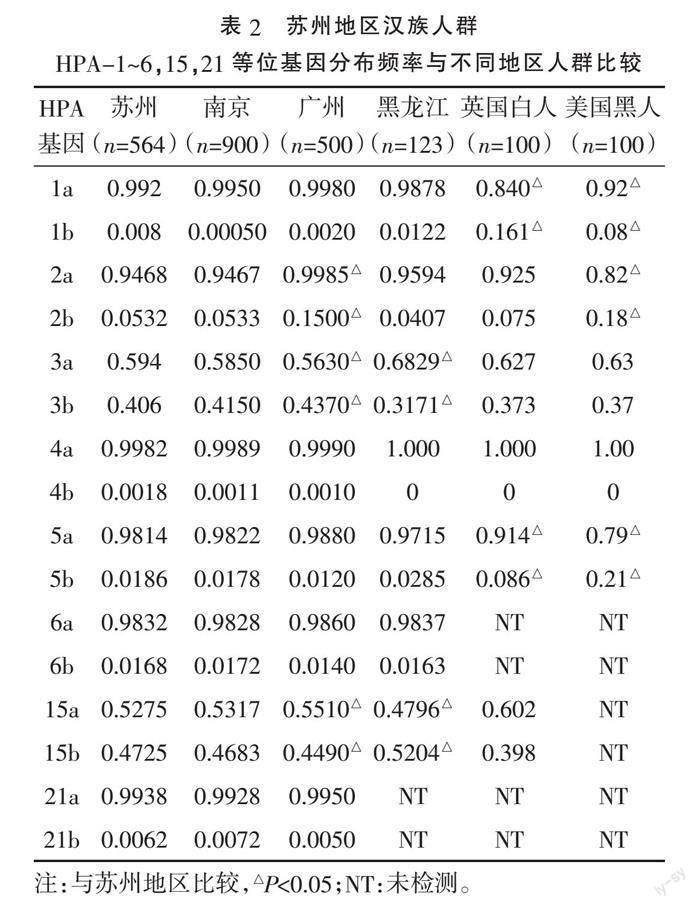
2.2 苏州地区HPA-1~6、15、21基因频率与国内外其他地区的比较 苏州地区单采血小板献血员HPA-1~6、15、21系统基因分布频率与张若洋等[5]报道的结果比较,差异均无统计学意义(P>0.05);HPA-1a基因频率与英国白人、美国黑人的差异有统计学意义(P<0.05),与南京、广州、黑龙江的差异无统计学意义(P>0.05);HPA-2基因频率与广州、美国黑人的差异有统计学意义(P<0.05);HPA-3和HPA-15基因频率与广州[7]、黑龙江差异有统计学意义(P<0.05)。HPA-5基因频率与南京、广州、黑龙江差异无统计学意义(P>0.05),与英国白人、美国黑人的差异有统计学意义(P<0.05)。见表2。
2.3 血小板CD36抗原检测结果 经ELISA检测和流式细胞术确认,564例标本中CD36抗原阳性552例(97.87%),阴性12例(2.13%),CD36缺失率2.13%,其中Ⅰ型CD36缺失1例(8.33%),Ⅱ型CD36缺失11例(91.67%)。
3 讨 论
由于HPA存在遗传多态性,且HPA基因在不同种族、不同地区人群中的分布存在差异,因此HPA抗原在血小板输注中引起同种免疫的风险具有一定的地域特征[6],引发的血小板免疫性疾病的几率也有差异。分析本地区人群HPA基因多态性特点可为临床需要时提供基因型配合的血小板,对血小板输注意义重大。
本研究采用实时荧光PCR法结合Taqman探针技术对564例单采血小板献血员标本HPA-1~6、10、15、21基因进行定性分析检测,发现HPA-3、15系统有aa、ab、bb 3种表型且杂合程度最高。HPA-1a、2a、4a、5a、6a和21a为本组高频抗原等位基因,以aa纯合子为主,HPA-1b、2b、4b、5b、6b和21b为低频抗原等位基因,以杂合子形式为主,其中HPA-10系统呈单特异性仅有HPA-10 aa,未检测出相应的b对偶基因。苏州地区单采血小板献血员HPA-1~6、10、15、21系统基因分布频率与张若洋等[5]报道的结果差异无统计学意义(P>0.05);HPA-1a基因频率与英国白人、美国黑人的差异有统计学意义(P<0.05),与南京、广州、黑龙江的差异无统计学意义(P>0.05),说明中国人群由HPA-1a引起的血小板输注无效较少见。苏州地区HPA-2基因频率与广州、美国黑人的差异有统计学意义(P<0.05);HPA-3和HPA-15基因频率与广州[7]、黑龙江的差异有统计学意义(P<0.05),说明HPA在中国人群中的分布存在一定的地域性。苏州地区HPA-5基因频率与南京、广州、黑龙江的差异无统计学意义(P>0.05),与英国白人、美国黑人差异有统计学意义(P<0.05),与文献[6-7]报道相似。
本研究结果顯示,苏州地区HPA-3和15系统不配合率分别为0.3660、0.3743,我国其他地区不配合率都较高[8],HPA-2、HPA-5不配合率是导致血小板无效输注的主要抗原系统。本研究结果仅显示HPA-5系统不配合率存在地区差异,苏州地区HPA-5不配合率低于广州地区[8](5a基因频率0.9731,5b基因频率0.0269,不配合率0.0510)和中国南方[8](5a基因频率0.997,5b基因频率0.003,不配合率0.0582),高于中国北方[8](5a基因频率0.9932,5b基因频率0.0068,不配合率0.01351)和吉林地区[9](5a基因频率0.998,5b基因频率0.002,不配合率0.004),也进一步证实HPA系统的地区差异性。因此,各地区建立血小板HPA基因资料库,重点关注各系统的配合,对临床血小板输注效果发挥积极作用。
除了HPA系统,近年来亚洲人群血小板CD36抗原缺失引起的输注无效及并发症也引起广泛的关注。CD36抗原缺失分为2种类型,即Ⅰ型(血小板和单核细胞均不表达CD36)和Ⅱ型(仅血小板不表达CD36)缺失。我国不同地区CD36缺失比例为0.75%~4.1%[10],其中广州、广西、深圳、上海和浙江的CD36抗原缺失频率平均为3.45%,以广西、浙江频率较高。本组标本CD36抗原缺失率为2.13%,与本血站前期调查结果2.48%较为相近[3],其中Ⅰ型缺失占8.33%,Ⅱ型缺失占91.67%。通过此次筛查,我们将重点关注临床输注血小板无效的原因,为由于CD36抗原缺失产生同种免疫抗体导致血小板输注无效的患者提供阴性血小板,以提高血小板输注效果。
综上所述,通过对苏州地区564例单采血小板献血员HPA基因分型和CD36抗原表型研究,进一步证实血小板抗原的基因分布具有高度多态性,并存在种族和区域差异。下一步我们将对反复输注血小板的患者进行血小板抗体筛查,了解该类患者血小板无效输注的免疫因素,制定相应的输血策略。
[参考文献]
[1] 董丽,方敏,王玉珏,等. 苏州地区无偿献血者血小板抗体检测及结果分析[J]. 中国输血杂志,2022,35(8):795-799.
[2] 赵桐茂. 人类血小板抗原(HPA)研究概况[J]. 中国输血杂志,2004,17(2):129-132.
[3] 何红红,陈婧,陈晔洲,等. 苏州地区献血者血小板CD36抗原表型筛查及基因突变分析[J]. 中国输血杂志,2021,
34(6):585-589.
[4] 赵阳,胡晓玉,王超,等. 安徽合肥地区单采血小板捐献者血样的HPA基因分型[J]. 临床输血与检验,2022,24(1):74-79.
[5] 张若洋,陈蓉,刘太香,等. 南京地区血小板捐献者HPA-1-29bw基因分型检测[J]. 中国输血杂志,2021,34(4):349-353.
[6] 周博,田茂生,马晨,等. 淄博地区血小板捐献者HLA-A,B和HPA1-17分型资料库的建立[J]. 临床输血与检验,2020,22(5):510-514.
[7] 苏湘晖,孙昂,谭涛,等. 岳阳汉族人群血小板抗原基因多态性研究[J]. 中国实验诊断学,2021,25(11):1677-1680.
[8] 叶欣,付涌水,罗广平,等. 广州地区无偿献血者HPA-1-6,15基因分型及频率调查[J]. 中国输血杂志,2008,21(12):921-924.
[9] 杨帆,韩瑜,焦立新,等. 吉林地区人群HPA-1~6,15系统基因多态性分析[J]. 中国实验诊断学,2016,20(5):750-751.
[10] 吴泳伦,孙爱农,蒲菲,等. 中山地区CD36阴性血小板供者库建立的探讨[J]. 中国输血杂志,2022,35(5):558-561.
[收稿日期] 2023-01-03
(本文编辑 缪宏建)
