肿瘤相关成纤维细胞在乳腺浸润性导管癌中的临床意义
2023-11-20朱永祺朱燕刘宏斌张晓娟
朱永祺 朱燕 刘宏斌 张晓娟
[摘 要] 目的:探討乳腺浸润性导管癌中肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)的临床意义。方法:选取乳腺癌改良根治手术标本102例,采用免疫组织化学方法检测浸润性导管癌组织及癌旁组织中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达,分析与临床病理参数的相关性及预后意义。结果:在乳腺浸润性导管癌组织中α-SMA阳性细胞率47.06%,而癌旁正常乳腺组织中无阳性细胞,差异有统计学意义(P=0.000)。癌组织中α-SMA表达与肿瘤直径、淋巴结转移及TNM分期显著相关(P<0.01)。单因素Log-Rank检验显示组织学分级、淋巴结转移、TNM分期、ER表达与预后相关(P<0.01)。多因素Cox回归分析显示组织学分级、淋巴结转移、TNM分期均具有独立预后意义(P<0.05)。结论:浸润性导管癌组织中CAFs增多促进肿瘤的发生发展及侵袭转移,有望成为乳腺癌免疫治疗的新靶点。
[关键词] 肿瘤相关成纤维细胞;α-平滑肌肌动蛋白;乳腺浸润性导管癌;免疫组织化学染色
[中图分类号] R737.9 [文献标志码] A [DOI] 10.19767/j.cnki.32-1412.2023.03.005
Clinical significance of cancer-associated fibroblasts
in invasive ductal carcinoma of the breast
ZHU Yongqi1, ZHU Yan2, LIU Hongbin2, ZHANG Xiaojuan2
(1Medical College of Nantong University, Jiangsu 226001;
2Department of Pathology, Second Affiliated Hospital of Nantong University / the First Hospital of Nantong)
[Abstract] Objective: To investigate the clinical significance of cancer-associated fibroblasts (CAFs) in invasive ductal carcinoma of the breast. Methods: 102 cases of breast cancer after modified radical mastectomy were selected, and immunohistochemical methods were used to detect the expression of α- Smooth muscle actin (α- SMA) in invasive ductal carcinoma tissues and adjacent tissues, and its correlation with clinical pathological parameters and prognostic significance were analyzed. Results: In invasive ductal carcinoma of the breast, the positive cell rate of α-SMA was 47.06%, while there were no positive cells in normal breast tissue adjacent to cancer, with a statistically significant difference (P=0.000). In cancer tissue, the expression of α-SMA was significantly correlated with tumor diameter, lymph node metastasis, and TNM staging (P<0.01). Single factor Log Rank test showed that histological grading, lymph node metastasis, TNM staging and ER expression were correlated with prognosis (P<0.01). Multivariate Cox regression analysis showed that histological grading, lymph node metastasis, and TNM staging had independent prognostic significance (P<0.05). Conclusion: The increase of CAFs in invasive ductal carcinoma can promote the occurrence, development, invasion and metastasis of the tumor, which is expected to become a new target of immunotherapy for breast cancer.
[Key words] cancer-associated fibroblasts; α-Smooth muscle actin; invasive ductal carcinoma of the breast; immunohistochemical staining
近年来我国乳腺癌发病率呈年轻化及逐年上升趋势[1]。越来越多研究表明,调控肿瘤微环境是控制肿瘤进展、提高肿瘤疗效的有效方法[2]。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)是肿瘤微环境中最重要的异质细胞群,能产生和分泌多种活性因子参与肿瘤微环境的调控,在肿瘤增殖、侵袭转移、微血管生成等方面发挥作用[3-5]。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)作为CAFs的特异性蛋白,在正常乳腺间质成纤维细胞中不表达,可反映乳腺癌间质CAFs的增殖活性。本文收集我院病理科2012—2016年乳腺浸润性导管癌改良根治手术标本102例,采用免疫组化方法检测癌组织中CAFs,探讨其与临床病理参数的相关性,分析影响乳腺癌预后因素。
1 资料与方法
1.1 一般资料 乳腺浸润性导管癌改良根治手术标本102例,患者术前均未经过内分泌治疗、放疗及化疗。患者均为女性,年龄32~78岁,平均51岁。肿瘤直径>2 cm 41例,≤2 cm 61例;WHO组织学分类:Ⅰ级28例,Ⅱ级42例,Ⅲ级32例;腋窝淋巴结转移40例,其中11例为微转移(淋巴结转移灶最大径≤2 mm),29例为宏转移(淋巴结转移灶最大径>2 mm);TNM临床分期:Ⅰ+Ⅱ期87例,Ⅲ+Ⅳ期15例。本研究经南通大学第二附属医院伦理委员会批准。
1.2 免疫组化检测 手术标本经10%中性福尔马林固定,石蜡包埋及4 μm连续切片,选取癌组织及癌旁3 cm以外的正常乳腺组织蜡块。采用鼠抗人α-SMA抗体(UMAB237,北京中杉)。以已知的阳性切片作为阳性对照,阴性对照以PBS液代替一抗。α-SMA阳性定位于肿瘤间质成纤维细胞,胞浆呈棕褐色或棕黄色,计算 α-SMA蛋白阳性细胞,而α-SMA阳性的乳腺导管、周围肌上皮细胞及间质小血管不计为阳性细胞。随机选取10个高倍视野计数约200个细胞,按阳性细胞百分比计分:0~10%计1分,11%~50%计2分,51%~75%计3分,76%~100%計4分;按染色强度计分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。将两者计分相乘为最终得分,>3分为阳性表达[6]。
1.3 统计学处理 应用SPSS 26.0统计学软件进行数据分析。计数资料以频数或率表示,组间比较采用χ2检验。绘制Kaplan-Meier生存曲线,采用单因素Log-Rank检验和多因素Cox回归分析可能影响预后的因素。P<0.05为差异有统计学意义。
2 结 果
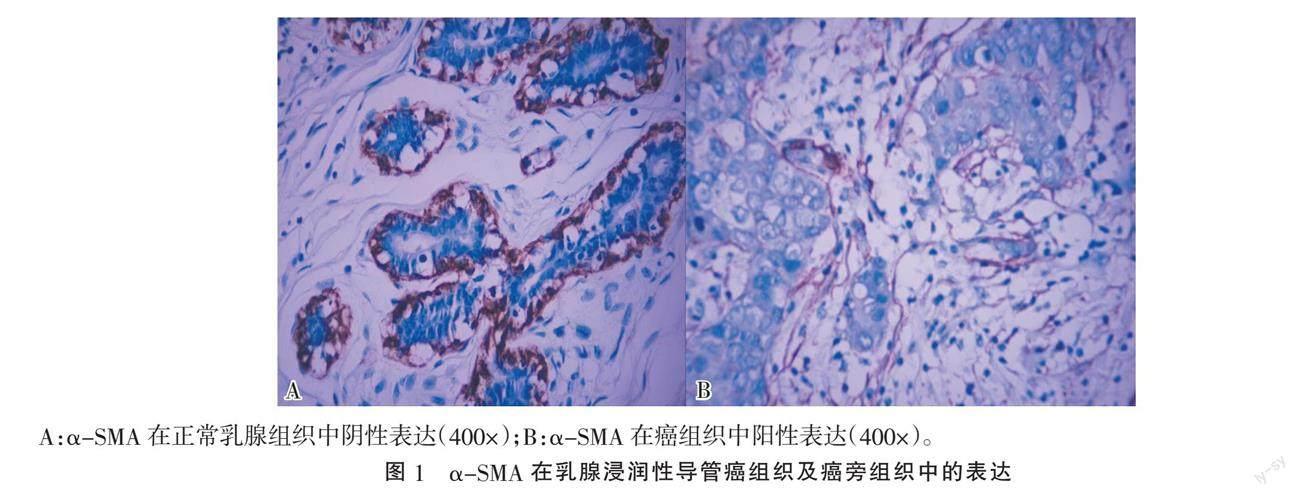
2.1 乳腺浸润性导管癌组织及癌旁组织中α-SMA阳性细胞 乳腺浸润性导管癌组织中48例(47.06%)存在α-SMA阳性细胞,而癌旁正常乳腺组织中无α-SMA阳性细胞,差异有统计学意义(χ2=62.769,P=0.000)。(图1)。
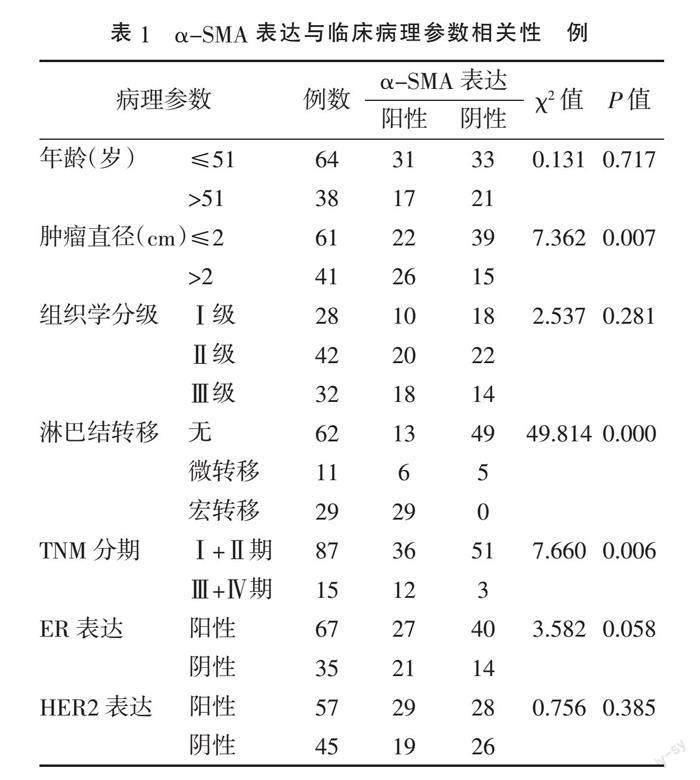
2.2 α-SMA表达与临床病理参数相关性 乳腺浸润性导管癌组织中α-SMA的表达与患者年龄、组织学分级、ER表达及HER2表达无关(P>0.05),而与肿瘤直径、腋窝淋巴结转移、TNM分期显著相关(P<0.01),即肿瘤直径越大、有腋窝淋巴结转移、临床分期高的乳腺浸润性导管癌组织中α-SMA 阳性表达率越高。腋窝淋巴结宏转移的所有标本均可见α-SMA阳性表达。见表1。
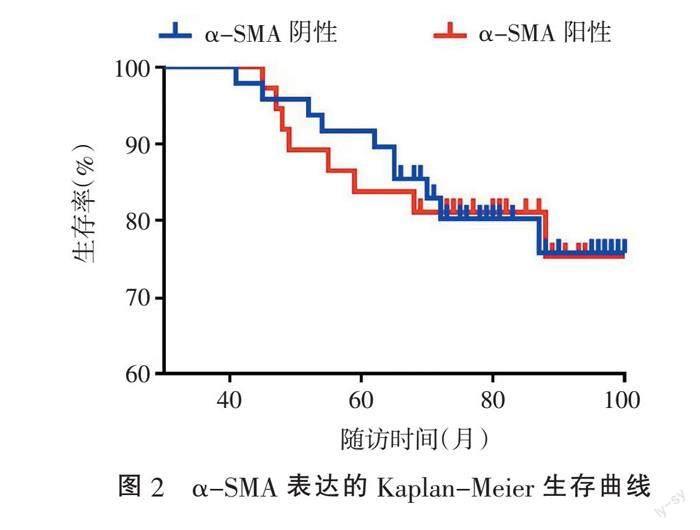
2.3 影响乳腺癌预后因素分析 102例乳腺浸润性导管癌患者中85例获得随访,随访率83.33%,随访时间66~115个月,平均84个月,其中67例存活,18例死亡。单因素Log-Rank检验显示,乳腺癌组织学分级、淋巴结转移、TNM分期、ER表达与患者预后密切相关(P<0.01),而患者年龄、肿瘤直径、HER2表达、α-SMA表达与预后无关(P>0.05)。多因素Cox回归分析显示,乳腺癌组织学分级、淋巴结转移、TNM分期具有独立预后意义(P均<0.05)。见表2。α-SMA阳性组与阴性组生存率的差异无统计学意义(P>0.05)。见图2。
3 讨 论
乳腺癌是影响女性生命健康最常见恶性肿瘤,肿瘤局部浸润和淋巴结转移是临床疗效差的主要原因。越来越多的研究表明,乳腺癌形成是多基因介入、多步进展并受肿瘤微环境控制的复杂过程。探究乳腺癌浸润和转移的机制对指导治疗、改善患者预后具有非常重要的意义。
肿瘤相关成纤维细胞分泌多种活性蛋白因子来促进癌细胞活化、增殖、侵袭和转移,促进血管生成及肿瘤基质的再塑[7-8]。同时,CAFs还抑制机体免疫系统,其机制主要是通过分泌多种细胞因子激活免疫抑制性细胞,继而下调免疫杀伤性细胞的功能。(1)转化生长因子β(TGF-β):CAFs通过分泌TGF-β引起白介素6(IL-6)和白介素10(IL-10)等下游因子的表达,促进肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)、髓源性抑制细胞(myeloid derived suppressor cells,MDSCs)以及调节性T细胞(Treg)的增加,从而抑制具有抗肿瘤作用的细胞毒T淋巴细胞(cytotoxic T lymphocytes,CTLs)的反应和NK细胞活性。TGF-β还可抑制NK细胞合成γ-干扰素(IFN-γ),并阻碍CD4+Th细胞向具有抗肿瘤活性的方向分化。(2)IL-6和IL-10:是重要的免疫负性调控因子,它们和单核细胞趋化蛋白1(MCP-1)一起吸引巨噬细胞到肿瘤微环境中并诱导其分化成抑制性M2型巨噬细胞,导致机体免疫功能受抑,促进癌细胞存活。(3)环氧化酶-2及其产物前列腺素E2(PGE2):PGE2诱导Treg细胞FOXP3蛋白表达,并抑制T细胞活化。说明CAFs具有多种促癌机制,靶向CAFs可能是潜在的治疗乳腺癌的有效方法。
本组研究结果显示,在乳腺浸润性导管癌组织中α-SMA阳性细胞率显著高于癌旁正常乳腺,差异有统计学意义(P=0.000),与张哲珺等[9]研究一致。α-SMA表达与肿瘤直径、淋巴结转移及TNM分期显著相关(P<0.01),与文献报道一致[10-11]。单因素Log-Rank检验显示,乳腺浸润性导管癌组织学分级、淋巴结转移、TNM分期、ER表达与预后显著相关(P<0.01),而患者年龄、肿瘤直径、HER2表达、α-SMA表达与预后无关(P>0.05)。多因素Cox回归分析显示,乳腺浸润性导管癌组织学分级、淋巴结转移及TNM分期具有独立的预后意义(P均<0.05)。
CAFs表达升高促进肿瘤的发生发展及侵袭转移,有望成为乳腺癌免疫治疗的新靶点。
[参考文献]
[1] 朱燕,杨其昌,刘宏斌,等. 驱动蛋白Kif2a在乳腺癌组织芯片中的表达及临床意义[J]. 实用医学杂志,2016,32(16):2663-2666.
[2] WU T,DAI Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett,2017,387:61-68.
[3] SHIMURA T,SASATANI M,KAWAI H,et al. Radiation-induced myofibroblasts promote tumor growth via mitochondrial ROS-activated TGFβ signaling[J]. Mol Cancer Res,2018,16(11):1676-1686.
[4] MATHOT P,GRANDIN M,DEVAILLY G,et al. DNA methylation signal has a major role in the response of human breast cancer cells to the microenvironment[J]. Oncogenesis,2017,6(10):e390.
[5] SUH J,KIM D H,SURH Y J. Resveratrol suppresses migration,invasion and stemness of human breast cancer cells by interfering with tumor-stromal cross-talk[J]. Arch Biochem Biophys,2018,643:62-71.
[6] 許良中,杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志,1996,6(4):229-231.
[7] STANISAVLJEVIC J,LOUBAT-CASANOVAS J,HERRERA M,et al. Snail1-expressing fibroblasts in the tumor microenvironment display mechanical properties that support metastasis[J]. Cancer Res,2015,75(2):284-295.
[8] JAIN R K,MARTIN J D,STYLIANOPOULOS T. The role of mechanical forces in tumor growth and therapy[J]. Annu Rev Biomed Eng,2014,16:321-346.
[9] 张哲珺,陆元志,钟雪云. 乳腺癌中Tenascin C、α-SMA和PDGFRα的表达及意义[J]. 临床与实验病理学杂志,2019,35(9):1013-1017.
[10] LUO H,TU G,LIU Z,et al. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression[J]. Cancer Lett,2015,361(2):155-163.
[11] ERSHAID N,SHARON Y,DORON H,et al. NLRP3 inflammasome in fibroblasts links tissue damage with inflammation in breast cancer progression and metastasis[J]. Nat Commun,2019,10(1):4375.
[收稿日期] 2022-10-06
(本文编辑 王晓蕴)
