次乌头碱通过cGAS/STING 通路调节胃癌细胞增殖、迁移、侵袭和免疫逃逸
2023-11-13胡洁琼冯彦虎兰州大学第二医院消化科兰州730030
王 芳 胡洁琼 冯彦虎 何 东 (兰州大学第二医院消化科,兰州 730030)
胃癌是目前第四大常见肿瘤类型,也是癌症死亡的第二大原因[1]。尽管胃癌治疗方法有所改进,如手术、化疗和放疗,但这些传统疗法在降低胃癌病死率方面效果有限[2]。胃癌细胞增殖、侵袭和转移是多数胃癌相关死亡和复发的主要原因,严重影响疗效[3]。此外,越来越多的证据表明,免疫逃逸对胃癌细胞存活和发展至关重要[4]。因此,寻找既能有效治疗胃癌又能抑制肿瘤活动的药物是临床急需解决的问题。传统癌症治疗会引起严重不良反应,因此,近几十年来,植物化学物质抗癌作用研究逐渐流行[5]。次乌头碱(hypaconitine,HA)是乌头中最重要的活性成分之一,具有抗炎、镇痛等作用[6]。据报道,HA 可抑制肺癌A549 细胞黏附、迁移和侵袭,表明HA 具有抗癌作用[7]。但HA 对胃癌细胞增殖、迁移、侵袭、免疫逃逸的影响鲜有报道。研究显示,激活环磷酸鸟苷-腺苷酸合成酶(cyclic GMPAMP synthase,cGAS)/干扰素基因刺激因子(stimulator of interferon gene,STING)信号通路可抑制胃癌进展[8]。但HA能否通过调控cGAS/STING通路影响胃癌细胞增殖、迁移、侵袭、免疫逃逸尚不可知。因此,本研究主要探讨HA 对胃癌细胞增殖、迁移、侵袭、免疫逃逸的影响及作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人胃癌细胞系BGC-823 购自上海美湾生物科技有限公司;人源NK 细胞购自上海继和生物科技有限公司。
1.1.2 主要试剂 HA 购自上海源叶生物科技有限公司;cGAS 抑制剂RU.521 购自美国MCE 公司;CCK-8 试剂盒购自无锡菩禾生物医药技术有限公司;趋 化 因 子 配 体(chemokine ligand,CXCL)2、CXCL8 ELISA 试剂盒购自伊艾博(武汉)科技股份有限公司;兔源一抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、基质金属蛋白酶(matrix metallopeptidase,MMP)-9、cGAS、STING、GAPDH、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养与分组 将BGC-823 细胞、NK 细胞培养于含10%胎牛血清的DMEM 培养基。取对数生长期BGC-823细胞,分为对照组(NC组)、HA低剂量组(HA-L 组)、HA 中剂量组(HA-M 组)、HA 高剂量组(HA-H 组)、RU.521(cGAS 抑制剂)组、HA-H+RU.521 组,参考文献及前期预实验结果,HA-L 组、HA-M 组、HA-H 组、RU.521 组BGC-823 细胞分别用2 µmol/L HA、4 µmol/L HA、8 µmol/L HA、1 µmol/L RU.521 处理24 h;HA-H+RU.521 组BGC-823 细胞用8 µmol/L HA 和1 µmol/L RU.521 同时处理24 h[7,9];NC 组BGC-823 细胞为未经任何处理的BGC-823 细胞。处理结束后,收集各组细胞或细胞上清用于后续实验。将上述各组BGC-823 细胞置于Transwell 上室,分别与置于Transwell 下室的NK细胞共培养24 h,共培养细胞体系依次命名为NC共培养组、HA-L 共培养组、HA-M 共培养组、HA-H 共培养组、RU.521 共培养组、HA-H+RU.521 共培养组,收集共培养的NK细胞用于NK细胞杀伤力鉴定。
1.2.2 CCK-8 检测BGC-823 细胞增殖 将BGC-823 细胞以3×103个/孔接种于96 孔板并培养24 h,按照1.2.1 处理后,10 µl/孔加入CCK-8 试剂,37 ℃再孵育1.5 h,酶标仪检测处理0 h、24 h时450 nm处吸光度。
1.2.3 克隆形成实验检测BGC-823 细胞克隆形成能力 将各组BGC-823 细胞以500 个/孔接种于6 孔板,培养14 d后4%多聚甲醛固定20 min,加入0.5%结晶紫溶液室温染色20 min,拍摄照片并计算克隆形成率。
1.2.4 划痕愈合实验检测BGC-823 细胞迁移 将各组BGC-823 细胞以3×105个/孔接种于6 孔板,培养至细胞融合度90%以上,采用200 µl 移液器吸管尖端在细胞表面划痕,显微镜下对0 h 和24 h 划痕进行拍照,并计算划痕愈合率。
1.2.5 Transwell 测定BGC-823 细胞侵袭 将30 µl Matrigel 基质胶均匀涂抹于Transwell 小室,37 ℃、5%CO2培养至基质胶完全凝固。各组BGC-823细胞加入不含胎牛血清的DMEM 培养基,稀释后的细胞浓度为2×105个/ml。Transwell 上 室 加入100 µl 细胞,下室加入500 µl 含10%胎牛血清的DMEM 培养基培养24 h,取出Transwell 小室,棉签轻轻擦拭上层细胞,甲醇固定30 min,结晶紫染色10 min,显微镜下拍照。
1.2.6 ELISA 检 测BGC-823 细 胞 上 清 中CXCL2、CXCL8 水平 严格按照ELISA 试剂盒说明书检测BGC-823细胞上清中CXCL2、CXCL8水平。
1.2.7 检测NK 细胞杀伤力[10]以NK 细胞为效应细胞,BGC-823 细胞为靶细胞,将NK 细胞与BGC-823 细胞以1∶10 比例加入96 孔板孵育4 h,离心并收集50 µl 上清,加入新的96 孔板,加入50 µl 乳酸脱氢酶孵育30 min,50 µl 终止液孵育1 h,酶标仪测量450 nm 处吸光度。NK 细胞杀伤力(%)=(实验组OD 平均值-仅培养BGC-823 细胞时OD 平均值-仅培养NK 细胞时OD 平均值)/(BGC-823 细胞用10 µl 30%TritonX-100培养时OD 平均值-仅培养BGC-823细胞时OD平均值)×100%。
1.2.8 Western blot 检 测BGC-823 细 胞PCNA、MMP-9、cGAS、STING 蛋白表达 RIPA 裂解缓冲液提取BGC-823 细胞总蛋白,定量、电泳、转膜、封闭,加入一抗PCNA(1∶2 000)、MMP-9(1∶2 000)、cGAS(1∶3 000)、STING(1∶1 000)、GAPDH(1∶1 000) 4 ℃孵育过夜,次日加入二抗(1∶4 000)室温孵育2 h,ECL 试剂观察蛋白条带显色,Image J 软件分析目的蛋白条带灰度值。
1.3 统计学分析 采用SPSS25.0软件进行统计学分析,符合正态分布且方差齐的数据以±s表示,采用单因素方差分析进行多组间差异比较,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 HA 对BGC-823 细胞增殖的影响 与NC 组比较,HA-L 组、HA-M 组、HA-H 组BGC-823 细胞OD450(24 h)、克隆形成率降低(P<0.05);与NC 组比较,RU.521 组BGC-823 细胞OD450(24 h)、克隆形成率升高(P<0.05);与HA-H 组比较,HA-H+RU.521 组BGC-823 细胞OD450(24 h)、克隆形成率升高(P<0.05),见图1、表1。
表1 各组BGC-823 细胞OD450(0 h、24 h)、克隆形成率比较(±s,n=6)Tab.1 Comparison of OD450 (0 h, 24 h) and clone formation rate of BGC-823 cells in each group (±s,n=6)
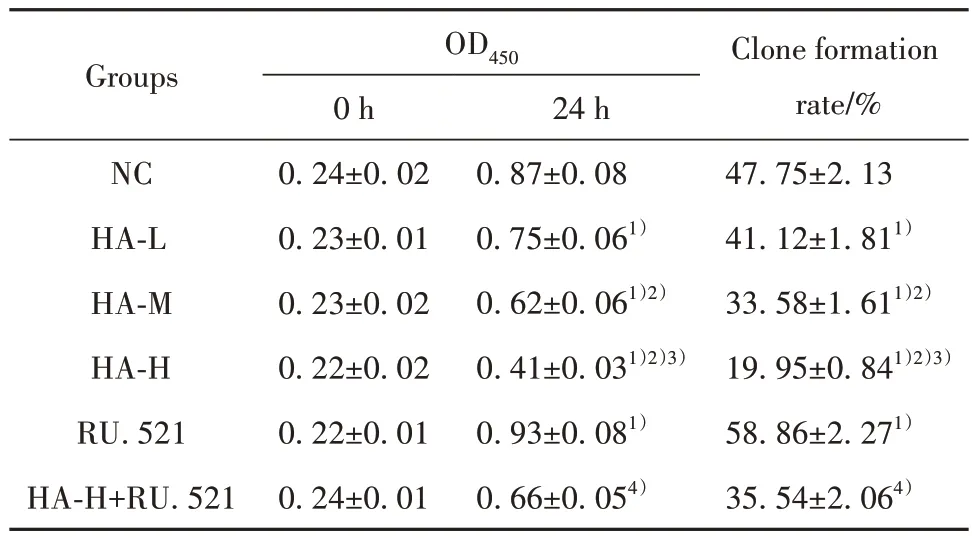
表1 各组BGC-823 细胞OD450(0 h、24 h)、克隆形成率比较(±s,n=6)Tab.1 Comparison of OD450 (0 h, 24 h) and clone formation rate of BGC-823 cells in each group (±s,n=6)
Note:Compared with NC group, 1)P<0.05; compared with HA-L group,2)P<0.05; compared with HA-M group, 3)P<0.05; compared with HA-H group, 4)P<0.05.
Clone formation rate/%47.75±2.13 41.12±1.811)33.58±1.611)2)19.95±0.841)2)3)58.86±2.271)35.54±2.064)Groups OD450 0 h 0.24±0.02 0.23±0.01 0.23±0.02 0.22±0.02 0.22±0.01 0.24±0.01 24 h 0.87±0.08 0.75±0.061)0.62±0.061)2)0.41±0.031)2)3)0.93±0.081)0.66±0.054)NC HA-L HA-M HA-H RU.521 HA-H+RU.521
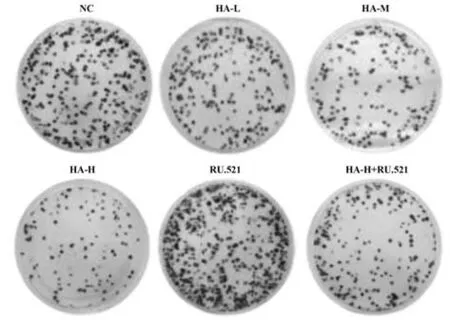
图1 克隆形成实验检测BGC-823细胞克隆形成Fig.1 Clone formation assay detects BGC-823 cell clone formation
2.2 HA 对BGC-823 细胞迁移的影响 与NC 组比较,HA-L 组、HA-M 组、HA-H 组BGC-823 细胞划痕愈合率降低(P<0.05);与NC 组比较,RU.521 组BGC-823 细胞划痕愈合率升高(P<0.05);与HA-H组比较,HA-H+RU.521组BGC-823细胞划痕愈合率升高(P<0.05),见图2、表2。
表2 各组BGC-823细胞划痕愈合率比较(±s,n=6)Tab.2 Comparison of scratch healing rates of BGC-823 cells in each group (±s,n=6)
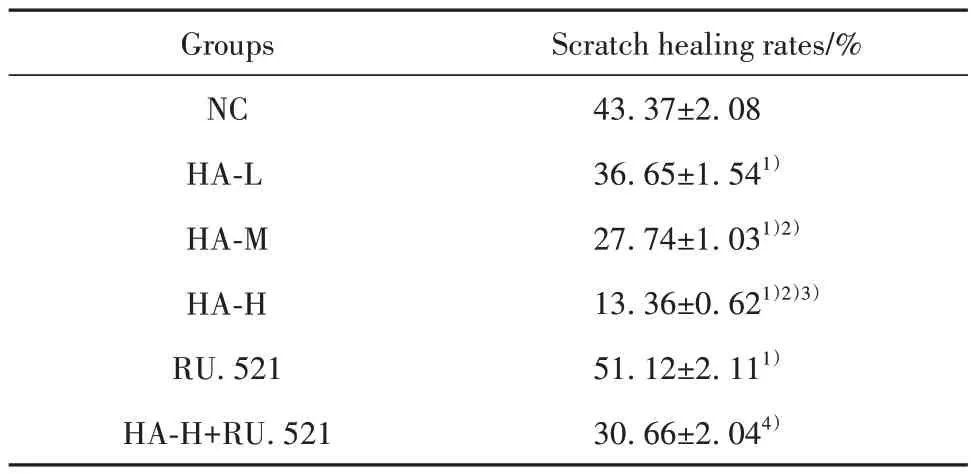
表2 各组BGC-823细胞划痕愈合率比较(±s,n=6)Tab.2 Comparison of scratch healing rates of BGC-823 cells in each group (±s,n=6)
Note:Compared with NC group, 1)P<0.05; compared with HA-L group,2)P<0.05; compared with HA-M group, 3)P<0.05; compared with HA-H group, 4)P<0.05.
Scratch healing rates/%43.37±2.08 36.65±1.541)27.74±1.031)2)13.36±0.621)2)3)51.12±2.111)30.66±2.044)Groups NC HA-L HA-M HA-H RU.521 HA-H+RU.521
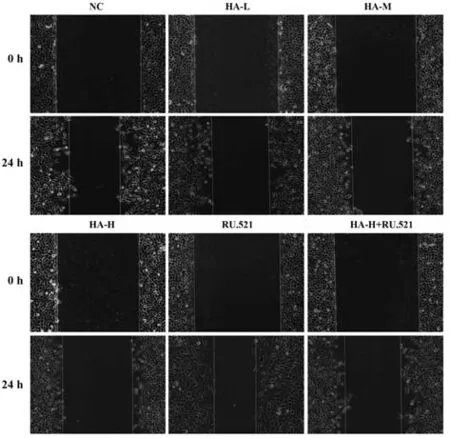
图2 划痕愈合实验检测BGC-823细胞迁移Fig.2 BGC-823 cell migration detected by scratch healing test
2.3 HA 对BGC-823 细胞侵袭的影响 与NC 组比较,HA-L 组、HA-M 组、HA-H 组BGC-823 细胞侵袭数减少(P<0.05);与NC 组比较,RU.521 组BGC-823 细胞侵袭数增多(P<0.05);与HA-H 组比较,HA-H+RU.521 组BGC-823 细 胞 侵 袭 数 增 多(P<0.05),见图3、表3。
表3 各组BGC-823细胞侵袭数比较(±s,n=6)Tab.3 Comparison of invasion numbers of BGC-823 cells in each group (±s,n=6)
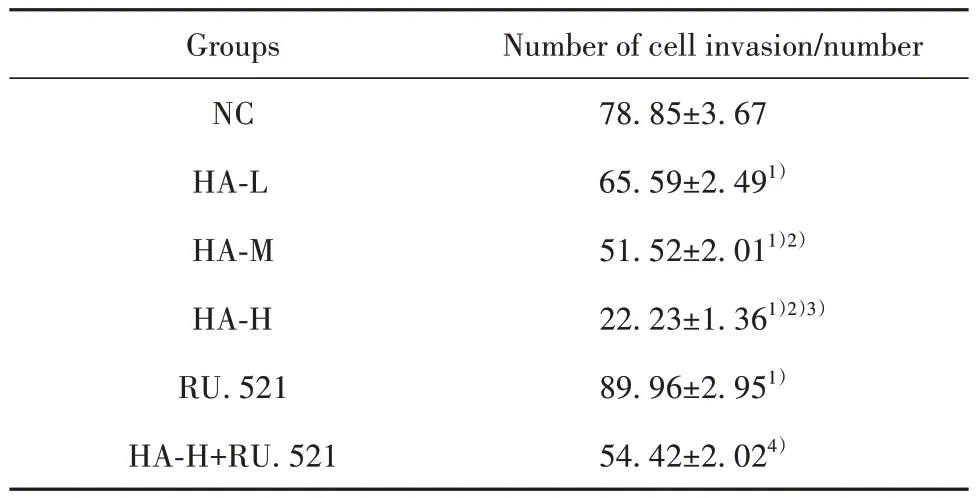
表3 各组BGC-823细胞侵袭数比较(±s,n=6)Tab.3 Comparison of invasion numbers of BGC-823 cells in each group (±s,n=6)
Note:Compared with NC group, 1)P<0.05; compared with HA-L group,2)P<0.05; compared with HA-M group, 3)P<0.05; compared with HA-H group, 4)P<0.05.
Number of cell invasion/number 78.85±3.67 65.59±2.491)51.52±2.011)2)22.23±1.361)2)3)89.96±2.951)54.42±2.024)Groups NC HA-L HA-M HA-H RU.521 HA-H+RU.521
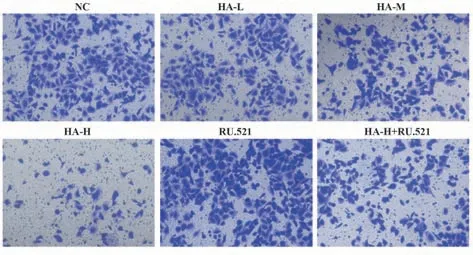
图3 Transwell实验检测BGC-823细胞侵袭(×400)Fig.3 BGC-823 cell invasion detected by Transwell assay(×400)
2.4 HA 对BGC-823 细胞上清CXCL2、CXCL8 水平的影响 与NC 组比较,HA-L 组、HA-M 组、HA-H 组BGC-823 细胞上清中CXCL2、CXCL8 水平降低(P<0.05);与NC 组比较,RU.521 组BGC-823 细胞上清中CXCL2、CXCL8 水平升高(P<0.05);与HA-H 组比 较,HA-H+RU.521 组BGC-823 细 胞 上 清 中CXCL2、CXCL8水平升高(P<0.05),见表4。
表4 各组BGC-823 细胞上清中CXCL2、CXCL8 水平比较(±s,n=6,pg/ml)Tab.4 Comparison of CXCL2 and CXCL8 levels in supernatant of BGC-823 cells in each group (±s,n=6,pg/ml)

表4 各组BGC-823 细胞上清中CXCL2、CXCL8 水平比较(±s,n=6,pg/ml)Tab.4 Comparison of CXCL2 and CXCL8 levels in supernatant of BGC-823 cells in each group (±s,n=6,pg/ml)
Note:Compared with NC group, 1)P<0.05; compared with HA-L group,2)P<0.05; compared with HA-M group, 3)P<0.05; compared with HA-H group, 4)P<0.05.
CXCL8 126.34±4.15 109.94±3.881)94.45±3.751)2)52.23±2.071)2)3)156.67±5.791)98.86±4.174)Groups NC HA-L HA-M HA-H RU.521 HA-H+RU.521 CXCL2 169.73±7.21 136.67±4.561)112.26±3.691)2)73.35±2.191)2)3)201.17±8.671)121.23±6.854)
2.5 HA 对共培养细胞体系NK 细胞杀伤力的影响 与NC 共培养组比较,HA-L 共培养组、HA-M 共培养组、HA-H 共培养组NK 细胞杀伤力增强(P<0.05);与NC 共培养组比较,RU.521 共培养组NK细胞杀伤力减弱(P<0.05);与HA-H共培养组比较,HA-H+RU.521 共培养组NK 细胞杀伤力减弱(P<0.05),见表5。
表5 各共培养细胞体系中NK细胞杀伤力比较(±s,n=6)Tab.5 Comparison of NK cell lethality in various co-cultured cell systems (±s,n=6)

表5 各共培养细胞体系中NK细胞杀伤力比较(±s,n=6)Tab.5 Comparison of NK cell lethality in various co-cultured cell systems (±s,n=6)
Note:Compared with NC co-cultured group, 1)P<0.05; compared with HA-L co-cultured group, 2)P<0.05; compared with HA-M cocultured group, 3)P<0.05; compared with HA-H co-cultured group, 4)P<0.05.
NK cell lethality/%7.69±0.37 17.79±0.861)26.65±1.331)2)40.77±2.191)2)3)3.26±0.211)20.23±1.014)Groups NC co-cultured HA-L co-cultured HA-M co-cultured HA-H co-cultured RU.521co-cultured HA-H+RU.521 co-cultured
2.6 HA 对BGC-823 细 胞PCNA、MMP-9 蛋 白 及cGAS-STING 通路相关蛋白表达的影响 与NC 组比 较,HA-L 组、HA-M 组、HA-H 组BGC-823 细 胞PCNA、MMP-9 蛋白表达降低,cGAS、STING 蛋白表达升高(P<0.05);与NC 组比较,RU.521 组BGC-823细胞PCNA、MMP-9蛋白表达升高,cGAS、STING蛋白表达降低(P<0.05);与HA-H 组比较,HA-H+RU.521 组BGC-823 细胞PCNA、MMP-9 蛋白表达升高,cGAS、STING 蛋白表达降低(P<0.05),见图4、表6。
表6 各组BGC-823细胞PCNA、MMP-9、cGAS、STING蛋白表达比较(±s,n=6)Tab.6 Comparison of protein expressions of PCNA, MMP-9, cGAS and STING in BGC-823 cells of each group (±s,n=6)
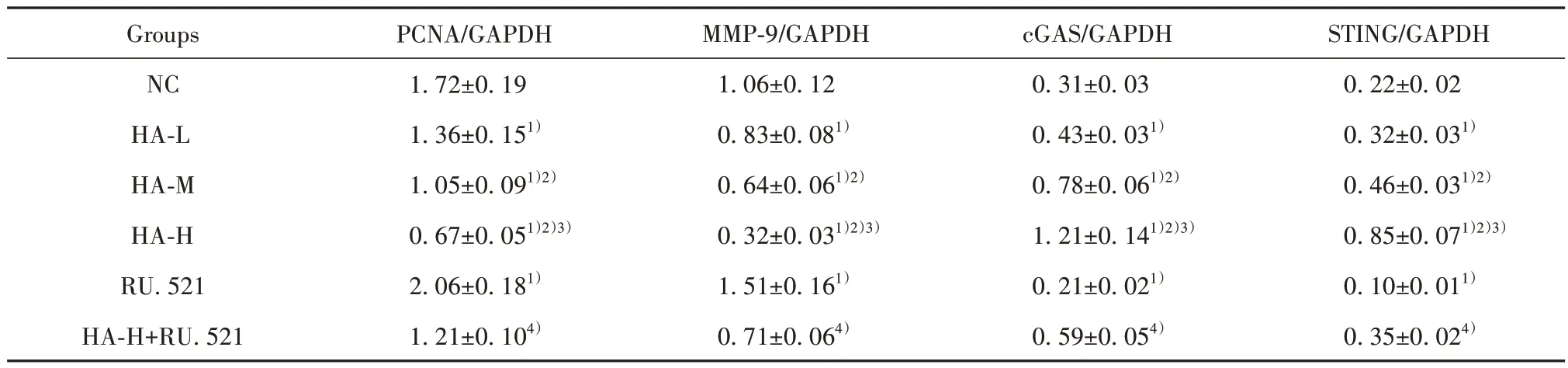
表6 各组BGC-823细胞PCNA、MMP-9、cGAS、STING蛋白表达比较(±s,n=6)Tab.6 Comparison of protein expressions of PCNA, MMP-9, cGAS and STING in BGC-823 cells of each group (±s,n=6)
Note:Compared with NC group, 1)P<0.05; compared with HA-L group, 2)P<0.05; compared with HA-M group, 3)P<0.05; compared with HA-Hgroup, 4)P<0.05.
Groups NC HA-L HA-M HA-H RU.521 HA-H+RU.521 PCNA/GAPDH MMP-9/GAPDH cGAS/GAPDH STING/GAPDH 0.22±0.02 0.32±0.031)0.46±0.031)2)0.85±0.071)2)3)0.10±0.011)0.35±0.024)1.72±0.19 1.36±0.151)1.05±0.091)2)0.67±0.051)2)3)2.06±0.181)1.21±0.104)1.06±0.12 0.83±0.081)0.64±0.061)2)0.32±0.031)2)3)1.51±0.161)0.71±0.064)0.31±0.03 0.43±0.031)0.78±0.061)2)1.21±0.141)2)3)0.21±0.021)0.59±0.054)
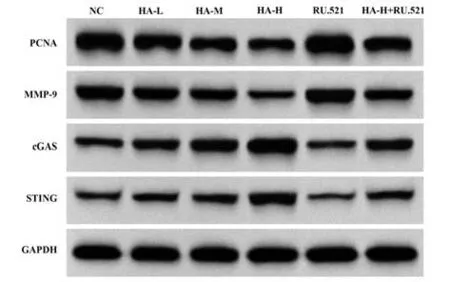
图4 Western blot 检 测BGC-823 细 胞PCNA、MMP-9、cGAS、STING蛋白表达Fig.4 Western blot detects PCNA, MMP-9, cGAS and STING protein expressions in BGC-823 cells
3 讨论
胃癌是消化道恶性肿瘤,具有发病率高、病死率高的特点[11]。临床治疗胃癌的一线药物毒性大、疗效差[12]。因此,胃癌治疗需要疗效和安全性更好的新型药物。
近年中药抗肿瘤作用显著,引起了国内外广泛关注,具有不良反应小、价格低廉等优点[13]。HA 是一种在乌头根中发现的二萜生物碱,具有细胞毒性作用[14]。据报道,HA 可抑制肝癌HepG2 细胞系生长,表明HA 具有抗肿瘤作用,与本研究结果一致[15]。本研究显示,HA 可抑制胃癌BGC-823 细胞增殖、迁移和侵袭,同时抑制增殖相关蛋白PCNA、迁移和侵袭相关蛋白MMP-9 表达,且呈剂量依赖性,表明HA 可抑制胃癌恶性进展。CXCL2、CXCL8是一类有利于肿瘤生长发育的趋化因子,其异常表达会导致免疫细胞无法在正确位置发挥抗肿瘤免疫应答[16];NK 细胞是免疫系统重要组成之一,可通过分泌毒性因子发挥免疫监视作用进而清除肿瘤细胞[10]。本研究显示,HA 可剂量依赖性地抑制BGC-823 细胞上清中CXCL2、CXCL8 表达,提高共培养体系中NK 细胞杀伤力,表明HA 可抑制BGC-823 细胞免疫逃逸。提示HA 可能成为治疗胃癌的潜在有效药物。
cGAS 是一种细胞质DNA 传感器,可激活STING 蛋白,随后诱导针对各种含DNA 病原体的保护性免疫防御并提供抗肿瘤免疫[17-18]。据报道,激活非小细胞肺癌的cGAS/STING 信号通路可促进NK 细胞浸润和抗肿瘤免疫[19];激活cGAS/STING 信号通路可抑制膀胱癌细胞增殖[20];抑制cGAS/STING信号通路可促发胰腺癌,表明cGAS/STING 信号通路参与肿瘤进展,与本研究结果一致[21]。本研究显示,与NC 组比较,RU.521 组BGC-823 细胞cGAS、STING 蛋白表达降低,BGC-823 细胞增殖、迁移、侵袭和免疫逃逸能力增强,表明cGAS/STING 信号通路参与BGC-823 细胞恶性生物学行为。此外,本研究还发现HA 可剂量依赖性地上调BGC-823 细胞cGAS、STING 蛋白表达,推测HA 可能通过cGAS/STING通路调节胃癌细胞增殖、迁移、侵袭和免疫逃逸。为验证该推测,本研究在高剂量HA 作用基础上增加cGAS 抑制剂RU.521 干预BGC-823 细胞或共培养细胞体系,结果显示RU.521 减弱了高剂量HA 对BGC-823 细胞增殖、迁移、侵袭和免疫逃逸的抑制作用,证实HA 可能通过激活cGAS/STING 通路抑制胃癌细胞增殖、迁移、侵袭和免疫逃逸。
综上,HA 可能通过激活cGAS/STING 通路抑制胃癌细胞增殖、迁移、侵袭和免疫逃逸。HA 对胃癌进展的抑制作用可能涉及其他通路,本研究尚未探究,将是后续研究重点。