肺泡巨噬细胞在慢性肺疾病中作用的研究进展①
2023-11-13金钰莹周佳旭延光海延边大学医学院功能学实验教学中心延吉133002
金钰莹 周佳旭 高 歌 延光海③ 崔 弘 (延边大学医学院功能学实验教学中心,延吉 133002)
近年来,慢性肺疾病被认为是严重的公共卫生问题,已成为导致患者死亡的主要原因。尽管相关治疗方法不断被研发,但患者的生活质量低,患肺癌的风险率也在世界范围内不断上升。多种因素可导致慢性肺疾病,如吸烟(直接或间接吸入),灰尘,空气污染和化学烟雾等[1]。研究人员发现肺泡巨噬细胞(alveolar macrophage,AMs)作为肺部抵御外来入侵的第一道屏障,在慢性肺病的发生和发展过程中非常重要。由于慢性肺病的异质性和有限的治疗选择,需进一步了解疾病病理生理学背后的细胞和分子机制。因此,本文简单论述了近些年AMs 在慢性肺疾病中的研究进展,以期为干预慢性肺部疾病提供指导。
1 AMs
1.1 AMs的来源 AMs起源于胚胎前体,在稳定状态下,以响应粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)传导的机制,AMs 亚群在原位增殖,通过局部自我更新维持细胞库。在炎症状态下,机体中红细胞-髓样祖细胞(erythro-myeloid progenitors,EMP)产生的前巨噬细胞在肺泡腔中迅速聚集进入炎症部位,参与炎症调节反应[2]。
1.2 AMs 的形态 AMs 是气道和肺部的常驻巨噬细胞,位于细支气管肺泡空间的肺泡上皮表面。不同时期AMs 的形态有所不同:正常AMs 的微绒毛均匀分布在细胞表面,细胞质体积较大并伴有大量溶酶体、吞噬体和酶。在急性炎症期间,AMs 直径增至约12 µm,并伴有大量过氧化物酶。在慢性进展期间,AMs 进一步增大和成熟,细胞质膜不规则,细胞核呈叶状,直径增长至14~40 µm[3]。AMs 代表了肺表面活性物质稳态、肺宿主防御和组织耐受性的重要细胞类型。
1.3 AMs 的作用 首先AMs 在肺稳定条件下具有抗炎作用,由于AMs 处于肺泡管腔中的暴露位置,并且气体交换发生在肺泡-毛细血管膜上[4]。导致AMs 产生胞吞作用:将气道中的微生物,死细胞和其他空气传播的颗粒有效清除,有利于持续维持氧气摄取。AMs 在肺泡空间内表现出抗炎活性,防止死细胞在肺泡中引发炎症或免疫反应。此外,胞吞作用促进AMs 分泌抗炎因子,如血小板活化因子(platelet activating factor,PAF)、前列腺素E2(prostaglandin E2,PGE2)、转化生长因子β(transforming growth factor-β,TGF-β),进一步抑制炎症反应。同时,AMs 在肺中具有促炎作用,其分泌IL-1β、IL-6、趋化因子18(chemokine ligand 18,CCL18)和血小板衍生生长因子(platelet derived growth factor,PDGF)和巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)等促炎症因子的过度产生会引发炎症性肺病,如急性肺损伤、哮喘和慢性阻塞性肺 疾 病(chronic obstructive pulmonary diseases,COPD)。因此,AMs 分泌的介质应进行严格调控以维持肺内稳态。此外,AMs 还部分通过内化和分解代谢肺表面活性剂来维持肺稳态,这对肺生物力学和免疫至关重要[5]。
2 AMs的极化反应
作为处于动态平衡状态的一类细胞,像其他组织驻留细胞一样,AMs 可以通过细胞极化反应改变其表型和功能对其微环境中的刺激或细胞因子信号做出反应,表达显著的可塑性、异质性。AMs 可被描述为经典活化的巨噬细胞(M1)和交替活化的巨噬细胞(M2),AMs表型根据细胞表面标志物的表达、特定因子的产生和生物活性方面的不同而存在差异性(详见图1)。
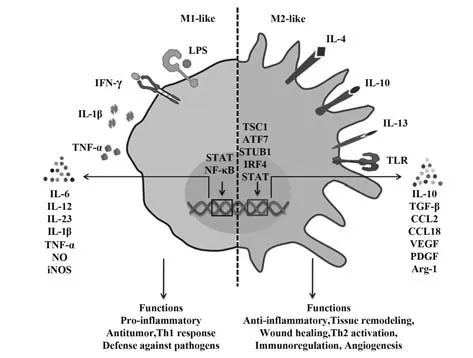
图1 AMs极化相关模式图Fig.1 Pattern diagram of polarization correlation of AMs
脂多糖(lipopoiysaccharide,LPS)、干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子(tumor necrosis gactor-α,TNF-α)、IL-1β 和IL-6 诱导巨噬细胞成为M1表型。M1 巨噬细胞主要产生细胞因子IL-12、IL-23、一氧化氮(nitric oxide,NO)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)[6]。在功能上,M1 巨噬细胞具有强大的促炎作用,常与Th1 免疫反应相关联参与促炎反应。并且M1 巨噬细胞具有强大的抗微生物和抗肿瘤活性,MATEU-JIMENEZ 等[7]发现在肺癌患者的肿瘤标本中,M1 巨噬细胞水平和M1/M2 的比例降低。M1 巨噬细胞还具有较强的吞噬病原微生物及抗原呈递能力,但其不受调控的过度产生可导致机体组织损伤并引发炎症反应[8]。
Th2 细胞因子(IL-4、IL-10、IL-13),还有糖皮质激素,免疫复合物Toll 样受体(Toll-like receptors,TLR)可诱导巨噬细胞成为M2 表型[9]。此外,转录因子和其他细胞内蛋白质,如结节性硬化复合物1(tuberous sclerosis complex 1,TSC1),转录激活因子7(activating transcription factor 7,ATF7),STIP1 同源性和包含U-Box 的蛋白质1(STIP1 homologous and U box containing protein 1,STUB1),干扰素调节因子(interferon regulatory factors,IRF)4,也都参与M2 巨噬细胞的极化[10]。M2巨噬细胞的功能包括抗炎、组织再生和修复、血管生成和免疫调节。通过分泌抗炎细胞因子IL-10、TGF-β、血管内皮生长因子(vascular endothelial growth factor,VEGF)促进炎症缓解和伤口愈合。ZHAO 等[11]发现STAT/IRF 信号通路在硅肺发病过程中参与调节巨噬细胞极化,并且IL-10 在二氧化硅暴露14 d 后表达持续增加。但是M2巨噬细胞过度产生导致促纤维化因子分泌过多。ZHU等[12]在博莱霉素诱导的小鼠肺纤维化模型中,观察到TGF-β 水平增加和TGF-β/Smad2 信号激活增强,巨噬细胞被招募到肺泡,过度激活M2 巨噬细胞。
3 AMs与慢性肺疾病
3.1 肺纤维化 肺纤维化是一种病因未知的慢性、进行性和不可逆的纤维化肺病,主要病理特点是细胞外基质的过度沉积,从而导致肺静态顺应性降低,气体交换中断,最终导致呼吸衰竭和死亡[13]。肺纤维化在诊断后3~5 年内病死率接近50%,虽然这种疾病的起源尚不清楚,但已经确定了几个影响肺纤维化的危险因素,包括吸烟、慢性病毒感染、胃食管反流和遗传易感性[14]。
AMs 在肺纤维化的发生和发展中起重要作用。M1巨噬细胞分泌细胞因子TNF-α,有利于修复肺泡上皮细胞的损伤、减缓肺纤维化。但是尽管急性肺损伤和持续性炎症涉及M1 巨噬细胞的夸大反应,慢性疾病(如纤维化和癌症)的发展主要是M2 巨噬细胞过度反应的结果。M2 巨噬细胞通过肺巨噬细胞的“吞噬-分泌-免疫作用”渐进式网络调节模式,激活M2 巨噬细胞过度产生纤维化介质如TGF-β 和PDGF,进一步激活信号转导途径,促进成纤维细胞在损伤区域的积累、增殖和活化,从而加速导致细胞外基质沉积过多,以及肺组织结构扭曲,最终导致肺纤维化和呼吸衰竭[15]。因此,调节M2 巨噬细胞和靶向TGF-β 信号被认为是针对肺纤维化的一种治疗策略,YAO等[16]研究发现,C/EBP同源蛋白可以调节M2 巨噬细胞的生成和TGF-β 信号传导参与肺纤维化的发病机制。此外,YANG 等[17]研究发现,在博莱霉素或蠕虫诱导的肺纤维化中,通过CC 趋化因子2(CC chemokine ligand 2,CCL2)/趋化因子受体2(CC chemokine receptor 2,CCR2)募集纤维细胞并活化M2 巨噬细胞,产生过多的细胞外基质,触发肺纤维化。M1和M2巨噬细胞的极化相互作用并影响疾病的持续时间和严重程度。CHANG 等[18]开发了一种新的内源性细胞靶向纳米平台,通过调节M1/M2 巨噬细胞进入平衡状态来抑制成纤维细胞过度激活,从而提高肺纤维化的治疗效果。因此,旨在调节AMs 表型的策略可能具有在临床环境中预防和治疗肺纤维化的巨大潜力。
3.2 哮喘 哮喘是一种具有复杂异质性但最常见的呼吸系统疾病之一,影响全球儿童和成人,其潜在的发病机制尚不清楚。哮喘的特征在于慢性炎症:支气管发炎和变窄,从而导致气流阻塞,哮喘发作。支气管狭窄的典型诱因不仅包括过敏原,还包括刺激性化学物质,冷空气和运动。黏液分泌增加或者气道壁增厚也会导致气管腔道变窄,进一步导致呼吸急促,喘鸣,咳嗽和胸闷[19]。各种哮喘表型在症状形成的原因和机制上各不相同,因此症状和恶化的严重程度及频率也各不相同。
由于哮喘的特点是气道高反应性和呼吸短促,因此为了解决潜在的慢性炎症,哮喘患者会接受免疫抑制性糖皮质激素治疗,例如可的松。此外,这种治疗可减少AMs 中的氧化应激并且增加M2 巨噬细胞所释放的IL-10 细胞因子,极大程度改变了哮喘的发展进程。IL-10 是一种有效的免疫抑制细胞因子,通过抑制巨噬细胞CD80、CD86还有主要组织相容性复合体Ⅱ(major histocompatibility complexⅡ,MHCⅡ)的表达,增加与其自身受体的相互作用,进一步抑制单核细胞和巨噬细胞向T 细胞呈递抗原的能力和促炎性细胞因子IL-12、IL-1β和TNF-α的分泌,最终抑制了Th1反应激活,减缓哮喘疾病的进程[20]。糖皮质激素的使用也增强了IL-4 驱动M2巨噬细胞产生CCL18。蛋白质微阵列分析显示哮喘患者痰中CCL18 水平升高,并且与哮喘患者痰中嗜酸性粒细胞的百分比相关。CCL18 也可以导致Th2细胞和嗜碱性粒细胞的募集,并诱导嗜碱性粒细胞释放组胺和细胞内钙,减缓哮喘病症加重[21]。HUOMAN 等[22]研究发现,在1 岁或8 岁哮喘儿童中CCL18 分泌水平升高。M2 巨噬细胞在哮喘中具有重要作用,针对M2 巨噬细胞的发育和功能的药物干预是哮喘治疗中一种有前景的方法,BECERRADÍAZ 等[23]研究发现,雄性激素可增加M2 巨噬细胞极化的能力,可为治疗哮喘的提供新的治疗方向。
3.3 COPD COPD 是一种涉及气道和肺实质的肺部慢性炎症疾病,并具有持续性、进行性和不可逆的气道阻塞[24]。COPD 的特征是持续的气流受限,并进一步发展为肺心病和呼吸衰竭等常见疾病。众所周知,COPD 是由吸入的有毒气体和颗粒引发的。在发达国家吸烟是引发COPD 的主要原因,在发展中国家,生物量暴露是引发COPD 的主要原因。因此,COPD 成为全世界高发病率和高病死率的主要疾病之一,给社会造成了重大的经济和社会负担[25]。
在COPD 患者中AMs处理和清除肺部颗粒方面发挥着核心作用。单核细胞在单核细胞选择性CCL2 和CXC 趋 化 因 子 配 体1(CXC chemokine ligand 1,CXCL1)的响应下募集增加,进一步导致COPD 患者的痰液和支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中 巨 噬 细 胞 的 水 平 增加[26]。极化后的M1、M2 巨噬细胞也参与了COPD的发病过程:M1 巨噬细胞的吞噬能力和Th1 的抗原呈递特性,可产生多种Th1 细胞因子,例如IL-1β、IL-6、IL-12 和TNF-α。HUANG 等[27]研究发现,香烟诱导的COPD 模型中,激活Notch 信号通路,并进一步使巨噬细胞的极性向M1 表型转移,IL-6、TNF-α和活性氧水平增加。相反,在面对外来颗粒物和微生物暴露,由Th2细胞因子诱导的M2巨噬细胞过度表达精氨酸酶-1(arginase-1,Arg-1)、IRF4 和甘露糖受体CD206并释放TGF-β,导致肌成纤维细胞活化、平滑肌增生及异常组织修复[28]。HAN 等[29]研究发现,电子香烟暴露可增强COPD 小鼠的气道扩张、黏液分泌和纤维生成,这与M2 巨噬细胞表型增加有关。并且持续接触香烟烟雾或生物质会显著消耗细胞内的抗氧化剂,如谷胱甘肽,导致过度氧化应激,从而抑制AMs 的细菌吞噬和细胞吞噬功能[30]。因此,COPD 中的AMs 会产生更多的促炎因子,导致组织损伤,以及AMs 吞噬功能的缺陷,共同影响COPD的进展。
3.4 硅肺 硅肺是一种众所周知的典型尘肺,由结晶游离性二氧化硅粉尘(直径<10 µm 的颗粒)吸入和沉积引起的硅结节和弥漫性肺纤维化疾病。决定患硅肺风险的关键因素包括终生累积暴露、吸入的二氧化硅总量和个体易感性。硅肺患者伴有不同的呼吸道症状,如咳嗽、气短、胸闷、发热和胸膜炎性疼痛等症状。目前硅肺是严重威胁工人身心健康的公共卫生问题,并且是全世界最重要的职业病之一[31]。
在临床试验中,全肺灌洗术可有效清除患者肺泡腔中的二氧化硅,清除小部分肺间质内杂质,其收集的BALF 中含有90%以上的AMs,有效改善硅肺患者的呼吸功能。AMs 的吞噬作用有效防止二氧化硅的侵袭,在AMs 的吞噬过程中酶不断地渗入细胞质,最终被其溶酶体降解。二氧化硅将被AMs吞噬,结果导致AMs 分解、坏死或凋亡。其中,AMs凋亡是二氧化硅诱发纤维化的一种重要发病机制。凋亡性AMs 分泌大量炎症因子,由于吞噬作用失败或凋亡性AMs 清除异常而导致AMs 凋亡水平逐渐升高,并进一步引起炎症联级。随后,肺成纤维细胞的增殖、活化和迁移合成并分泌胶原蛋白,最终导致硅肺纤维化[32]。ZHAO 等[33]研究发现,AMs 的凋亡水平与自噬有关,在硅肺大鼠模型的肺组织中观察到异常自噬活动。AMs 溶酶体逐渐减少,而AMs 自噬体增加。TAN 等[34]研究发现,海藻糖通过保护人硅肺AMs 自噬溶酶体系统减轻细胞凋亡。总体而言,在硅肺病进展的早期阶段发生的细胞凋亡反应具有补偿功能,可去除受损细胞并清除炎症,从而导致肺组织重塑。但是,随着AMs 细胞凋亡的持续增加,可能导致硅肺病的进一步恶化。
3.5 肺结核 结核分枝杆菌(M.tuberculosis,Mtb)引起的肺结核(tuberculosis,TB)是世界范围内致命的传染病之一。Mtb 是一种细胞内病原体,具有复杂的细胞壁,由长链脂肪酸、糖脂、肽聚糖和蛋白质组成,通过吸入含有细菌的雾化飞沫传播。Mtb 与人类共存了数万年,即使面对过多的宿主抗菌效应机制,仍旧持续存在。因此,Mtb 继续带来毁灭性的发病率和病死率,仅在2015 年就造成180 万人死亡,并潜伏感染了大约世界人口的25%[35]。
AMs 在分枝杆菌的发病机制中起着核心作用,在早期和慢性感染期间的主要细胞生态位。AMs通过多种机制消除Mtb,包括产生氧和氮成分、细胞因子、吞噬体酸化和自噬细胞内Mtb 等过程。当Mtb 生物体在肺泡空间中播种,它们将被AMs 吞噬捕获,同时维持较低的细胞活化状态和迁移潜力。AMs 的吞噬能力是通过与不同的表面受体结合,例如补体受体(complement recetor,CR)、表面活性剂分子、DC-SIGN(DC-specific ICAM-3 grabbing non-integrin,CD209)和甘露糖受体(mannose receptor,MR)等,有助于组织修复、炎症消退、免疫耐受诱导以及防止过度炎症[36]。AMs 表达多种模式识别受体,包括TLR、C 型凝集素受体(C-type lectin-like receptor,CLEC)和Nod 样受体(NOD-like receptors,NLR)。GUPTA 等[37]研究证明,生物脂蛋白激活人和小鼠AMs 上的TLR2 可以杀死细胞内Mtb。WAGGENER等[38]研究证明,脾酪氨酸激酶(spleen tyrosine kinase,SYK)/胱天蛋白酶募集域蛋白9(caspase recruitment domain protein 9,CARD9)信号通路的受体有助于抗分枝杆菌防御。树突状细胞相关性C型植物血凝素1(dendritic cell-associated C-type lectin-1,Dectin-1)通过衔接子CARD9分子发出信号,一旦充分激活,鼠类实验系统以及结核病患者中的AMs 产生NO,有效杀死Mtb。
3.6 肺癌 在全球范围内,肺癌是广泛的具有临床病理特征的异质性疾病。肺癌的生长、侵袭和转移是一个复杂的动态过程,涉及肿瘤组织的内在遗传异常及其与免疫系统的相互作用。肺肿瘤浸润性免疫细胞中约66.7%由T 细胞和B 细胞组成,其余细胞由肿瘤相关巨噬细胞(tumour-associated macrophages,TAMs)以及少量浸润性树突状细胞和天然细胞组成。
在肺癌中,TAMs 作为关键先天免疫细胞发挥着双重作用。一方面,TAMs 可调节原发性肿瘤的生长、抗肿瘤适应性免疫反应、肿瘤血管生成、细胞外基质重塑、脉管系统内血管浸润、转移部位外渗,抑制肿瘤的生长。TAMs 代表了大部分肿瘤基质,并与微环境中的恶性细胞(成纤维细胞和血管内皮细胞)保持复杂的相互作用,从而肿瘤细胞和TAMs之间形成正反馈,影响癌症的生长和转移[39]。另一方面,小鼠肺组织内的间质巨噬细胞有助于TAMs的集合并支持体内肿瘤的生长,而单核细胞衍生的TAMs 则以转移的形式促进肿瘤的发展[40]。TAMs以M2 表型巨噬细胞为主,表现出明显的免疫抑制性IL-10和TGF-β细胞因子表达谱,以及较弱的抗原呈递能力抑制Th1 免疫适应性。GUNASSEKARAN等[41]研究发现,在肿瘤微环境中将M2 型TAMs 重新编程为M1 巨噬细胞是癌症治疗的关键策略。利用M1 外显体工程携带NF-κB p50 siRNA 和miR-511-3p,培养M1 细胞极化,将TAMs 重新编程为M1 巨噬细胞。M2 巨噬细胞进一步产生血管内皮生长因子(vascular endothelial growth factor,VEGF)和环氧合酶2(cyclooxygenase-2,COX-2)衍生的PGE2,表明M2巨噬细胞为促肿瘤细胞[42]。
不同AMs 表型在慢性肺疾病中发挥的作用不同,M1 巨噬细胞主要分布于肺组织炎症浸润部位,促进炎症反应。M2 型巨噬细胞在结节与纤维化部位大量存在,抵抗炎症反应、促进组织修复和伤口愈合。但是M1/M2 巨噬细胞极化的不平衡会对各种疾病的发展产生不利影响。在早期炎症发生时,M1 巨噬细胞分泌大量促炎因子,M1 巨噬细胞的过度增殖导致炎症细胞浸润、炎症反应加重,引发哮喘。随后,M1 巨噬细胞发生凋亡,吞噬病原微生物能力减弱,引发硅肺。在炎症后期,巨噬细胞表型由M1转变为M2,分泌大量抗炎因子,促进组织再生和修复、血管生成,M2 巨噬细胞过度产生纤维化介质,引发肺纤维化、COPD、肺癌。
4 展望
综上所述,AMs 在肺部疾病中充当气道炎症的协调者,并积极参与每种慢性肺疾病的组织学特征的发展。更好地理解AMs 在慢性肺病中的机制,调节AMs 的极化反应和功能,并抑制炎症性疾病的潜在进展,可能会指导开发出治疗慢性肺疾病的新疗法。