白芍总苷调控Nrf-2/HO-1信号通路对支气管哮喘小鼠气道重塑的影响
2023-11-13尹珊珊青海红十字医院小儿内科西宁810000
尹珊珊 马 红 姜 琦 (青海红十字医院小儿内科,西宁 810000)
支气管哮喘(简称哮喘)是一种复杂的气道疾病,临床较为常见,其特征为慢性炎症、气道高反应性和气道重塑,具有较高的发病率及病死率,已严重威胁全球人民的健康和生活[1]。气道重塑是哮喘气道高反应性和肺功能障碍的主要原因,TGF-β1是一种在哮喘患者气道中增多的生长因子,其失调对于气道重塑至关重要[2-3]。据报道,TGF-β1 水平升高可促进哮喘中支气管上皮细胞和气道平滑肌细胞(airway smooth muscle cells,ASMCs)增殖,参与哮喘患者气道重塑[4-5],故TGF-β1 为降低哮喘发病率和病死率的潜在治疗靶点。此外,氧化应激功能障碍是气道重塑的另一个关键触发因素。已有研究证实氧化应激会增强TGF-β1 诱导的ASMCs 细胞活力,抗氧化调节已成为近年来哮喘研究的热点[6]。作为一种有效的抗氧化因子,核因子E2 相关因子2(nuclear factor erythroid 2 related factor 2,Nrf-2)水平与哮喘进展密切相关[7];血红素加氧酶-1(heme oxygenase 1,HO-1)是Nrf-2 的重要靶基因,具有抗炎和抗氧化特性,Nrf-2/HO-1 通路的激活可减弱气道重塑[8]。因此,靶向氧化应激也是气道重塑介导的哮喘的潜在治疗策略。
白芍总苷(total glucosides of paeony,TGP)为白芍的有效部位,具有广泛的药理作用,包括抗炎、抗氧化和免疫调节[9-10]。TGP 在中国已被广泛应用于治疗自身免疫性疾病,包括类风湿关节炎、系统性红斑狼疮、过敏性接触性皮炎等,是一种有前景的抗炎和免疫药物[9,11-12]。研究显示,TGP可下调TGF-β1表达,抑制心肌重构[13];还可显著提高抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性,对抗氧化应激,防止糖尿病相关的肾损伤[14]。然而TGP 是否能抑制哮喘小鼠的气道重塑还未可知。因此,本研究采用卵清白蛋白(ovalbumin,OVA)诱导建立小鼠支气管哮喘模型,探究TGP 对模型小鼠气道重塑的影响及潜在机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 从北京维通利华实验动物技术有限公司购入SPF 级雄性BALB/c 小鼠50 只,6~7 周龄,体质量18~22 g,饲养于恒温室,动物房温度保持在(24±3) ℃,相对湿度40%~60%,并在可控制的光照下保持12 h/12 h 明暗交替。该研究得到青海红十字医院动物护理和使用委员会的批准(202109001),并按照实验动物使用的3R 原则给予人道关怀。适应性饲养7 d后开始实验。
1.1.2 主要试剂与仪器 白芍总苷胶囊(帕夫林,宁波立华制药有限公司,国药准字:H20055058,规格0.3 g);OVA(Sigma-Aldrich,A21772);Nrf-2 抑制剂ML385(北京百奥莱博科技有限公司,M00240);HE 染色试剂(C0105)、RIPA 裂解液(P0013B)、BCA试剂盒(P0010)均购自碧云天生物科技公司;AB-PAS染色试剂盒(G1285)购自北京Solarbio 公司;小鼠半胱 氨 酰 白 三 烯1(cysteinyl leukotriene 1,CysLT1)(ml058762)、TGF-β1(ml002115)ELISA 试剂盒购自上海酶联生物科技有限公司;小鼠半胱氨酰白三烯受 体1(cysteinyl leukotriene receptor 1,CysLTR1)ELISA 试剂盒(KT-34072)购自美国Kamiya Biomedical 公司;总抗氧化能力(total antioxidant capacity,TAOC)检测试剂盒(比色法,A015-1-2)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(比色法,A005-1-2)、SOD(WST-1 法,A001-3-2)、CAT(A007-2-1)测定试剂盒购自南京建成生物工程研究所;TRIzol(9108-1)、PrimeScriptTMRT 试剂盒(RR037A)、SYBR®Premix Ex TaqTMⅡ试剂盒(RR820A)购自日本TaKaRa;TGF-β1、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)和金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinase 1,TIMP-1)的引物购自上海GenePharma 公司;兔源一抗TGF-β1(ab215715)、Nrf-2(ab137550)、HO-1(ab189491)、Lamin B1(ab16048)、GAPDH(ab181602)和二抗羊抗兔IgG H&L(HRP)(ab205718)购自英国Abcam公司。
iMark680 多功能酶标仪、蛋白转膜装置(美国Bio-Rad 公司);NanoDrop 2000 分光光度计(美国Thermo Scientific 公 司);ABI 7500 实 时 荧 光 定 量PCR 仪(美国应用生物系统公司);IX71 荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 分组及模型制备 将50 只BALB/c 小鼠随机分为对照组(Control 组)、模型组(OVA 组)、TGP低剂量组(TGP-L,460 mg/kg)、TGP高剂量组(TGP-H,920 mg/kg)、TGP+ML385 组(TGP 920 mg/kg+ML385 30 mg/kg)[15],每组10 只。除Control 组外,其余各组小鼠参考文献[16]方法采用OVA 致敏建立哮喘模型:分别在实验第1 天、第7 天腹腔注射0.2 ml OVA致敏液(4 mg OVA+150 µl 氢氧化铝),从第21 天开始将小鼠置于雾化箱内使用10%OVA 激发液(20 g OVA+200 ml 生理盐水)进行雾化,每周3 次,每次30 min,连续8 周;Control 组给予等量生理盐水雾化。TGP 各剂量组在每次雾化前1 h 给予相应剂量的TGP 混悬液灌胃,TGP+ML385 组在每次雾化前1 h 给予30 mg/kg 的ML385 和920 mg/kg 的TGP 灌胃,Control 组和OVA 组给予等量生理盐水;各组均连续给药8 周,最后一次激发24 h 后进行取材和指标检测。
药物剂量的换算:给药剂量按成人平均体质量70 kg 体表面积换算,小鼠体质量按20 g 计,对应给药剂量为成人的9.1 倍;TGP 成人每日给药剂量为3.6 g,则小鼠每日给药剂量为460 mg/kg,因此设置低、高剂量药物剂量为460、920 mg/kg。
1.2.2 小鼠一般状态观察 观察致敏和激发前后各组小鼠的行为学变化,是否有气促、呼吸困难、打喷嚏、烦躁不安、喘息等典型的哮喘症状。
1.2.3 小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎症相关因子的测定 处死小鼠,75%乙醇浸泡2 min 后,行气管插管,结扎右肺,用1 ml预冷的PBS缓慢冲洗小鼠左肺3次,合并3次灌洗液,纱布过滤去除黏液后离心(4 ℃、2 000 r/min离心10 min),取上清。按照ELISA 试剂盒说明书检测各组小鼠BALF中TGF-β1、CysLT1、CysLTR1水平。
1.2.4 小鼠肺组织氧化应激指标的测定 将小鼠左侧肺组织按照1∶9 的比例加入生理盐水研磨,2 500 r/min 离心10 min 后,取匀浆上清液,按照试剂盒说明书检测肺匀浆中T-AOC、SOD、GSH-Px、CAT活性。
1.2.5 小鼠肺组织病理学变化 取小鼠右肺上叶组织,用4%多聚甲醛固定,石蜡包埋,切片,进行HE 和AB-PAS 染色,观察气道周围炎症细胞的浸润情况及杯状细胞分泌黏液情况;并对各组肺组织进行病理学分级评分;每只小鼠肺切片任取5 个独立区域进行评分,取平均值。评分标准如表1。

表1 肺组织HE和AB-PAS染色评分标准Tab.1 Lung tissue HE and AB-PAS staining scoring standards
1.2.6 RT-qPCR 检 测 肺 组 织TGF-β1、MMP-9 和TIMP-1 的mRNA 表达 取小鼠右肺中叶组织,使用TRIzol 从各组织中提取总RNA,NanaDrop 分光光度计检测总RNA 的浓度和纯度;然后按照试剂盒说明书将RNA 反转录为cDNA,进行PCR 扩增。反应体系(25 µl):SYBR®Premix Ex TaqTMⅡ(2×)12 µl,正反向 引 物 各0.5 µl,cDNA(200 ng/µl) 1 µl,ddH2O 11 µl。反应条件:94 ℃预变性10 min;95 ℃变性15 s,60 ℃退火20 s,75 ℃延伸20 s,进行40 个循环。以GAPDH 作为对照,采用2-ΔΔCt方法计算目的基因的相对表达量。引物序列见表2。

表2 RT-qPCR引物序列Tab.2 RT-qPCR primer sequences
1.2.7 Western blot检测肺组织TGF-β1/Nrf-2/HO-1通路相关蛋白表达 取小鼠右肺下叶组织,使用含有1%蛋白酶抑制剂的RIPA 裂解缓冲液提取细胞总蛋白(用于TGF-β1、HO-1 检测),并采用细胞核蛋白提取试剂盒提取细胞核中的蛋白质(用于Nrf-2检测),然后使用BCA 检测试剂盒进行定量。将样品在98 ℃下加热5 min 变性,取等量蛋白质样品(30 µg/孔)加至10%SDS-PAGE 凝胶上行电泳分离,然后转移至PVDF 膜,5%脱脂奶粉室温封闭2 h,加入相应一抗(TGF-β1、Nrf-2、HO-1,1∶1 000;GAPDH、Lamin B1,1∶2 000)于4 ℃下孵育过夜,次日,将膜与HRP标记的羊抗兔IgG二抗(1∶5 000)室温孵育1 h,ECL 显色。以GAPDH、Lamin B1 为内参,通过与内参的灰度比,得出各目的蛋白的相对表达量。
1.3 统计学分析 数据采用SPSS22.0、GraphPad Prism 8.0 和Image-Pro Plus 6.0 软件进行分析,结果以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA),组间有差异进一步采用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠的一般状态 致敏阶段:各组小鼠表现均正常,各组间无差异。激发阶段:OVA 组小鼠出现典型的哮喘症状,如打喷嚏、烦躁不安、喘息等,而TGP-L 组和TGP-H 组小鼠的哮喘症状较OVA组明显减轻,且TGP-H 组小鼠哮喘症状的改善程度优于TGP-L 组;TGP+ML385 组小鼠的哮喘症状较TGP-H组加重,Control组小鼠表现正常。
2.2 各组小鼠BALF 中TGF-β1、CysLT1、CysLTR1水平 与Control 组相比,OVA 组小鼠BALF 中TGFβ1、CysLT1、CysLTR1 水平显著升高(P<0.05);与OVA 组相比,TGP-L 组和TGP-H 组小鼠BALF 中上述指标水平显著降低(P<0.05),与TGP-H 组相比,TGP-L 组和TGP+ML385 组上述指标水平显著升高(P<0.05)。见表3。
表3 各组小鼠BALF中炎症相关因子水平(±s,n=10)Tab.3 Levels of inflammatory-related factors in BALF of mice in each group (±s,n=10)
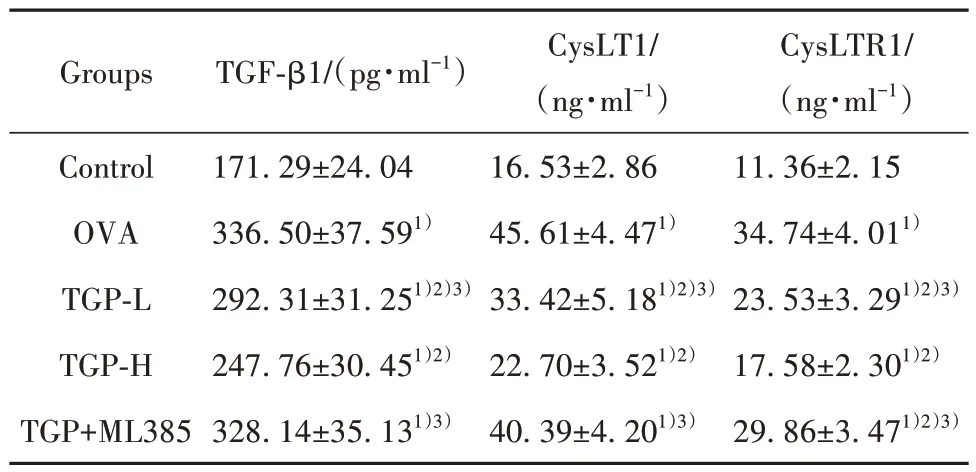
表3 各组小鼠BALF中炎症相关因子水平(±s,n=10)Tab.3 Levels of inflammatory-related factors in BALF of mice in each group (±s,n=10)
Note:Compared with Control group, 1)P<0.05; compared with OVA group, 2)P<0.05; compared with TGP-H group, 3)P<0.05.
CysLTR1/(ng·ml-1)11.36±2.15 34.74±4.011)23.53±3.291)2)3)17.58±2.301)2)29.86±3.471)2)3)Groups TGF-β1/(pg·ml-1)Control OVA TGP-L TGP-H TGP+ML385 171.29±24.04 336.50±37.591)292.31±31.251)2)3)247.76±30.451)2)328.14±35.131)3)CysLT1/(ng·ml-1)16.53±2.86 45.61±4.471)33.42±5.181)2)3)22.70±3.521)2)40.39±4.201)3)
2.3 各组小鼠肺匀浆中T-AOC、SOD、GSH-Px、CAT活性 与Control 组相比,OVA 组小鼠肺匀浆中TAOC、SOD、GSH-Px、CAT 活性显著降低(P<0.05);与OVA 组相比,TGP-L 组和TGP-H 组小鼠肺匀浆中上述指标的活性均显著升高(P<0.05);与TGP-H 组相比,TGP-L 组和TGP+ML385 组小鼠肺匀浆中上述指标的活性显著降低(P<0.05)。见表4。
表4 各组小鼠肺匀浆中T-AOC、SOD、GSH-Px、CAT活性(±s,n=10,U/mg prot)Tab.4 Activities of T-AOC, SOD, GSH-Px and CAT in lung homogenate of mice in each group (±s,n=10,U/mg prot)
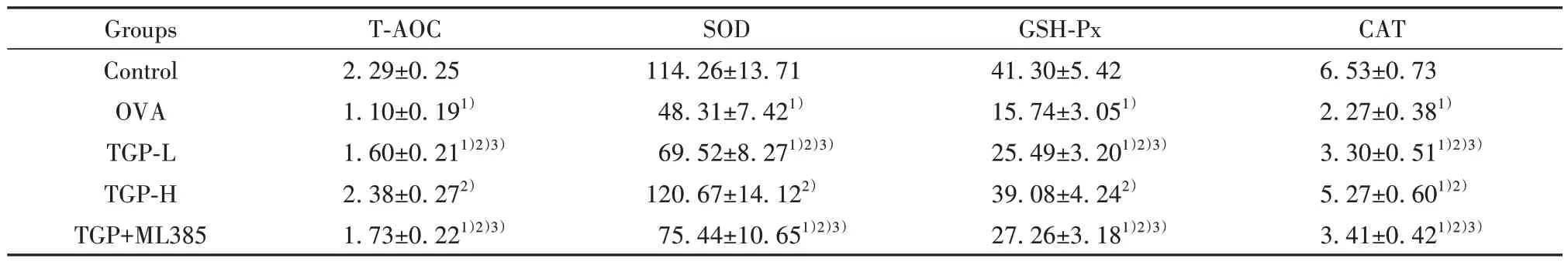
表4 各组小鼠肺匀浆中T-AOC、SOD、GSH-Px、CAT活性(±s,n=10,U/mg prot)Tab.4 Activities of T-AOC, SOD, GSH-Px and CAT in lung homogenate of mice in each group (±s,n=10,U/mg prot)
Note:Compared with Control group, 1)P<0.05; compared with OVA group, 2)P<0.05; compared with TGP-H group, 3)P<0.05.
CAT 6.53±0.73 2.27±0.381)3.30±0.511)2)3)5.27±0.601)2)3.41±0.421)2)3)Groups Control OVA TGP-L TGP-H TGP+ML385 T-AOC 2.29±0.25 1.10±0.191)1.60±0.211)2)3)2.38±0.272)1.73±0.221)2)3)SOD 114.26±13.71 48.31±7.421)69.52±8.271)2)3)120.67±14.122)75.44±10.651)2)3)GSH-Px 41.30±5.42 15.74±3.051)25.49±3.201)2)3)39.08±4.242)27.26±3.181)2)3)
2.4 各组小鼠肺组织病理学变化 HE 和AB-PAS染色结果显示,Control 组支气管和肺泡结构清晰,肺泡壁无增厚,支气管周围无明显炎症细胞浸润,未见杯状细胞增生;与Control 组相比,OVA 组小鼠肺组织支气管周围可见大量炎症细胞浸润,杯状细胞增生明显,黏液分泌增加,肺组织炎症和黏液分泌评分显著升高(P<0.05);与OVA 组相比,TGP-L组和TGP-H 组小鼠肺组织气道炎症明显减轻,黏液分泌减少,炎症和黏液分泌评分显著降低(P<0.05);与TGP-H 组相比,TGP-L 组和TGP+ML385 组小鼠肺组织气道炎症和黏液分泌评分均显著升高(P<0.05)。见图1、表5。
表5 各组小鼠肺组织病理评分(±s,n=10)Tab.5 Histopathological scores of lung tissues of mice in each group (±s,n=10)
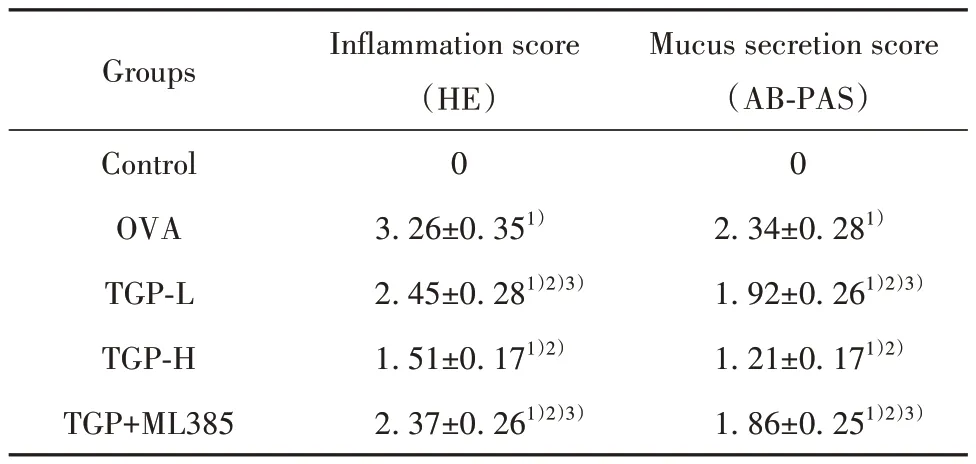
表5 各组小鼠肺组织病理评分(±s,n=10)Tab.5 Histopathological scores of lung tissues of mice in each group (±s,n=10)
Note:Compared with Control group, 1)P<0.05; compared with OVA group, 2)P<0.05; compared with TGP-H group, 3)P<0.05.
Groups Control OVA TGP-L TGP-H TGP+ML385 Inflammation score(HE)0 Mucus secretion score(AB-PAS)0 2.34±0.281)1.92±0.261)2)3)1.21±0.171)2)1.86±0.251)2)3)3.26±0.351)2.45±0.281)2)3)1.51±0.171)2)2.37±0.261)2)3)
2.5 各组小鼠肺组织TGF-β1、MMP-9 和TIMP-1 的mRNA 表达 与Control 组相比,OVA 组小鼠肺组织TGF-β1、MMP-9 mRNA 表 达 显 著 升 高,TIMP-1 mRNA 表达显著降低(P<0.05);与OVA 组相比,TGP-L 组和TGP-H 组小鼠肺组织TGF-β1、MMP-9 mRNA 表达显著降低,TIMP-1 mRNA 表达显著升高(P<0.05);与TGP-H 组 相 比,TGP-L 组 和TGP+ML385组小鼠肺组织TGF-β1、MMP-9 mRNA 表达显著升高,TIMP-1 mRNA 表达显著降低(P<0.05)。见表6。
表6 各 组 小 鼠 肺 组 织TGF-β1、MMP-9 和TIMP-1 的mRNA表达(±s,n=10)Tab.6 mRNA expressions of TGF-β1, MMP-9 and TIMP-1 in lung tissues of mice in each group (±s,n=10)
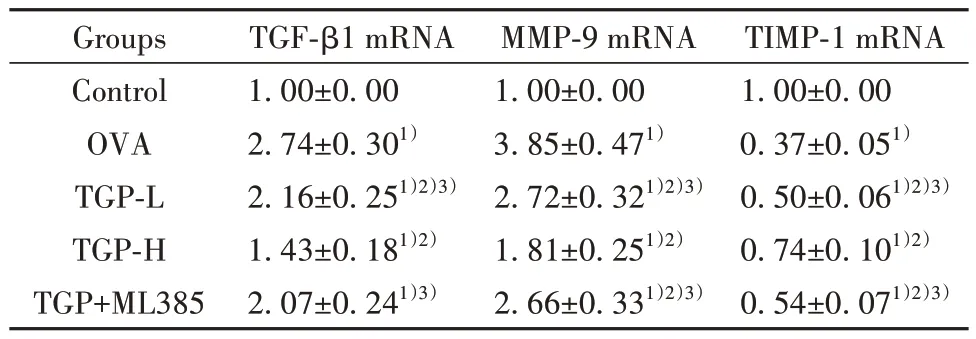
表6 各 组 小 鼠 肺 组 织TGF-β1、MMP-9 和TIMP-1 的mRNA表达(±s,n=10)Tab.6 mRNA expressions of TGF-β1, MMP-9 and TIMP-1 in lung tissues of mice in each group (±s,n=10)
Note:Compared with Control group, 1)P<0.05; compared with OVA group, 2)P<0.05; compared with TGP-H group, 3)P<0.05.
TIMP-1 mRNA 1.00±0.00 0.37±0.051)0.50±0.061)2)3)0.74±0.101)2)0.54±0.071)2)3)Groups Control OVA TGP-L TGP-H TGP+ML385 TGF-β1 mRNA 1.00±0.00 2.74±0.301)2.16±0.251)2)3)1.43±0.181)2)2.07±0.241)3)MMP-9 mRNA 1.00±0.00 3.85±0.471)2.72±0.321)2)3)1.81±0.251)2)2.66±0.331)2)3)
2.6 各组小鼠肺组织TGF-β1/Nrf-2/HO-1通路相关蛋白表达 与Control 组相比,OVA 组小鼠肺组织TGF-β1 蛋白表达显著升高(P<0.05),Nrf-2 和HO-1蛋白表达有所增加,但差异无统计学意义(P>0.05);与OVA 组相比,TGP-L 组和TGP-H 组小鼠肺组织TGF-β1蛋白表达显著降低,Nrf-2、HO-1蛋白表达显著升高(P<0.05);与TGP-H 组相比,TGP-L 组和TGP+ML385 组小鼠肺组织Nrf-2、HO-1 蛋白表达显著降低(P<0.05),TGF-β1 蛋白表达显著升高(P<0.05)。见图2、表7。

图2 各组小鼠肺组织TGF-β1/Nrf-2/HO-1 通路相关蛋白表达Fig.2 Expressions of TGF-β1/Nrf-2/HO-1 pathway-related proteins in lung tissues of mice in each group
表7 各组小鼠肺组织TGF-β1、Nrf-2、HO-1 蛋白的表达(±s,n=10)Tab.7 Expressions of TGF-β1, Nrf-2 and HO-1 proteins in lung tissues of mice in each group (±s,n=10)

表7 各组小鼠肺组织TGF-β1、Nrf-2、HO-1 蛋白的表达(±s,n=10)Tab.7 Expressions of TGF-β1, Nrf-2 and HO-1 proteins in lung tissues of mice in each group (±s,n=10)
Note:Compared with Control group, 1)P<0.05; compared with OVA group, 2)P<0.05; compared with TGP-H group, 3)P<0.05.
HO-1/GAPDH 0.21±0.04 0.23±0.04 0.55±0.071)2)3)0.80±0.091)2)0.53±0.061)2)3)Groups Control OVA TGP-L TGP-H TGP+ML385 TGF-β1/GAPDH 0.13±0.02 0.64±0.071)0.41±0.051)2)3)0.29±0.041)2)0.43±0.061)2)3)Nrf-2/Lamin B1 0.15±0.03 0.20±0.04 0.37±0.051)2)3)0.48±0.071)2)0.34±0.051)2)3)
3 讨论
气道重塑是哮喘的主要病理特征之一,目前的临床药物(包括长效β2-激动剂、支气管扩张剂和吸入性皮质类固醇)对气道重塑影响不大[17]。因此,探索对气道重塑有效的药物对哮喘的临床治疗具有重要意义。本研究表明,TGP 通过影响氧化应激减弱OVA 致敏小鼠的气道重塑,这可能为治疗哮喘提供了有力证据。
气道重塑是指气道结构改变,包括上皮下纤维化、ASMCs 和杯状细胞增生及细胞外基质(extracellular matrix,ECM)过多,这些是肺功能下降的主要原因[18]。气道重塑包含多种病理因素,包括过敏原、生长因子、ROS 和促炎因子[19]。如CysLT1 通过与其受体CysLTR1 结合在哮喘中发挥促炎作用[20];且CysLT1 和TGF-β1 可通过促进ASMCs 的增殖和迁移促进气道重塑,加速气道壁增厚[21-22]。有研究表明,ASMCs 增生或TGF-β1 的调节是消除气道重塑的潜在治疗靶点[2-3]。本研究发现TGP 减少了OVA 小鼠的肺泡炎症浸润和气道重塑,同时抑制了TGF-β1、CysLT1 和CysLTR1。然而,其他CysLTs 也在哮喘的炎症反应和气道重塑中发挥关键作用,TGP 介导气道重塑和炎症反应的改善是否与其他CysLTs 有关仍需进一步研究[23]。此外,氧化应激引起的气道重塑也引起了研究人员的广泛关注。氧化应激可通过激活NF-κB 的免疫反应性促进肺炎症因子表达[24];且氧化应激介导TGF-β1 的激活导致AMSCs 的高反应性和上皮损伤[25-26]。ECM 也是氧化应激诱发的气道重塑过程中的标志之一,氧化应激激活介导了基质金属蛋白酶的产生,也促进了肺纤维化、ECM 和组织结构改变,导致气道重塑[27]。本研究结果显示,TGP 降低了哮喘小鼠肺中TGF-β1和MMP-9 表达,并提高了TIMP-1 及抗氧化应激相关因子表达。表明TGP 提高了抗氧化防御,并降低了下游MMP-9表达,进一步证实TGP 介导了哮喘中氧化应激过程的抑制。
Nrf-2 参与氧化应激诱导的肺损伤过程,一旦受到氧化应激的刺激,Nrf-2 就会进入细胞核并激活HO-1 表达,从而缓解氧化应激[28]。Nrf-2/HO-1 通路是对抗氧化损伤的主要防御机制,激活的Nrf-2位于细胞核中,可使HO-1、SOD、CAT 和GSH-Px 激活[29]。在哮喘中,Nrf-2/HO-1 通路激活可降低MMP-9 表达[30]。基于Nrf-2激活对氧化应激的抑制作用,课题组假设Nrf-2 和HO-1 的表达水平可能会因OVA 的反应而降低,但结果表明二者并未发生显著变化,相反,在OVA 的刺激下,Nrf-2、HO-1 表达有所增加。课题组认为模型小鼠核Nrf-2和HO-1的增加可能是肺在巨大氧化压力和炎症条件下的代偿作用,是小鼠的适应性保护机制,与PAN 等[31]的研究结果一致,即在OVA 的刺激下,Nrf-2 被释放并在肺组织的细胞核中适度积累。通过给予TGP 干预后,Nrf-2的核表达和随后HO-1 的表达显著增加;说明TGP 可扩大Nrf-2的核表达。而在哮喘小鼠中,当使用Nrf2抑制剂ML385 阻断Nrf-2/HO-1 通路的激活后,TGP对哮喘小鼠肺组织氧化应激和气道重塑的抑制被明显减弱,这些数据表明TGP 可降低TGF-β1 表达,并可通过激活Nrf-2/HO-1信号转导进一步激活抗氧化防御机制。
综上所述,TGP 可调节氧化应激和炎症诱发的支气管哮喘小鼠的气道重塑,其作用机制可能与降低TGF-β1表达,激活Nrf-2/HO-1通路有关。本研究仅从氧化应激和炎症反应的角度初步探讨了TGP对支气管哮喘小鼠气道重塑的保护机制,在未来的研究中,课题组将采用体外细胞实验深入分析其作用机制;此外,由于气道重塑与免疫细胞释放的促炎细胞因子有关,以及TGP 具有强大的免疫调节作用,其发挥作用的具体机制是否与机体免疫有关仍需进一步研究。