蒲公英甾醇对2,4-二硝基氯苯诱导的特应性皮炎小鼠模型的改善作用①
2023-11-13马天怡吴秋月朴英实金桂花任香善
马天怡 毛 敏 吴秋月 赵 益 朴英实 金桂花 任香善
(延边大学医学院病理学教研室肿瘤研究中心,延吉 133002)
特应性皮炎(atopic dermatitis,AD)是一种常见的慢性复发性炎症性皮肤病,通常发生在儿童时期,临床表现包括皮肤干燥、发作性急性湿疹、渗出性瘙痒性皮损[1]。AD 具有广泛的症状和体征,会限制日常活动能力,造成较重的心理负担[2]。AD 的发病机制较为复杂,且尚未明确,不少学者认为AD 的发病受遗传和环境因素的双重影响,与遗传疾病、表皮屏障缺陷、免疫反应改变以及皮肤微生物平衡破坏关系密切,其中以Th1/Th2 失衡最为关键[3-5]。AD 尚无有效的治愈方式,相关症状只能被缓解,避免疾病反复发作,其主要治疗药物为糖皮质激素、抗组胺药物、抗生素、免疫抑制剂等,但这些药物均伴随一些不良反应,如肝功能损伤、胃肠道不适、白细胞和血小板减少等[6-7]。为了更好地改善AD 患者的疾病状况,越来越多的学者开始研究中草药有效成分对AD 的治疗效果,以期找到治疗效果好、副作用小、经济实惠的AD治疗药物[8-11]。
蒲公英(taraxasterol,Tar)作为一种传统中草药,有清热解毒、利尿通淋、清肝明目的作用,临床上常用于痈、肿等的治疗。蒲公英甾醇是蒲公英中具有抗炎作用的重要活性成分之一[12-14]。目前,国内外学者均有证实蒲公英甾醇通过降低炎症因子TNF-α、IL-4、IL-6 等的水平治疗结肠炎、肝损伤、类风湿关节炎、肾损伤等相关疾病[15-20],但尚未见蒲公英甾醇治疗AD 的相关报道。本实验拟初步探讨蒲公英有效成分蒲公英甾醇对2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)诱导的AD 小鼠模型的治疗作用及可能的分子机制,为蒲公英甾醇的应用和开发提供实验数据,以期拓宽AD 的治疗途径,寻求治疗效果更好、副作用更少、更经济便利的治疗方案。
1 材料与方法
1.1 材料
1.1.1 实 验 动 物 46 只6~8 周 龄SPF 级 雄 性BALB/c 小鼠,体质量(20±2) g,购自延边大学实验动物中心,饲养于延边大学医学院动物房。动物房温度为(24±1) ℃,湿度为(45±10)%,由国家标准固体混合饲料喂养,自由摄食和饮水。
1.1.2 药物与试剂 DNCB(Sigma 公司,D1529)与基质(丙酮∶橄榄油=1∶3)配成的0.5%、0.25%的DNCB 溶液常温避光保存;泼尼松龙(SP8730)、羧甲基纤维素钠(Carboxymethyl,CMC,C8621)(索莱宝生物科技有限公司);蒲公英甾醇(纯度99.9%,成都瑞芬思生物科技有限公司,P-002);氯化钠注射液(南华干牧,兽药字270071460);小鼠TNF-α、IL-4、IL-6 ELISA 试剂盒(上海酶联生物科技有限公司,ml002095、ml1002049、ml1002093);HE 染色剂(北京中杉金桥公司,ZLI-9610);重组Anti-CD4 抗体(Abcam,ab183685);兔二步法试剂盒(PV-9000)、PBS 缓冲液(ZLI-9063)、免疫组化抗原修复缓冲液(ZLI-9067)、DAB 显色试剂盒(ZLI-9018)均为北京中杉金桥公司产品。
1.2 方法
1.2.1 分组与模型制备 适应性喂养7 d 后,将46 只小鼠随机分为空白对照组、药物毒性组(该组不做AD 建模,只给予蒲公英甾醇检验药物毒性)、模型对照组、阳性对照组、低浓度蒲公英甾醇组、高浓度蒲公英甾醇组。前两组每组3 只,后四组每组10只。
采用JIN 等[21]和张茜等[22]DNCB 半抗原反复刺激的方法建立小鼠AD 模型。具体建模方法如下:于实验前1 d(Day 0)用电推剪进行小鼠腹部剃毛,露 出 约2 cm×2 cm 大 小 的 皮 肤。实 验 第1 天 将0.5%DNCB涂于小鼠左耳(20 µl)及腹部(100 µl)剃毛处皮肤进行初次致敏,第5、7、9、11、13 天改用0.25%DNCB 涂于小鼠左耳(20 µl)及背部(100 µl)剃毛处皮肤进行激发,即隔日刺激1 次,持续10 d(图1)。空白对照组和药物毒性组仅涂DNCB 的溶剂,涂抹时间及涂抹剂量与模型组相同。实验期间小鼠自由进食、饮水,并按照实验动物3R 原则给予人道主义关怀。

图1 小鼠AD建模及各组处理方法Fig.1 Mice AD modeling and treatments in each group
1.2.2 给药方法 小鼠分为药物毒性组、空白对照组、模型组、阳性对照组、蒲公英甾醇组。DNCB涂抹建模后Day15开始以口服灌胃方式进行14 d的治疗。阳性对照组每天给予泼尼松龙10 mg/kg[23];蒲公英甾醇浓度参考文献[24-26],分别采用5 mg/kg、10 mg/kg 两个浓度,药物毒性组、空白对照组、模型组每天给予等体积CMC(图1)。
1.2.3 检测指标与方法
1.2.3.1 建模指标 AD 小鼠模型造模成功后皮肤开始出现明显的红斑、水肿和结痂等表现,左耳厚度明显增厚,搔抓次数明显增加,分值越高表明模型建立越成功。
1.2.3.2 小鼠皮损程度评分 Day 14 肉眼观察激发部位皮肤,参考临床特应性皮炎积分(SCORAD)指数评价标准对小鼠皮损程度进行评价[27]。评价标准为:重度红斑、水肿、鳞屑、表皮脱落计3 分;中度红斑、水肿、鳞屑、表皮脱落计2 分;轻度红斑、水肿、鳞屑、表皮脱落计1分;正常皮肤计0分。
1.2.3.3 小鼠左耳厚度的记录及变化程度评分Day 0 开始用游标卡尺测量小鼠左耳中部厚度并进行记录,DNCB 激发后于Day 7、Day 14 再次测量、记录,计算小鼠左耳中部厚度差距。根据厚度分级:刺激前后耳朵厚度明显增加计1 分;刺激前后耳朵厚度无明显变化计0分。
1.2.3.4 小鼠搔抓次数的记录及评分 记录Day 0、Day 7、Day 14小鼠的搔抓次数。测定方式为将小鼠单独置于安静环境中,拍摄并统计10 min 内小鼠搔抓耳部及腹部的次数,后肢连续搔抓耳部及腹部视为1次搔抓活动,当后爪落地或被舔舐时代表本次搔抓结束,连续长时间搔抓记为1 次。根据小鼠搔抓次数评分:刺激前后搔抓次数明显增加计1分;刺激前后搔抓次数无明显变化计0分。
1.2.4 治疗指标
1.2.4.1 小鼠皮损程度评分 Day 28 观察表皮剥脱、出血、渗出、红斑、结痂的变化。评分标准同
1.2.3.2。
1.2.4.2 小鼠左耳厚度记录 Day 15 开始给予处理措施后,于Day 21、Day 28再次用游标卡尺测量小鼠左耳中部厚度并进行记录,计算小鼠左耳中部厚度差距,根据厚度分级:小鼠耳朵厚度无明显改变计1分;小鼠耳朵厚度明显降低计0分。
1.2.4.3 小鼠搔抓次数记录 记录Day 21、Day 28的小鼠搔抓次数。根据小鼠搔抓次数评分:小鼠搔抓次数无明显减少计1 分;小鼠搔抓次数明显减少计0分。分值越低表明药物治疗效果越好。
1.2.4.4 称重计算小鼠胸腺指数、脾指数 Day 29将小鼠安乐死,取胸腺、脾脏(用滤纸吸干多余的血液)称重(精确到0.1 mg)并进行数据分析。胸腺指数(mg/g)=胸腺重量(mg)/体重(g)×10;脾脏指数(mg/g)=脾脏重量(mg)/体重(g)×10。
1.2.4.5 ELISA 检测炎症因子 Day 29 按照试剂盒说明将小鼠眼球摘除取血1 ml,室温下自然凝固10~20 min。4 ℃、2 000~3 000 r/min 离心20 min,取血清,储存于-20 ℃。ELISA 检测各组TNF-α、IL-4、IL-6三种炎症因子水平。
1.2.4.6 HE 染色 Day 29 将小鼠安乐死,取小鼠距耳缘约5 mm 处耳部皮损组织和腹部皮损组织用10%甲醛固定48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切4 µm 厚片,45 ℃烤片烘干,二甲苯脱蜡,苏木精-伊红染色,乙醇脱水,二甲苯透明,树胶封片。显微镜下观察表皮间隙有无水肿,表皮有无角化过度或角化不全,棘层及颗粒层厚度,真皮炎症细胞(以嗜酸性粒细胞为主)浸润情况。
1.2.4.7 免疫组化 ①脱蜡和水化:切片置于60 ℃烤箱中烘烤2 h,而后依次浸入二甲苯15 min 2 次,无水乙醇15 min 2 次,85%乙醇5 min,75%乙醇5 min,PBS缓冲液冲洗3次,每次3 min;②抗原修复:置于EDTA 溶液中,95 ℃加热10 min,室温降温,PBS缓冲液冲洗3次,每次3 min;③内源性过氧化物酶封闭:加入阻断性内源性过氧化物酶适量反应10 min,PBS 缓冲液冲洗3 次,每次3 min;④抗原抗体结合:免疫组化笔描边后,每张玻片加入100 µl一抗反应,4 ℃过夜,第2 天加入反应增强液,37 ℃反应20 min,随后加入二抗,37 ℃反应20 min;⑤显色:加入新鲜配制的DAB 显色液,室温孵育1 min 左右,自来水冲洗;复染:自来水冲洗,苏木素染色液孵育30 s,分化、冲洗反蓝,随后梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察染色结果,并观察CD4+T淋巴细胞浸润情况。
1.3 统计学处理 数据采用SPSS22.0及Prism 8.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 AD 建模结果 空白对照组评分为0,建模各组评分均>4 分,建模小鼠皮肤均出现明显的红斑、水肿、结痂、角皮脱落、左耳厚度增加、搔抓次数增多等表现。与空白对照组相比,AD 建模各组评分升高,差异有统计学意义,提示AD 小鼠模型建立成功(P<0.01,图2A、B、表1)。
表1 小鼠AD情况评分比较(±s)Tab.1 Comparison of AD condition scores in mice (±s)
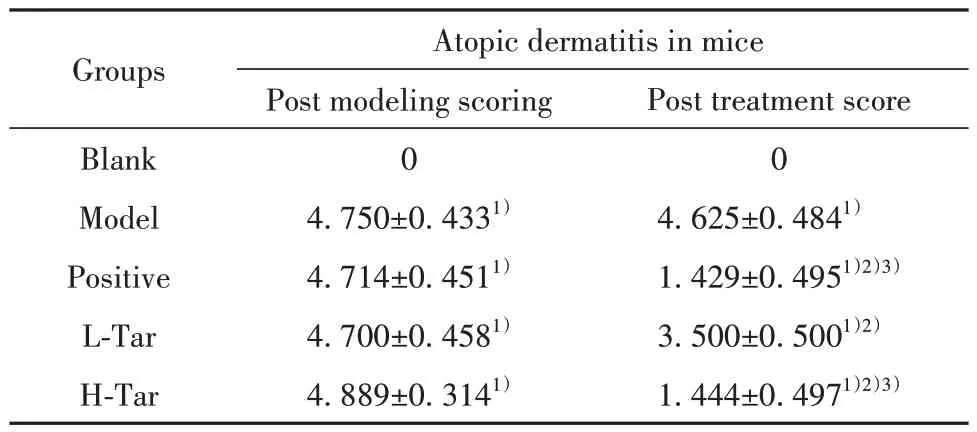
表1 小鼠AD情况评分比较(±s)Tab.1 Comparison of AD condition scores in mice (±s)
Note:1) P<0.01 vs blank control group;2)P<0.01 vs model control group;3) P<0.01 vs L-Tar group.
Groups Atopic dermatitis in mice Post modeling scoring 0 4.750±0.4331)4.714±0.4511)4.700±0.4581)4.889±0.3141)Post treatment score 0 4.625±0.4841)1.429±0.4951)2)3)3.500±0.5001)2)1.444±0.4971)2)3)Blank Model Positive L-Tar H-Tar
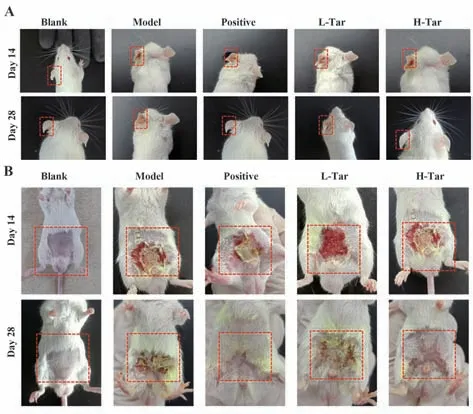
图2 给药后小鼠生理改变Fig.2 Physiological changes of mice after administration
2.2 各组小鼠耳厚、搔抓次数统计 随着DNCB 的刺激,与空白对照组相比,建模各组小鼠耳厚明显增厚(P<0.01),搔抓次数明显增加(P<0.01)。给予药物干预后,小鼠AD 情况得到改善。与模型组相比,低、高浓度蒲公英甾醇组小鼠耳厚明显变薄(P<0.01),搔抓次数减少(P<0.01),与泼尼松龙阳性对照组表现相符,高浓度蒲公英甾醇组较低浓度蒲公英甾醇组降低程度更加明显(P<0.01,图3)。
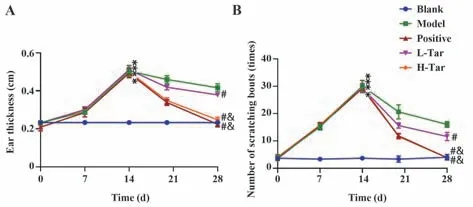
图3 小鼠耳厚、搔抓次数统计Fig.3 Statistics of mouse ear thickness and scratching times
2.3 小鼠治疗评分 给予药物治疗后,小鼠AD 皮损情况明显改善。与模型对照组相比,小鼠皮损情况好转,皮肤结痂,无红斑,无出血,毛发开始正常生长,左耳厚度明显变薄,搔抓次数明显减少(P<0.01),皮炎情况评分明显降低,且与药物浓度呈正相关(P<0.01)。见图2A、B、图3、表1。
2.4 各组脏器指数比较 与模型组相比,低、高浓度蒲公英甾醇可明显降低AD 模型小鼠的胸腺指数(P<0.01,图4A),其效果与泼尼松龙阳性对照组的免疫抑制作用一致;低、高浓度蒲公英甾醇亦可显著降低小鼠脾脏指数(P<0.01,图4B),推测可能与抑制被过度激活的B淋巴细胞有关。脏器指数的降低与药物浓度呈正相关。
2.5 各组皮损组织病理变化 与模型组相比,蒲公英甾醇治疗组小鼠镜下可见表层增厚水肿、过度角化、炎症细胞浸润、棘层肥厚等情况明显减轻。随着蒲公英甾醇浓度升高,治疗效果明显增强(图5A),且对肝肾无明显毒性(图5B、C)。提示蒲公英甾醇能明显改善小鼠AD的皮肤状况,促进恢复。
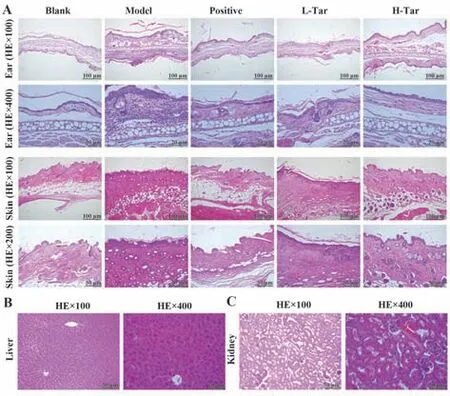
图5 给药后小鼠病理改变Fig.5 Pathologic changes of mice after administration
2.6 各组免疫组化结果 给予药物后,CD4+T 细胞浸润情况好转。与模型组相比,阳性对照组、低浓度蒲公英甾醇组、高浓度蒲公英甾醇组、病变周围CD4+T 细胞减少,表明蒲公英甾醇具有治疗效果,可以降低AD 炎症程度(图6),提示蒲公英甾醇可以减轻CD4+T细胞的炎症浸润情况,促进恢复。
2.7 各组血清中炎症水平检测 两种不同浓度给药组血清中炎症因子TNF-α 含量的平均值分别为171.44、166.44,与模型组(243.78)相比明显降低;同时,阳性对照组、低浓度蒲公英甾醇组、高浓度蒲公 英 甾 醇 组 中IL-4(8.72、7.96)、IL-6(23.29、21.98)含量相比模型组(17.50;45.13)显著降低(P<0.01)且与药物浓度呈正相关(P<0.01,图7)。提示蒲公英甾醇能够显著降低血清中炎症因子TNF-α、IL-4、IL-6水平。
3 讨论
AD 是一种与遗传和过敏相关的,表现为皮肤干燥、剧烈瘙痒的皮肤病。AD 的发病机制包括免疫系统功能障碍和表皮屏障功能障碍,与遗传、免疫、环境等多重因素相关[1]。该疾病多发生于婴儿期,患病率呈逐年上升趋势[28]。虽然AD 具体的发病机制尚未明确,但Th1/Th2 细胞失衡被认为是AD发生的主要原因之一。在AD 的发病中,炎症细胞浸润显著增加、Th2 相关细胞因子介导B 细胞活化使免疫球蛋白E(IgE)水平显著升高,且Th2 相关细胞因子可在诱导Th2 细胞活化增加的同时抑制Th1细胞。增加的IgE 与肥大细胞和嗜碱性粒细胞相关受体反应是AD 发生的主要机制。IL-4、IL-6 等炎症因子可诱导CD4+向Th2 分化,Th2 分泌IL-4 在B 细胞向IgE 转化中发挥关键作用。Th1 和Th22 分泌的TNF-α是公认的细胞促炎症因子,被认为是AD的诱因。因此调节Th1/Th2平衡可以改善疾病(图8)[29-31]。
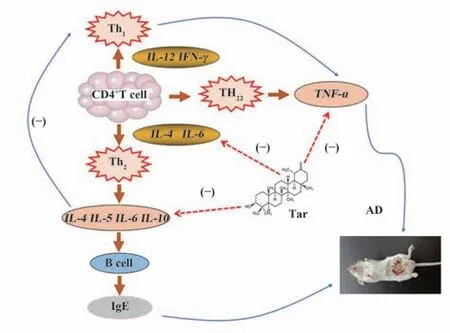
图8 蒲公英甾醇改善AD的相关机制Fig.8 Mechanism of dandelion sterol improving AD
当前治疗AD 的药物主要有皮质类固醇和免疫抑制剂,但这些药物均有较为严重的副作用。因此,愈来愈多的学者开始从中草药中探索新的AD治疗药物,以期找到疗效显著、服用方便、副作用小的新型药物[8-11]。蒲公英甾醇是蒲公英的主要活性成分之一,研究表明,该成分对肝损伤、类风湿关节炎、肾损伤等多种疾病模型均有治疗作用,其中最为显著的是抗炎作用[15]。蒲公英甾醇已被证明可通过抑制炎症介质TNF-α、IL-4、IL-6、IL-8 等的产生抑制溃疡性结肠炎[17];通过调节κB 抑制剂、IκB 激酶和转化生长因子活化激酶1(transform growth factor β activated kinase 1,TAK1)抑制 核 因子-κB(NF-κB)激活以抑制IL-1β 诱导的小鼠类风湿关节炎[18];通过调控TLRs/NF-κB 和Bax/Bcl-2 等炎症相关信号转导通路改善肝损伤等炎症[20]。
本研究中,蒲公英甾醇的应用剂量参考文献[24-26],采用了5 mg/kg 和10 mg/kg 浓度。本研究结果表明,蒲公英甾醇能明显改善AD 小鼠模型的皮肤病理状态,降低皮肤厚度,减少搔抓次数,减少炎症细胞浸润,对AD 具有良好的治疗作用,且对肝、肾无明显药物毒性,副作用少。同时ELISA结果显示,应用蒲公英甾醇的各组小鼠血清中TNF-α、IL-4、IL-6 水平显著降低。提示蒲公英甾醇可能通过调节这3种炎症因子调节Th1/Th2的平衡紊乱,减少IgE转化,从而抑制AD的发展,缓解AD情况。因此蒲公英可能是治疗AD 的具有发展前景的一类中草药。本研究为临床使用蒲公英甾醇治疗AD 提供了部分理论支持,但蒲公英甾醇治疗AD 的具体机制还需进一步研究。