CD4+T细胞在心力衰竭小鼠模型中的变化及细胞因子释放的研究①
2023-11-13贾玉玲张君彩吴丽侠赵海彬蒋玉柱
贾玉玲 张君彩 吴丽侠 高 静 赵海彬 蒋玉柱
(石家庄市第四医院(河北医科大学附属妇产医院),石家庄 050011)
心力衰竭(heart failure,HF)是60 岁以上住院老年人最常见的心血管疾病,但针对急性失代偿型和射血分数保留型HF 的治疗策略,目前均未被证实可提高患者生存率[1-2]。心室重构是慢性HF 发生发展的主要病理基础,包括间质纤维化、炎症细胞浸润、心肌细胞肥大、细胞坏死和糖原贮积等,是影响HF病程进展和死亡率的决定因素[3]。
T 辅助(T helper,Th)细胞,也称为CD4+细胞或CD4 阳性细胞,是适应性免疫系统中的效应细胞之一[4]。当心肌细胞受到各种不良刺激时,会释放细胞因子招募血液及局部的Th 细胞至损伤处,Th 细胞进一步激活可促使细胞外基质过度沉积,从而引起并加重间质纤维化诱发HF[5]。淋巴细胞可根据表型不同分为多个亚群,如Th1、Th2、调节性T 细胞(regulatory T cell,Treg)等[6]。近年研究发现,CD4+T淋巴细胞可通过分泌不同的细胞因子在HF 的发生发展过程中发挥“双刃剑”作用[7]。目前针对CD4+T淋巴细胞与心室重构关系的研究仍处于初级阶段,尚不明确不同阶段CD4+T 淋巴细胞亚群改变与HF的关系。因此,本研究使用HF 小鼠模型,观察不同时间点CD4+T 淋巴细胞亚群的变化,以期为改善心肌重构、治疗HF提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 10 周龄SPF 级雄性C57BL/6J 小鼠30 只,体质量(25±2) g,购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2014-0001。饲养环境保持温度22~26 ℃,湿度40%~60%,12 h昼夜周期交替,适应性喂养7 d。
1.1.2 主要试剂与仪器 Ⅰ型胶原蛋白ab270993)、CD4+T细胞(ab183685)、T-bet(ab53174)、GATA-3(ab8933)、FoxP3(ab215206)特异性一抗购自英国Abcam;特异性二抗(批号:20201108)购自南京金斯瑞生物科技有限公司;IFN-γ、IL-2、IL-4、IL-6、IL-10 ELISA 试剂盒(批号:200824、200715、200514、201206、201109)购自深圳市达科为生物工程有限公 司;Visual Sonics Vevo 2100 system (Visualsonics Inc.,加拿大)超声机;BX45显微镜(奥林巴斯)。
1.2 方法
1.2.1 慢性HF 小鼠的建模及分组 采用心脏外周负荷法制备小鼠心衰模型[7]。使用戊巴比妥钠(30 mg/kg 体重)对小鼠进行腹腔内麻醉,备皮消毒后于第二肋肋间隙做纵向切口打开胸腔,暴露主动脉胸段;最后,在主动脉的头臂干与左颈总动脉间下方穿入7-0 细线,把26 G 细针与主动脉弓共同结扎,结扎后取出细针。然后随机分为手术造模后2周(n=10)、4 周(n=10)组,另外10 只小鼠设为假手术组,假手术组仅打开胸腔暴露主动脉但不进行结扎。
1.2.2 心脏超声动态观察 小鼠麻醉后前胸脱毛,采用Visual Sonics Vevo 2100 system 超声机(频率17 MHz)取小鼠左心室长轴切面后进行M 超声检测,测量左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左 室 射 血 分 数(left ventricular ejection fraction,LVEF)、左心室收缩末期大小(left ventricular end-systolic dimension,LVESD)、左心室舒张末期大小(left ventricular end-diastolic dimension,LVEDD),所有数据检测3 个心动周期并计算测量的平均值。
1.2.3 心脏病理学检查 小鼠处死后剪开心包,剔除附属物,生理盐水反复冲洗心脏至溶液变清亮,用滤纸将多余水分吸干后浸入4%中性甲醛溶液。经乙醇脱水、石蜡包埋后,置于切片机中连续切片,经脱蜡、二甲苯透明后,Masson 染色检测心脏纤维化;免疫组化染色检测Ⅰ型胶原和CD4+T 细胞表达。BX45显微镜40倍观察拍照,每张玻片选3个视野,Image J软件分析。
1.2.4 血清炎症因子检测 ELISA 检测小鼠血清IFN-γ、IL-2、IL-4、IL-6 和IL-10 水平。取小鼠腹主动脉血,4 ℃、3 000 r/min 离心10 min(半径12.6 cm),取血清分装,-20 ℃保存备用,根据相应试剂盒说明书步骤进行指标检测。
1.2.5 Western blot 取适量大鼠心脏组织,加入RIPA 裂解液制成蛋白提取液,BCA 法测定蛋白浓度。加入4×SDS 蛋白上样缓冲液煮沸后备用。将样品分别加入不同泳道进行聚丙烯酰胺凝胶电泳,浓缩胶电压80 V,分离胶电压100 V,后转至PVDF膜,3%BSA 封闭。加入T-bet(1∶1 000)、GATA-3,(1∶1 000)、FoxP3(1∶1 000)特异性一抗,于4 ℃孵育过夜。TBST洗膜3次,加入特异性二抗(1∶2 000)孵育1 h。TBST 洗膜3 次,ECL 化学发光液曝光显影,Image J图像分析软件系统进行半定量分析。
1.3 统计学分析 采用SPSS26.0对数据进行统计学分析,以±s表示。数据经正态性检验和方差齐性检验,多组比较使用单因素方差分析(One Way ANOVA),两两比较采用t检验。不符合正态和方差齐性检验的数据采用秩和检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 左室功能的评价 与假手术组比较,造模2周、4 周后小鼠心脏扩大且收缩功能下降,表现为LVESD 和LVEDD 显著增大,而LVFS、LVEF 显著下降,差异均有统计学意义(P<0.05);与造模2 周比较,造模4 周后LVFS、LVEF 显著降低(P<0.05),但LVESD 和LVEDD 并没有进一步增高(P>0.05)。见表1。
表1 各组大鼠心功能指标比较(±s,n=10)Tab.1 Comparison of heart function indexes of rats in each group (±s,n=10)
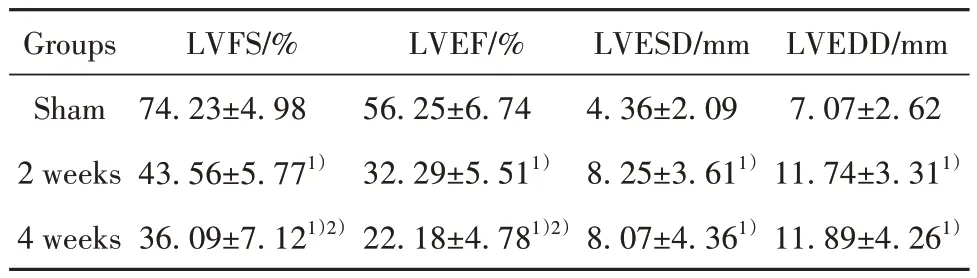
表1 各组大鼠心功能指标比较(±s,n=10)Tab.1 Comparison of heart function indexes of rats in each group (±s,n=10)
Note:Compared with sham operation group, 1)P<0.05; compared with 2 weeks after modeling, 2)P<0.05.
LVEDD/mm 7.07±2.62 11.74±3.311)11.89±4.261)Groups Sham 2 weeks 4 weeks LVFS/%74.23±4.98 43.56±5.771)36.09±7.121)2)LVEF/%56.25±6.74 32.29±5.511)22.18±4.781)2)LVESD/mm 4.36±2.09 8.25±3.611)8.07±4.361)
2.2 小鼠HF 病理进程中左室病理组织学改变对三组小鼠进行心脏病理切片分析(图1、2)。低倍镜下显示假手术组小鼠心脏形态正常,造模2 周和4 周后心肌增厚、心腔减小。Masson 染色及免疫组化染色检测各组大鼠心肌组织纤维化及胶原沉积程度,结果表明,与假手术组相比,造模2 周、4 周后小鼠心肌组织纤维化和Ⅰ型胶原阳性面积显著增加,差异有统计学意义(P<0.05),与造模后2 周相比,造模后4 周心肌组织纤维化和Ⅰ型胶原阳性面积显著增加(P<0.05)。
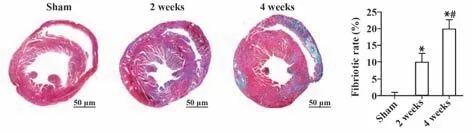
图1 各组小鼠心脏纤维化面积百分比比较Fig.1 Comparison of percentage of cardiac fibrosis area of mice in each group
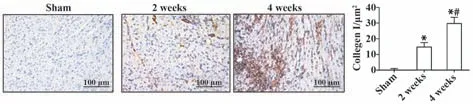
图2 各组小鼠心脏胶原蛋白沉积程度比较(×20)Fig.2 Comparison of collagen deposition in hearts of mice in each group (×20)
2.3 大鼠心脏CD4+T 淋巴细胞变化 对三组小鼠进行心脏病理切片分析(图3),结果表明,与假手术组相比,造模2 周、4 周后小鼠心肌组织中的CD4+T淋巴细胞显著增多(P<0.05);与造模后2周相比,造模后4周CD4+T淋巴细胞显著增多(P<0.05)。
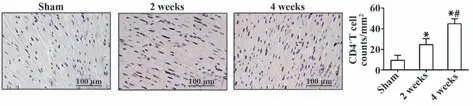
图3 各组小鼠心脏CD4+T细胞数量比较(×20)Fig.3 Comparison of the number of mice heart CD4+T cells in each group (×20)
2.4 各组大鼠心肌组织炎症因子表达水平 对假手术组、2 周、4 周组小鼠心肌组织炎症因子进行分析,结果见表2。与假手术组相比,造模后2 周、4 周小鼠心肌组织炎症因子IFN-γ、IL-2 水平显著升高(P<0.05),IL-4、IL-6、IL-10 水平显著降低;与造模后2 周相比,造模后4 周小鼠心肌组织炎症因子IFN-γ、IL-2 水平显著升高(P<0.05),IL-4、IL-6、IL-10水平显著降低(P<0.05)。
表2 各组小鼠心肌组织炎症因子表达水平(±s,n=10)Tab.2 Expression levels of inflammatory factors in myocardial tissue of mice in each group (±s,n=10)
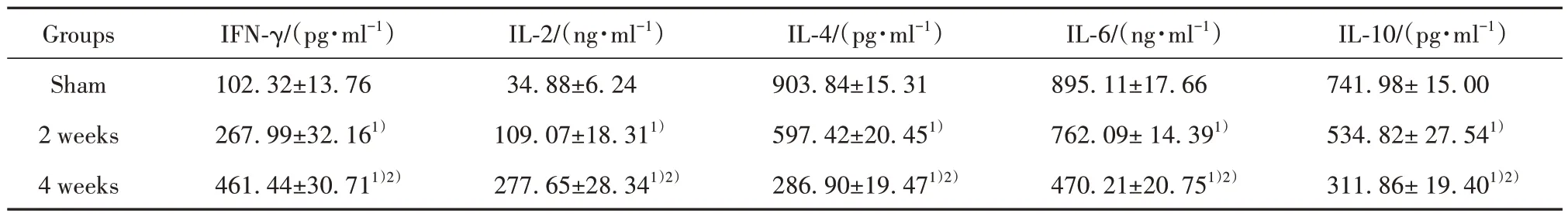
表2 各组小鼠心肌组织炎症因子表达水平(±s,n=10)Tab.2 Expression levels of inflammatory factors in myocardial tissue of mice in each group (±s,n=10)
Note:Compared with sham operation group, 1)P<0.05; compared with 2 weeks after modeling, 2)P<0.05.
IL-10/(pg·ml-1)741.98± 15.00 534.82± 27.541)311.86± 19.401)2)Groups Sham 2 weeks 4 weeks IFN-γ/(pg·ml-1)102.32±13.76 267.99±32.161)461.44±30.711)2)IL-2/(ng·ml-1)34.88±6.24 109.07±18.311)277.65±28.341)2)IL-4/(pg·ml-1)903.84±15.31 597.42±20.451)286.90±19.471)2)IL-6/(ng·ml-1)895.11±17.66 762.09± 14.391)470.21±20.751)2)
2.5 各组小鼠心肌组织T-bet、GATA-3、FoxP3 蛋白表达量比较 Western blot检测小鼠心肌组织T-bet、GATA-3、FoxP3 蛋白相对表达量,结果如图4。与假手术组相比,造模后2周、4周小鼠心肌组织T-bet水平显著升高,GATA-3、FoxP3 水平降低,差异有统计学意义(P<0.05);与造模后2 周相比,造模后4 周小鼠心肌组织T-bet 水平显著升高,GATA-3、FoxP3 水平降低,差异有统计学意义(P<0.05)。

图4 小鼠心肌组织T-bet、GATA-3、FoxP3蛋白表达量比较Fig.4 Comparison of protein levels of T-bet, GATA-3 and FoxP3 in mice myocardial tissue
3 讨论
HF是各种器质性心脏病发展的终末阶段,临床表现为呼吸困难和乏力(活动耐量受限),以及液体潴留(肺淤血和外周水肿)[8]。HF 根据左心室射血分数可分为射血分数降低型(左心室射血分数<40%)、射血分数保留型(左室射血分数值≥50%)和射血分数中间值的心衰(左室射血分数为40%~49%)[9]。射血分数降低型HF 患者经过临床治疗后虽然可以在很大程度上改善临床症状、延长患者寿命、提高患者生活质量,但HF 是一种慢性、自发进展性疾病,无法根治;且射血分数保留型HF 目前尚缺乏能够降低患者病死率的治疗手段[10]。左心室的病理性重构是HF 发病的主要机制之一[11]。心室重构是由于各种不良刺激对心肌细胞造成持续性损害,或机械负荷过重等导致炎症细胞因子过度表达及神经内分泌系统异常激活,从而使心肌结构和功能发生不可逆的病理改变,主要表现为心肌细胞增粗增长、间质成分增多、心肌纤维化、细胞坏死和糖原贮积等[12-13]。
本研究通过增加心脏外周负荷法制备小鼠HF模型,结果表明手术2 周及4 周后小鼠出现左心射血分数下降、心室增大等HF 表现;进一步病理染色结果表明,HF小鼠心肌组织纤维化及胶原沉积呈进行性加重;以上数据均表明HF 小鼠出现了明显的心室重构,且心脏的功能和结构随时间的增长逐渐恶化。新近研究发现,CD4+T 淋巴细胞作为适应性免疫应答中的关键细胞亚型,在HF 的发生发展中起到至关重要的作用[14-15]。本研究结果表明,随着时间的推移,CD4+T 淋巴细胞的数量在心肌组织中逐渐增多,提示其可能通过释放IL-2、IFN-γ和TNF-α等因子促进HF 的发生发展。既往研究发现,抑制T细胞功能能够缓解HF的病理改变,如KALLIKOURDIS 等[16]研究发现,使用abatacept 可在抑制T 细胞激活的同时提高IL-10 水平,缓解压力超负荷导致的HF。此外,CD4+T 淋巴细胞可根据其功能和细胞表面表达的分子分为不同亚群,如Th1 细胞主要表达IFN-γ、IL-2;Th2 细胞主要表达IL-4、IL-6;Treg 主要表达IL-10 等,且不同亚群在HF 的进展中发挥不同作用[17]。通过检测不同亚群CD4+T细胞分泌的炎症因子,本研究发现,随着病程增长,IFN-γ 和IL-2表达逐渐升高,而IL-4、IL-6 和IL-10 表达逐渐降低,可能是由Th1 细胞增多而Th2、Treg 数量减少导致。既往数据表明Th1 细胞在非缺血性HF 患者心脏中大量浸润,进一步的机制研究发现Th1 可通过细胞整合素α4与心成纤维细胞结合诱导TGF-β表达,从而促进细胞外基质成分的沉积[18]。相反,Treg 可通过抑制炎症反应缓解HF的病理进展,如CHEN等[19]研究发现有氧运动可使Treg 亚群比例相对上调,从而改善HF 大鼠的症状;此外Treg 与成纤维细胞共培养可抑制细胞外基质成分的积累,从而阻碍心脏纤维化的发生[20]。为进一步探究CD4+T淋巴细胞亚群变化的调控机制,本研究检测了心脏组织中Tbet、GATA-3 及FoxP3 的表达水平,结果显示随着时间延长,T-bet 蛋白水平逐渐增高,而GATA-3 和FoxP3 蛋白水平逐渐降低。其中,T-bet 蛋白是前体Th0 细胞向Th1 细胞分化的关键转录因子,而GATA-3 则调控了Th0 细胞向Th2 细胞转化[21]。此外,Th1 和Th2 可以相互调节,Th1 细胞分泌的IL-2、IFN-γ 可促进其自身成熟,抑制Th2 细胞分化;而Th2 细胞可通过分泌IL-4、IL-6 等因子抑制Th1 细胞分化成熟,二者共同影响免疫应答的格局[22]。FoxP3 是Treg 发育和维持过程中的关键转录因子,在调节机体免疫耐受、维持机体自稳态中起重要作用[23]。以上结果表明CD4+T淋巴细胞亚群失衡可能是HF 发病的关键。本研究仅关注了淋巴细胞亚群的作用,但心肌重构与其他免疫细胞相关,未来研究可针对其他细胞类型进行深入研究。
综上所述,随着HF 的发生发展,CD4+T 淋巴细胞亚群数量增加并发生比例失衡,导致炎症因子水平改变,从而引起心室重构加重HF 的病理表现。本研究为心衰中CD4+T淋巴细胞在基础和转化研究上的应用提供理论依据。