内皮型一氧化氮合酶G894T基因多态性与2型糖尿病肾病关系的Meta分析
2023-11-13徐石张谢敏娟
徐石张,谢敏娟
内皮型一氧化氮合酶G894T基因多态性与2型糖尿病肾病关系的Meta分析
徐石张1,谢敏娟2
1.宜春市人民医院肾内科,江西宜春 336000;2.宜春学院病理教研室,江西宜春 336000
系统性评价内皮型一氧化氮合酶(endothelial nitric oxidesynthase,eNOS)中G894T基因多态性与2型糖尿病肾病(type 2 diabetic nephropathy,T2DN)的关联。计算机检索PubMed、Cochrane Library、EMBASE、Science Citation Index、Wiley Online Library、Google Scholar、中国期刊全文数据库、中国生物医学文献数据、万方数据库、中国科技期刊数据库等电子数据库,根据纳入与排除标准,纳入G894T基因多态性与T2DN关联的病例对照研究,利用Review Manager5.1和Stata12.0软件,对相关基因型与等位基因频率的差异行Meta分析。此次研究纳入23篇文献,共包含T2DN患者4655例与2型糖尿病(type 2 diabetes mellitus,T2DM)患者4093例。①T2DN组基因型TT频率(=1.39,95%:1.10~1.76,<0.01)与基因型GT频率(=1.33,95%:1.13~1.57,<0.01)均明显高于T2DM组,基因型GG频率明显低于T2DM组(=0.66,95%:0.55~0.79,<0.01),结果均存在明显异质性。②等位基因T的频率T2DN组明显高于T2DM组(=1.41,95%:1.21~1.65,<0.01)。③中国人群T2DN组基因型GT频率(=2.37,95%:1.81~3.09,<0.01)与等位基因T频率(=2.07,95%:1.62~2.65,<0.01)均明显高于T2DM组,基因型GG频率明显低于T2DM组(=0.42,95%:0.32~0.55,<0.01),且结果均无统计学异质性。④ 2项研究中的对照组不符合Hardy-Weinberg平衡,剔除该2项研究后行敏感性分析,结果无明显变化。G894T基因多态性可能与T2DN的发病相关。
2型糖尿病;糖尿病肾病;一氧化氮合酶;基因多态性;Meta分析
内皮型一氧化氮合酶(endothelial nitric oxidesynthase,eNOS)含有25个内含子和26个外显子,编码1个含有1203个氨基酸的蛋白质,eNOS基因是第一个被测定的人类NOS基因[1]。有研究证实eNOS基因存在多种变异,其中第7外显子处G894为T变异最为常见,将导致编码的谷氨酸变成天冬氨酸。eNOS基因的G894T变异和多种疾病密切相关,其中与糖尿病性肾病(diabetic nephropathy,DN)的关系研究最常见,而糖尿病的高糖状态也可直接抑制eNOS基因的表达[2-3]。
目前,已有部分文献报道eNOS中G894T基因多态性与T2DN的关系,但结论仍存在争议。本研究检索和纳入相关文献,着重探讨我国人群中G894T基因多态性与T2DN的关系,并进行Meta分析。同时,利用敏感性分析与回归分析从多角度研究总体异质性的来源,并以独特的多重亚组分析方法逐个进行报道。
1 材料与方法
1.1 检索策略
以“endothelial nitric oxide synthase” “eNOS” “NOS” “G894T” “diabetic nephropathy” “DN” “polymorphism” “内皮细胞eNOS” “一氧化氮合酶” “2型糖尿病” “糖尿病性肾病” “基因多态性”为主题词、标题词、关键词,分别检索PubMed、EMBASE、Cochrane Library、Wiley Online Library、Science Citation Index、Google Scholar、中国期刊全文数据库、万方数据库、中国生物医学文献数据、中国科技期刊数据库等电子数据库。以PubMed数据库为例,英文检索式:“endothelial nitric oxide synthase” (MeSH) OR “polymorphism” (MeSH) OR “diabetic nephropathy” (MeSH);以中国生物医学文献数据库为例,中文检索式:“一氧化氮合酶”OR “多态性” OR “糖尿病性肾病”。检索时间均为1990年1月至2021年12月。并同时检索纳入文献的参考文献。
1.2 文献选择
纳入标准:①eNOS中G894T基因变异与T2DN关联性的病例对照研究;②文献中有描述 2型糖尿病(type 2 diabetes mellitus,T2DM)的诊断标准;③对照组为T2DM患者,且不伴有糖尿病性肾病;④文献中明确提供各个等位基因或基因型的例数;⑤PCR引物基因序列设计中,正向引物:5ʹ-AAG GCA GGA GAC AGT GGA TGG A-3ʹ,负向引物:5ʹ-CCC AGT CAA TCC CTT TGG TGC TCA-3ʹ。
排除标准:①研究对象不明确,或包含1型糖尿病患者;②重复数据的研究。
1.3 数据提取
两名研究员分别独立提取纳入文献的相关数据,包含第一作者、发表时间、国家、对象类型(实验组、对照组)、Hardy-Weinberg(-)平衡检验、肾病组病例数(GG、GT、TT)、非肾病组病例数(GG、GT、TT)等。当提取数据存在差异,则由第三位研究员发起讨论后决定。
1.4 文献偏倚风险评价
依照NHI-NHGRI研究工作组推荐的遗传关联性研究报告规范对纳入文献进行偏倚风险评价。每项标准以“是(满足)” “否(不满足)” “不清楚(未描述)”分别进行评价。内容:计算把握度、对照组特征、实验组特征、连锁不平衡检测、多态性检测、计算错误率、-检验、盲法、多重检验校正、协变量调整、危险因素发现、人群分层分析、重复性、功能验证性试验。
1.5 统计学方法
利用RevMan公司官方网站提供的Review Manager 5.1软件,对纳入的研究进行Meta分析。分类变量采用相对危险度(odds ratio,OR)合并总体效应,连续性变量采用加权均数差(weighted mean difference,WMD)合并总体效应。每个合并研究效应量均做异质性检验,如值统计量、2统计量,若<0.10说明存在异质性,则采用随机效应模型,反之采用固定效应模型。利用Stata12.0软件对研究进行发表偏倚检验(漏斗图、Begg检验),并对存在异质性的研究进行回归分析,探讨其异质性来源。总体结果以<0.05为差异有统计学意义。
2 结果
2.1 文献资料
依照检索策略对数据库进行检索,初步获得173篇文献,阅读摘要后排除125篇内容不相关文献,对剩余的48篇文献进行精读,根据纳入与排除标准,最终23篇文献纳入此次系统评价,筛选流程见图1[4-26];其中包含16篇外文研究,有2篇文献中对照组不符合-平衡。23篇文献中共8748例患者,其中T2DM患者4093例,T2DN患者4655例,一般情况和基因型数据见表1,文献偏倚风险评价见图2。
2.2 不同基因型与T2DN的关系
将23篇文献中基因型GG的频率进行Meta分析,结果存在统计学异质性(<0.01,2=71%),采用随机效应模型合并结果,总体效应显示T2DN组基因型GG频率明显低于T2DM组(=0.66,95%:0.55~0.79,<0.01)(图3)。同样,基因型TT与基因型GT文献间均有异质性,随机效应模型的Meta分析结果显示,T2DN组基因型TT频率(=1.39,95%:1.10~1.76,<0.01)与基因型GT频率(=1.33,95%:1.13~1.57,<0.01)均明显高于T2DM组,见图4、图5。
2.3 等位基因T与T2DN的关系
Meta分析中等位基因T的异质性检验,<0.01,2=73%,有统计学异质性,采用随机效应模型合并结果,显示等位基因T的频率T2DN组明显高于T2DM组(=1.41,95%:1.21~1.65,<0.01),见图6。
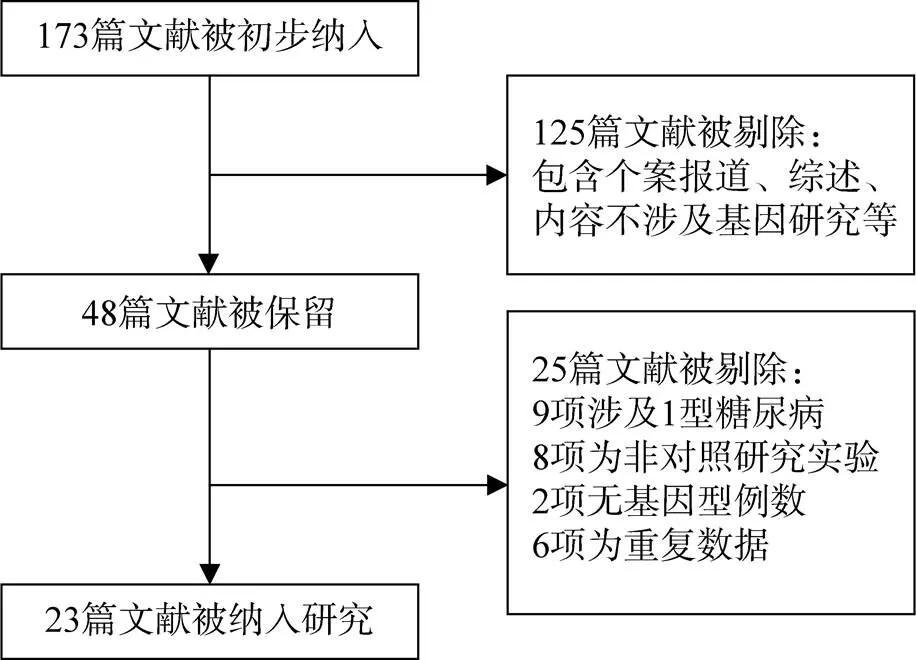
图1 文献筛选流程
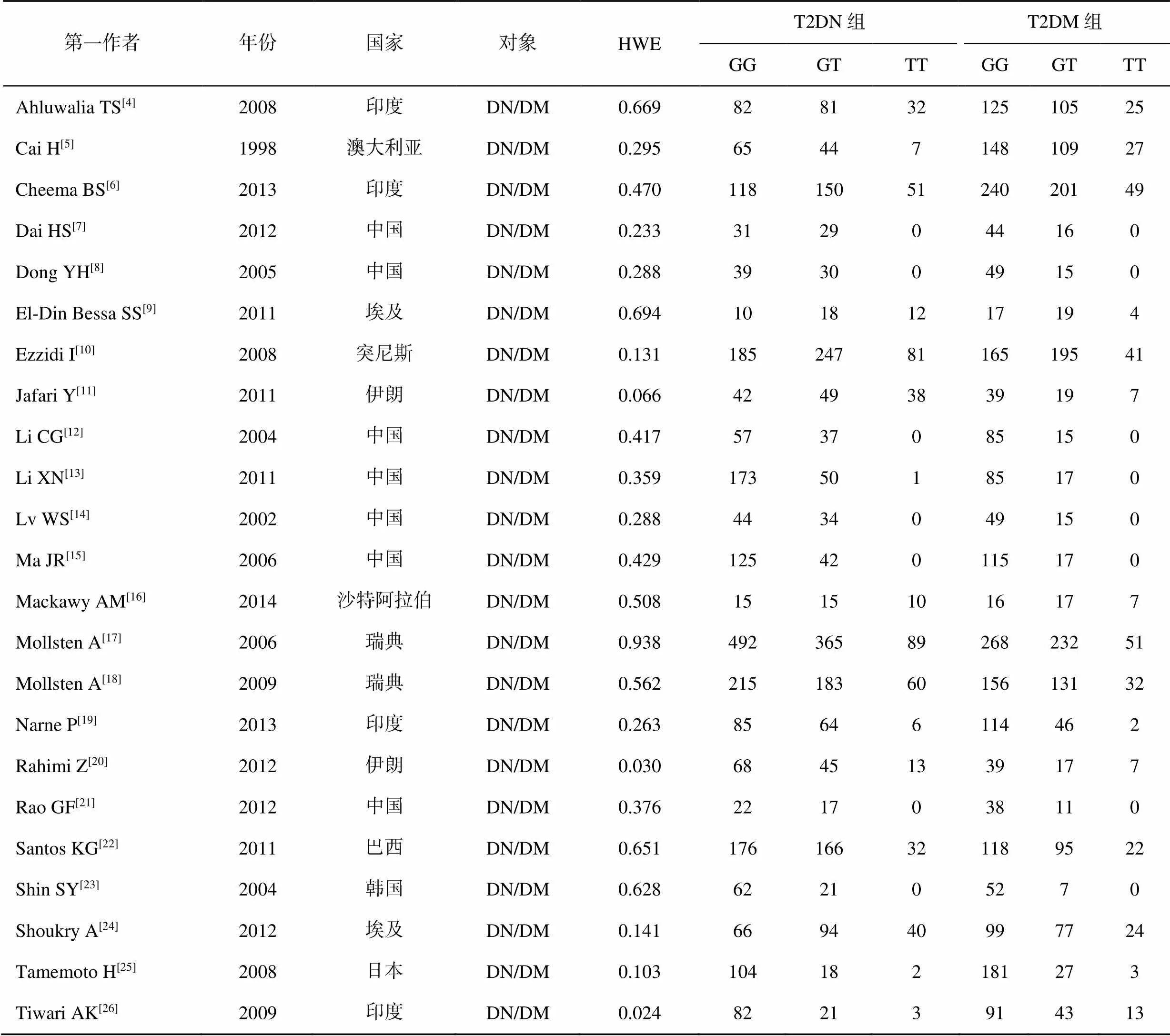
表1 纳入文献的一般资料
注:DN:糖尿病肾病;DM:糖尿病;HWE:Hardy-Weinberg(-)平衡
2.4 不同亚组中基因多态性与T2DN的关系
针对文献发表年份、-平衡、不同人群等多因素,采用Meta分析方法对异质性来源进行研究,在基因型GG与基因型GT Meta分析中发现不同人群是总体效应的异质性来源之一。其中,中国人群T2DN组基因型GG频率明显低于T2DM组(=0.42,95%:0.32~0.55,<0.01),且结果无统计学异质性(=0.66,2=0)。中国人群T2DN组基因型GT频率高于T2DM组(=2.37,95%:1.81~3.09,<0.01),研究文献具有同质性(=0.63,2=0),见表2。在基因型TT Meta分析中,发现-平衡是总体异质性来源之一。在符合-平衡文献中,亚组分析显示T2DN组基因型TT频率显著高于T2DM组(=1.48,95%:1.19~1.84,<0.01),且结果不存在异质性(=0.10,2=34%)。
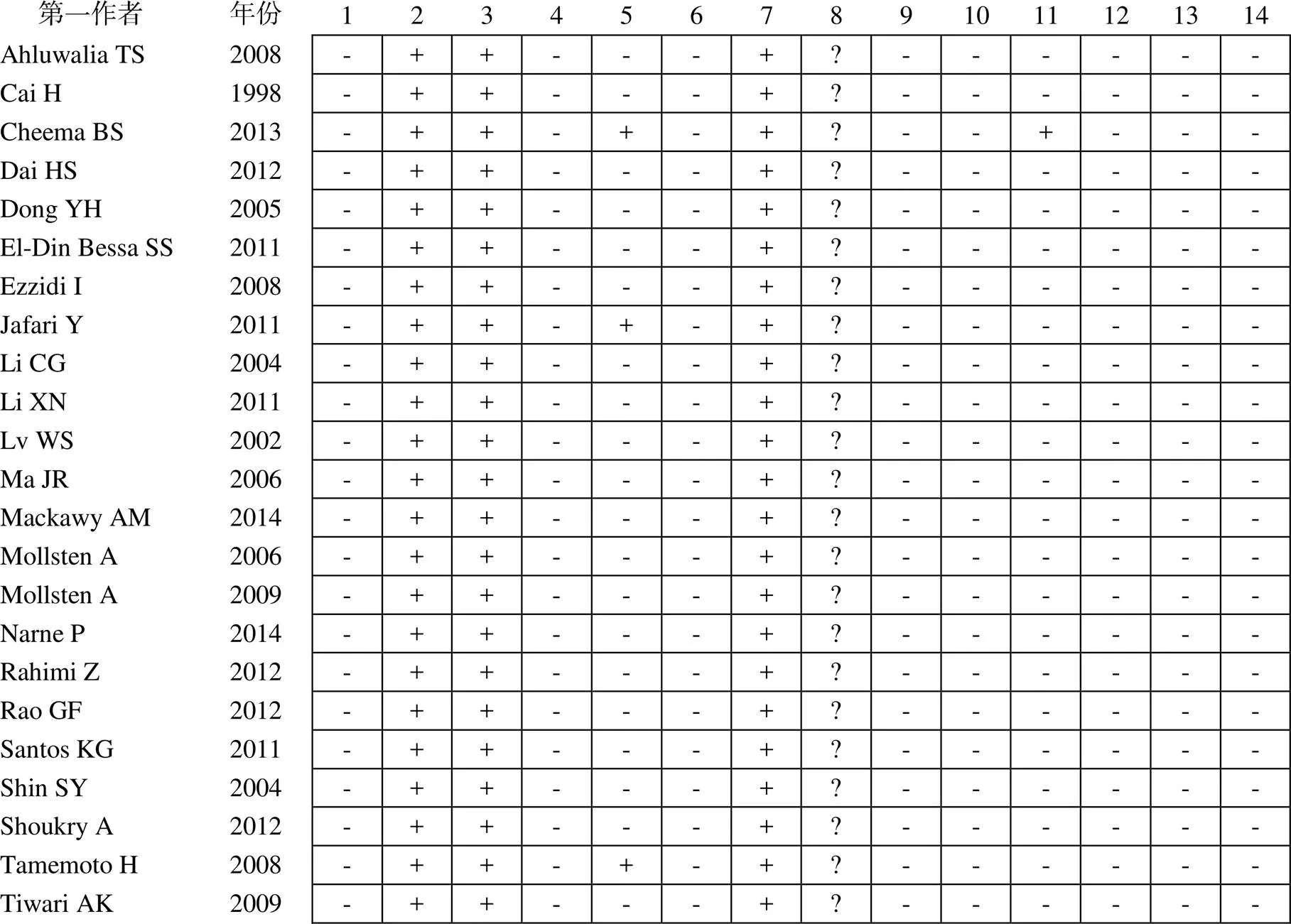
图2 纳入文献的偏倚风险评价
注:1:计算把握度;2:对照组特征;3:实验组特征;4:连锁不平衡检测;5:多态性检测;6:计算错误率;7:-检验;8:盲法;9:多重检验校正;10:协变量调整;11:危险因素发现;12:人群分层分析;13:重复性;14:功能验证性试验

图3 基因型GG与T2DN关联性的Meta分析

图4 基因型GT与T2DN关联性的Meta分析
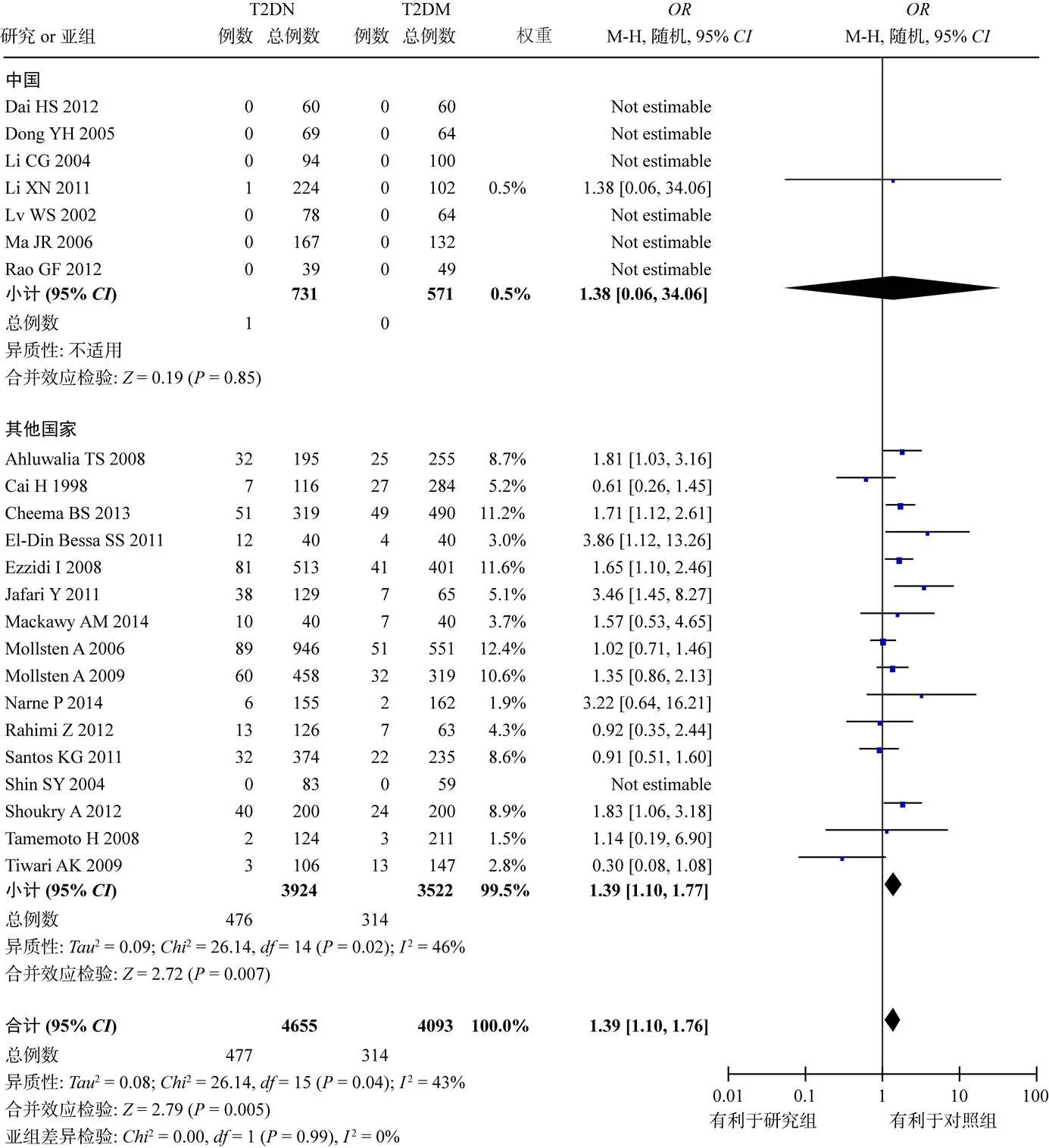
图5 基因型TT与T2DN关联性的Meta分析

图6 等位基因T与T2DN关联性的Meta分析
等位基因T的Meta回归分析发现,不同人群与-平衡均是总体效应的异质性来源。进行亚组分析显示,中国人群T2DN组等位基因T频率明显高于T2DM组(=2.07,95%:1.62~2.65,<0.01),且结果无统计学异质性(=0.82,2=0)。在符合-平衡的亚洲文献中,亚组分析显示人群T2DN组等位基因T频率高于对照组(=1.72,95%:1.48~2.00,<0.01),且结果无异质性(=0.20,2=23%)。
3 讨论
由于人群迁移、不随机婚配等因素,不同群体间基因型比例存在差异,若研究群体符合-平衡,就考虑来自同一蒙德尔群体,能有效减少研究中的群体差异,提高研究整体质量[27-28]。本次Meta分析中包含2项亚洲人群研究不符合-平衡,将其数据剔除后行敏感性分析,发现结果与全体研究一致,仍存在明显异质性。为深入探讨其异质性来源,本研究针对文献发表年份、-平衡、不同人群等多因素,通过Meta回归分析发现-平衡与不同人群是总体效应异质性的主要来源之一,再次将2项研究数据剔除后行亚组分析,发现亚洲人群T2DN组中等位基因T与基因型TT的频率均明显高于T2DM组,而基因型GG的频率显著低于T2DM组,且结果均不存在统计学异质性。而在非洲人群的亚组分析中得到类似的结果。因此,后续同类对照研究时,样本应尽量选用同一蒙德尔群体。
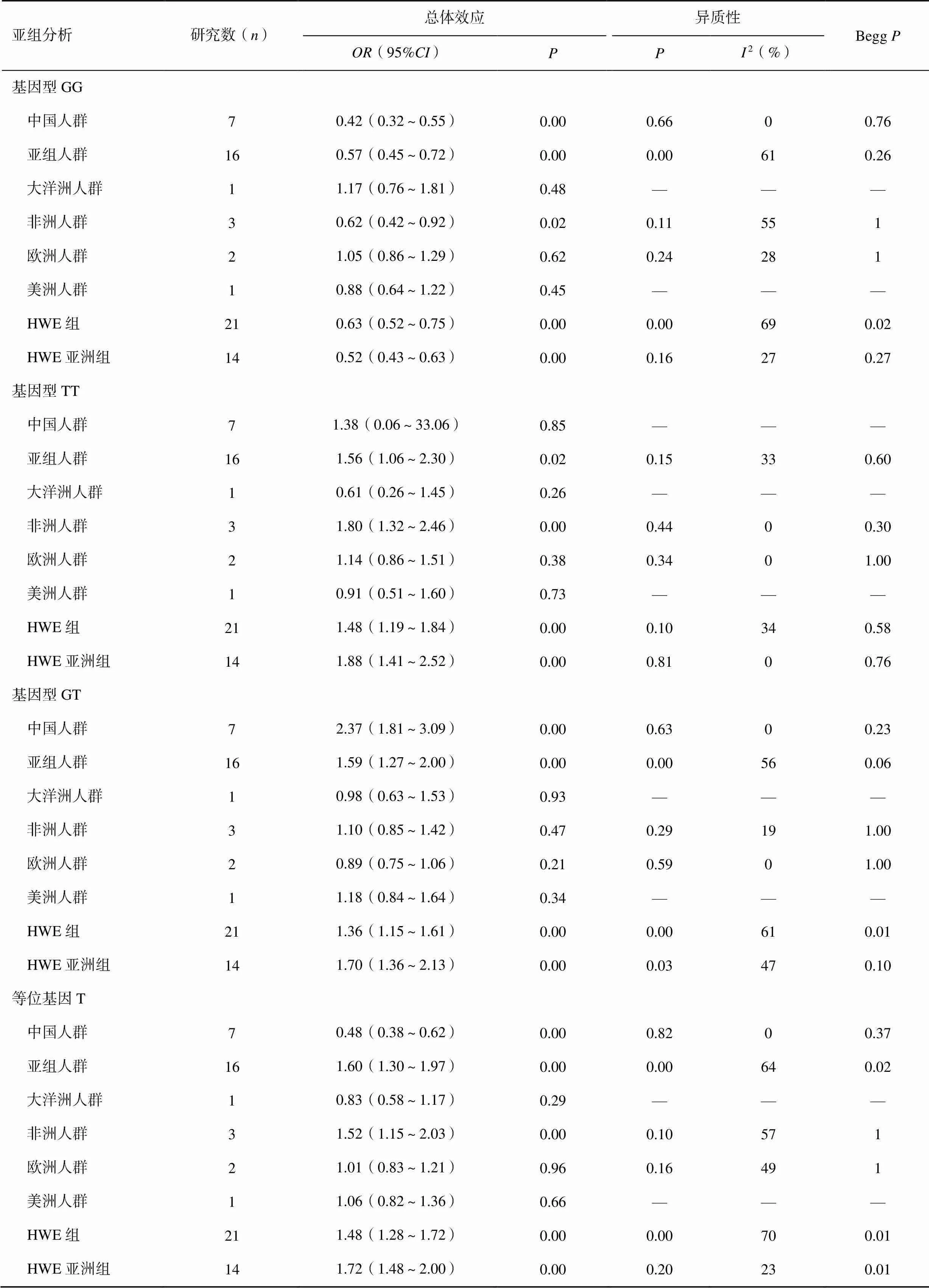
表2 G894T基因多态性的亚组分析
注:HWE:Hardy-Weinberg(-)平衡
eNOS基因是第一个被测定的NOS基因,关于eNOS基因多态性与DN的关系研究最多,被认为是DN的恶化因子而非启动因素,等位基因a、等位基因T、基因型TT频率等因素均可影响其表达。eNOS的基因变异包含多个位点,其中第7位外显子处G894→T突变,导致密码子298位谷氨酸被天门冬氨酸替代,影响酶的空间结构与活性下降,通过降低NO的生成,调节血管舒张,抑制血小板及单核细胞的黏附,抑制血管平滑肌细胞增殖[3]。在DN中,eNOS基因多态性通过产生异常NO水平影响血压改变和动脉粥样硬化,对肾脏的保护作用减弱而加速DN的进展。在我国人群中,G894T突变是一种常见的eNOS基因变异。此次Meta分析中纳入7项我国人群的研究,共包含571名T2DM患者与731名T2DN患者。但所有T2DM患者中均未检测到基因型TT,仅有1例T2DN患者属于基因型TT。在多重亚组分析中,我国人群T2DN组基因型GG频率明显低于T2DM组,而基因型GT与等位基因T频率显著高于T2DM组,且结果均无统计学异质性。因此,eNOS中G894T突变可能是我国人群T2DN的危险因素与恶化因子,但需将来进一步证实。
本研究进行了多项亚组分析,包括-平衡、不同人群、不同种族等,尽量减小样本差异导致的研究缺陷。eNOS中G894T基因多态性可能与T2DN发病存在联系,而样本质量、对照人群的选择可能是影响此次Meta分析结果的因素,深入探讨时需要在种族、地域分类基础上进行大规模、大样本的针对性研究。
[1] OLIVEIRA-PAULA G H, LACCHINI R, TANUS- SANTOS J E. Clinical and pharmacogenetic impact of endothelial nitric oxide synthase polymorphisms on cardiovascular diseases[J]. Nitric Oxide, 2016, 63(2): 39–51.
[2] MORRIS B J, GLENN C L, WILCKEN D E, et al. Influence of an inducible nitric oxide synthase promoter variant on clinical variables in patients with coronary artery disease[J]. Clin Sci, 2001, 100(5): 551–556.
[3] MORIDAIRA K, YANAGISAWA H, NODERA M, et al. Enhanced expression of vsmNOS mRNA in glomeruli from rats with unilateral ureteral obstruction[J]. Kidney Int, 2000, 57(4): 1502.
[4] AHLUWALIA T S, AHUJA M, RAI T S, et al. Endothelial nitric oxide synthase gene haplotypesand diabetic nephropathy among Asian Indians[J]. Mol Cell Biochem, 2008, 314(1–2): 9–17.
[5] CAI H, WANG X, COLAGIURI S, et al. A common Glu298-Asp (894G-T) mutation at exon 7 of the endothelial nitric oxidesynthase gene and vascular complications in type 2 diabetes[J]. Diabetes Care, 1998, 21(12): 2195–2196.
[6] CHEEMA B S, KOHLI H S, SHARMA R, et al. Endothelial nitric oxide synthase gene polymorphisms and renal responsiveness to RAS inhibition therapy in type 2 diabetic Asian Indians[J]. Diabetes Res Clin Pract, 2013, 99(3): 335–342.
[7] DAI H S, ZHANG Y. An association study of MTHFR and eNOSgenes polymorphism with diabetic nephropathy[J]. Chin J Trauma Disabil Med, 2012, 20(6): 4–6.
[8] DONG Y H, QU S P, LV W S, et al. Gene polymorphism inchromosome 7q35 and susceptibility to diabetic nephropathy[J]. Chin J Endocrinol Metab, 2005, 21(1): 47–50.
[9] EL-DIN BESSA S S, HAMDY S M. Impact of nitric oxide synthase Glu298Asp polymorphism on the development of end-stage renaldisease in type 2 diabetic Egyptian patients[J]. Ren Fail, 2011, 33(9): 878–884.
[10] EZZIDI I, MTIRAOUI N, MOHAMED M B, et al. Association of endothelial nitric oxide synthase Glu298Asp, 4b/a, and −786T>C gene variants with diabetic nephropathy[J]. J Diabetes Complicat, 2008, 22(5): 331–338.
[11] JAFARI Y, RAHIMI Z, VAISIRAYGANI A, et al. Interaction of eNOS polymorphism with MTHFR variants increase the risk of diabetic nephropathy and its progression in type 2 diabetes mellitus patients[J]. Mol Cell Biochem, 2011, 353(1–2): 23–34.
[12] LI C G, LV S Y, QI Y Q, et al. Association study of 894G-T mutation at exon 7 of endothelial nitric oxide synthasegene and diabetic nephropathy with hypertension[J]. Acta Acad Med Qingdao Univ, 2004, 40(3): 200–202.
[13] LI X N, YU M X, WU X Y, et al. Association of endothelial nitric oxide synthase gene Glu298Asp polymorphism with diabetic kidney disease[J]. J Clin Nephrol, 2011, 11(8): 351–353.
[14] LV W S, DONG Y H, WANG H Y, et al. A study of theassociation between polymorphism of endothelial nitric oxidesynthase gene and diabetic nephropathy[J]. Chin J Diabetes, 2002, 10(2): 81–84.
[15] MA J R, YU D M, LIU D M. Study on the relationship between G894T mutation in endothelial constitutive nitric oxide synthase (ecNOS) gene and diabetic nephropathy[J]. Tianjin Med J, 2006, 34(8): 527–530.
[16] MACKAWY A M, KHAN A A, MELS B. Association of the endothelial nitric oxide synthase gene G894T polymorphism with the risk of diabetic nephropathy in Qassim region, Saudi Arabia-A pilot study[J]. Meta Gene, 2014, 2: 392–402.
[17] MOLLSTEN A, WESSMAN M, SVENSSON M, et al. Glu298Asp and NOS4ab polymorphisms in diabetic nephropathy[J]. Ann Med, 2006, 38(7): 522–528.
[18] MOLLSTEN A, LAJER M, JORSAL A, et al. The endothelial nitricoxide synthase gene and risk of diabetic nephropathy and development of cardiovascular disease in type 1 diabetes[J]. Mol Genet Metab, 2009, 97(1): 80–84.
[19] NARNE P, PONNALURI K C, SINGH S, et al. Association of the genetic variants of endothelial nitric oxide synthase gene with angiographically defined coronary artery disease and myocardial infarction in South Indian patients with type 2 diabetes mellitus[J]. J Diabetes Complications, 2013, 27(3): 255–261.
[20] RAHIMI Z, VAISI-RAYGANI A, RAHIMI Z, et al. Concomitant presence of endothelial nitric oxide 894T and angiotensin Ⅱ-converting enzyme D alleles are associated with diabetic nephropathy in a Kurdish population from Western Iran[J]. Nephrology (Carlton), 2012, 17(2): 175–181.
[21] RAO G F, CHEN E F, LIN H Y, et al. The correlation of eNOS gene polymorphism and susceptibility to diabetic nephropathy[J]. China Modern Doctor, 2012, 50(7): 49–50.
[22] SANTOS K G, CRISPIM D, CANANI L H, et al. Association of eNOS gene polymorphisms with renal disease in Caucasians with type 2 diabetes[J]. Diabetes Res Clin Pract, 2011, 91(3): 353–362.
[23] SHIN S Y, BAEK S H, CHANG K Y, et al. Relations between eNOS Glu298Asp polymorphism and progression of diabetic nephropathy[J]. Diabetes Res Clin Pract, 2004, 65(3): 257–265.
[24] SHOUKRY A, SHALABY S M, ABDELAZIM S, et al. Endothelial nitricoxide synthase gene polymorphisms and the risk of diabeticnephropathy in type 2 diabetes mellitus[J]. Genet Test Mol Biomarkers, 2012, 16(6): 574–579.
[25] TAMEMOTO H, ISHIKAWA S E, KAWAKAMI M. Association of the Glu298Asp polymorphism of the eNOS Gene with ischemic heartdisease in Japanese diabetic subjects[J]. Diabetes Res Clin Pract, 2008, 80(2): 275–279.
[26] TIWARI A K, PRASAD P, THELMA B K, et al. Oxidative stress pathway genes and chronic renal insufficiency in Asian Indians with type 2diabetes[J]. J Diabetes Complications, 2009, 23(2): 102–111.
[27] LI Y. A comparison of tests for Hardy-Weinberg equilibrium in national genetic household surveys[J]. BMC Genet, 2013, 14(1): 14.
[28] MAYO O. A century of Hardy-Weinberg equilibrium[J]. Twin Res Hum Genet, 2008, 11(3): 249–256.
Meta-analysis of the relationship between endothelial nitric oxide synthase G894T gene polymorphism and type 2 diabetic nephropathy
XU Shizhang, XIE Minjuan
1.Department of Nephrology, the People’s Hospital of Yichun City, Yichun 336000, Jiangxi, China; 2.Department of Pathology, Yichun University, Yichun 336000, Jiangxi, China
To assess the relation of endothelial nitric oxidesynthase (eNOS) G894T with diabetic nephropathy in type 2 diabetic nephropathy (T2DN).To search from the database of PubMed, Cochrane Library, EMBASE, Science Citation Index, Wiley Online Library, Google Scholar, China National Knowledge Infrastucture, China Biology Medicine, Wanfang Data, China science and technology journal, obtainliteratures according to the selection criteria, extract relevant data and perform statistical analysis by Review Manager5.1 and Stata12.0. Meta analysis of differences in frequency between related geno types and alleles.The study searched 23 literatures including 4655 T2DN and 4093 type 2 diabetes mellitus (T2DM). ①In group of T2DN, the frequency of TT genotype (=1.39, 95%: 1.10−1.76,<0.01) and GT genotype (=1.33, 95%: 1.13−1.57,<0.01) were higher than T2DM group, the frequency of GG genotype was lower than T2DM group (=0.66, 95%: 0.55−0.79,<0.01). However, there was an obviousheterogeneity in the publications. ② In group of T2DN, the frequency of T allele was higher than T2DM (=1.41, 95%: 1.21−1.65,<0.01). ③The subgroup analysis of Chiness show frequency of GT genotype (=2.37, 95%: 1.81−3.09,<0.01) and T allele (=2.07, 95%: 1.62−2.65,<0.01) were higher thanT2DM, the frequency of GG genotype was lower thanT2DM (=0.42, 95%: 0.32−0.55,<0.01). Importantly, there was no statistical heterogeneity in the results. ④Two literatures did not meet Hardy-Weinberg equilibrium. However, it did not bias the study by sensitive analysis.The polymorphism of eNOS G894T gene may be associated with the pathogenesis of T2DN.
Type 2 diabetes mellitus; Diabetic nephropathy; Nitric oxidesynthase; Gene polymorphism; Meta-analysis
R692
A
10.3969/j.issn.1673-9701.2023.30.005
江西省卫生健康委科技计划项目(20204732)
谢敏娟,电子信箱:380746203@qq.com
(2022–09–20)
(2023–10–10)
