高效薄层色谱、薄层质谱和HPLC指纹图谱联用技术鉴定杜仲不同部位的化学成分差异
2023-11-08张建青果德安
刘 星,王 玲,姚 帅,张建青,果德安*
高效薄层色谱、薄层质谱和HPLC指纹图谱联用技术鉴定杜仲不同部位的化学成分差异
刘 星1, 2,王 玲2,姚 帅2,张建青2,果德安1, 2*
1. 南京中医药大学药学院,江苏 南京 210023 2. 中国科学院上海药物研究所,中药标准化技术国家工程研究中心,上海 201203
建立杜仲不同部位的高效薄层色谱(high performance thin layer chromatography,HPTLC)、高效薄层质谱鉴别方法(TLC/MS)和高效液相色谱(HPLC)指纹图谱,比较杜仲皮、叶、雄花、种子的差异,寻找差异性成分,并互相验证,用于杜仲的质量控制。通过优化供试品制备、展开剂和显色剂等条件,建立杜仲皮的HPTLC,并将该方法应用于杜仲皮、叶、雄花、种子的区分,寻找差异性斑点;利用QTOF/MS对4个部位的HPTLC斑点进行鉴定,明确差异性成分;采用HPLC建立杜仲皮、叶、雄花、种子的指纹图谱,采集多批次数据,利用偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)筛选对4个部位区分贡献较大的差异性成分,与薄层色谱和薄层质谱鉴定结果互相验证。自建HPTLC鉴别方法优于各国药典,可清晰地实现4个部位的区分;利用QTOF/MS对主要斑点进行分析,共鉴定27个成分,其中10个成分通过对照品确认;基于HPLC的PLS-DA多元统计分析筛选出14个差异性成分(VIP>1)。松脂醇二葡萄糖苷在HPTLC、TLC/MS和HPLC检测技术下均鉴定为杜仲皮的特异性成分;ulmoidoside A、ulmoidoside B、ulmoidoside C、ulmoidoside D是种子中稳定的差异性标志物;对于叶和花的鉴别,3种鉴别方式所得到的差异性标志物差别较大,叶中共找到7个标志物,花中共找到9个标志物。建立的高效薄层色谱、薄层质谱和HPLC指纹图谱方法均可实现杜仲皮、叶、雄花、种子的区分,联用技术寻找到的差异性成分为杜仲及其中成药质量控制指标的选择奠定基础。
杜仲;不同部位;薄层色谱;薄层质谱;指纹图谱;多元统计分析;松脂醇二葡萄糖苷
杜仲Oliv.为杜仲科杜仲属多年生落叶乔木,是我国传统药用植物。其干燥树皮是名贵中药杜仲,干燥叶是另一味中药杜仲叶。2者都被收载于《中国药典》2020年版中,具有补肝肾、强筋骨的功效,用于治疗肝肾不足、腰膝酸痛等[1]。杜仲树需生长15年以上其树皮方可做药用,药用资源紧张[2]。近年来,人们对杜仲非传统药用部位叶、雄花、种子的化学成分和药理作用开展了系统的研究[3-6]。杜仲皮、叶、雄花、种子化学成分相似,主要为木脂素类、环烯醚萜类、黄酮类、苯丙素类[7-8]。市场上植物提取物、中药制剂、保健品中存在药用部位与非药用部位相互掺杂的现象。因此有必要建立区分杜仲不同部位的质量控制方法。
目前报道的文献大多是针对杜仲皮建立薄层色谱鉴别[9-10]或指纹图谱鉴别方法[11-13],尚未有文献建立薄层色谱质谱或指纹图谱鉴别方法对杜仲皮、叶、雄花、种子4个部位同时进行区分,本研究从高效薄层色谱(high performance thin layer chromatography,HPTLC)、薄层质谱(thin layer chromatography-mass spectrometry,TLC/MS)、HPLC指纹图谱3个层面建立杜仲不同部位的分析方法,并结合偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)等化学模式识别方法,揭示杜仲不同部位间的差异,为杜仲药材质量控制及评价提供参考依据。
1 仪器与材料
1.1 仪器
HPTLC系统(瑞士卡玛公司),包括薄层自动点样仪ATS4、薄层成像仪VISUALIZER、薄层自动展开仪ADC2、薄层自动浸渍器、薄层板加热器III和visionCATS工作站;Waters ACQUITY Arc高效液相色谱仪(美国Waters公司),配有二元泵、柱温箱、样品管理器、PDA 2998检测器;UPLC-QTOF/MS系统由Waters ACQUITY UPLC型超高效液相色谱仪和Waters Xevo G2-S Q-TOF质谱仪组成;Quintix 224-1CN-1型电子天平(赛多利斯北京有限公司);Milli-Q Integral型超纯水系统(美国默克公司);P180H超声波水浴锅(德国埃尔玛公司)。
1.2 药物与试剂
对照品松脂醇二葡萄糖苷(批号8963)、松脂醇单葡萄糖苷(批号9285)、丁香树脂醇双葡萄糖苷(批号8792)、京尼平苷(批号8598)、京尼平苷酸(批号1241)、车叶草苷酸(批号9614)、桃叶珊瑚苷(批号7683)均购自上海诗丹德生物技术有限公司;杜仲树脂酚双葡萄糖苷(批号PS012113)购自成都普思生物科技股份有限公司,以上对照品质量分数均大于98%;绿原酸(批号110753-202018,96.1%)、芦丁(批号100080-202012,91.6%)均购自中国食品药品检定研究院;液相分析试剂用乙腈为色谱纯(美国霍尼韦尔公司);磷酸为分析纯(上海阿拉丁生化科技股份有限公司);样品制备及薄层展开用甲醇、二氯甲烷、冰醋酸等溶剂均为分析纯(国药集团上海化学试剂有限公司)。
1.3 样品
共收集15批杜仲皮、9批杜仲叶、10批杜仲雄花、9批杜仲种子,样品产地见表1。药材均由上海药物研究所中药现代化中心姚帅高级实验师通过性状、显微等鉴定为杜仲.Oliv.。
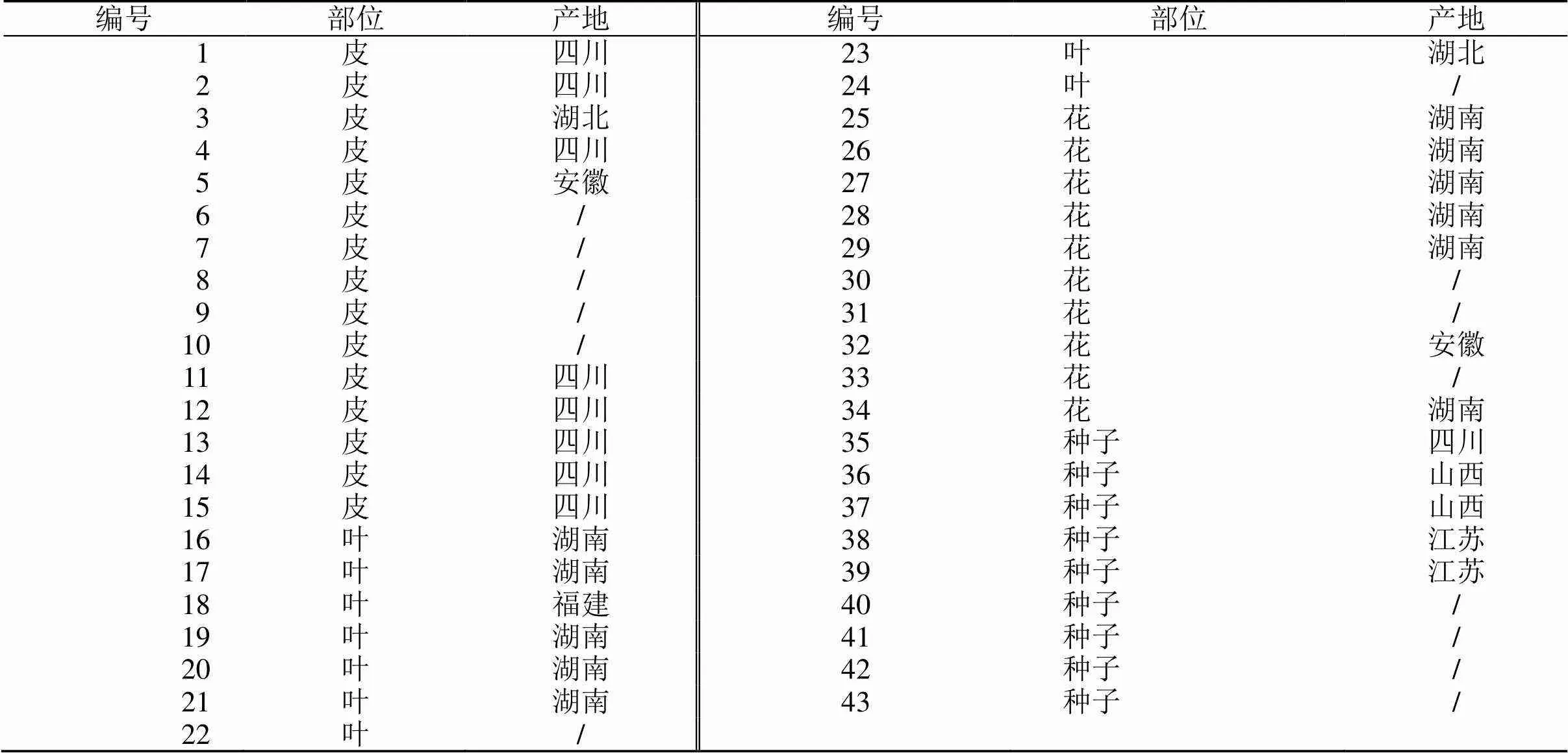
表1 杜仲皮、叶、雄花、种子样品信息
2 方法
2.1 TLC/MS分析
2.1.1 对照品溶液的制备 称取对照品松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香树脂醇双葡萄糖苷、京尼平苷酸、车叶草苷酸、桃叶珊瑚苷适量,加甲醇溶解配成质量浓度分别为0.25、0.25、0.25、0.50、0.50、0.50 mg/mL的对照品溶液,即得。
2.1.2 薄层色谱供试品溶液的制备 精密称取杜仲皮、叶、雄花、种子粉末(过3号筛)约0.5 g,加甲醇5 mL,超声处理(功率1130 W,频率37 kHz)15 min,14 000 r/min离心10 min,取上清液作为供试品溶液。
2.1.3 质谱供试品溶液的制备 取已展开的高效薄层板,沿展开方向剪取部分条带,经显色后置可见光下检视定位斑点,未显色部分按定位结果刮取对应斑点,加50%甲醇1 mL超声处理30 min,14 000 r/min离心10 min,取上清液作为供试品溶液。
2.1.4 薄层色谱条件 采用超高效薄层色谱板G60 F254(20 cm×10 cm,Merck,Darmstadt,德国)。吸取对照品、供试品溶液各10 μL,以条带状方式点样于高效薄层板上,以二氯甲烷-冰醋酸-甲醇-水(15∶6∶2∶2)为展开剂,展开,取出,晾干;以10%硫酸乙醇为显色剂,浸10%硫酸乙醇之后105 ℃加热5 min显色,置可见光下检视。
2.1.5 质谱条件 电喷雾ESI源,负离子模式检测;毛细管电压1.0 kV;锥孔电压40 V;source offset 80 V;离子源温度100 ℃;脱溶剂温度450 ℃;脱溶剂体积流量800 L/h;质谱扫描方式为Fast DDA,扫描范围为100~1500,扫描时间0.20 s;碰撞能设置为低质量端裂解能量10~20 V,高质量端裂解能量40~50 V。
2.2 HPLC分析
2.2.1 对照品溶液的制备 精密称取对照品松脂醇二葡萄糖苷、松脂醇单葡萄糖苷、丁香树脂醇双葡萄糖苷、杜仲树脂酚双葡萄糖苷、京尼平苷、京尼平苷酸、绿原酸、芦丁适量,加甲醇溶解配成质量浓度分别为50、50、100、50、50、100、100、100 μg/mL的对照品溶液。
2.2.2 供试品溶液的制备 精密称取杜仲皮、叶、雄花、种子细粉(过3号筛)0.6 g,加50%甲醇20 mL,称定质量,超声处理(功率1130 W,频率37 kHz)30 min,放冷,再称定质量,用50%甲醇补足减失的质量,14 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜滤过,取续滤液即得。
2.2.3 色谱条件 采用Waters HSS T3(250 mm×4.6 mm,5 μm)色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~48 min,5%~21% A;48~60 min,21%~36% A)。柱温为30 ℃,体积流量为1.0 mL/min,进样量为10 μL,检测波长为230 nm。
3 结果与分析
3.1 HPTLC方法的优化
对HPTLC供试品制备方式、展开剂和显色剂进行了优化。以杜仲皮为对象,比较了《香港中药材标准》《韩国药典》和《欧洲药典》中的供试品制备方式以及4种自建的制备方法,具体见表2。
不同迭代下,3种算法的MAPE的性能对比如图2所示。由图2可知,随着迭代次数的增加,3种模型的错误率都逐渐下降,这是由于随着训练次数增加网络参数的分布越来越接近最小值点。但是BP网络在达到一定的训练次数后错误率出现震荡并且有逐渐增加的趋势,而SVM和高斯过程回归的错误率稳定下降,这间接的证明了这两种算法可以使网络初始参数的分布区域更加接近最小值点,并且有效地避免了局部震荡。对比这两类算法,高斯过程回归算法错误率更低,效率更高。

表2 供试品制备方法
结果表明,不同提取方式在不同显色剂下得到的图谱轮廓具有较大差异,其中方法《韩国药典》、自建方法1、2得到成分较为丰富,自建方法1(甲醇超声处理15 min)相比于其他制备方法操作简便省时,背景干扰较小,因此作为最终供试品制备方式。色谱条件方面考察二氯甲烷-甲醇-甲酸(30∶10∶1)、三氯甲烷-甲醇-水(10∶5∶1)、甲苯-乙酸乙酯-甲酸(65∶35∶1)、二氯甲烷-甲醇-冰醋酸-水(15∶2∶6∶2)4种展开剂对杜仲薄层分离的影响,结果表明展开剂三氯甲烷-甲醇-水(10∶5∶1)和二氯甲烷-甲醇-冰醋酸-水(15∶2∶6∶2)获得的薄层斑点较多,斑点细窄。进一步考察了硫酸-水(2∶8)、稀硫酸试液、茴香醛试液、10%硫酸乙醇试液等显色剂,结果表明,采用10%硫酸乙醇试液显色剂获得条带清晰、斑点分离度好,因此最终选择二氯甲烷-甲醇-冰醋酸-水(15∶2∶6∶2)用于杜仲药材的薄层分析,结果见图1。
3.2 杜仲不同部位的HPTLC及区分
采用上述供试品制备和色谱条件,对杜仲皮、叶、雄花、种子进行分析,代表性样品结果如图2所示。从整体上看,杜仲皮和种子的斑点较少,叶和花的斑点较多。薄层板底部的斑点(Rf=0.10、0.14、0.17,棕色)以及Rf=0.36处的红褐色斑点在皮、叶中均可观察到;在杜仲皮中,Rf=0.32处的棕色斑点在叶、雄花、种子中观察不到,可作为区分皮与其他部位的特征斑点;在杜仲叶中,除了Rf值在0.1~0.2的棕色斑点以及Rf=0.36的斑点外,还可以观察到Rf=0.27(棕色),Rf=0.54(红褐色),Rf=0.85(红褐色)处几个颜色较深的主斑点,说明这些成分在叶中的含量较高,其中Rf=0.85处的红褐色斑点仅存在于杜仲叶中可作为其特征斑点。在杜仲雄花中,斑点Rf=0.1(黑色),Rf=0.24(红褐色),Rf=0.36(红褐色),Rf=0.45(紫色)为主要斑点,但杜仲种子在Rf=0.1和Rf=0.24,杜仲皮和叶在Rf=0.36存在与花颜色相近的斑点,因此将Rf=0.45的紫色斑点作为花的特征斑点。此外,Rf=0.38处的细蓝棕色斑点,Rf=0.63处的黄色斑点以及Rf=0.67和Rf=0.71处的2个紫色斑点仅存在于杜仲雄花中,也可以作为其特征斑点。在种子中,斑点较少且颜色相近,主要集中于薄层板的下三分之一处,与其他部位的条带轮廓差异较大。各个薄层斑点通过质谱进行鉴别并用对照品进行进一步验证,见表3。

A-展开剂为二氯甲烷-甲醇-甲酸(30∶10∶1),显色剂为硫酸-水(2∶8) B-展开剂为三氯甲烷-甲醇-水(10∶5∶1),显色剂为稀硫酸试液 C-展开剂为甲苯-乙酸乙酯-甲酸(65∶35∶1),显色剂为茴香醛试液 D-展开剂为二氯甲烷-甲醇-冰醋酸:水(15∶2∶6∶2),显色剂为10%硫酸乙醇试液;条带1、2、3、4、5、6、7的供试品制备方式分别对应文中所述的《香港中药材标准》《韩国药典》《欧洲药典》及4种自建方法
3.3 杜仲不同部位的TLC/MS鉴定及区分
通过质谱对薄层色谱得到的主要斑点和差异性斑点进行鉴定,进一步明确杜仲皮、叶、雄花、种子所含成分的差异。取“2.1.3”项下制备的4个部位斑点的供试品溶液,进行UPLC-QTOF/MS分析,共检测到31个成分,杜仲皮的薄层斑点检测到7个成分(图3),主要是木脂素类;杜仲叶、雄花的薄层斑点各检测到17个成分(图4、5),主要是黄酮类;杜仲种子的薄层斑点检测到9个成分(图6),主要是环烯醚萜类。从4个部位共鉴定了27个成分,举例说明具体鉴定过程:斑点p4(Rf=0.32),一级质谱图可见加和离子峰727.242 0([M-H+HCOOH]−)和准分子离子峰681.240 8([M-H]−),二级质谱图中可见519.186 3([M-H-Glc]−)、357.133 6([M-H-2Glc]−)、151.038 7([M-H-C24H34O13]−)等碎片,151.038 7是四氢呋喃环裂解后形成的特征离子,根据这些碎片信息初步将斑点p4(Rf=0.32)鉴定为松脂醇二葡萄糖苷,用该对照品进行验证,薄层板上相同Rf值处出现颜色相同的斑点(图2),鉴定结果可靠准确。斑点p3(Rf=0.36)的TIC图中可见3个色谱峰,对应的母离子分别为373.114 1([M-H]−),787.267 3([M-H+HCOOH]−),520.179 4([M-H]−),根据它们的一级和二级质谱信息,推测该斑点可能含有京尼平苷酸、丁香树脂醇双葡萄糖苷、eucomoside B,用对照品进行验证(图2),斑点p3(Rf=0.34)含有丁香树脂醇双葡萄糖苷、京尼平苷酸,由于没有eucomoside B对照品,所以该成分未进行验证。鉴定的27个成分中共有6个成分用对照品在薄层板上进行了验证(图2)。
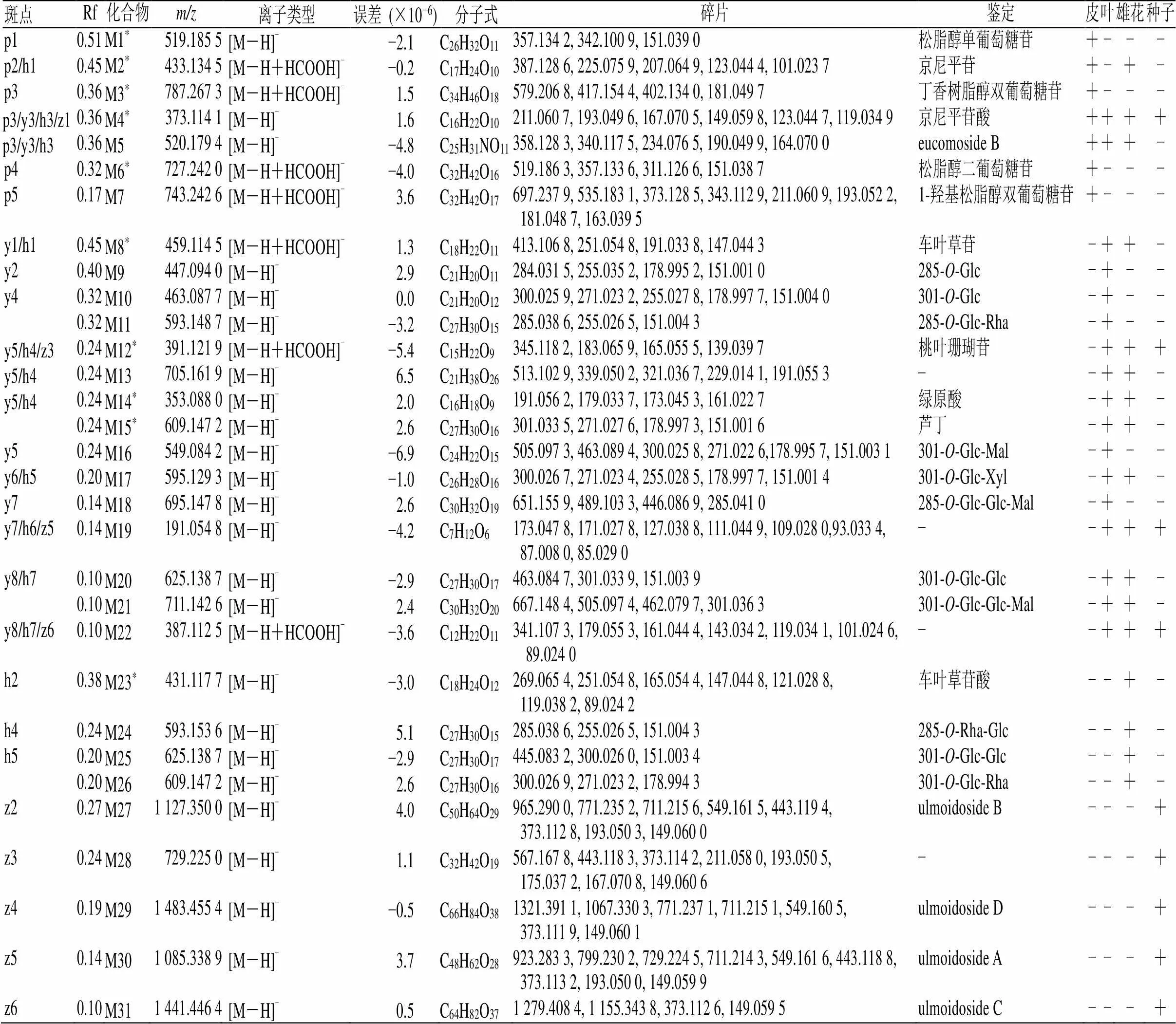
表3 杜仲不同部位斑点的质谱信息
*表示与对照品比对确认 “+”-检测到 “−”-未检测到
“*” refers to the compound identified by comparing with reference standard “+”- detected “-”-not detected

图3 杜仲皮的TLC/MS图谱

图4 杜仲叶的TLC/MS图谱
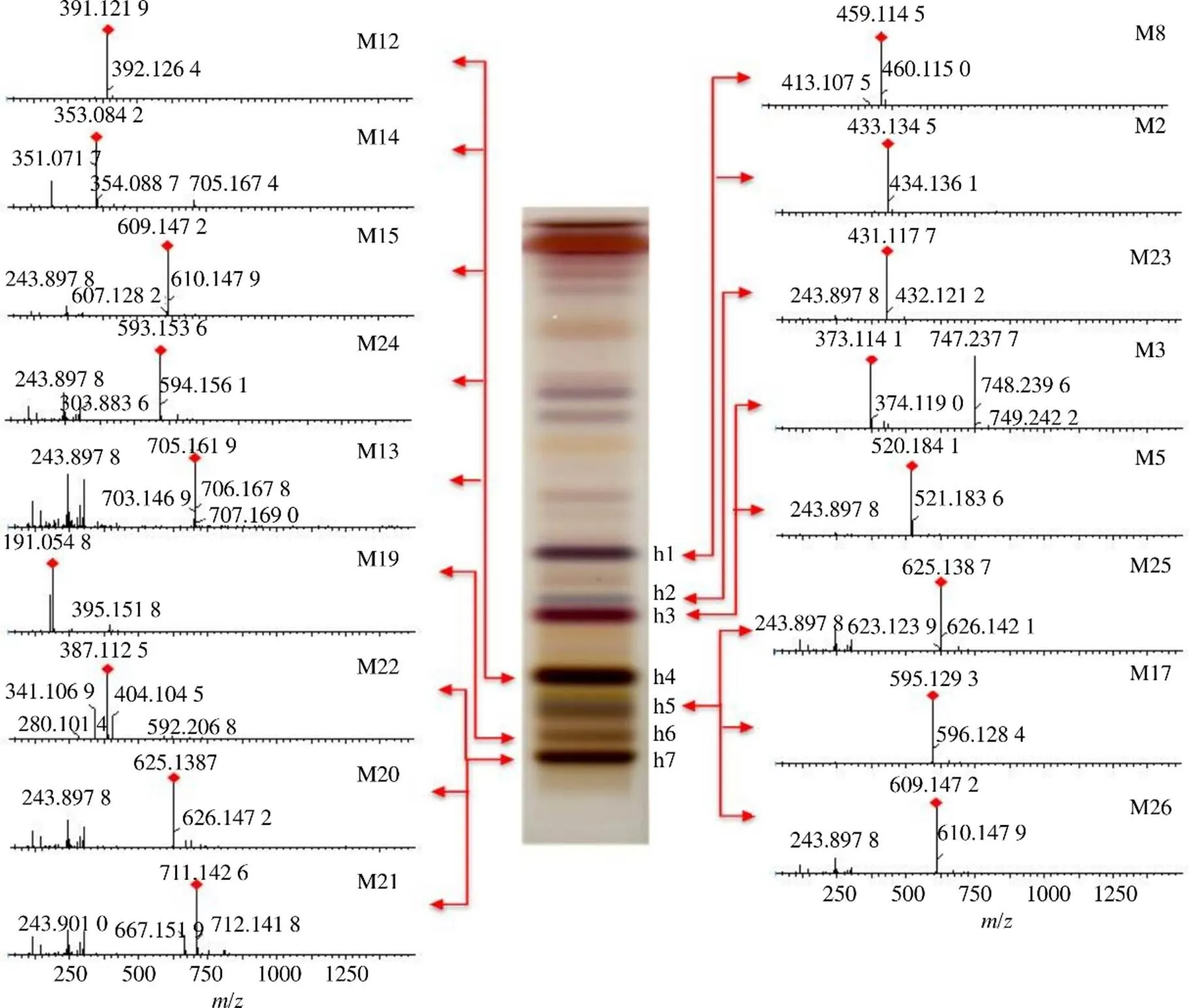
图5 杜仲雄花的TLC/MS图谱

图6 杜仲种子的TLC/MS图谱
京尼平苷酸是4个部位的共有成分,eucomoside B是皮、叶、花的共有成分,桃叶珊瑚苷、191.054 8、387.112 5是叶、花、种子的共有成分。化合物M1:松脂醇单葡萄糖苷、M3:丁香树脂醇双葡萄糖苷、M6:松脂醇二葡萄糖苷、M7:1-羟基松脂醇双葡萄糖苷仅存在于杜仲皮中。化合物M9:285--Glc(447.094 0)、M10:301--Glc(463.087 7)、M11:285--Glc-Rha(593.148 7)、M16:301--Glc-Mal(549.084 2)、M18:285--Glc-Glc-Mal(695.147 8)仅存在于杜仲叶中。化合物M23:车叶草苷酸、M24:285--Rha-Glc(593.153 6)、M25:301--Glc-Glc(625.138 7)、M26:301--Glc-Rha(609.147 2)仅存在于杜仲雄花中。化合物M27:ulmoidoside B、M28:729.2250、M29:ulmoidoside D、M30:ulmoidoside A、M31:ulmoidoside C仅存在于杜仲种子。这些差异性成分对应的薄层斑点体现在杜仲皮中p1(Rf=0.51),p3(Rf=0.36),p4(Rf=0.32),p5(Rf=0.17),杜仲叶中y2:(Rf=0.40),y4:(Rf=0.32),y5:(Rf=0.24),y7:(Rf=0.14),杜仲雄花中h2:(Rf=0.38),h4:(Rf=0.24),h5:(Rf=0.20),杜仲种子中z2:(Rf=0.27),z3:(Rf=0.24),z4:(Rf=0.19),z5:(Rf=0.14),z6:(Rf=0.10)。这些差异性的斑点及其对应的质谱信号可作为杜仲不同部位薄层质谱区分的特征。
3.4 杜仲不同部位的HPLC色谱及差异性区分
按照“2.2.3”项方法,采用建立的HPLC指纹图谱方法,对15批杜仲皮、9批杜仲叶、10批杜仲雄花、9批杜仲种子的指纹图谱进行采集。为检测仪器稳定性,每隔6针进1针QC溶液。各部位叠加图谱及对照图谱如图7所示。15批杜仲皮标定了13个共有峰,9批杜仲叶标定了15个共有峰,10批杜仲雄花标定了14个共有峰,9批杜仲种子标定了13个共有峰。4个部位指纹图谱的轮廓图表明杜仲皮中的峰7,杜仲叶中的峰5、6,杜仲雄花中的峰8、9,杜仲种子中的峰10、11、12、13是明显有差异的色谱峰。
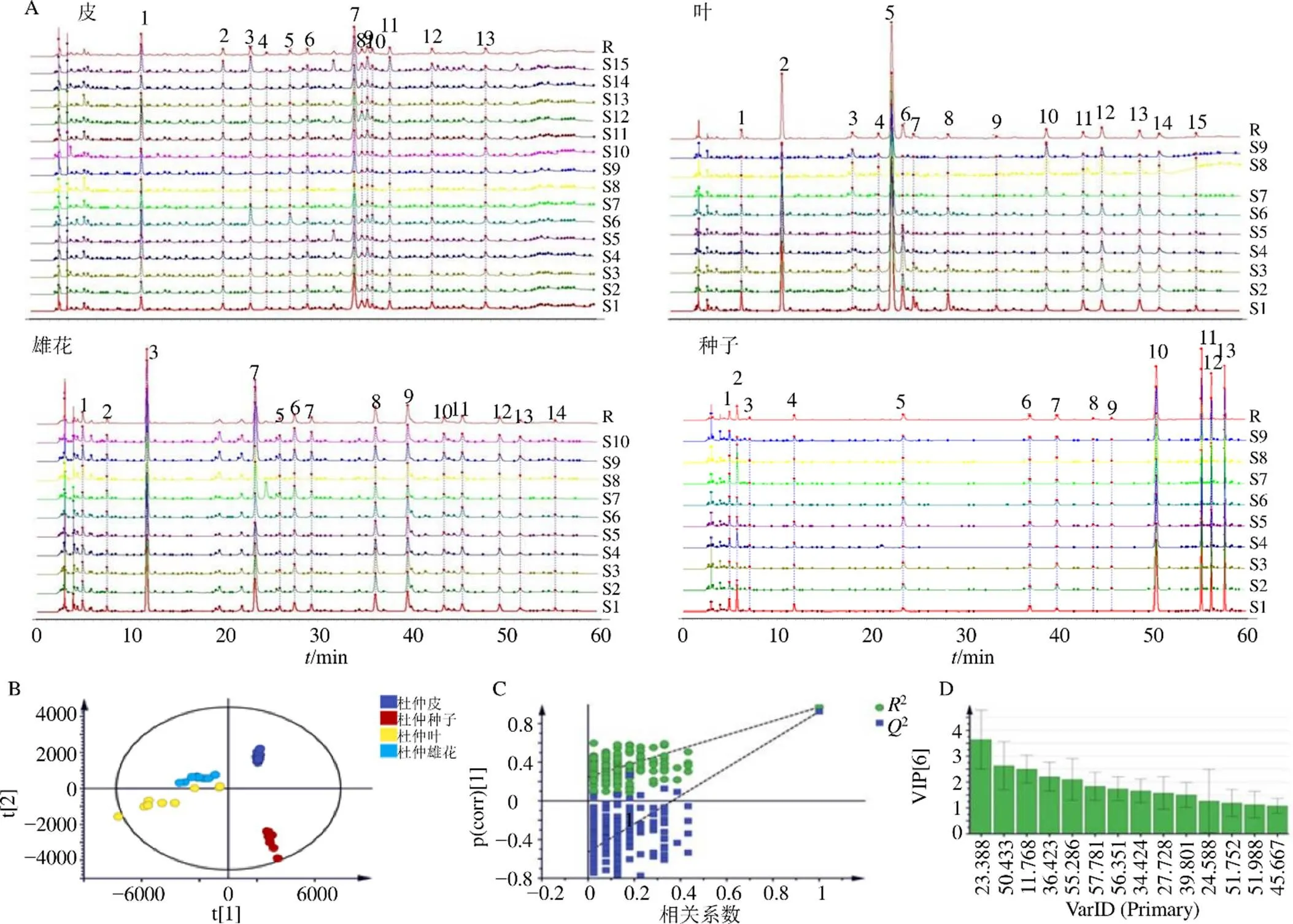
皮:1-京尼平苷酸 5-京尼平苷 7-松脂醇二葡萄糖苷 10-杜仲树脂酚双葡萄糖苷 11-丁香树脂醇双葡萄糖苷 13-松脂醇单葡萄糖苷;叶: 2-京尼平苷酸 5-绿原酸 10-芦丁;雄花:3-京尼平苷酸 4-绿原酸 6-京尼平苷 9-芦丁
为了全面、科学、客观地找寻区分4个部位的差异性成分,将15批杜仲皮,9批杜仲叶,10批杜仲雄花,9批杜仲种子的各色谱峰峰面积导入SIMCA-14.1软件进行多元统计分析。采用PLS-DA模型对数据进行统计分析,标度化方法为Par,自变量累积解释能力参数(2)为0.934,因变量累积解释能力参数(2)为0.972,预测能力参数(2)为0.934,均大于0.5,说明建立模型有较好的解析能力和预测能力。对该模型进行扰动测试,200次验证结果显示,2和2在纵轴的截距分别为0.248,−0.529,说明PLS-DA没有过拟合情况,预测结果可靠(图7-C)。由PLS-DA得分图(图7-B)可知杜仲皮、叶、花、种子样品能够实现很好的区分,说明4个部位之间的化学成分存在差异。以VIP值>1为标准,筛选得到14个差异性成分,分别为皮:峰7(松脂醇二葡萄糖苷,R=34.424 min);叶:峰5(绿原酸,R=23.388 min),峰6(R=24.588 min),峰l4(R=51.752 min),峰12(R=45.667 min);雄花:峰3(京尼平苷酸,R=11.768 min),峰8(R=36.423 min),峰6(京尼平苷,R=27.728 min),峰9(芦丁,R=39.801 min),峰13(R=51.988 min);种子:峰10(ulmoidoside A,R=50.433 min),峰11(ulmoidoside C,R=55.286 min),峰12(ulmoidoside D,R=56.351 min),峰13(ulmoidoside B,R=57.781 min)。综合考虑4个部位指纹图谱的轮廓图中差异明显的色谱峰以及VIP值筛选出的差异性成分,将皮中峰7(松脂醇二葡萄糖苷)作为皮的特征峰;叶中峰6(R=24.588 min)作为叶的特征峰;雄花中峰8(R=36.423 min)作为雄花的特征峰;种子中峰10(ulmoidoside A),峰11(ulmoidoside C),峰12(ulmoidoside D),峰13(ulmoidoside B)作为种子的特征峰。
3.5 HPTLC、TLC/MS和HPLC指纹图谱对杜仲不同部位差异性成分阐述
4 讨论
HPTLC方法是《中国药典》2020年版法定的鉴别手段,尤其随着自动点样仪、自动展开仪、薄层自动浸渍器等全自动仪器的普及,使得传统的薄层色谱也能够实现标准化的操作,增加了薄层色谱的重现性。但薄层色谱仍面临需要主观判断、斑点鉴定难、共流出严重的困境。TLC/MS联用技术很大程度上可以改善这种劣势,在薄层保留时间和斑点颜色的基础上,提供了精确的相对分子质量和碎片信息,增加了新维度的信息,使得鉴定结果更为可靠。

表4 高效薄层色谱、薄层质谱和液相指纹图谱检测到的差异性成分
在杜仲不同部位的鉴定中,利用薄层质谱在叶中找到了5个特征成分,同时检测这5个特征成分,比薄层的1个斑点,液相的1个特征峰的鉴定结果更为客观、可靠。在本研究中,也存在薄层色谱寻找到的差异性斑点未在质谱中检测到的情况,可能是由于该成分质谱响应较差,如叶中Rf=0.85(红褐色)的斑点。
本研究中,由于客观原因,采用的是离线的薄层质谱联用,操作较为复杂,但当薄层和质谱在线联用的时候,则有可能实现标准化操作。考虑到高分辨质谱费用比较昂贵,可以将薄层色谱与低分辨质谱联用,也可以取得类似的结果。薄层质谱联用技术在中药,尤其是在中成药的鉴别方面是一种非常有潜力且容易推广的技术,一方面能够在复杂体系和共流出严重的情况下监控目标化合物,另一方面可实现多味药的同时鉴别,改变《中国药典》中成药中“一味药一薄层方法”现状,缩短检测时间和检测成本。
利益冲突 所有作者均声明不存在利益冲突
[1]中国药典[S]. 一部. 2020: 173.
[2]郭姝, 刘杰, 李娜, 等. 指纹图谱结合一测多评法评价杜仲叶代替杜仲皮的可行性 [J]. 中药材, 2020, 43(4): 896-902.
[3]Luo L F, Wu W H, Zhou Y J,. Antihypertensive effect ofOliv. extracts in spontaneously hypertensive rats [J]., 2010, 129(2): 238-243.
[4]He M Z, Jia J, Li J M,. Application of characteristic ion filtering with ultra-high performance liquid chromatography quadrupole time of flight tandem mass spectrometry for rapid detection and identification of chemical profiling inOliv [J]., 2018, 1554: 81-91.
[5]雒晓梅, 宿美凤, 常晓燕, 等. 基于LC-MS联用的杜仲主要化学成分定性及定量分析 [J]. 中国现代中药, 2019, 21(8): 1029-1040.
[6]Jia J, Liu M, Wen Q,. Screening of anti-complement active ingredients fromOliv. branches and their metabolismbased on UHPLC-Q-TOF/MS/MS [J]., 2019, 1124: 26-36.
[7]冯淼, 王超纯, 凌伟红, 等. 基于指纹图谱和化学模式识别评价杜仲叶质量[J]. 中草药, 2023, 54(9): 2931-2939.
[8]Wang C Y, Tang L, He J W,. Ethnobotany, phytochemistry and pharmacological properties of: A review [J]., 2019, 47(2): 259-300.
[9]韩磊, 邓翀, 宋小妹. 杜仲生品及其炮制品的薄层色谱鉴别 [J]. 黑龙江科技信息, 2015(16): 121.
[10]刘玲, 鲍家科. 杜仲药材薄层色谱鉴别研究 [J]. 中国民族民间医药, 2014, 23(2): 8-9.
[11]范彦博, 袁明洋, 张义生. 四川产杜仲药材高效液相色谱指纹图谱的建立 [J]. 医药导报, 2016, 35(10): 1121-1124.
[12]刘星, 周欣, 周美, 等. 贵州产杜仲高效液相色谱指纹图谱的建立与分析 [J]. 医药导报, 2015, 34(1): 84-88.
[13]资文, 刘韶, 彭应枝. 基于指纹图谱和化学计量学技术筛选张家界产杜仲的标志性成分 [J]. 中药材, 2015, 38(9): 1831-1834.
Chemical variance in different parts ofby HPTLC, TLC/MS and HPLC hyphenated techniques
LIU Xing1, 2, WANG Ling2, YAO Shuai2, ZHANG Jian-qing2, GUO De-an1, 2
1. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. National Engineering Laboratory for TCM Standardization Technology, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
To establish the high performance thin layer chromatography (HPTLC), thin layer chromatography-mass spectrometry (TLC/MS) and high performance liquid chromatography (HPLC) fingerprint for the identification of bark, leaf, flower and seed of Duzhong (Oliv.) and differential components were filtrated and verified for the quality control of.HPTLC method was established by optimizing the sample preparation, mobile phase and derivatization reagent and applied to identify the bark, leaf, male flower, seed ofbased on the specific spots and/or peaks. HPTLC spots in four parts were then identified through quadrupole time of flight mass spectrometry (QTOF/MS) to find the differential components. HPLC was used to establish the fingerprints of bark, leaf, flower and seed of. Partial least squares discriminant analysis (PLS-DA) was used to screen the chemical markers that contributed greatly to the differentiation of the 4 parts based on multiple batches of data and the results were verified with TLC and TLC/MS.HPTLC identification method is the best compared to the method reported in pharmacopoeia from other countries, and can clearly distinguish the four parts. Additionally, the main spots were analyzed by QTOF/MS, and a total of 27 components were identified, 10 of which were confirmed by reference substances. Fourteen differential components (VIP > 1) were screened out by PLS-DA based on HPLC. According to the results obtained by HPTLC, TLC/MS and HPLC, pinoresinol diglucoside were selected as the characteristic component of bark, ulmoidoside A, ulmoidoside B, ulmoidoside C, ulmoidoside D as the robust markers in seed. The differential markers obtained by these three methods varied widely, with seven markers in leaf, nine markers in flower in total.HPTLC, TLC/MS, HPLC methods established could be used to effectively distinguish bark, leaf, flower and seed of, and the screened differential components lay a solid foundation for the selection of quality control indexes ofand its related Chinese patent medicines.
Oliv.; different parts; HPTLC; TLC/MS; HPLC fingerprint; multivariate statistical analysis; pinoresinol diglucoside
R286.2
A
0253 - 2670(2023)21- 7166 - 10
10.7501/j.issn.0253-2670.2023.21.025
2023-03-06
国家自然科学基金青年项目(82003940);岐黄工程首席科学家项目(2020)
刘 星,女,硕士研究生,研究方向为质量控制方法研究。E-mail: 15136456231@163.com
通信作者:果德安,男,研究员,博士生导师,主要从事中药分析与现代质量标准研究。Tel: (021)50271516 E-mail: daguo@simm.ac.cn
[责任编辑 时圣明]
