超声-微波联合提取紫薯花色苷及其稳定性研究
2023-11-07澜蒋雅茵
玉 澜蒋雅茵,张 鹏
(1.广西科技师范学院 食品与生化工程学院,广西来宾 546199;2.广西科技师范学院 功能性食品配料工程技术研究中心,广西来宾 546199)
0 引言
紫薯(Purple Potato)是甘薯的一种特殊品种类型,皮肉呈紫红至深紫,主要产于广西、广东、福建等亚热带地区[1]。近年来,随着人们对新型营养保健食物资源开发热点的追求,紫薯相关产品的研发应用也层出不穷[2]。紫薯含有大量的花色苷(Anthocyanin),相较葡萄、草莓、紫甘蓝和紫苏等其他果蔬中的花色苷,稳定性更强[3],是花色苷色素的良好来源。
花色苷属于多酚类化合物,由花青素与植物体内各种单糖通过糖苷键缩合形成[4]。不仅可用于食品的着色,还具有抗衰老、抗变异及抗肿瘤等许多对人体有益的营养保健作用[5],在食品及医疗领域有极大的开发价值和十分广阔的应用前景。但其结构中含有活泼的酚羟基,稳定性较差,易在强酸、强碱或高温环境中丧失生物活性[6]。目前常用的花色苷提取方法中,超声辅助提取法是利用超声波辐射产生的机械效应和热效应加速花色苷溶解[7];微波辅助提取法是利用高频率微波令细胞内的极性物质吸收大量微波能,利于有机溶剂进入细胞内溶解释放花色苷[8]。这2种辅助提取方法具有不破坏花色苷、提取时间短、效率高和杂质少等优点。
本文将2种辅助提取方法联合,以广西巴马紫薯为研究对象,以乙醇为提取溶剂,考察乙醇体积分数、超声时间、超声功率以及液料比对花色苷提取率的影响,采用响应面法优化提取工艺条件,并考察光照时间、温度变化及pH值对紫薯花色苷提取液稳定性的影响。
1 材料与方法
1.1 材料与试剂
紫薯(品种为巴马紫薯,购自广西巴马瑶族自治县);无水柠檬酸、氯化钠、氯化钾抗坏血酸、结晶乙酸钠、盐酸、无水乙醇等均为国产分析纯。
1.2 仪器与设备
PHS-3C型酸度计(上海智光仪器仪表有限公司);KQ-300DB型数控超声波清洗器(昆山市超声仪器有限公司);XH-100B型微波催化合成仪(北京翔鹄科技发展有限公司);H1850型台式高速离心机(湘仪离心机仪器有限公司);UV-2700型紫外-可见分光光度计(岛津企业管理(中国)有限公司);HH-S6型数显恒温水浴锅(金坛市医疗仪器厂)。
1.3 试验方法
1.3.1 原料预处理
制备紫薯粉末:紫薯洗净去皮切成0.5 cm薄片,用护色剂(0.6%氯化钠、0.6%柠檬酸、0.6%抗坏血酸)浸泡10 min后,置于45 ℃烘箱内60 min,烘干表面水分[9],真空干燥12 h后粉碎过80目筛,将紫薯粉末置于密封袋中低温避光保存。
1.3.2 提取工艺流程
称取2.0 g紫薯粉末,以乙醇-水溶液为提取试剂,按试验方案设计的液料比进行混合后,设置一定的功率、时间条件,分别置于微波合成仪中进行微波辅助提取,再置于超声波清洗仪中超声振动提取后离心作用(4 000 r/min,10 min),即得花色苷提取液。
1.3.3 确定紫薯花色苷最大吸收波长
以去离子水为对照,使用紫外-可见分光光度计,在可见波长400~700 nm范围内对稀释的澄清花色苷提取液进行吸收光谱扫描[10],根据获得的吸收光谱图,确定提取液中花色苷的最大吸收波长为532 nm。
1.3.4 测定花色苷的提取量
采用pH示差法测定紫薯花色苷的提取量[11]。取1 mL紫薯花色苷提取液于10 mL纳氏比色管中,分别用KCl-HCl溶液(pH=1.0)和CH3COONa-HCl溶液(pH=4.5)定容至10 mL,使用分光光度计分别在波长532,700 nm处测定其吸光度A532nm和A700nm,代入式(1)和式(2),利用pH示差法计算花色苷的提取量(Y)[12]:
式中 Mw——矢车菊素-3-O-葡萄糖苷的摩尔质量,449.2 g/mol;
DF——稀释倍数;
V——提取液的总体积,mL;
ε——矢车菊素-3-O-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm);
L——光程,1 cm;
m——样品质量,g。
1.3.5 单因素试验
在固定乙醇体积分数50%,微波功率500 W,微波温度40 ℃,微波时间1.5 min,超声温度40 ℃,超声功率150 W,超声时间30 min,液料比为20:1 mL/g的基础上,进行单因素试验,研究乙醇体积分数(40%,50%,60%,70%,80%)、超声功率(120,150,180,210,240 W)、超声时间(10,20,30,40,50 min)、微波功率(300,400,500,600,700 W)、微波时间(0.5,1,1.5,2,2.5 min)、液料比(15:1,20:1,25:1,30:1,35:1 mL/g)对紫薯花色苷提取量的影响,每个试验重复3次。
1.3.6 响应面试验设计
在单因素试验的基础上,选取乙醇体积分数(A)、超声功率(B)、超声时间(C)及液料比(D)为自变量,花色苷提取量(Y)为响应指标,利用Design-Expert.V8.0.6.1软件中Box-Behnken设计4因素3水平的响应面优化试验,确定紫薯花色苷的最佳提取工艺参数。试验因素与水平设计见表1。

表1 试验设计因素水平表Tab.1 Test design factor level
1.3.7 稳定性试验
(1)光照时间对花色苷稳定性的影响
分别移取10 mL提取液于6支试管,置于日光下,每隔1 h测定试管溶液中花色苷含量,考察光照时间对紫薯花色苷稳定性的影响。
(2)温度对花色苷稳定性的影响
分别移取10 mL提取液于7支试管,放置于设置温度为30,40,50,60,70,80,90 ℃的恒温水浴锅中,1 h后测定试管溶液中的花色苷含量,考察温度变化对紫薯花色苷稳定性的影响。
(3)pH值对花色苷稳定性的影响
分别移取10 mL提取液于9支试管,调节各试管内溶液pH值为1,2,3,4,5,6,7,8,9,观察提取液的颜色变化,考察pH值对紫薯花色苷稳定性的影响。
2 结果与分析
2.1 单因素试验
如图1所示,乙醇体积分数在40%~60%,花色苷提取量呈上升趋势;在60%~80%,提取量缓慢降低。表明乙醇体积分数为60%时,紫薯样品与乙醇-水溶液已充分反应,其中的花色苷充分溶出,提取量达到最大值,为0.820 8 mg/g。故将乙醇体积分数确定为60%。

图1 乙醇体积分数、超声功率和超声时间对紫薯花色苷提取量的影响Fig.1 Effects of ethanol volume fraction,ultrasonic power and ultrasonic time on the extraction amount of anthocyanin from purple potato
在超声功率120~210 W,花色苷提取量保持上升趋势。在超声功率达210 W时,提取液中的花色苷含量达到最大值,为0.808 9 mg/g,此后的提取量急剧下降,原因可能是超声功率过大会造成花色苷结构的变化,导致提取量减少。故将超声功率确定为210 W。
花色苷提取量随着超声时间增加快速增大,超声提取20 min时,提取液中的花色苷含量达到最大值,为0.840 1 mg/g;在20~50 min,花色苷的提取量持续下降。说明继续增加超声时间会使花色苷分子结构遭到破坏,导致其继续分解,提取量减少。故将超声时间确定为20 min。
微波功率、微波时间和液料比对紫薯花色苷提取量的影响如图2所示。

图2 液料比对紫薯花色苷提取量的影响Fig.2 Effect of liquid-solid ratio on extraction amount of anthocyanin from purple potato
微波功率在300~700 W,花色苷提取量呈先上升后下降趋势。微波功率达500 W时,提取量最高,为0.753 1 mg/g。说明随着微波功率升高,导致溶液体系温度过高[13],花色苷结构受到破坏,提取量下降。故将微波功率确定为500 W。
花色苷提取量随着微波时间增加先增大,至1 min时,达到最大值,为0.710 7 mg/g;此后的1~2.5 min,花色苷提取量持续下降。说明随着微波辐射时间延长,提取液中的花色苷发生降解,导致提取量降低。故将微波时间确定为1 min。
花色苷提取量在液料比增至20:1 mL/g时,提取完全,含量达到最大值,为0.739 7 mg/g,此后随着液料比增大,花色苷提取量持续下降。说明乙醇溶剂增加会导致杂质成分的溶出,导致提取量下降。故将液料比确定为20:1 mL/g。
2.2 响应面试验结果
2.2.1 响应面试验设计结果
根据Box-Behnken响应面法优化设计的试验方案,使用Design-Expert软件进行回归分析,得到二次多项式回归方程:Y=1.140 5+0.140 2A+0.042 0B+0.114 2C+0.080 1D-0.047 7AB+0.036 4AC-0.075 3AD+0.01 1BC-0.001 5BD+0.074 6CD-0.1504A2-0.168 5B2-0.203 1C2-0.151 5 D2。
2.2.2 回归模型的方差分析
方差分析与显著性检验见表2。

表2 方差分析与显著性检验Tab.2 Analysis of variance and significance test
模型P<0.000 1,表明回归模型极显著,失拟项P=0.294 9>0.05,表明模型失拟项不显著;模型的相关系数R2=0.952 4,说明模型能够解释95.24%的变化;调RAdj2=0.904 9,表明模型与实测值拟合程度较好。综上所述,可用模型分析预测紫薯花色苷的最优超声-微波联合提取工艺。回归方程一次项A,C,D及二次项A2,B2,C2,D2对花色苷提取量存在极显著地影响,一次项B及交互项AD,CD影响显著,其余因素不显著。考察的4个因素对花色苷提取量的影响顺序依次为乙醇体积分数(A)>超声时间(C)>液料比(D)>超声功率(B)。
2.2.3 各因素交互作用分析
进一步对影响紫薯花色苷提取量的4个因素进行交互作用分析,结合图3各交互作用响应曲面和等高线图可知,乙醇体积分数与液料比、超声时间与液料比交互作用对花色苷提取量影响显著(P<0.05);乙醇体积分数与超声功率、乙醇体积分数与超声时间、超声功率与超声时间、超声功率与液料比交互作用对紫薯花色苷的提取量影响不显著(P>0.05),与方差分析结果一致。

图3 各因素交互作用对花色苷提取量的影响Tab.3 Effect of interaction of various factors on the extraction amount of anthocyanin
2.2.4 确定最佳工艺条件和回归模型验证试验
利用Design-Expert.V8.0.6.1软件中Numerical分析预测出提取紫薯花色苷的最佳工艺参数:乙醇体积分数65.10%、超声时间24.29 min、液料比21.44:1 mL/g、超声功率212.32 W,花色苷提取量的预测值达到1.161 0 mg/g。根据实际试验条件及方案的可行性,调整参数为乙醇体积分数65%、超声时间24 min、液料比21:1 mL/g、超声功率210 W,在此工艺条件下进行提取试验,3次试验结果分别为1.133 8,1.079 9,1.100 9 mg/g,平均值为1.104 9 mg/g(RSD=2.46%),与理论预测值相近,说明模型可信度较高。
2.3 稳定性试验结果
如图4所示,暴露在日光下1~4 h,试管溶液中的花色苷含量出现小幅度降低,后随着光照时间延长,花色苷逐渐降解,含量持续降低。可看出花色苷的稳定性随光照时间增长而减弱,短时间内的光照对花色苷稳定性的影响程度不大。
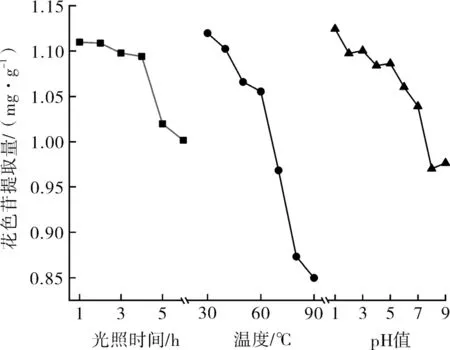
图4 光照时间、温度和pH值对紫薯提取液中花色苷含量的影响Fig.4 Effects of light time,temperature and pH value on anthocyanin content in purple potato extract
试管溶液中花色苷含量随温度升高而降低,在30 ~40 ℃,温度对花色苷稳定性影响程度不大;至60 ℃以后,高温环境使得试管溶液中的花色苷快速分解,导致花色苷含量下降明显。
在酸性条件(pH值为1.0~5.0)下,试管溶液呈红色,花色苷含量随pH值变化较小;在pH值为5.0~8.0,试管溶液呈粉色至紫色,试管溶液中的花色苷含量随pH值增大而大幅度降低,稳定性较差;当pH值达到9.0时,试管溶液呈蓝绿色,花色苷含量随pH值的变化幅度较小。
3 结语
本文采用超声-微波联合提取法提取紫薯中的花色苷,以响应面法对提取工艺进行优化,获得最优工艺参数为乙醇体积分数65%、超声功率210 W、超声时间24 min、液料比21:1 mL/g、微波时间1 min、微波功率500 W,在此工艺下可得最大紫薯花色苷提取量1.104 9 mg/g,高于单独使用超声辅助提取法或微波辅助提取法。稳定性研究结果表明,试管溶液中紫薯花色苷的含量随着光照时间延长、温度升高及pH值的增大均逐渐降低。花色苷在温度高于60 ℃后分解速度加快、稳定性较差,处酸性条件中稳定性较好、碱性条件则易分解,继续延长光照时间也将导致花色苷悉数分解。即表明在较短时间内,光照对花色苷稳定性影响不大,温度和pH值的变化对花色苷稳定性影响较大。
