榆黄蘑菌丝生长条件优化
2023-11-07巫桂芬梁剑柳黄秋婵廖建杰苏美琪
巫桂芬,苏 劲,梁剑柳,黄秋婵,廖建杰,苏美琪
(广西民族师范学院 广西崇左 532200)
榆黄蘑(Pleurotus citrinopileatus)是一种珍稀食(药)用真菌,学名为金顶侧耳,隶属于担子菌门、蘑菇目、侧耳科、侧耳属[1-3]。由于其菌盖显草黄色或鲜黄色,所以又称为金顶蘑或榆黄蘑,其表面光滑、呈漏斗状,历来有“真菌之花”的美称。榆黄蘑味道鲜美,营养丰富,属于高营养、低热量的理想保健品,市场前景广阔[4]。榆黄蘑子实体中含有丰富的活性物质,如多糖、黄酮、蛋白质、维生素等,长期食用,有抗氧化、免疫调节等药用功能[5-7],此外食用榆黄蘑还可预防葡萄球菌、大肠杆菌、肺炎杆菌和肺结核杆菌的感染[8-10]。榆黄蘑符合联合国粮农组(FAO)和世界卫生组织(WHO)关于新食品资源的要求,是一种高营养、低热量、名贵的食药两用真菌,是老年人心血管疾病患者和肥胖症患者的理想保健食品[11-13]。
培养基中碳源、氮源、温度、光照度、pH 值和湿度等条件对食用菌菌丝生长有一定影响[14-16]。林铃等[17]对榆黄蘑菌丝培养基中碳源进行筛选,但未对配方中的碳含量进行优化试验。洪沛等[18]、Wang等[19]归纳总结了光环境三要素(光质、光照度、光照时长)对食用菌生长发育的影响及其可能的调控机制,讨论了食用菌光生理研究中存在的问题。刘妮等[20]、Wu 等[21]研究发现,不同的食用菌菌丝在颜色、形态、菌丝致密程度、满皿时间及平均生长速度等宏观形态上有很大差异。罗莹等[22]、Li 等[23]通过对食用菌菌丝颜色、密度、均匀度、平均生长速率和生长指数进行比较,探讨了7 种不同谷物对试验菌株菌丝生长的影响。我国南方地区关于榆黄蘑栽培的研究不多,尤其是在广西等地对榆黄蘑菌丝生长条件研究甚少[24]。而榆黄蘑菌丝培养直接影响其产量和品质,因此,进行榆黄蘑菌丝生长条件优化尤为重要。笔者采用PDA 培养基培养菌丝,并对其生长过程所需的温度、光照时间、琼脂质量浓度、pH值、碳源、氮源等条件进行优化。采用正交试验方法探究不同条件对榆黄蘑菌丝生长的影响,筛选出榆黄蘑菌丝生长最佳培养条件,以期为榆黄蘑生产提供参考依据。
1 材料与方法
1.1 材料
本试验材料为山东省平邑县食用菌研究所提供的平顶8-31 榆黄蘑,通过组织分离纯化获得菌丝。榆黄蘑子实体菌盖为草黄色至鲜黄色、光滑、漏斗形,边缘内卷,直径3.00~10.00 cm。菌肉白色,菌褶白色、密、延生、不等长。菌柄偏生、白色、内实,长2.00~10.00 cm,粗0.50~1.50 cm,往往基部相连。
1.2 主要仪器设备与试剂
立式压力蒸汽灭菌锅(江阴滨江医疗设备有限公司),光照培养箱(上海慧泰仪器制造有限公司),超净工作台(上海苏净实业有限公司),电子天平(上海佑科仪器仪表有限公司)。
可溶性淀粉、细菌学蛋白胨、牛肉膏、柠檬酸铵、蔗糖、麦芽糖、葡萄糖、硝酸铵、琼脂粉、无水乙醇、维生素B1 等试剂药品均为分析纯。
1.3 方法
试验时间为2021 年6 月21 日至12 月21 日,地点为广西民族师范学院崇智楼。采用完全随机试验设计,共设定6 个单因素处理,每个处理3 次重复,在处理后17 d 统计菌丝生长量,具体设计方案如下。
1.3.1 不同光照时间对菌丝生长的影响 以光照时间为单因素变量,光照时间分别为0、12、24 h。所有处理均采用PDA 培养基在28 ℃恒温环境中培养,观察菌丝浓密程度及测量菌丝生长量。
1.3.2 不同温度对菌丝生长的影响 以温度为变量,分别设定为室温(平均温度25 ℃)、5、28、32、35 ℃。采用PDA 培养基培养,接种完成后将各处理置于相应的培养环境中培养,记录室内早、中、晚各时间段温差变化,观察菌丝浓密程度及测量菌丝生长量。
1.3.3 不同琼脂质量浓度对菌丝生长的影响 以琼脂质量浓度为变量,利用琼脂质量浓度做梯度调节培养基的凝固程度。各处理培养基琼脂质量浓度 分 别 为0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08 g·mL-1。将培养菌丝置于28 ℃恒温环境中培养,观察菌丝浓密程度及测量菌丝生长量。
1.3.4 不同pH 值对菌丝生长的影响 以pH 值为变量,各处理pH 值分别为5.00、5.50、6.00、6.50、7.00、7.50、8.00、8.50。采用PDA 培养基培养,利用酸或碱调节培养基内的pH 值并置于28 ℃恒温环境中培养,观察菌丝浓密程度及测量菌丝生长量。
1.3.5 不同碳源对菌丝生长的影响 以不同碳源为变量,以PDA 培养基为CK,CK 的碳源为马铃薯,其余处理碳源分别为葡萄糖、麦芽糖、蔗糖、可溶性淀粉,处理质量浓度为0.020 g·mL-1。通过分析筛选出最适碳源,再进行碳源梯度试验,其梯度处理分别为0.005、0.010、0.015、0.020、0.025、0.030、0.035 g·mL-1。各处理置于28 ℃恒温环境中培养,观察菌丝浓密程度及测量菌丝生长量。
1.3.6 不同氮源对菌丝生长的影响 以PDA 培养基为CK,在以上优选的碳源培养基中设计不同氮源作为变量,氮源分别为硝酸铵、柠檬酸铵、蛋白胨、牛肉膏,处理质量浓度为0.020 g·mL-1。通过分析筛选出最适氮源,再进行氮源梯度试验,其梯度处理分别为0.005、0.010、0.015、0.020、0.025、0.030、0.035 g·mL-1。各处理置于28 ℃恒温环境中培养,观察菌丝浓密程度及测量菌丝生长量。
1.3.7 正交试验验证 根据单因素试验结果选择温度为25、28、32 ℃,琼脂质量浓度0.010、0.020、0.030 g·mL-1,牛 肉 膏 质 量 浓 度 为0.010、0.015、0.020 g·mL-1,进行3 因素3 水平的正交试验,每个处理设置3 次重复。
1.4 数据处理
采用Excel 2010 计算菌丝各水平的平均生长量及其极差,采用SPSS 20.0 进行正交试验以及显著性分析。
2 结果与分析
2.1 不同光照时间对榆黄蘑菌丝生长的影响
由表1 可知,不同光照时间对榆黄蘑菌丝生长量的影响无显著差异;但暗环境下菌丝转色相对较快(图1)。榆黄蘑在接种的次日菌丝复活,在9~13 d之间菌丝生长速度最快,一般在17~19 d 长满。暗处理的菌丝长满较光处理的菌丝快1~2 d。其中,12 h 光处理的菌丝在9~10 d 出现一次爆发性增长。从菌丝生长形态看,黑暗培养的菌丝生长相对较密,光照时间为12 h 的菌丝生长密度中等,光照时间为24 h 的菌丝较为稀疏。可见光照时间长短影响菌丝生长及转色,而黑暗条件下菌丝生长快且平稳,后期转色快。

图1 不同光照时间对菌丝生长的影响(部分)Fig.1 Effect of different illumination time on hyphae growth(partial)

表1 不同光照时间对菌丝生长的影响Table 1 Effect of different illumination time on hyphae growth
2.2 不同温度对榆黄蘑菌丝生长的影响
由图2 可以看出,不同温度对榆黄蘑的菌丝生长速率影响较大。试验期间室温日平均温度为25 ℃;在生长前4 d 中,由于天气降温,室温处理组中菌丝生长均较慢,28 ℃处理中菌丝扩散较快,室温处理组中菌丝相对较密,35 ℃处理中菌丝旺盛,5 ℃处理中均未有菌丝生长。随着天气的回暖增温,室温处理中的菌丝生长逐渐加快,且相对较密,但在17 d 后所有处理的菌丝停止生长,原因是使用的胶塞为实心胶塞,菌丝生长到一定时间试管内的氧气不足则菌丝出现停止生长现象。从整体上来看,室温菌丝生长受环境温度变化影响较大,在4~9 d 室温环境中的菌丝生长状况优于其他温度处理组,试验结果表明,崇左市当季室温环境有利于菌丝的发菌与吃料,但总体表现为25~28 ℃最适合菌丝生长。
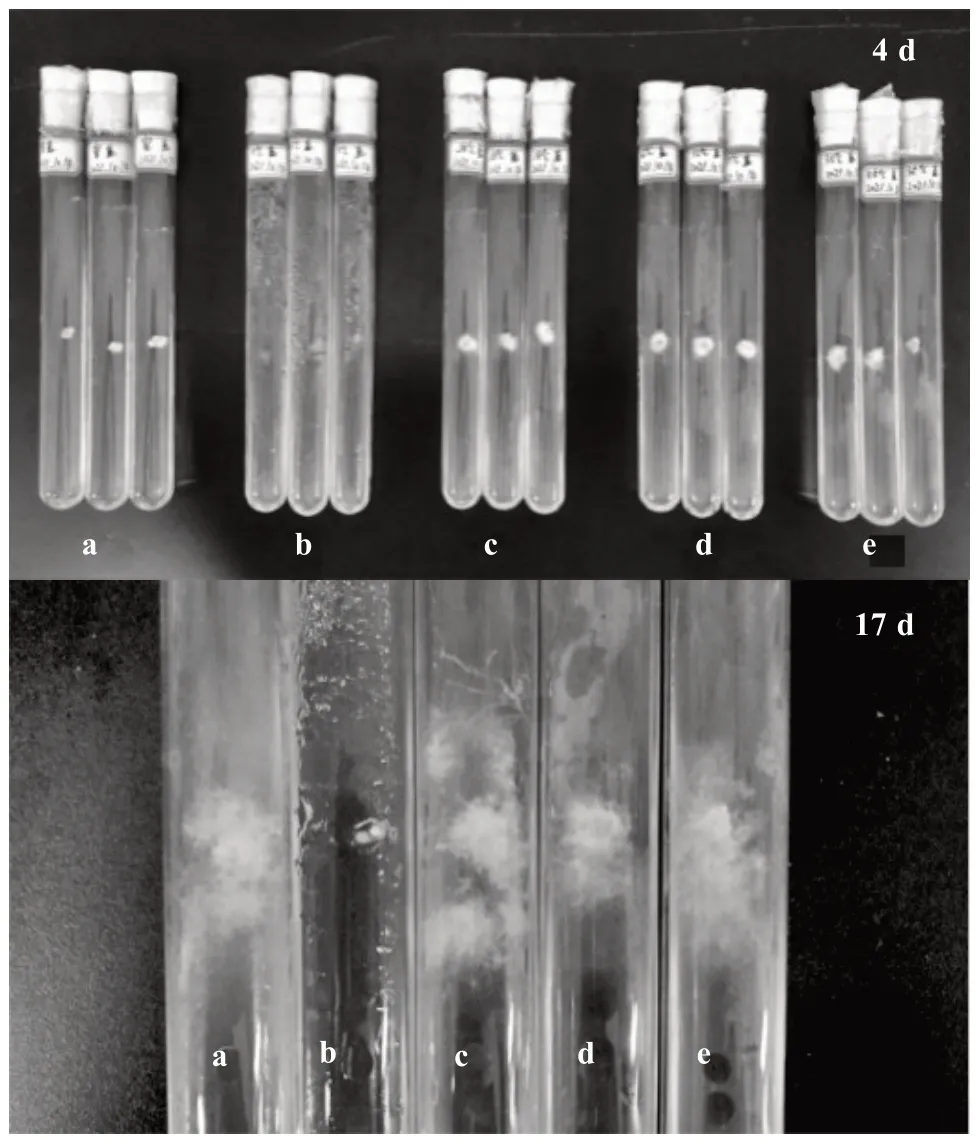
图2 不同温度对菌丝生长的影响(部分)Fig.2 Effect of different temperature on hyphae growth(partial)
由表2 可知,不同温度对榆黄蘑菌丝日均生长量的影响存在极显著差异。在室温、28、32 ℃的培养温度下榆黄蘑菌丝生长量显著大于5 和35 ℃。室温、28、32、35 ℃的培养温度环境下榆黄蘑菌丝生长量极显著大于5 ℃。
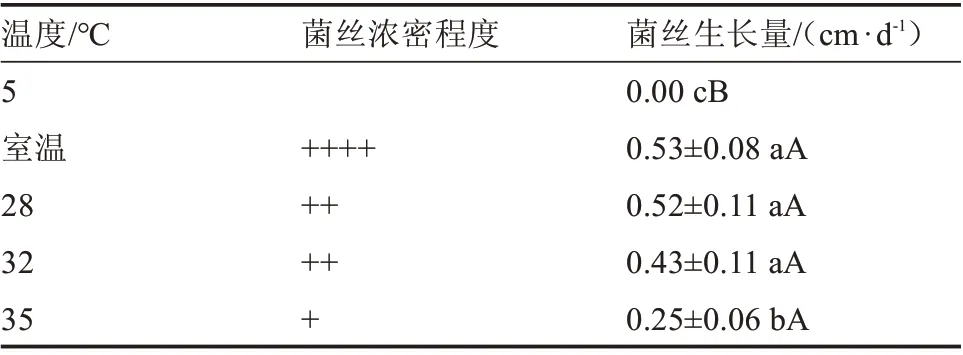
表2 不同温度对菌丝生长的影响Table 2 Effect of different temperature on hyphae growth
2.3 不同琼脂质量浓度对榆黄蘑菌丝生长的影响
由图3 和表3 可知,不同琼脂质量浓度对榆黄蘑的菌丝日平均生长量及生长速率有一定的影响。不同琼脂质量浓度梯度试验中,质量浓度低则试管环境湿度大,质量浓度高则试管相对湿度低。从各处理来看,接种后3 d,0.01~0.06 g·mL-1处理均有菌丝生长,0.07、0.08 g·mL-1未见菌丝生长,其中,0.01 g·mL-1处理组均有菌丝生长及扩散;0.02、0.03 g·mL-1处理也有菌丝生长,但相对较慢;而0.04、0.06 g·mL-1处理中只有部分试管有菌丝生长。接种后6 d,0.04、0.05、0.06 g·mL-1处理中的菌丝生长相对较好;0.03~0.06 g·mL-1处理中接种部位菌丝生长密集形成类似球状,其中0.03 g·mL-1处理中菌丝相对较为稀疏,0.04~0.06 g·mL-1处理中菌丝相对浓密。结果表明,试管内的湿度对菌丝生长影响表现为湿度越高菌丝生长越快,菌丝稀疏;湿度越低菌丝生长越慢,菌丝浓密。

图3 不同琼脂浓度对菌丝生长的影响(部分)Fig.3 Effect of different agar concentration on hyphae growth(partial)
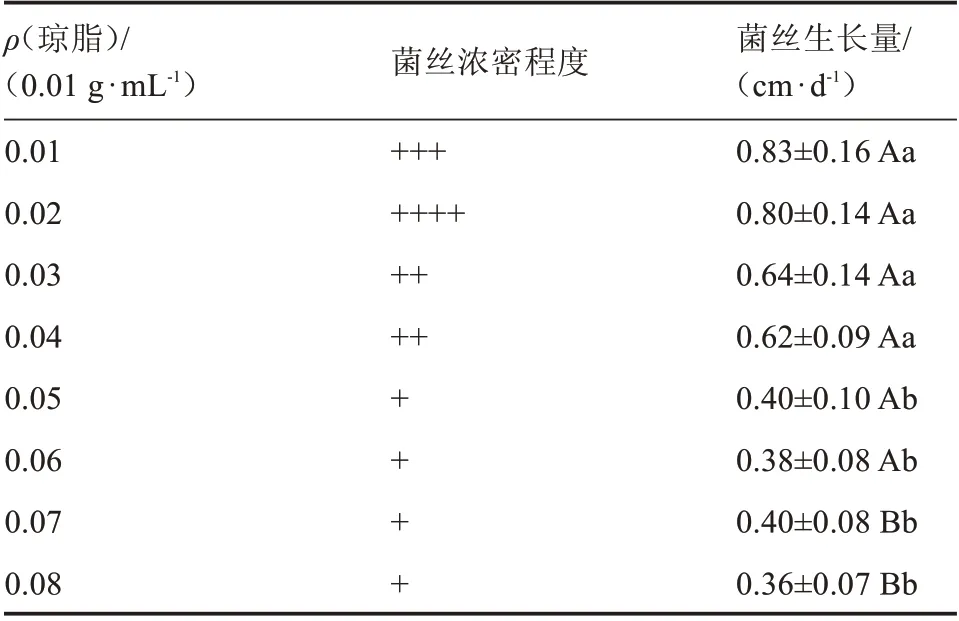
表3 不同琼脂质量浓度对菌丝生长的影响Table 3 Effect of different agar concentration on hyphae growth
由表3 可知,不同琼脂质量浓度对榆黄蘑菌丝日均生长量的影响呈极显著差异。0.01~0.04 g·mL-1的琼脂培养的榆黄蘑菌丝生长量显著大于0.05~0.08 g·mL-1,0.01~0.06 g·mL-1的琼脂培养的榆黄蘑菌丝生长量极显著大于0.07~0.08 g·mL-1。
2.4 不同pH值对榆黄蘑菌丝生长的影响
由图4 和表4 可知,pH 值在5.00~8.50 之间对榆黄蘑菌丝生长的影响表现为前期影响小、后期影响变大。在制备培养基的过程中,pH 值越高,培养基中的琼脂凝固得越快,反之则不易凝固。在接种后3 d,pH 6.00、6.50、7.00、7.50 处理中的接种部位菌丝生长较密。而在接种后12 d,pH 6.50 处理中的菌丝均已长满培养基,其他处理的菌丝还未长满。接种后15 d,pH 5.50、6.00 处理中菌丝均长满培养基,pH 7.00、7.50、8.00、8.50 处理中菌丝均长满培养基且长出培养基外。

图4 不同pH 值对菌丝生长的影响(部分)Fig.4 Effect of different pH on hyphae growth(partial)

表4 不同pH 值对菌丝生长的影响Table 4 Effect of different pH on hyphae growth
由表4 可知,不同pH 值对榆黄蘑菌丝生长的影响无显著差异。pH 值在5.00~8.50 范围内,虽培养基琼脂凝固程度受pH 值的影响,但对菌丝生长并无显著影响。
2.5 不同碳源对榆黄蘑菌丝生长的影响
2.5.1 碳源对榆黄蘑菌丝生长的影响 由表5 和图5 可知,不同碳源对榆黄蘑菌丝生长的影响无显著差异。碳源为淀粉时,榆黄蘑菌丝日平均生长量最大,为0.83 cm。碳源为蔗糖时,榆黄蘑菌丝日平均生长量为0.79 cm。其次是CK、葡萄糖和麦芽糖。后续试验选取菌丝日平均生长量最大的淀粉作为碳源的梯度试验。

图5 不同碳源对菌丝生长的影响Fig.5 Effect of different carbon sources on hyphae growth
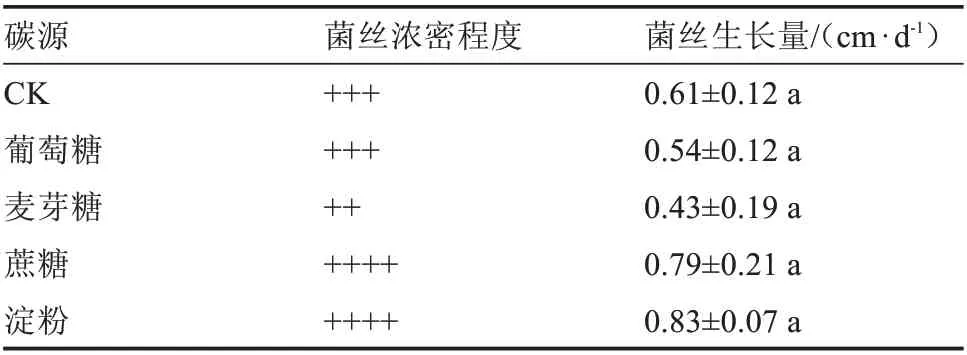
表5 不同碳源对菌丝生长的影响Table 5 Effect of different carbon sources on hyphae growth
2.5.2 淀粉质量浓度对榆黄蘑菌丝生长的影响
由表6 和图6 可知,不同淀粉质量浓度对榆黄蘑的菌丝生长影响较小。接种后5 d,0.005 g·mL-1淀粉处理的培养基表面菌丝颜色浅;0.010 g·mL-1淀粉处理的培养基表面菌丝均变白;0.015 g·mL-1淀粉处理的菌丝颜色浅;0.020 g·mL-1淀粉处理的菌丝较为稀疏;0.025 g·mL-1淀粉处理的菌丝颜色较浅;0.030 g·mL-1淀粉处理的菌丝长势相对较强;0.035 g·mL-1淀粉处理的菌丝相对较密。以上各处理菌丝长满培养基后,菌丝生长情况均无明显区别,通过单因素方差分析得知,不同淀粉质量浓度对榆黄蘑菌丝生长的影响无显著差异。

图6 不同淀粉质量浓度对菌丝生长的影响(部分)Fig.6 Effect of different starch content on hyphae growth(partial)
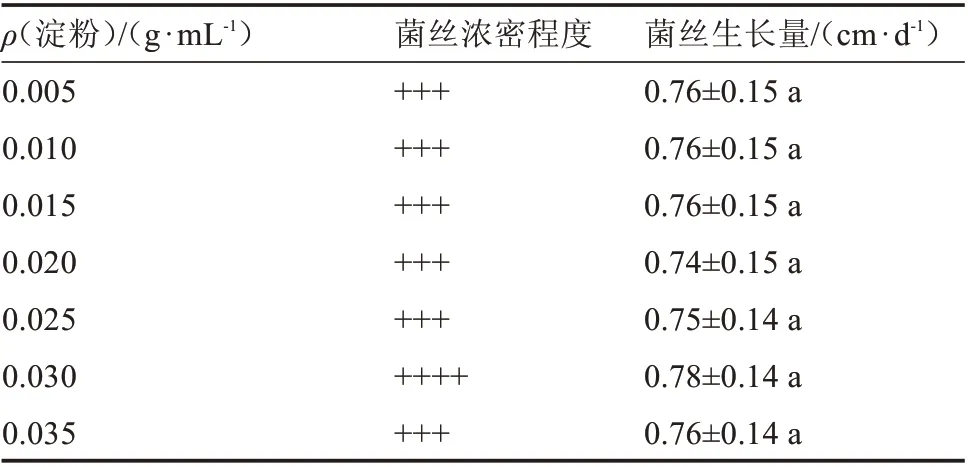
表6 不同淀粉质量浓度对菌丝生长的影响Table 6 Effect of different starch content on hyphae growth
2.6 不同氮源对榆黄蘑菌丝生长的影响
2.6.1 氮源筛选 由表7 和图7 可知,不同氮源对榆黄蘑菌丝生长有选择性作用。培养基的氮源为牛肉膏时,榆黄蘑菌丝日平均生长量最大,为0.68 cm;其次是CK、蛋白胨、硝酸铵和柠檬酸铵。而柠檬酸铵对榆黄蘑菌丝生长具有抑制作用,因此,以牛肉膏作为榆黄蘑培养的最佳氮源。通过单因素方差分析得知,不同氮源对榆黄蘑菌丝生长的影响存在极显著差异。
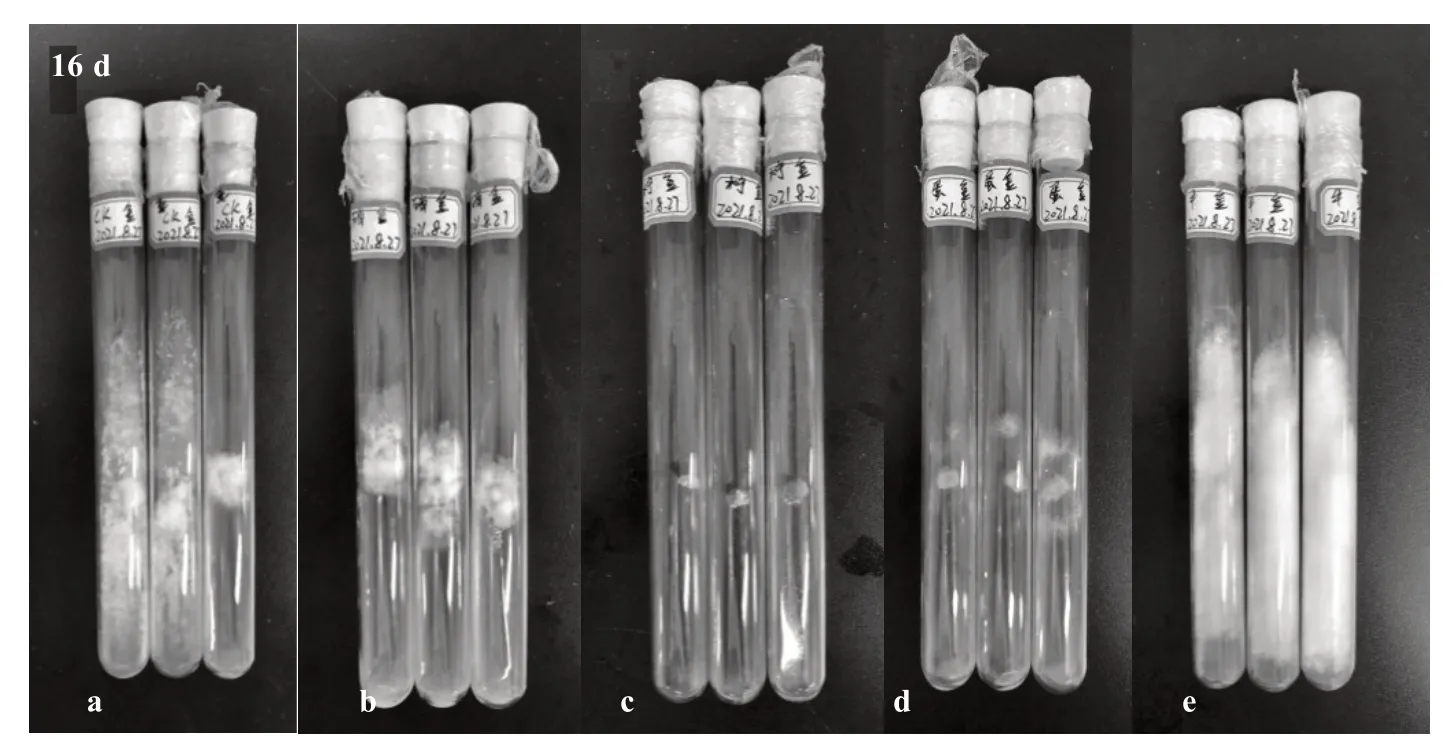
图7 不同氮源对菌丝生长的影响Fig.7 Effect of different nitrogen sources on hyphae growth
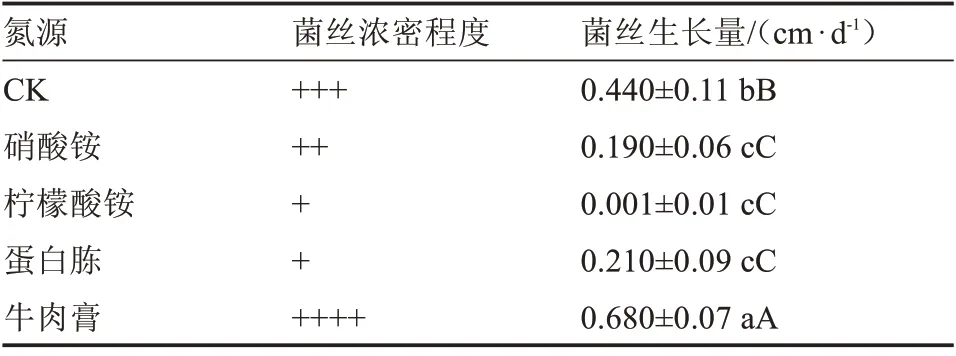
表7 不同氮源对菌丝生长的影响Table 7 Effect of different nitrogen sources on the growth of hyphae
2.6.2 牛肉膏质量浓度对榆黄蘑菌丝生长的影响 由图8 和表8 可知,不同牛肉膏质量浓度影响榆黄蘑菌丝的生长。接种后2 d,牛肉膏质量浓度由低到高的培养基依次陆续有菌丝长出。接种后5 d,0.020~0.035 g·mL-1牛肉膏处理中,起初生长出来的菌丝出现被溶解的假象。接种后9 d,0.020~0.035 g·mL-1牛肉膏处理中,再次出现白色菌丝,逐渐变密。接种后16 d,0.005 g·mL-1牛肉膏处理中的菌丝最早长满培养基,其他依次为0.010、0.015、0.020、0.025、0.030、0.035 g·mL-1。试验结果表明,过量的氮源会抑制榆黄蘑菌丝的生长,待菌丝对生长环境调整适应后又开始陆续生长、变密。

图8 不同牛肉膏质量浓度对菌丝生长的影响(部分)Fig.8 Effect of different beef extract contents on hyphae growth(partial)
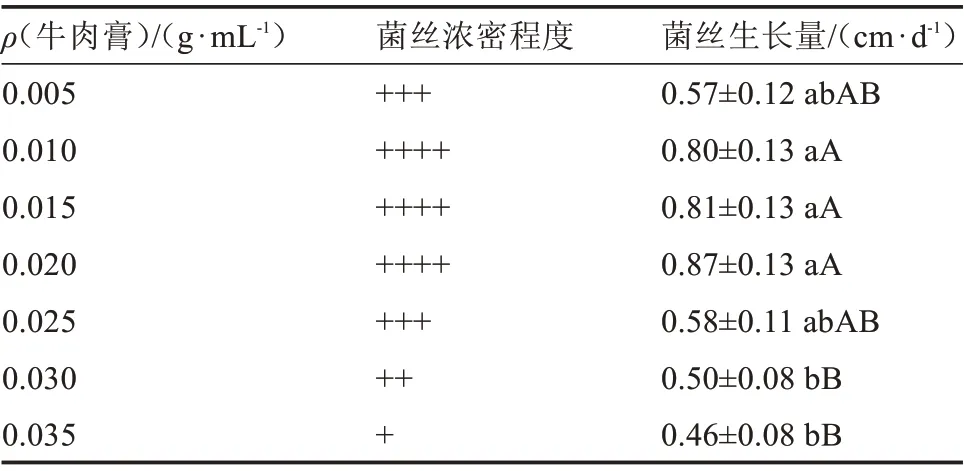
表8 不同牛肉膏质量浓度对菌丝生长的影响Table 8 Effect of different beef extract contents on hyphae growth
不同牛肉膏质量浓度对榆黄蘑菌丝生长的影响存在显著差异。0.015、0.020 g·mL-1牛肉膏处理的榆黄蘑菌丝生长量显著大于0.030、0.035 g·mL-1牛肉膏处理。0.010 g·mL-1牛肉膏处理的榆黄蘑菌丝生长量极显著大于0.035 g·mL-1牛肉膏处理,而0.005、0.025 g·mL-1牛肉膏处理均与其他处理组无显著差异。
2.7 榆黄蘑菌丝培养条件正交试验分析
由表9 可知,根据单因素试验结果,选择温度 为25、28、32 ℃,琼 脂 质 量 浓 度0.01、0.02、0.03 g·mL-1,牛 肉 膏 质 量 浓 度 为0.010、0.015、0.020 g·mL-1,进行3 因素3 水平的正交试验。根据分析可知,温度、琼脂质量浓度、牛肉膏质量浓度对榆黄蘑菌丝的影响顺序为温度>琼脂质量浓度>牛肉膏质量浓度。其中,榆黄蘑菌丝培养条件最佳组合为温度32 ℃以及0.01 g·mL-1的琼脂和0.015 g·mL-1的牛肉膏。

表9 菌丝生长条件正交试验分析Table 9 Analysis of orthogonal test on hyphae growth conditions
3 讨论与结论
笔者以榆黄蘑作为试验材料,对其菌丝生长条件中光照时间、温度、琼脂质量浓度、pH、碳源、氮源进行优化筛选,为榆黄蘑的生产与推广提供技术支持。结果表明,光照时间、pH、碳源对榆黄蘑菌丝生长的影响均不存在显著差异,但光照时间影响菌丝转色,光照时间越长,转色时间越久,黑暗环境下可以加快菌丝转色。根据马玮超等[25]、雷萍等[26]研究推测,榆黄蘑菌丝转色与滤纸纤维素酶、羧甲基纤维素酶、β-葡萄糖苷酶和半纤维素酶、漆酶、多酚氧化酶活性有关,光照条件下榆黄蘑菌丝相关酶活性受到抑制,从而抑制了菌丝的转色。pH 值试验表明,pH 值越高琼脂凝固越快,而pH 6.50 菌丝生长浓密程度及琼脂凝固程度都相对较适宜。原因是琼脂的组成成分在酸性介质中会水解生成还原糖或低聚糖,从而弱化了琼脂的凝固作用[27]。碳源为0.03 g·mL-1淀粉时,菌丝生长情况及浓密程度相对较适宜。碳源是微生物菌丝生长发育活动的主要能量来源,碳源丰富有利于菌丝的生长,但过量的碳源起不到促进生长的作用。
不同温度对榆黄蘑菌丝生长的影响存在极显著差异。榆黄蘑菌丝在崇左市夏季和秋季的室温及28、32、35 ℃的恒温环境下均可生长,温度过低抑制菌丝生长,温度过高会出现溶菌的现象,单因素试验结果表明,室温(日均温度25 ℃)为榆黄蘑菌丝生长的最适宜温度条件。温度过高使某些蛋白酶类发生变质,从而出现溶菌现象。因此,控制温度可以改善菌丝的生长情况。不同琼脂质量浓度对榆黄蘑菌丝生长的影响存在极显著差异。在封闭试管内琼脂质量浓度越低,湿度越大,菌丝生长越快,琼脂质量浓度越高,湿度越小,菌丝生长越慢。由于水是物质反应必不可少的成分,因此环境中缺水不利于菌丝的生长。
不同氮源对榆黄蘑菌丝生长的影响呈极显著差异,其中牛肉膏为榆黄蘑菌丝生长最佳氮源。不同牛肉膏质量浓度对榆黄蘑菌丝生长量的影响存在显著差异。正交试验结果表明,0.015 g·mL-1牛肉膏为最佳含量。过量的氮源会抑制榆黄蘑菌丝的生长,但缺少氮源也不利于菌丝的生长,因此,合适的氮源是种植榆黄蘑的一个关键因素。温度、湿度及氮源对榆黄蘑菌丝生长有较大的影响,因此,选择合适的温度、湿度及氮源对提高榆黄蘑菌丝长势有重要意义。正交试验结果表明,温度、琼脂质量浓度、牛肉膏质量浓度对榆黄蘑菌丝生长的影响顺序为温度>琼脂质量浓度>牛肉膏质量浓度。因而在榆黄蘑菌丝培养过程中,要认真把握好培养的温度、氮源的选择、氮源的含量、琼脂质量浓度等条件,从而更有利于菌丝稳健生长。
