黄瓜主要农艺性状分子标记研究进展
2023-11-07李亚航施艳娥崔浩楠
李亚航,施艳娥,丁 卓,崔浩楠
(河北省特色园艺种质挖掘与创新利用重点实验室·河北科技师范学院园艺科技学院 河北秦皇岛 066000)
黄瓜(Cucumis sativusL.)是葫芦科甜瓜属一年生植物,普遍种植于世界上各个国家和地区,是很常见的蔬菜作物。另外,黄瓜具有较高的营养价值,含有蛋白质、钙、磷、铁、钾、胡萝卜素、维生素B2、维生素C、维生素E 及烟酸等营养素。常食黄瓜对人体有许多益处,能够起到抗衰老、降血糖等功效[1]。研究发现,黄瓜起源于印度,而中国是次级起源中心之一,可分为华北型、华南型、欧洲温室型、欧美加工型等类型[2]。
分子标记是以个体间遗传物质内核苷酸序列变异为基础的遗传标记,是DNA 水平遗传多态性的直接反映[3]。其主要可分为四大类,第一大类是基于分子杂交的方法,主要指RFLP。第二大类是基于PCR 的DNA 扩增方法,又可分为两类,一类是使用随机引物,以RAPD 为代表;而另一类是利用特定引物或引物对扩增的标记,主要有SCAR、STS、SSR、TRAP、SRAP、EST-SSR 等分子标记。第三大类是通过PCR 与酶切相结合的方法,主要有AFLP 以及CAPS。第四大类是基于单个核苷酸多态性的DNA 标记,目前是指SNP[4]。分子标记技术发展迅速,相较于传统的黄瓜育种,黄瓜分子标记技术的应用减少了人力、物力、时耗;同时,极大地提高了遗传分析的准确性和育种的有效性。分子标记技术在不断更新,其在黄瓜研究的各个方面均有应用,是黄瓜研究必要的辅助手段之一。分子标记技术在园艺作物种子纯度检测方面有着较多应用研究,在西瓜[5-6]、辣椒[7-8]、甜瓜[9-10]、茄子[11]中多有报道,在黄瓜种子纯度鉴定上的应用也比较多。
1 黄瓜果实相关性状分子标记
1.1 黄瓜苦味性状
黄瓜果实苦味影响黄瓜品质,进而对黄瓜的生产造成损失。而分子标记辅助选择在黄瓜果实苦味选择上具有很好的实用性,其快速且准确,能够有效提高黄瓜品质改良效率。
池秀蓉等[12]以黄瓜纯合自交系9110Gt 和03828 作亲本构建的F2群体为试验材料,通过品尝的方式进行苦味鉴定,在黄瓜苗期品尝子叶,在成株期品尝真叶或卷须。最终获得了1 个与营养器官(子叶、真叶、卷须)无苦味基因(bi)连锁的AFLP标记,遗传距离6.43 cM 并将该标记转变为SCAR标记。李曼等[13]以黄瓜纯合自交系9110Gt 和9930作亲本构建的F2群体为试验材料,然后通过SSR标记对其进行基因连锁分析,将黄瓜营养体苦味基因Bi定位在黄瓜第6 染色体上,距两侧标记SSR02309 和SSR00004 的 距 离 为1.7、2.2 cM。Zhang 等[14]以黄瓜纯合自交系9110Gt 和9930 作亲本杂交获得的重组自交系(RIL)进行定位,将黄瓜苦味新基因bi-3定位在5 号染色体SSR00116 和SSR05321 之间,遗传距离为6.3 cM。顾兴芳等[15]以黄瓜纯合自交系931(果实苦味显性Bt)和932(果实无苦味隐性bt)作亲本构建的F2群体为试验材料,获得了与位于Bt基因两侧的2 个AFLP 标记(相连锁),分别是E23M66-101 和E25M65-213,遗传距离分别为5.0、4.0 cM。李宗扬等[16]以黄瓜果实有苦味品系D9320 和无苦味品系D0432-3-4 作亲本构建的6 世代群体以及372 株F2群体为试验材料,最终研究表明,黄瓜果实苦味基因Bt与15 个多态性标记被定位在同一连锁群,Bt位于SSR12291和SSR02118 之间,距离两侧标记的遗传距离为1.9、1.8 cM。前人研究表明[13-16],黄瓜营养器官苦味基因Bi不受黄瓜果实苦味基因Bt影响,为独立遗传。Bt基因是单基因显性遗传,但纯合基因型bibi对Bt基因有着隐性上位作用;在Bi基因杂合的情况下,无论Bt基因是否存在,均会导致黄瓜果实出现苦味。相关黄瓜苦味性状分子标记及序列详见表1。
1.2 黄瓜果皮光泽性状
黄瓜果皮光泽在生产及市场上均具有一定的价值,果皮有光泽的黄瓜更加迎合消费者的喜好,能更好地满足市场需求。因此,黄瓜果皮光泽性状具有较高的研究应用价值。
近年来,董邵云等[17]以果皮有光泽自交系1101为母本,以3 个无光泽自交系1162、9930、1107 为父本,分别构建6 世代遗传群体。研究分析表明,黄瓜光泽性状由显性单基因G控制,有光泽对无光泽为显性。此外,还将G基因定位至黄瓜第5 染色体上,其侧翼标记分别是CS28 和SSR15818,遗传距离为2.0、6.4 cM。杜辉[18]以华南型黄瓜自交系S52 和欧洲温室型自交系S06 作亲本构建的F2群体为试验材料,获得了与D(黄瓜果皮光泽亮度)基因连锁的SSR 标记CMCTN71,其遗传距离为25.8 cM。Zhang 等[19]将果皮无光泽基因定位在黄瓜第5 染色体上,侧翼标记SSR19172 和SSR00772。周冰钰[20]以少蜡粉果皮光亮品种D0432-3-4 和多蜡粉果皮灰暗品种649 为亲本构建F2群体,使18 个SSR 多态性标记与控制黄瓜果皮光泽的基因g定位至同一连锁群,其遗传距离为102.7 cM,控制黄瓜果皮光泽性状的基因g位于标记SSR17321 和CSW1008 之间,遗传距离为2.8、2.0 cM,并将g基因定位至黄瓜第5 染色体上。
据报道,对控制黄瓜果皮光泽性状的基因已经有较多研究,但在不同学者的研究结果中存在差异。董邵云等[17]以果皮有光泽欧洲温室型黄瓜自交系1101 为母本,以3 个无光泽华北型自交系1162、9930、1107 为父本,分别构建6 世代遗传群体,进行表型鉴定和遗传规律分析,结果表明,黄瓜果皮光泽性状受单基因控制,黄瓜果皮有光泽性状对无光泽性状为显性。周冰钰[20]在5 个材料中以光泽度仪挑选出光泽度相差最大的2 个品种作亲本(D0432-3-4 为少蜡粉果皮光亮欧洲温室型黄瓜,649 为多蜡粉果皮灰暗华南型黄瓜)构建6 世代群体,在F1、BC1、BC2和F2群体中进行遗传规律分析,研究表明,黄瓜果皮光泽性状是质量性状,受单基因控制,其中黄瓜果皮有光泽性状对无光泽性状为隐性。在董邵云等[17]的研究中,为排除果皮表面蜡粉的干扰,调查表型时将果皮表面的蜡粉拭去,而周冰钰[20]的研究则探讨了蜡粉与果皮光泽的关系,蜡粉的有无可能是二者研究结果相反的重要原因,亲本材料生态型的差异与测定果皮光泽方法的不同也会对研究结果造成影响。另外,黄瓜果皮光泽(亮度)则由D基因控制,Zhai 等[21]对D基因进行成功克隆,将D位点缩小到24.5 kb 区域,确定了编码C2H2型锌转录因子CsDULL的候选基因(Cs5G577350),当CsDULL 完全缺失时,果皮有光泽。同时首次证明了D与Tu(果瘤)属于同一基因座,但是D与G之间的关系仍需要进一步研究。
1.3 黄瓜果皮颜色性状
黄瓜嫩果的果皮主要分为墨绿、深绿、绿色、黄绿、白绿等颜色,成熟后的黄瓜果皮一般呈现黄绿色。果皮颜色性状是重要的商品性状和品种特征。目前,分子标记在黄瓜果皮颜色鉴定分析方面的应用也比较多,对果皮颜色进行研究有助于培育出更多迎合市场需求的新品种。
前人对黄瓜果皮颜色的研究结论不尽相同,李亚利[22]以绿皮黄瓜WD3 和白皮黄瓜B-2-2 为亲本构建的F2群体为试验材料,通过集群分离分析法(BSA)构建DNA 池,利用380 个SRAP 随机引物进行扩增。通过研究分析,其中多态性标记ME9EM1-309 与黄瓜果皮绿色基因遗传距离为6.0 cM,ME8EM14-425 与黄瓜果皮绿色基因遗传距离为8.3 cM,研究结果表明,试验材料中黄瓜果皮绿色受单基因控制,黄瓜果皮绿色对白色为完全显性。孙晓丹等[23]以黄绿果皮黄瓜631 和乳白果皮黄瓜D0351 作亲本构建的F2群体为试验材料,获得了与果皮颜色相连锁的9 个引物,其中E43M61与黄瓜白色果皮基因遗传距离为5.2 cM;以黄绿果皮黄瓜631 和乳白果皮黄瓜翠玉8 号作亲本构建的F2群体为试验材料,获得了与果皮颜色相连锁的7个引物,其中E34M59与黄瓜白色果皮基因遗传距离为5.6 cM,证实了黄瓜嫩果白色果皮颜色性状由1 对隐性基因ww控制,而果皮绿色又分为绿色与浅绿色,控制嫩果皮白色的基因w对控制果皮绿色的基因yg为隐性。董邵云等[24]以黄瓜嫩果深绿色果皮自交系1507 和白色果皮自交系1508 作亲本构建的6 世代遗传群体为试验材料,最终将控制黄瓜白色果皮性状的w基因定位在黄瓜3 号染色体上,与其两侧标记SSR23141 和SSR23517 遗传距离为1.9 和4.9 cM。同时,研究结果表明,试验材料1508 嫩果皮白色由隐性基因(w)控制,果皮绿色对果皮白色为显性。张婷婷等[25]以嫩果皮色不同的3份黄瓜种质Q8、Q16、Q24 配置的2 个杂交组合Q16×Q8 和Q16×Q24 及6 世代遗传群体为试验材料,共定位到了3 个QTL 位点,在Q16×Q8 组合的7 个连锁群上定位到2 个QTL 位点,分别位于第1和第3 染色体上;在Q16×Q24 组合的7 个连锁群上定位到1 个QTL 位点,位于第3 染色体上。牛玉倩等[26]以经过EMS 诱变后携带白化基因的野生黄瓜649 与Gy14、9930 分别构建的F2群体为试验材料,最终将黄瓜白化突变基因al定位在SNP5044706 与SNP4730918 标记之间约66 kb 的区间内,即定位在黄瓜第7 染色体上。王梅馨[27]以成熟果皮显黄棕色的黄瓜自交系PW 和成熟果皮显绿色的黄瓜自交系Gy2 作亲本构建的4 世代遗传群体(P1、P2、F1、F2)为试验材料,通过研究分析,最终将控制黄瓜成熟果皮颜色yellow-brown(yb)基因精细定位在17 kb 区间范围内,两侧标记为SNP_499872 和SNP_516951。刘汉强[28]以绿皮黄瓜Q30和白皮黄瓜Q24 作亲本构建的F2群体为试验材料,最终将控制黄瓜嫩果白色果皮的单核基因w定位在3 号染色体8.2 kb 范围内,同时证明了黄瓜嫩果白色果皮由1 个隐性基因控制,果皮绿色对白色为显性。结果与李亚利[22]、孙晓丹等[23]、董邵云等[24]研究结果一致。黄瓜嫩果皮色分离后代中常出现许多过渡色,呈现出类似于数量性状的连续变异,因此张婷婷等[25]、申晓青等[29]认为黄瓜嫩果皮色不仅受到1对主基因控制,还可能受多个微效多基因控制。
Jiao 等[30]以绿皮黄瓜品系L68 和Q30 及白皮黄瓜品系Q24 和L66 为试验材料,最终研究发现,APRR2、TKN4及TKN2基因间相互作用,调节黄瓜果皮叶绿素含量,进而影响嫩瓜果皮颜色。目前,黄瓜嫩果皮白色由基因w控制已经被证实,黄瓜嫩果皮绿色的调控机制也基本明确。相关黄瓜果皮颜色性状分子标记及序列详见表2。
1.4 黄瓜果刺性状
Wellington[31]发现了第1 个控制黄瓜果刺颜色的基因B。据报道,黄瓜黑刺对白刺为显性,由1 对等位基因所控制[32-34]。研究还发现了与B基因不同的B-2基因[35],与B、B-2基因不同的B-3、B-4基因[36]。Heang等[37]研究获得了1 个与B基因遗传距离为14.5 cM的AFLP 标记ECAMCTC150。彭佳林等[38]以黄瓜黑刺自交系S52,黑刺野生种hardwickii 和3 个白刺黄瓜材料S1003、WI1983G、397 分别构建的BC1或F2遗传群体为试验材料,利用3 个定位群体将B基因定位在黄瓜第4 号染色体上,侧翼基因SSRB-130和SSRB-107,距离分别为2.01 和0.78 cM,并通过等位基因变异分析验证了CsaG003095即为黄瓜黑刺基因B。陈龙[39]以野生型黑刺自交系PI197088和突变型白刺黄瓜自交系SA0422 为亲本构建的F2群体为试验材料,通过多态性标记筛选,表明黄瓜黑刺性状由2 对基因控制(B和B2),另外,将B2基因定位至黄瓜第5 染色体上,与B2基因最近的两侧标记为SSR13237 和SSR03514,遗传距离为12.94、2.42 cM。Liu 等[40]通过研究证明了CsMYB60是调控黄瓜果刺颜色的关键基因,具有较高的应用价值。Xie 等[41]以NCG122 与NCG121 作亲本构建的F2群体为试验材料,最终获得了与黄瓜果实多刺基因ns连锁的分子标记nsIndel55 和nsIndel39。
Zhang 等[42]以大果刺黄瓜PI197088 和小果刺黄瓜SA0422 作亲本构建的F2分离群体为试验材料,最终筛选到了6 个与果刺大小基因相关的新标记,果刺大小SS/ss基因座位于标记SE1 和SSR43 两侧区域。据目前报道,黄瓜果刺大小的调控机制尚不明确。
据陈龙[39]研究推测,B-3和B-4基因即为B和B2基因。彭佳林等[38]研究表明,CsaG003095即为黄瓜黑刺基因B,而控制黄瓜黑刺性状的另一个基因B2目前并未被精细定位。相关黄瓜果刺性状分子标记及序列详见表3。
1.5 黄瓜其他相关性状
分子标记技术在黄瓜上应用较多,在黄瓜果肉颜色、黄瓜全雌性、黄瓜单性结实等方面也有一些研究。李博等[43]以黄瓜绿色果肉品种和白色果肉品种进行双列杂交,最终检测到1 个与黄瓜果肉颜色有关的QTL,与最近标记距离为6.01 cM,贡献率为11.86%。周胜军等[44]利用SSR 分子标记筛选出了2个与黄瓜全雌性紧密连锁的分子标记,遗传距离为7.7 和6.8 cM。牛志红等[45]通过QTL 检测,确定了1 个与黄瓜单性结实相关的QTL 位点,位于3 号染色体SSR19430 和SSR15419 标记之间,遗传距离6.6 cM,另外,通过QTL-Seq 技术,发现4 个与黄瓜单性结实相关的QTL 位于黄瓜1、3、6 号染色体。黄瓜瓜把长是品种特征性状,有时也会作为果实外观品质指标影响其市场价值,Xu 等[46]以Jin5-508 和YN 杂交F1为试验材料,预测了黄瓜瓜把长中的候选基因,并最终证明了CsFnl7.1在增加黄瓜瓜把长性状上发挥着重要作用,将Fnl7.1定位于标记In‐Del05 和SNP04 之间的14.1 kb 内。文中所出现的全雌性分子标记及序列见表4。

表4 黄瓜全雌性分子标记及引物[44]Table 4 Molecular markers and primers for all female cucumber
2 黄瓜抗病性相关分子标记
2.1 黄瓜霜霉病抗性
黄瓜霜霉病是种植过程中最普遍且极具毁灭性的病害之一,严重的会导致绝产,其病原菌为专性卵菌古巴假霜霉菌(Pseudoperonospora cubensis)[47]。培育黄瓜抗霜霉病品种是防治黄瓜霜霉病最经济有效的方法,近年来,QTL 分析在黄瓜霜霉病分子标记开发上有较多应用。
在2013 年,Zhang 等[48]以黄瓜抗霜霉病自交系K8 和感霜霉病自交系K18 为试验材料,通过QTL分析,检测到5 个抗霜霉病QTL,分别是dm1.1、dm5.1、dm5.2、dm5.3、dm6.1。其中,dm1.1和dm6.1的基因座分别在1 号和6 号染色体上,dm5.1、dm5.2和dm5.3的基因座在5 号染色体上并且确定了6个 连 锁 的 SSR 标 记:SSR31116、SSR20705、SSR00772、SSR11012、SSR16882 和SSR16110,该研究为黄瓜抗霜霉病分子标记辅助选择提供了理论基础。而后Yoshioka 等[49]以黄瓜霜霉病高抗品种PI197088 与高感品种9930 构建的具有111 个株系的重组自交系群体为试验材料,通过QTL 分析,确认了dm1.1、dm3.1、dm4.1、dm5.1、dm5.2、dm5.3等6 个QTL 位点,抗性贡献率较大的为dm1.1、dm4.1、dm5.3。Wang 等[50]以黄瓜霜霉病高抗品种330628和高感品种9930 构建的243 个F2:3群体为试验材料,通过348 对SSR 和SNP 标记,检测到4 个QTL分别为dm2.1、dm4.1、dm5.1、dm6.1,主要抗性QTL为dm4.1和dm5.1。Li 等[51]以黄瓜霜霉病高抗品种PI197088 和高感品种长春密刺构建的具有183 个株系的F2:3群体为试验材料,通过141 个SSR 标记,鉴 定 到5 个QTL(dm1.1、dm3.1、dm4.1、dm5.1、dm5.2),主 要 抗 性QTL 为dm4.1。杨 益 宁[52]以18363S、18461S、18031S、18019S、18026S、18364S、18043S、18042S 等8 个待改良品种和供体亲本IL52 为试验材料,从5 个与黄瓜抗霜霉病基因连锁的Indel 标记中筛选出2 个在这9 种试验材料间均有多态性的通用Indel 标记,分别是17ID42 和17ID73,其中17ID73 多态性更加显著。谢笑笑[53]以黄瓜抗霜霉病自交系K8 和感病自交系K18 作亲本构建的RIL 群体为试验材料,对黄瓜霜霉病抗性QTL 进行了定位分析,共检测到3 个QTL 位点。2015 年春,检测到dmQTL5.1和dmQTL5.2,都位于黄瓜5 号染色体上;2015 年秋,重复检测到这2 个位点,贡献率由33.6% 和21.7% 变为了53.6% 和31.1%。另外,苗期鉴定时还在黄瓜6 号染色体上检测到QTL 位点dmQTL6.1。孟攀奇等[54]以抗霜霉病黄瓜Q9 和感霜霉病黄瓜Q10 作亲本构建的F2分离群体为试验材料,通过研究发现黄瓜抗霜霉病由单隐性基因控制,感病对抗病为不完全显性。另外,筛选出与黄瓜霜霉病抗性基因紧密连锁的AFLP 标记,并把该标记转变为了SCAR 标记。前人发现的这些QTL 位点可以用于开发黄瓜抗霜霉病分子标记,而这些分子标记可以进一步用于黄瓜霜霉病分子标记辅助选择。
2.2 黄瓜白粉病抗性
黄瓜白粉病是黄瓜生产上危害较大的病害之一,其主要传播途径为空气传播,是黄瓜生长过程中普遍发生的病害,主要危害黄瓜叶片[55]。白粉病在发展至中后期时对光合作用有较强影响,严重时可致黄瓜减产40%[56]。引起黄瓜白粉病的病原菌是专性白粉菌,主要是瓜单囊壳菌[Sphaerotheca fulig‐inea(Schlecht)]以及二孢白粉菌(Erysiphe cichora‐cearumDC.)[57]。国内外对黄瓜白粉病进行了多方面的研究,并且开发出与黄瓜白粉病连锁的分子标记,挖掘出与抗黄瓜白粉病相关的关键基因,为后续黄瓜白粉病抗性基因精细定位研究奠定了基础。
沈丽平[58]以高感白粉病的黄瓜品种D8 和高抗白粉病的黄瓜品种JIN5 作亲本构建的F2群体以及经过6 代回交得到的抗白粉病的14 个高代回交系为试验材料,最终获得与黄瓜白粉病抗性相连锁的分子标记UBC809,并将该标记转变为SCAR 标记。另外,以高感白粉病黄瓜品种D8 和高抗白粉病品种JIN5 作亲本构建的188 株F2单株为作图群体,最终检测到控制黄瓜白粉病抗性的QTL 位点2 个,其位于第3 连锁群上,贡献率分别是7.6% 和13.5%。Sakata 等[59]以santou 和PI197088-1 黄瓜作亲本构建的重组自交系F7为试验材料,在20 和26 ℃下,分别检测到3 个和2 个与黄瓜白粉病抗性相关的QTL,分别在1、2、3 和4 连锁群上,其中1个QTL 在高温、低温下均起作用,其他2 个仅在高温或低温下起作用。张海英[60]以黄瓜重组自交群体和2 个F2分离群体为试验材料,获得了与黄瓜白粉病抗性基因连锁的共显性SSR 标记SSR97-200 和SSR273-300,遗传距离分别为5、13 cM,还获得了与白粉病感病基因连锁的AFLP 标记P63M51-384 和SCAR 标记PMSCAR-300,遗传距离为7 cM。简德明[61]以抗白粉病美国露地黄瓜自交系WIS2758 和感白粉病欧洲温室型黄瓜后代自交系19032 及597株F2单株为试验材料,通过分析研究,最终获得了与黄瓜白粉病基因连锁的AFLP 标记并转化为SCAR 标记,遗传距离均为7 cM。张桂华等[62]以黄瓜抗白粉病母本Q9 和感白粉病父本Q10 及组合(津春3 号)的F2分离群体为试验材料,获得了1 个AFLP 标记,与黄瓜白粉病抗性基因连锁,遗传距离5.56 cM。郝俊杰等[63]以黄瓜高抗白粉病资源74 和感白粉病资源80 杂交构建的F1、F2群体为试验材料,通过研究分析,最终将抗白粉病基因定位于SSR15321 和SSR07531 之间,遗传距离为3.06 cM,物理距离238 444 bp,能够解释41.95% 的表型变异。张圣平等[64]以黄瓜高抗白粉病纯合自交系K8和感白粉病K18 的杂交后代F1、F2:3为研究对象,通过QTL 定位,得到了4 个白粉病抗性基因的QTL位点pm5.1、pm5.2、pm5.3和pm6.1,其中pm5.2是黄瓜白粉病抗性基因的主效QTL 位点。王维[65]以SSL508-27 与D8 作亲本构建的次级F2分离群体为试验材料,将黄瓜抗白粉病基因片段的物理距离从6.81 Mb 缩短至98.4 kb,将其定位于标记In‐Del01 和SNP16996485 之间。近些年来,还有学者研究开发出黄瓜白粉病抗性SNP 标记[66]。张鹏等[67]通过研究获得了与黄瓜白粉病抗性密切相关的SNP 多态性标记140 个。相关抗病基因的分子标记及序列详见表5。
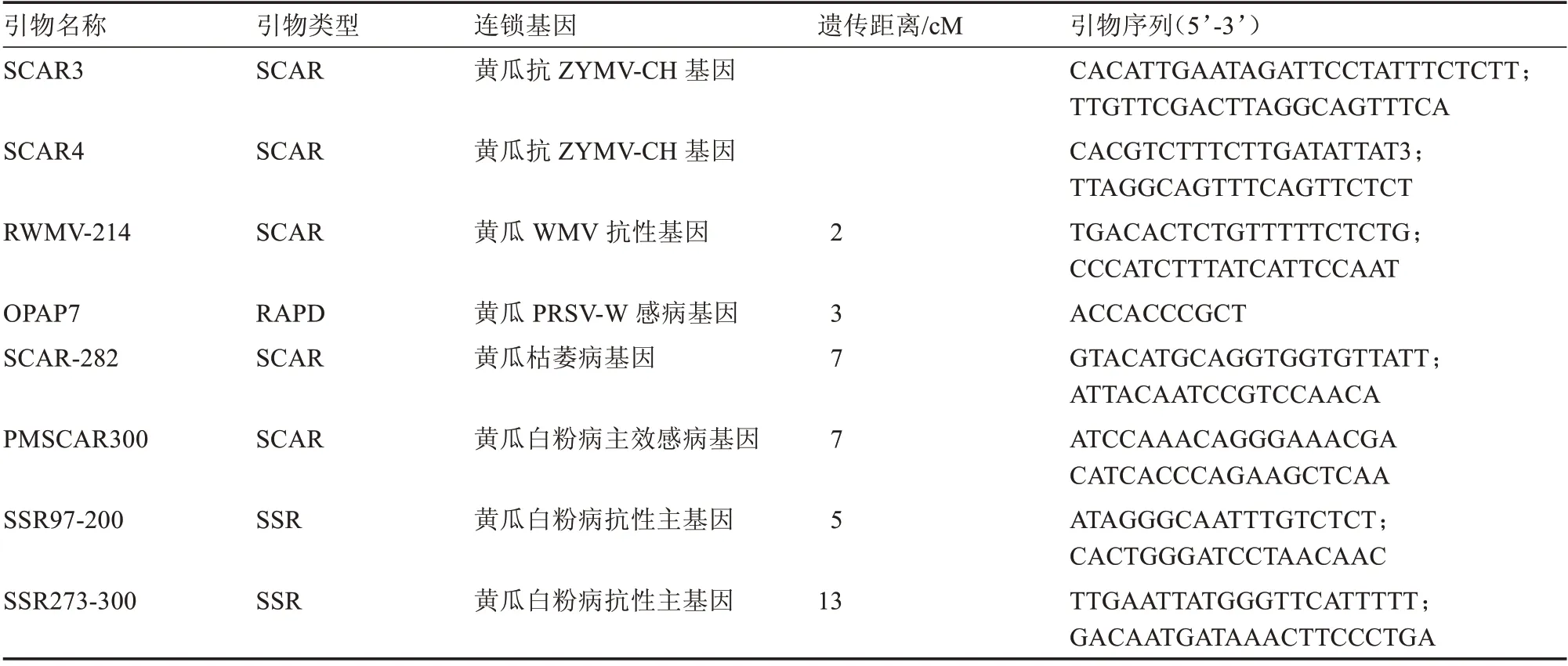
表5 黄瓜抗病基因相关分子标记及引物[60]Table 5 Molecular markers and primers related to cucumber disease resistance genes
2.3 黄瓜枯萎病抗性
黄瓜枯萎病是一种土传病害,在黄瓜生产上危害性极强,主要是由尖孢镰刀菌(Fusadmn oxyspo‐rum)引起的,在我国引起黄瓜枯萎病的是生理小种4 号。对于黄瓜枯萎病的防治方法,目前有农业防治、生物防治及化学防治,但效果有限,防治黄瓜枯萎病最经济有效的方法就是选育黄瓜抗枯萎病品种[68]。多年来,国内外学者对黄瓜枯萎病进行了多方面的研究,开发出相关分子标记并定位到相关QTL 位点,但目前黄瓜抗枯萎病基因并未被精细定位,仍需要进一步研究。
张海英[60]以黄瓜重组自交系群体和2 个F2分离群体为试验材料,最终得到与黄瓜枯萎病抗性基 因 连 锁 的 AFLP 标 记 P-GTG/M-CCA-310、SCAR 标记SCAR-282 和RAPD 标记OPD9-300,遗传距离分别为7、7、14 cM。周红梅等[69]以黄瓜抗枯萎病WIS2757 和感枯萎病津研2 号及F1、F2群体为试验材料,构建抗、感池对黄瓜枯萎病进行SSR 分析,获得了9 个与黄瓜枯萎病抗性基因连锁的SSR 分子标记并将其初步定位于黄瓜2 号染色体上的标记SSR17631 和SSR00684 之间。Dong 等[70]利用Superina(P1)和Rijiecheng(P2)构造不同世代,以F1、B1(F1×Superina)、B2(F1×Rijiech‐eng)和F2为试验材料,基于BSA-seq 技术,开展黄瓜枯萎病QTL 定位,将1 个主效QTL 定位在2号染色体上,并且利用5 对InDel 引物将其精细定位在黄瓜2 号染色体上的1 248 093~1 817 308 bp范围内。
2.4 其他病害相关分子标记
杨义等[71]对19 份黄瓜材料进行ZYMV 接种,开发出位于VPS4-like 基因内部并与zmy 位点紧密结合的InDel 标记,可用于黄瓜抗性鉴定及抗病育种。王惠哲等[72]以黄瓜抗病亲本66 和感病亲本A18 及F1、F2、BC1群体为试验材料,通过研究分析,最终发现黄瓜炭疽病抗性是由一对单隐性基因控制的,感病对抗病为不完全显性。除此之外,还将与炭疽病抗性相关基因的一个共显性AFLP 标记转化为SCAR 标记。Pan 等[73]以150Gy14 和9930 为亲本构建的重组自交系以及1043 个F2为材料,通过QTL 分析及dCAPs 鉴定等技术,最终将cla基因座与3 个预测基因定位至黄瓜5 号染色体32 kb区域,并且发现几乎在美国所有的黄瓜改良品种中抗性等位基因都来自PI197087。同年,Wang 等[74]研究表明,CsSGR基因是一个抗霜霉病、角斑病及炭疽病的基因,该基因是通过调控叶绿素降解进而使得黄瓜对多种病原菌有抗性,这为后续筛选抗感材料奠定了重要基础。Zhang 等[75]以PI183967 和931 为亲本构建了160 个F9重组自交系,而后对这160 个F9重组自交系和405 对SSR 引物进行了QTL 分析,研究结果表明,PI183967 幼苗对蔓枯病的抗性主要由2 对QTL 和多个主效QTL 控制。共检 测 到6 个 抗 性QTL,分 别 为gsb3.1、gsb3.2、gsb3.3、gsb4.1、gsb5.1及gsb6.1。在其中3 个季节均检测到5 号染色体上的gsb5.1,其表型变异率最高,为17.9%,位于SSR15321 和SSR07711 之间0.5 cM 处。
3 分子标记在黄瓜品种纯度检测上的应用
品种纯度是种子质量评价和种子等级评价的重要指标[76]。品种纯度的检测对农业生产及销售等方面具有重要价值。而通过SSR 分子标记能够迅速可靠地检测品种纯度。
李春等[77]通过在240 对黄瓜SSR 引物中筛选出17 对亲本间多态的纯合引物,最终确定了Cs100和Cs109 两对SSR 标记,快速准确地鉴定了华南型黄瓜川绿15 号的种子纯度。孟淑春等[78]利用分子标记技术,从10 对特异性分子标记的SSR 引物中筛选出最为清晰的引物SSR05748 对京研绿翡翠黄瓜进行纯度鉴定,结果与田间鉴定一致。赵海燕等[79]利用SSR 分子标记技术鉴定了黄瓜新品种科润99,结果与田间鉴定结果几乎一致。杨宏等[80]利用164 对全基因覆盖的SSR 引物对亲本DNA 扩增,其中28 对引物有多态性,这些引物扩增得到的特征性片段构成了川绿2号亲本的DNA 指纹图谱。孟淑春等[81]以京研冬美9 号的父本、母本和F1代为试验材料,通过72 对SSR 引物对这些材料进行了多态性筛选,最终成功鉴定了京研冬美9 号种子纯度并且筛选出 2 对特异性引物 SSR17922 和SSR02218,通过SSR 分子标记进行了纯度鉴定,与田间鉴定结果相吻合。SSR 分子标记在黄瓜纯度检测上的应用已经比较成熟,多年以来通过SSR 分子标记对黄瓜纯度检测的报道较多。通过分子标记对黄瓜进行纯度检测与田间鉴定结果几乎没有差异,同时具有效率高、节省人力物力的优点。
4 总结与展望
笔者通过对黄瓜相关分子标记研究进展进行综述,发现关于黄瓜分子标记在前些年应用较多的包括AFLP、SCAR 等分子标记;近些年来,SSR 分子标记的应用比较广泛,普遍应用于黄瓜研究各个方面。对于SNP 标记,目前在黄瓜研究上的应用主要包括指纹图谱构建、遗传多样性分析、黄瓜杂交种鉴定[82-84]等方面,但在黄瓜上的研究应用相对其他分子标记较少。SNP 标记具有更好的稳定性和准确性,期望在以后黄瓜分子研究中能更多应用到SNP 标记。
黄瓜分子标记具有很高的应用价值,在未来仍会继续发展。要将分子标记辅助选择与传统育种相结合,合理利用多态性丰富的分子标记,并根据研究的对象和目的,有针对性地选用合适的分子标记。对于黄瓜抗病性育种,目前大多数是对霜霉病、白粉病、枯萎病等主要病害,而黄瓜灰霉病、蔓枯病、根腐病等病害相关分子标记需要进一步研究。另外,随着时代发展,品质育种越发重要,与黄瓜品质基因紧密连锁的分子标记有待于进一步研究。
