组成及比例和制备工艺对欧前胡素-黄芩苷/葛根素共无定形系统形成和储存稳定性的影响
2023-11-07曾慧玲蒋且英赵国巍欧阳琪廖正根
童 雨,曾慧玲,蒋且英,赵国巍,欧阳琪,姜 晟,廖正根*
组成及比例和制备工艺对欧前胡素-黄芩苷/葛根素共无定形系统形成和储存稳定性的影响
童 雨1,曾慧玲1,蒋且英2,赵国巍1,欧阳琪1,姜 晟1,廖正根1*
1. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004 2. 江西中医药大学 实验动物科技中心,江西 南昌 330004
研究组成、比例及制备工艺对欧前胡素-黄芩苷/葛根素共无定形系统(imperatorin-baicalin/puerarin co-amorphous system,Imp-Bai/Pue@CAS)形成和储存物理稳定性的影响。采用偏光显微镜、X射线粉末衍射、差示扫描量热分析等方法对喷雾干燥法、旋转蒸发法和低温研磨法3种制备方法制备的不同比例的欧前胡素-黄芩苷样品和欧前胡素-葛根素样品进行物态表征;对室温,40 ℃及40 ℃、75%相对湿度3种储存条件下的CAS样品[Imp-Bai@CAS(1∶8、1∶10、1∶12)和Imp-Pue@CAS(1∶2、1∶3)]物态的动态变化进行物态表征;结合涂膜法和3种制备方法(喷雾干燥法、旋转蒸发法和低温研磨法)研究欧前胡素、黄芩苷和葛根素3种成分结晶趋势。当欧前胡素和黄芩苷/葛根素组合时,物质的量比分别达到1∶8和1∶2,或更高比例的黄芩苷/葛根素、喷雾干燥条件下可形成共无定形系统(CAS),而旋转蒸发法和低温研磨法条件下未能形成CAS;欧前胡素-葛根素共无定形系统(Imp-Pue@CAS)的储存稳定性和葛根素比例呈正相关,而欧前胡素-黄芩苷1∶8共无定形系统[Imp-Bai@CAS(1∶8)]储存稳定性最佳;3种成分的结晶趋势为欧前胡素>黄芩苷>葛根素。2种成分组合形成CAS时,结晶更慢的成分比例高有利于CAS的形成;喷雾干燥工艺更易制成Imp-Bai/Pue@CAS;合适的比例有利于维持CAS的储存物理稳定性。
欧前胡素;黄芩苷;葛根素;组成;比例;制备工艺;共无定形系统;物理稳定性;喷雾干燥法;旋转蒸发法;低温研磨法;结晶
许多活性成分难溶于水,生物利用度低,限制其制剂开发和应用[1]。有研究表明,将药物无定形化是改善难溶性成分溶解度的有效手段,但是单组分无定形药物属于热力学不稳定状态,极易在制备和贮存中重结晶,从而失去溶出优势[2];因此,物理稳定性,包括形成和储存稳定性是药物能否制成无定形制剂的重要评价指标[3]。目前,常采用一定的制备方法将药物与聚合物辅料制备成无定形聚合物固体分散体以提高其稳定性[4],但传统的固体分散体也存在着聚合物易吸湿、药物和聚合物相容性差、载药量低等问题[5];而将药物与小分子辅料或另一种药物制成共无定形系统(co-amorphous system,CAS)因可能克服聚合物固体分散体的吸湿性和载药量低等问题,同时,可实现具有协同作用和联合作用的药物组合等优点,而逐渐成为固体分散体技术发展的新方向[6]。已有研究表明,聚合物的种类、比例及制备方法对聚合物固体分散体的制备和储存稳定性均有重大影响[7-9],而CAS的研究主要集中在药辅比1∶1,通过研磨法制成CAS的性能评价方面[10-11],因此,有必要研究组成与比例及制备工艺对形成和储存稳定性的影响。
具有相同药理活性或协同作用的药物-药物组合是CAS的研究方法之一[12]。白芷-黄芩、白芷-葛根是中药常用药对[13],分别常用于治疗鼻炎[14]和头痛[15]。欧前胡素、黄芩苷和葛根素分别是白芷、黄芩和葛根中的有效成分,且均为难溶性成分[16-18]。而欧前胡素[19]和黄芩苷[20]都对鼻炎、哮喘等呼吸道黏膜慢性炎症有治疗效果;欧前胡素[21]和葛根素[22]都可以用于偏头痛的治疗。同时,本课题组的前期实验发现欧前胡素对黄芩苷[23]和葛根素[24]有促吸收作用。
基于3种成分的来源、潜在临床价值以及联合用药在生物药剂学行为上的有益作用,欧前胡素与黄芩苷、欧前胡素与葛根素分别有开发为治疗鼻炎和偏头痛组合制剂的潜能,故本实验以欧前胡素-黄芩苷/葛根素为模型,结合方剂中2个药对白芷-黄芩/葛根的比例及各味药材中欧前胡素[25]、黄芩苷[26]及葛根素含量范围[27],研究药物-药物组成、比例及制备工艺对CAS的形成和储存稳定性的影响,为CAS的处方设计与工艺选择提供指导。
1 仪器和材料
1.1 仪器
B-290型小型喷雾干燥机,瑞士Büchi公司;BAS124S型电子天平,赛多利斯科学仪器北京有限公司;Oxford Diffraction型X射线衍射仪,日本Rigaku公司;Genius3型漩涡混合器,德国IKA集团;明美MshotMS60型偏振光显微镜(polarized microscope,PLM),广州市明美光电技术有限公司;Diamond DSC型差示扫描量热分析仪,美国Perkin Elmer公司;Plus-E2-10TH型衡量分析型超纯水机,南京易普易达科技发展有限公司;OBS-2000型旋转蒸发仪,上海爱朗仪器有限公司;DZF-6050型真空干燥箱,上海市新苗医疗器械制造有限公司。
1.2 材料
欧前胡素原料药(批号AF21100901,质量分数98.0%)、黄芩苷原料药(批号AF21021101,质量分数98.0%),成都埃法生物科技有限公司;葛根素原料药,质量分数98.0%,批号CPG20190518,西安昊轩生物科技有限公司;纯化水,Milli-Q水纯化系统自制;其他试剂均为分析纯。
2 方法与结果
2.1 样品制备
2.1.1 不同比例CAS的制备 分别按物质的量比2∶1、1∶1、1∶2、1∶4、1∶6、1∶8、1∶10、1∶12(各组合中欧前胡素均称取0.100 g,黄芩苷分别称取0.083、0.165、0.330、0.661、0.991、1.321、1.652、1.982 g)及3∶1、2∶1、1∶1、1∶2、1∶3(各组合中欧前胡素均称取0.100 g,葛根素分别称取0.051、0.077、0.154、0.308、0.462 g)称取欧前胡素-黄芩苷、欧前胡素-葛根素原料药,加无水乙醇超声完全溶解后进行喷雾干燥(喷雾干燥条件为雾化气为氮气,雾化压力0.2 MPa;蠕动泵以8.4 mL/min体积流量抽取溶液,氮气以40 m3/h的体积流量运行,进口温度设置为60 ℃),制备CAS(Imp-Bai@CAS和Imp-Pue@CAS)。
2.1.2 不同制备方法条件下CAS的制备
(1)喷雾干燥法制备CAS:分别按物质的量比1∶0、1∶8、1∶10、1∶12、0∶1及1∶2、1∶3、0∶1称取欧前胡素-黄芩苷原料药和欧前胡素-葛根素原料药(除1∶0及0∶1组合中原料药称取1.000 g外,其余组合与“2.1.1”项中相同组合下各物质的称取量相同),加无水乙醇超声完全溶解后进行喷雾干燥(条件同“2.1.1”项),制备CAS(Imp-Bai@ CAS和Imp-Pue@CAS)。
(2)低温研磨法制备CAS:按喷雾干燥法比例称取欧前胡素-黄芩苷、欧前胡素-葛根素原料药,采用等量递增法初步混合后、在冷藏过的研钵中于冰水浴条件下研磨,每研磨3 min,停下间隔约1 min后继续研磨,持续1 h,制备CAS(Imp-Bai@CAS和Imp-Pue@CAS)。
(3)旋转蒸发法制备CAS:按喷雾干燥法比例称取欧前胡素-黄芩苷、欧前胡素-葛根素原料药,用无水乙醇超声完全溶解后,倒入梨形瓶中,55 ℃水浴真空(−0.1 MPa)旋转蒸发去除溶剂,制备CAS(Imp-Bai@CAS和Imp-Pue@CAS)。
2.1.3 物理混合物(physical mixture,PM)的制备 分别按物质的量比1∶8、1∶10、1∶12和1∶2、1∶3称取欧前胡素-黄芩苷和欧前胡素-葛根素原料药(投药量同“2.1.2”项),过100筛后采用等量递增法初步混合,再利用漩涡混合器震动混合10 min,得到不同物质的量比的PM(Imp-Bai@PM和Imp-Pue@PM)。
2.2 固态表征
2.2.1 PLM 分别取欧前胡素、黄芩苷、葛根素原料药和“2.1.1”“2.1.3”项下各制备样品适量置于载玻片上,用液体石蜡均匀分散开,在40×10倍偏光显微镜下观察,图像信息用D3K-MS软件采集。结果见图1。

图1 晶体、PM和CAS的PLM图
原料药和Imp-Bai@PM、Imp-Pue@PM中会出现明显的双折射现象,表明样品是晶体。欧前胡素-黄芩苷、欧前胡素-葛根素喷雾干燥样品中,物质的量比分别为2∶1~1∶6、3∶1~1∶1时,能看到双折射现象,表明样品中有晶体;物质的量比分别为1∶8~1∶12、1∶2~1∶3时,双折射现象消失,表明样品为CAS形态;提示随黄芩苷/葛根素比例提高有利于CAS形成。
2.2.2 粉末X射线衍射法(powder X-ray diffraction,PXRD) 分别取欧前胡素、黄芩苷、葛根素原料药和各制备样品,使用X射线衍射仪进行观测,光源为Cu靶Kα射线,电压50 kV,管点流1.0 mA,步长0.02°,步时10 s,扫描范围25°~45°。PXRD结果见图2~5。
图2、3分别显示3种原料药,物理混合物和不同比例的欧前胡素-黄芩苷及欧前胡素-葛根素喷雾干燥样品的PXRD结果。结果显示欧前胡素、黄芩苷和葛根素原料药均出现晶体衍射峰。Imp-Bai@ PM、Imp-Pue@PM的PXRD图基本是原料药PXRD图谱的叠加。欧前胡素-黄芩苷和欧前胡素-葛根素物质的量比分别为2∶1~1∶6和3∶1~1∶1喷雾干燥制成的样品中,都出现了欧前胡素晶体衍射峰,但未出现黄芩苷和葛根素的晶体衍射峰,说明样品中有欧前胡素晶体存在;直至2种组合物质的量比分别为1∶8~1∶12和1∶2~1∶3的样品中,没有结晶峰,表明系统全为CAS。结果还显示,随着黄芩苷/葛根素比例的增加,欧前胡素晶体特征峰逐渐减少,直至欧前胡素-黄芩苷、欧前胡素-葛根素物质的量比分别为1∶8、1∶2时,欧前胡素晶体特征峰完全消失。

图2 欧前胡素、黄芩苷晶体,不同比例Imp-Bai@PM和喷雾干燥法制备的不同比例Imp-Bai@CAS样品的PXRD图
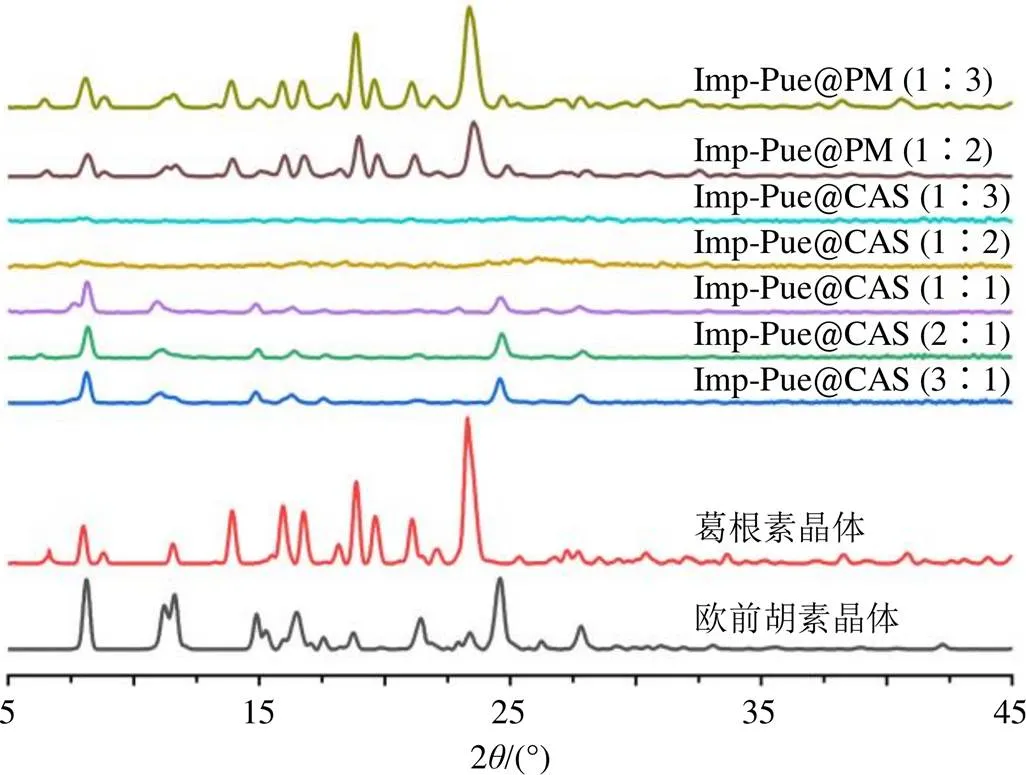
图3 欧前胡素、葛根素晶体,不同比例Imp-Pue@PM和喷雾干燥法制备的不同比例Imp-Pue@CAS样品的PXRD图

图4 不同方法制备单组分无定形PXRD图
图4显示3种方法制备的欧前胡素样品均有晶体特征峰存在;低温研磨法和旋转蒸发法制备的黄芩苷品中有晶体特征峰,而喷雾干燥的样品中特征峰消失,说明黄芩苷无定形只能由喷雾干燥法制成;低温研磨法制备的葛根素样品中有晶体特征峰,旋转蒸发法和喷雾干燥法制备的样品中特征峰消失,说明葛根素无定形可由喷雾干燥法和旋转蒸发法制成。欧前胡素-黄芩苷1∶8、1∶10、1∶12样品和欧前胡素-葛根素1∶2、1∶3样品可以形成CAS。进一步用低温研磨法、旋转蒸发法制备相应比例的样品。
图5显示由低温研磨法和旋转蒸发法制备的3种欧前胡素-黄芩苷及2种欧前胡素-葛根素物质的量比的样品中都有着不同程度的晶体衍射峰,只有喷雾干燥法的样品中衍射峰消失。说明只有喷雾干燥法容易制备Imp-Bai@CAS和Imp-Pue@CAS。
2.2.3 差示扫描量热法(differential scanning calorimetry,DSC)分析 采用差示扫描热分析仪对各原料药,各样品进行热行为测试,原料药和样品各约7 mg放于铝盘中,氮气为保护气,升温速率10 ℃/min,从30 ℃升温至250 ℃。数据用Netzsch Proteus热分析软件(Version 4.2)处理,结果见图6、7。欧前胡素、黄芩苷、葛根素3种原料药分别在在102.0、215.3、213.0 ℃处有1个吸热熔融峰。Imp-Bai@PM、Imp-Pue@PM的DSC图在101 ℃左右和213 ℃/233 ℃各有1个吸热熔融峰,分别对应欧前胡素、黄芩苷/葛根素的吸热熔融峰,但Imp-Pue@PM中葛根素的吸热熔融峰和葛根素原料药相比有较大移动。欧前胡素-黄芩苷物质的量比为1∶8~1∶12制成的样品中101 ℃和213 ℃处的熔融峰消失,且分别在63.95、65.09、66.86 ℃处出现了1个玻璃化转变温度(g);欧前胡素-葛根素物质的量比为1∶2和1∶3制成的样品中吸热熔融峰消失,分别在55.5 ℃和56.9 ℃出现了唯一的g。DSC图还显示黄芩苷过熔点后降解;欧前胡素-黄芩苷组合中在160 ℃出现了1个尖锐的放热峰,并在196 ℃出现吸热峰,随后降解。由于吸热峰的位置更靠近黄芩苷的吸热峰,提示在160 ℃出现的放热峰应为黄芩苷的重结晶。

图6 原料药和物理混合物DSC图

图7 不同比例共无定形DSC图
2.3 结晶倾向测定
根据Van Eerdenbrugh等[28]测定活性成分结晶趋势的方法,稍作修改,即分别称取欧前胡素、黄芩苷、葛根素原料药各0.015 g,用无水乙醇溶解后定容至10 mL。取3片干净的玻璃载玻片,分别用移液枪取100 μL的药物乙醇溶液滴在载玻片上,另取一片干净载玻片将药液快速刮平,使乙醇快速挥发。将载玻片室温下放置30 min后,在偏振光显微镜下观察。观察后将载玻片放于真空干燥箱中室温干燥24 h(真空度为−0.1 MPa)后,取出放于盛有变色硅胶的干燥器中室温保存,1周后取出再次用偏振光显微镜观察结晶情况,结果见图8。室温下放30 min后,欧前胡素体系出现了大量的双折射现象,表明欧前胡素已经结晶;黄芩苷和葛根素在室温下放30 min后未见到明显的双折射现象,表明30 min内2成分未结晶,但在室温储放7 d后均出现了大量的双折射现象,表明黄芩苷和葛根素贮存的7 d中发生了结晶。
2.4 储存稳定性考察
将欧前胡素-黄芩苷物质的量比为1∶8~1∶12样品和欧前胡素-葛根素物质的量比1∶2~1∶3样品室温真空干燥(真空度为−0.1 MPa)24 h后,分别放在室温、40 ℃的盛有变色硅胶的干燥器及40 ℃、75%相对湿度(relative humidity,RH)的干燥器中(盛有饱和NaCl溶液),3种储存条件下的样品在0 d取样后,室温和40 ℃条件储存样品每月,40 ℃、75% RH每2周取样用于PXRD。

图8 3种成分溶剂蒸发后不同时间PLM图
3种储存条件下不同储存时间欧前胡素-葛根素的PXRD图见图9,Imp-Pue@CAS(1∶2)在40 ℃储存条件下,1个月内出现了欧前胡素衍射峰,表明存在欧前胡素晶体;室温储存条件下,7个月内出现了欧前胡素和葛根素晶体衍射峰,表明存在欧前胡素和葛根素晶体;相同储存条件下,Imp-Pue@ CAS(1∶3)未见衍射峰,表明两者仍然以CAS存在。在40 ℃、75% RH条件下储存2周,欧前胡素-葛根素物质的量比1∶2和1∶3样品中均出现了欧前胡素晶体衍射峰和葛根素衍射峰,表明均既存在欧前胡素晶体,也存在葛根素晶体,但欧前胡素-葛根素物质的量比1∶3样品的衍射峰数量更少,峰面积更小,表明物质的量比1∶3样品的结晶程度小于物质的量比1∶2样品。结果显示,物质的量比1∶3的Imp-Pue@CAS物理稳定性强于物质的量比1∶2的样品。
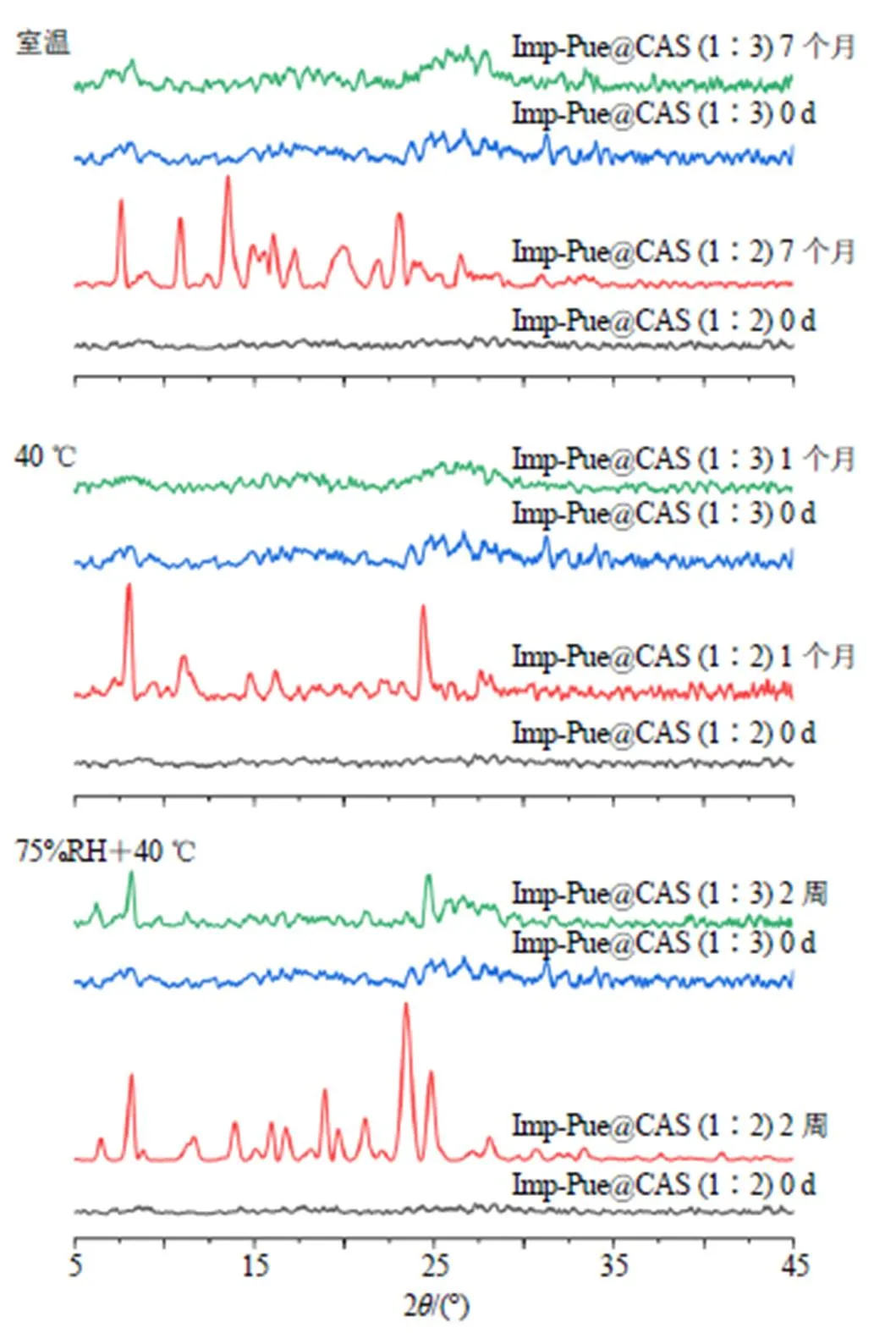
图9 不同储存条件下不同比例Imp-Pue@CAS不同时间的PXRD图
3种储存条件下不同储存时间欧前胡素-黄芩苷的PXRD图见图10,在室温下储存6个月或40 ℃条件下储存2个月后,Imp-Bai@CAS(1∶8)未见衍射峰,但物质的量比为1∶10和1∶12的欧前胡素-黄芩苷样品均出现了衍射峰;在40 ℃、75% RH条件下储存2周后,所有样品均出现衍射峰,但欧前胡素-黄芩苷(1∶8)样品衍射峰数量明显更少,且峰面积更小,这些结果表明物质的量比为1∶8的Imp-Bai@CAS更稳定。同时室温和40 ℃储存条件下,物质的量比为1∶10和1∶12的欧前胡素-黄芩苷样品均在25.4°处出现黄芩苷的特征衍射峰,而在高温高湿条件下尽管25.4°等处未出现黄芩苷特征衍射峰,但是在5.5°、6.6°、13°处出现了新的特征峰,这些峰与黄芩苷晶型的特征峰一致[29],表明存在黄芩苷晶体,这些结果至少说明欧前胡素没有先于黄芩苷结晶析出。

图10 不同储存条件下不同比例Imp-Bai@CAS不同时间PXRD图
3 讨论
3.1 比例对CAS形成的影响
PLM和PXRD的结果显示,随着黄芩苷/葛根素比例的增加,至欧前胡素-黄芩苷、欧前胡素-葛根素物质的量比分别为1∶8、1∶2时,喷雾干燥样品和双折射现象消失,表明欧前胡素-黄芩苷/葛根素2种组合中各成分均以无定形形式存在;DSC结果显示其仅有1个g,说明样品形成了均匀混合的CAS[30]。实验结果和改变聚合物比例能促进固体分散体的形成一致[10],表明比例会影响CAS的形成。欧前胡素-黄芩苷、欧前胡素-葛根素物质的量比分别为1∶8、1∶2时,2种组合喷雾干燥才能形成CAS,提示不同药物组合形成CAS的比例不同。
3.2 组成对CAS形成物理稳定性的影响
和黄芩苷相比,葛根素可以用更少的量和欧前胡素形成CAS,推测是由成分本身结晶趋势的差异造成的。因此,对3种成分的结晶趋势进行测定。根据Van Eerdenbrugh等[28]的分类标准,I类(快速结晶):在样品旋涂30 min内,结晶程度至少达到半结晶;II类(中等结晶速度):样品在干燥容器放置7 d后,结晶度至少达到半结晶;III类(缓慢结晶):样品在干燥容器放置7 d后,结晶度仍是微量结晶或无结晶。显然,欧前胡素属于I类快速结晶药物;黄芩苷和葛根素属于II类中等结晶速度药物。Van Eerdenbrugh等[28]还提出结晶速度快的药物一般相对分子质量较小,结构简单,分子柔性差。而欧前胡素相对分子质量为270.28,比黄芩苷/葛根素要小,且结构中有更多的环状结构和双键,分子柔性较差,故更易结晶,和本实验结果一致。但由于黄芩苷/葛根素分别属于黄酮/异黄酮类化合物,结构上相似,相对分子质量相近,分别为446.37和416.38,且涂膜法无法区分黄芩苷和葛根素的结晶能力,进一步用3种制备方法考察2种单体成分形成无定形的难易,结果显示黄芩苷无定形只能由喷雾干燥法制成;葛根素无定形可由喷雾干燥法和旋转蒸发法制成,提示葛根素比黄芩苷更容易形成无定形。由以上结果可知3种成分的结晶能力依次是欧前胡素>黄芩苷>葛根素。
喷雾干燥法制备Imp-Bai/Pue@CAS时,低黄芩苷/葛根素组合中出现的结晶主要为欧前胡素晶体,可能与欧前胡素为I类快速结晶药物有关,表明CAS的形成与组成自身的无定形形成能力密切相关,组成形成无定形能力越强在CAS中越易形成无定形。提高黄芩苷/葛根素的占比,欧前胡素-黄芩苷和欧前胡素-葛根素物质的量比分别达到1∶8和1∶2时才能形成CAS,欧前胡素-黄芩苷和欧前胡素-葛根素2种药物组合需要不同比例才能形成CAS,可能与黄芩苷和葛根素的无定形形成能力不同有关。一般III类结晶速度的药物即使没有辅料也能形成无定形,I类结晶速度的药物通常必须与辅料达到紧密的分子水平混合,且需要较多的辅料才能形成固体分散体[31]。在本实验中为了抑制难以形成无定形的成分结晶(如欧前胡素),自身无定形形成能力越低的组分(如黄芩苷),需要的比例越高,反之则越低(如葛根素),可能是后者更不易有序排列导致其与欧前胡素更易达到分子水平的混合。
3.3 不同制备方法对CAS形成的影响
研磨法是通过高速撞击力和摩擦力在短时间内对样品进行充分混合,改变样品的存在状态,使其成为无定形[32]。在本实验中通过在冷藏过的研钵中对药物进行手动研磨,一方面,可能研磨时对药物施加的力不足,导致药物的晶体结构破坏不完全;另一方面,尽管以冰水浴的方式控制研磨时的温度,但由于研磨时产生大量的热会诱导样品迅速重结晶[33],PXRD表征图谱显示2种药物组合中2中成分的衍射峰均存在,提示2种成分均存在晶体形式。
旋转蒸发法和喷雾干燥法都属于溶剂挥发法,但旋转蒸发法的溶剂是逐渐蒸发的,而喷雾干燥法中药液在接触到热气流后溶剂会迅速挥发,挥发速度要远快于旋转蒸发法。一般越快的挥发速度越能防止药物分子重排成晶体,从而更易制成无定形产品[34-35],所以在本实验中只有喷雾干燥法成功制备CAS。
3.4 组成与比例对CAS储存物理稳定性的影响
物质的量比1∶3的Imp-Pue@CAS的储存稳定性比物质的量比1∶2的样品更稳定;物质的量摩尔比为1∶8的Imp-Bai@CAS的储存稳定性比物质的量比1∶10和1∶12的样品更稳定,表明CAS的储存稳定性会受到比例的影响。CAS的稳定性和成分之间的相互“载药量”有关,任一成分过量都可能会破坏系统的稳定性,使其恢复到结晶状态[36-37],因此,欧前胡素-葛根素中更高的葛根素占比稳定性更高,而欧前胡素-黄芩苷中更低的黄芩苷占比稳定性更高,可能原因是欧前胡素-葛根素2种组分比例相差不大,因而2种组分均无显著的过量,而欧前胡素-黄芩苷2种组分比例差值过大,因而黄芩苷显著过量。由于易结晶的药物在无定形系统中更易结晶[31],因而欧前胡素-葛根素中易结晶的欧前胡素先于葛根素结晶;而欧前胡素-黄芩苷组成中易结晶的欧前胡素并未先于黄芩苷结晶,也提示欧前胡素-黄芩苷中可能超出了欧前胡素的最大“载药量”,从而过多的黄芩苷分子对欧前胡素形成空间位阻,使欧前胡素不先于黄芩苷结晶。
4 结论
本实验3种组分的结晶趋势依次为欧前胡素>黄芩苷>葛根素。组成和比例会协同影响CAS的稳定性。当结晶速度快的成分和结晶速度慢的成分构建CAS时,一定比例条件下,结晶快的成分往往会先重结晶,适度提高结晶速度慢成分的比例(Imp-Pue@CAS中的葛根素)可提高CAS的形成和储存稳定性;但增加的比例过高(如Imp-Bai@CAS中的黄芩苷),超出了组合成分的最大“载药量”,更高比例的组分易结晶,反而会使CAS的储存稳定性下降。
总之,在构建药物-药物CAS以发挥药物的联合或协同治疗作用时,药物组合的选择除考虑其药理/药动学上的有益相互作用外,还应充分考虑药物本身的无定形形成能力。对于无定形形成能力为I类的药物而言,选择无定形形成能力强的药物作为共形成体更有利于构建稳定的CAS;如果选择无定形形成能力相对较差的药物作为共形成体,则需要更高的比例以在空间上更大程度上隔离I类药物分子的相互作用,从而阻止其结晶,同时应考虑到,由于共形成体无定形形成能力有限,过高比例又会因自身浓度过高而增加分子碰撞机会导致自身结晶,因此应进行最适比例的研究。从工艺角度考虑,喷雾干燥因溶剂挥发速度快而易制成CAS,同时因该工艺可实现工业化应用,因此是制备CAS的可行工艺选择。
利益冲突 所有作者均声明不存在利益冲突
[1]Oliveira V D S, de Almeida A S, Albuquerque I D S,. Therapeutic applications of solid dispersions for drugs and new molecules:andactivities [J]., 2020, 12(10): 933.
[2]Wang J, Chang R M, Zhao Y N,. Coamorphous loratadine-citric acid system with enhanced physical stability and bioavailability [J]., 2017, 18(7): 2541-2550.
[3]Baird J A, Van Eerdenbrugh B, Taylor L S. A classification system to assess the crystallization tendency of organic molecules from undercooled melts [J]., 2010, 99(9): 3787-3806.
[4]Mendonsa N, Almutairy B, Kallakunta V R,. Manufacturing strategies to develop amorphous solid dispersions: An overview [J]., 2020, 55: 101459.
[5]Jelić D. Thermal stability of amorphous solid dispersions [J]., 2021, 26(1): 238.
[6]Shi Q, Wang Y N, Moinuddin S M,. Co-amorphous drug delivery systems: A review of physical stability,andperformance [J]., 2022, 23(7): 259.
[7]Fu J P, Cui L, Yang C B,. Screen for inhibitors of crystal growth to identify desirable carriers for amorphous solid dispersions containing felodipine [J]., 2018, 19(3): 1231-1242.
[8]Kawakami K, Bi Y, Yoshihashi Y,. Time-dependent phase separation of amorphous solid dispersions: Implications for accelerated stability studies [J]., 2018, 46: 197-206.
[9]Han G Q, Wang B, Jia M L,. Optimization and evaluation of resveratrol amorphous solid dispersions with a novel polymeric system [J]., 2022, 19(8): 8019-8034.
[10]Ruponen M, Rusanen H, Laitinen R. Dissolution and permeability properties of co-amorphous formulations of hydrochlorothiazide [J]., 2020, 109(7): 2252-2261.
[11]Wang J, Chang R M, Zhao Y N,. Coamorphous loratadine-citric acid system with enhanced physical stability and bioavailability [J]., 2017, 18(7): 2541-2550.
[12]Han J W, Wei Y F, Lu Y,. Co-amorphous systems for the delivery of poorly water-soluble drugs: Recent advances and an update [J]., 2020, 17(10): 1411-1435.
[13]胥庆华. 中药药对大全 [M]. 北京: 中国中医药出版社, 1996: 67-68.
[14]杨若俊, 熊磊, 代丽, 等. 熊磊辨治小儿过敏性鼻炎的思路及常用药对 [J]. 中医药导报, 2020, 26(8): 91-92.
[15]程京艳, 张贵君, 黄睿. 配伍对葛根中四种黄酮类药效组分的影响 [J]. 时珍国医国药, 2014, 25(5): 1115-1116.
[16]徐志杰. 欧前胡素固体分散体凝胶骨架缓释片的制备及药动学评价 [J]. 中草药, 2022, 53(17): 5321-5329.
[17]李晶, 刘访遥, 陈剑超. 黄芩苷PEG-PCL纳米胶束的体外评价、细胞内分布及抗心肌细胞凋亡的研究 [J]. 中国现代应用药学, 2020, 37(12): 1427-1432.
[18]吴秀娟, 庞遵霆, 杨思彤, 等. 共无定形技术改善葛根素水溶性及增溶机制研究 [J]. 药学学报, 2021, 56(2): 585-592.
[19]咸哲民, 姜京植, 赵雨喆, 等. 欧前胡素通过Nrf2/HO-1抗氧化途径对哮喘模型小鼠气道炎症的影响 [J]. 中草药, 2018, 49(19): 4596-4601.
[20]杨婧兴, 蔡超, 赵妍, 等. 黄芩苷在呼吸道黏膜慢性炎症性疾病中的抗炎作用及机制研究进展 [J]. 首都医科大学学报, 2022, 43(6): 919-923.
[21]李时凤. 欧前胡素对硝酸甘油型偏头痛模型大鼠治疗作用的PK-PD研究 [D]. 成都: 西华大学, 2016.
[22]张新, 黄国锋. 葛根素注射液治疗偏头痛急性发作临床观察 [J]. 黑龙江医学, 2006, 30(7): 529.
[23]Zhu M L, Liang X L, Zhao L J,. Elucidation of the transport mechanism of baicalin and the influence of aAngelicae Dahuricae extract on the absorption of baicalin in a Caco-2 cell monolayer model [J]., 2013, 150(2): 553-559.
[24]Liao Z G, Liang X L, Zhu J Y,. Transport properties of puerarin and effect of extract ofAngelicae dahuricae on puerarin intestinal absorption usingandmodels [J]., 2014, 28(9): 1288-1294.
[25]李玉华, 刘晶晶, 李景清, 等. HPLC法测定不同产地兴安白芷中欧前胡素与异欧前胡素的含量 [J]. 中国药品标准, 2021, 22(5): 465-470.
[26]郑如文, 刘港辉, 江志强, 等. 黄芩UPLC-DAD指纹图谱的建立及其黄芩苷和汉黄芩苷的含量研究 [J]. 中南药学, 2021, 19(9): 1898-1903.
[27]黄紫炎, 沈钱能, 李平, 等. 不同产地葛根饮片的UPLC指纹图谱结合多成分含量测定研究 [J]. 中国中药杂志, 2019, 44(10): 2051-2058.
[28]Van Eerdenbrugh B, Baird J A, Taylor L S. Crystallization tendency of active pharmaceutical ingredients following rapid solvent evaporation: Classification and comparison with crystallization tendency from undercooled melts [J]., 2010, 99(9): 3826-3838.
[29]朱理平, 梅雪锋, 王建荣, 等. 一种黄芩苷A晶型、其制备方法及其应用: 中国, CN104844669B [P]. 2017-08-29.
[30]Nair A, Varma R, Gourishetti K,. Influence of preparation methods on physicochemical and pharmacokinetic properties of co-amorphous formulations: The case of co-amorphous atorvastatin: Naringin [J]., 2020, 15(3): 365-379.
[31]Kawakami K. Crystallization tendency of pharmaceutical glasses: Relevance to compound properties, impact of formulation process, and implications for design of amorphous solid dispersions [J]., 2019, 11(5): 202.
[32]Żarów A, Zhou B, Wang X Q,. Spectroscopic and X-ray diffraction study of structural disorder in cryomilled and amorphous griseofulvin [J]., 2011, 65(2): 135-143.
[33]Martínez L M, Cruz-Angeles J, Vázquez-Dávila M,. Mechanical activation by ball milling as a strategy to prepare highly soluble pharmaceutical formulations in the form of co-amorphous, co-crystals, or polymorphs [J]., 2022, 14(10): 2003.
[34]王星星, 孟旭. 共无定形给药系统研究进展 [J]. 中国药事, 2019, 33(5): 544-554.
[35]方晓萍, 胡义, 卢山, 等. 共无定形药物的研究进展 [J]. 中国医药工业杂志, 2022, 53(7): 953-961.
[36]Martínez L M, Videa M, Sosa N G,. Long-term stability of new co-amorphous drug binary systems: Study of glass transitions as a function of composition and shelf time [J]., 2016, 21(12): 1712.
[37]Wu W, Ueda H, Lobmann K,. Organic acids as co-formers for co-amorphous systems - influence of variation in molar ratio on the physicochemical properties of the co-amorphous systems [J]., 2018, 131: 25-32.
Effects of composition, proportion and preparation process on formation and storage stability of imperatorin-baicalin/puerarin co-amorphous system
TONG Yu1, ZENG Hui-ling1, JIANG Qie-ying2, ZHAO Guo-wei1, OUYANG Qi1, JIANG Sheng1, LIAO Zheng-gen1
1. Key Laboratory of Modern Chinese Medicine Preparations, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Laboratory Animal Science Center, Jiangxi University of Chinese Medicine, Nanchang 330004, China
To study effects of composition, proportion and preparation process on the formation and storage physical stability of imperatorin-baicalin/puerarin co-amorphous system (Imp-Bai/Pue@CAS).Imperatorin-baicalin samples and imperatorin-puerarin samples with different proportions prepared by spray drying method, rotary evaporation method and low temperature grinding method were characterized by polarizing microscope, X-ray powder diffraction and differential scanning calorimetry. CAS samples [Imp-Bai@CAS (1:8, 1:10, 1:12) and Imp-Pue@CAS (1:2, 1:3)]were stored at room temperature, 40 ℃ and 40 ℃, 75% relative humidity, which were characterized by the dynamic change of the state. The crystallization trend of imperatorin, baicalin and puerarin was studied by coating method and three preparation methods (spray drying method, rotating evaporation method, low temperature grinding method).The molar ratios of imperatorin and baicalin/puerarin were 1:8 and 1:2, respectively. The co-amorphous system (CAS) could be formed under the conditions of spray drying, or higher proportion of baicalin/puerarin, while the CAS could not be formed under the conditions of rotary evaporation and low temperature grinding. The storage stability of imperatorin-puerarin co-amorphous system (Imp-Pue@CAS) was positively correlated with the proportion of puerarin, while imperatorin-baicalin 1:8 co-amorphous system [Imp-Bai@CAS (1:8)]had the best storage stability. The crystallization trends of the three components are as follows: imperatorin > baicalin > puerarin.When the two components are combined to form CAS, the higher proportion of components with slower crystallization is beneficial to the formation of CAS. Spray drying process is easier to make Imp-Bai/Pue@CAS; An appropriate ratio is beneficial to maintain the storage physical stability of the CAS.
imperatorin; baicalin; puerarin; component; proportion; preparation technology; co-amorphous system; physical stability; spray drying method; rotating evaporation method; low temperature grinding method; crystallization
R283.6
A
0253 - 2670(2023)21 - 6997 - 10
10.7501/j.issn.0253-2670.2023.21.008
2023-06-04
国家自然科学基金资助项目(82160751);江西中医药大学中药制剂技术与制药装备创新团队(CXTD22006)
童 雨,男,硕士研究生,研究方向为药物新剂型与新技术。E-mail: 2941367621@qq.com
通信作者:廖正根,男,教授,理学博士,博士生导师,从事中药制剂及新剂型研究。Tel: (0791)87118658 E-mail: lyzlyg@163.com
[责任编辑 郑礼胜]
