铁死亡相关肌肉骨骼系统疾病的概述及中医药干预进展
2023-11-07袁普卫康武林高亚丽白元帅王振凯
董 佩,袁普卫, *,康武林,高亚丽,白元帅,姚 彬,王振凯,刘 扬
·综 述·
铁死亡相关肌肉骨骼系统疾病的概述及中医药干预进展
董 佩1,袁普卫1, 2*,康武林2,高亚丽1,白元帅1,姚 彬1,王振凯1,刘 扬1
1. 陕西中医药大学,陕西 咸阳 712000 2. 陕西中医药大学附属医院,陕西 咸阳 712046
铁死亡是一种新型的细胞死亡形式,与铁过载和脂质过氧化有关,在许多疾病的发展中具有重要作用。骨质疏松症、骨关节炎、类风湿关节炎、骨肉瘤、脊髓损伤、肌少症等肌肉骨骼系统疾病严重影响患者生活质量,已成为全球公共卫生系统的主要负担。铁死亡与上述肌肉骨骼系统疾病的发生发展密切相关,表明铁死亡可能成为肌肉骨骼系统疾病的治疗的新靶点。中医药在肌肉骨骼系统疾病治疗中有其独特的优势,已有大量研究证实中医药通过铁死亡途径参与肌肉骨骼系统疾病的调节,显示出良好的研究前景。通过探讨铁死亡与肌肉骨骼系统疾病的关联,总结中医药通过介导铁死亡防治肌肉骨骼系统疾病研究进展,为开发新的治疗策略及中医药更好的治疗肌肉骨骼系统疾病治疗提供思路。
铁死亡;骨质疏松症;骨关节炎;类风湿关节炎;脊髓损伤;骨肉瘤;肌少症
细胞死亡模式分为程序性和非程序性细胞死亡2类[1]。自溶或异溶是非程序性细胞死亡的主要形式;程序性细胞死亡是一个活跃有序的过程,在生物体的进化、内部环境的稳定性和多系统的发展中具有重要作用,包括细胞凋亡、自噬、铁死亡和焦亡等[2]。铁死亡与其他程序性细胞死亡不同,是细胞死亡的一种非凋亡模式,主要特征是铁过载和脂质活性氧积累导致的细胞死亡[3]。骨质疏松症、骨关节炎、类风湿关节炎(rheumatoid arthritis,RA)、骨肉瘤、脊髓损伤、肌少症等肌肉骨骼系统疾病的发生发展与铁过载、脂质过氧化密切相关,铁死亡有望成为肌肉骨骼系统疾病治疗新的研究方向。中药具有资源丰富、安全性高、多靶点、多途径等优势。目前,国内外研究主要从分子机制、靶向调控及中药单体/活性成分、中药复方、针灸等角度探讨铁死亡调控对肌肉骨骼系统疾病的影响。基于此,通过对铁死亡的概述、机制及中医药治法干预铁死亡调节肌肉骨骼系统疾病的研究现状进行综述,为肌肉骨骼系统疾病的防治及进一步的药物开发提供新方向。
1 铁死亡概述
Dolma等[4]发现了一种具有诱导癌细胞死亡的新化合物Erastin,但其细胞死亡的方式与以往不同,没有核形态改变、DNA片段化和半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)活化,且这一过程不能被Caspase抑制剂逆转,是一种新型的细胞死亡模式。Yang等[5]和Yagoda等[6]发现Ras选择性致死化合物3(Ras-selective lethal 3,RSL3)与Erastin相似,并检测到活性氧和铁水平升高都与Ras信号传导密切相关。Dixon等[7]发现Erastin触发的细胞死亡的特征是铁依赖性活性氧的大量细胞内积累,因此,正式命名为这种细胞死亡为铁死亡。
铁死亡是一种新型的细胞死亡形式。在形态学上,主要表现为线粒体体积减少、双层膜密度增加,但细胞膜保持完整,细胞核大小正常[8];生化上通过谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)控制的细胞内微环境的氧化,产生大量活性氧,促进铁死亡[9]。总之,铁死亡涉及许多病理生理过程,其机制和调控途径复杂,涉及多种信号分子和代谢途径,参与多种疾病的发生和发展。
2 铁死亡的机制
2.1 铁代谢
铁参与各种重要蛋白酶的合成,是身体生命活动的基本元素[10-11]。铁代谢异常引起的铁过载是铁死亡的主要特征之一。铁通过与细胞膜上的转铁蛋白受体1(transferrin receptor 1,TFR1)结合进入细胞,其中金属还原酶(six-transmembrane epithelial antigen of prostate 3,STEAP3)将Fe3+还原为Fe2+。最后,二价金属转运蛋白1(recombinant divalent metal transporter 1,DMT1)将Fe2+释放到细胞质中的动态铁池(labile iron pool,LIP)中。LIP能够主动摄取细胞质中的游离铁,溶酶体中存在大量LIP[12]。因此,溶酶体被认为是导致铁死亡的主要细胞器[13]。过量的Fe2+通过铁转运蛋白1(ferroportin 1,FPN1)在细胞外运输,并储存在铁蛋白重链和轻链中。在生理条件下,铁蛋白提供强缓冲,调节对缺铁和铁过量的生理反应,维持体内平衡。在病理条件下,铁过载可以通过芬顿和哈伯-韦斯反应产生活性氧,诱导铁死亡[14]。
2.2 脂质过氧化
脂质过氧化是铁死亡的另一个关键因素。研究表明,脂质过氧化物会破坏脂质双分子层的稳定性,导致细胞膜崩解[15]。脂质组学分析表明,花生四烯酸(arachidonic acid,AA)和肾上腺酸是诱导铁死亡的关键因素,在羟基自由基存在下可以发生过氧化[16]。多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)容易发生脂质过氧化,因为亚甲基桥中存在高活性氢原子。羟基自由基可以通过链式反应直接与膜磷脂中的PUFAs相互作用,形成脂质过氧化物,攻击细胞膜并引发铁死亡[17]。脂质过氧化物分解产生的衍生物,包括4-羟基壬烯醛和丙二醛,可以与核酸和蛋白质反应,导致细胞的进一步破坏[18]。这些衍生物也可用作检测铁死亡和脂质过氧化的重要分子标志物。此外,Fe2+可用作脂氧合酶的辅助因子,催化PUFAs的脂质过氧化[19]。研究表明[20],溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)和长链脂酰辅酶A合成酶4(acyl-CoA synthase long chain member 4,ACSL4)都参与PUFAs的脂质过氧化,是铁死亡的重要分子标志物。
2.3 胱氨酸/谷氨酸逆向转运体(System Xc-)/谷胱甘肽/GPX4途径
GPX4是铁死亡的重要特异性标志物,可在铁死亡过程中将脂质过氧化物还原为脂质醇[21]。谷胱甘肽由甘氨酸、谷氨酸和半胱氨酸组成,是氧化应激反应中的重要抗氧化剂,以还原谷胱甘肽和氧化谷胱甘肽的形式广泛存在于细胞中。GPX50降解脂质过氧化物需要谷胱甘肽提供电子来完成该过程[22]。谷胱甘肽合成需要细胞内摄取半胱氨酸,半胱氨酸由System Xc-介导,System Xc-将细胞外胱氨酸转运到细胞中并进一步将其转化为半胱氨酸,然后用于谷胱甘肽生物合成[23]。研究表明,选择性抑制System Xc-导致细胞内谷胱甘肽降低,从而加剧活性氧积累并最终导致铁死亡[24-25]。
2.4 p53
Jiang等[26]研究发现,p53沉默的人肺癌H1299细胞经过活性氧处理后,细胞活性没有变化,而用活性氧处理p53激活后的细胞,其死亡率达到90%,加入铁死亡抑制剂铁抑素-1后,细胞死亡率降低40%,表明p53可诱导铁死亡。另有研究表明,p53可以抑制System Xc-对半胱氨酸的摄取,下调溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)亚基的表达,使谷胱甘肽过氧化物酶活性和细胞的抗氧化能力降低,活性氧增加,导致细胞铁死亡[27]。
综上所述,Fe3+通过与细胞膜上的TFR1结合进入细胞,其中STEAP3将Fe3+还原为Fe2+,DMT1将Fe2+释放到胞质中的LIP中,铁过载可以通过芬顿反应和哈伯-韦斯反应产生活性氧来诱导铁死亡。System Xc-将细胞外胱氨酸转运到细胞中并进一步将其转化为半胱氨酸,System Xc-的选择性抑制剂导致细胞内谷胱甘肽降低,从而加剧活性氧积累并导致铁死亡。p53可抑制System Xc-对半胱氨酸的摄取,通过下调SLC7A11亚基的表达,导致半胱氨酸依赖性谷胱甘肽过氧化物酶活性和细胞的抗氧化能力降低,脂质活性氧增加,进而导致细胞铁死亡。RSL3可通过拮抗GPX4诱导铁死亡,羟基自由基可通过链式反应直接与膜磷脂中的PUFAs相互作用形成脂质过氧化物,诱导铁死亡。具体机制见图1。
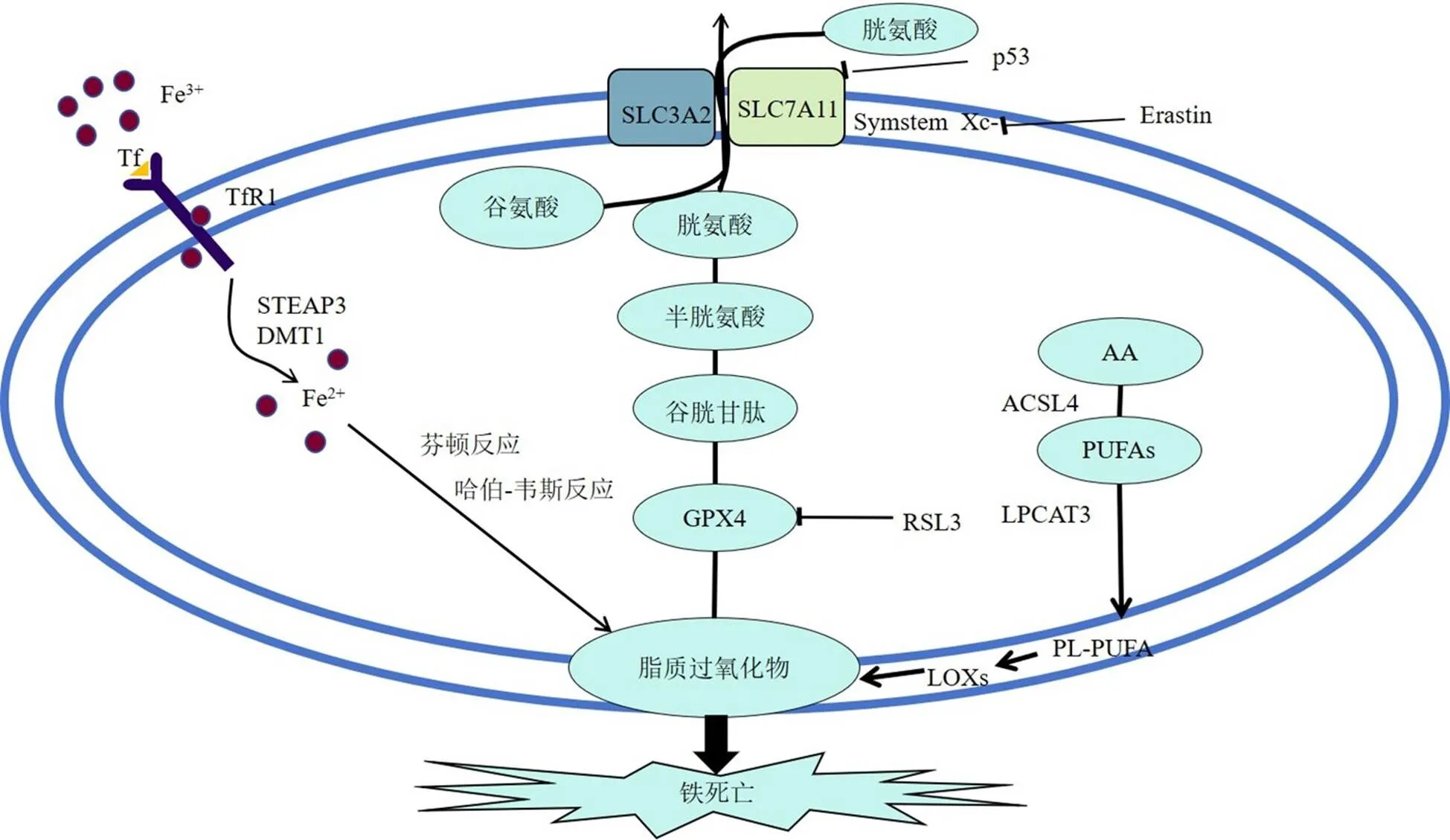
图1 铁死亡的机制
3 铁死亡与肌肉骨骼系统疾病的关联
大量研究表明铁死亡在肌肉骨骼系统疾病发病机制中具有重要作用,证实铁死亡与肌肉骨骼系统疾病的发病相关。因此,铁死亡的调控可能是治疗质疏松症、骨关节炎、类风湿关节炎、骨肉瘤、脊髓损伤、肌少症等肌肉骨骼疾病的潜在靶点。近年来,越来越多研究者专注于研究铁死亡在肌肉骨骼系统疾病领域的应用,现将其中的代表性疾病分别进行阐述。
3.1 骨质疏松症
随着全球人口的老龄化加剧,骨质疏松症的发病率快速攀升,已成为重要的公共健康问题。研究发现,铁过载是骨质疏松症发生的重要危险因素[28]。铁过载可以抑制成骨细胞的活性,促进破骨细胞的分化和成熟,导致骨形成与骨吸收的动态平衡被打破,引起骨质流失,最终导致骨质疏松症的发生[29]。长期给予右旋糖酐铁的小鼠组织中铁含量增加,骨成分发生变化,骨吸收增加,骨小梁稀疏和骨皮质变薄[30]。Qu等[31]发现唑来膦酸通过触发F-box蛋白9介导的p53泛素化和降解,促进破骨细胞铁死亡来减少骨量流失,从而治疗骨质疏松症。基于糖皮质激素诱导的骨质疏松症模型,Lu等[32]发现地塞米松10 μmol/L可以诱导小鼠的成骨细胞铁死亡,其机制与GPX4和System Xc-的下调有关。研究发现,高脂肪和高糖可激活p38信号传导,进而导致成骨细胞铁死亡和糖尿病患者骨质流失,而敲除甲基转移酶样3可抑制凋亡信号调节激酶1-p38通路的激活,导致铁死亡衰减[33]。Yang等[34]在糖尿病骨质疏松症的小鼠模型中发现血红素加氧酶-1(heme oxygenase-1,HO-1)等促铁死亡基因,靶向HO-1能抑制骨细胞中脂质过氧化的发生,并有效改善骨小梁结构紊乱。此外,铁螯合剂能有效抑制铁过载和破骨细胞分化,减少骨破坏,改善骨组织微结构,防止骨质流失[35]。控制铁过载可以在一定程度上维持铁稳态的平衡,可能是预防骨质疏松的有效手段之一[36]。Liu等[37]通过骨质疏松症动物模型和细胞模型,进一步阐明了铁死亡与骨质疏松的关系。多项研究表明铁死亡参与了骨质疏松症的发生发展,但是具体机制尚不清楚。
3.2 骨关节炎
骨关节炎是一种由多种因素引起的慢性退行性疾病。铁代谢异常被认为是骨关节炎发生发展的危险因素之一[38]。研究发现,骨关节炎患者滑液中铁的浓度明显高于健康人[39],此外,关节损伤程度与血清铁蛋白升高呈正相关。Miao等[40]发现随着GPX4的降低,软骨细胞对氧化应激的敏感性逐渐增加,表明GPX4在骨关节炎铁死亡中具有重要作用,此外,GPX4可以通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)/核因子-κB(nuclear factor-κB,NF-κB)途径加剧细胞外基质降解,导致骨关节炎的发生。Guo等[41]发现软骨细胞铁死亡可以刺激软骨细胞中基质金属蛋白酶13表达增加和胶原蛋白II表达降低。将铁抑素-I注射到骨关节炎小鼠模型中,可以上调II型胶原蛋白的表达并延缓骨关节炎发展[42]。另有研究发现,-甘露糖能通过抑制缺氧诱导因子-2α(hypoxia-inducible factor-2α,HIF-2α)介导的软骨细胞对铁死亡的敏感性来缓解骨关节炎的进展,表明-甘露糖是骨关节炎的潜在治疗策略[43]。此外,异常的细胞内铁代谢会导致大量的铁积累,继而参与滑膜变化、软骨变性和软骨下骨重塑的病理过程。滑膜炎症在骨关节炎的疼痛发生中可能具有重要作用,具体表现为滑膜内衬细胞增生、炎细胞浸润、血管增生。Luo等[44]研究发现,淫羊藿苷可激活System Xc-/ GPX4信号通路,降低GPX4、SLC7A11和SLC3A2L表达,从而保护滑膜细胞免于死亡。结合最新研究发现铁死亡与骨关节炎具有相关性,为骨关节炎药物治疗提供了新思路。
3.3 RA
RA是一种全身性炎症性疾病,其基本病理表现为滑膜炎,并逐渐出现软骨破坏、骨侵蚀,最终导致关节畸形和功能丧失,可并发一些严重的系统性疾病。研究发现,铁死亡在自身免疫性疾病和炎症性疾病中具有重要的调节作用,RA风险的增加可能与成纤维细胞样滑膜细胞(fibroblast like synovial cells,FLS)中抗氧化系统的功能障碍有关,抑制RA中FLS增殖和恢复滑膜稳态等多种策略有望作为其潜在的治疗方向[45]。人成纤维细胞特异蛋白1(human fibroblast specific protein1,FSP1)的异常表达可能与RA的发展有关,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和p38/JNK信号通路。基于抑制活性氧诱导的过氧化反应,FSP1可以抑制滑膜和软骨细胞铁死亡,进而延缓RA的进程[46]。Wu等[47]发现Erastin 40 mg/kg和TNF拮抗剂依那西普联合可以诱导成纤维细胞铁死亡,并延缓RA进展。此外,辅酶Q10是一种脂溶性抗氧化剂,是铁死亡的关键调节剂,FSP1通过与辅酶Q10结合来改善脂质过氧化并阻止铁死亡,延缓RA进展[48]。目前,铁死亡在RA的发生发展中具有重要作用,但具体机制仍需进一步研究。
3.4 骨肉瘤
骨肉瘤是发生在儿童和青少年中的一种恶性骨肿瘤,目死亡率较高,一些患者遭受身体和心理上的伤害。虽然早期诊断和及时用药或手术可大大提高患者的生活质量,但后续的身心康复治疗有限,疗效也不尽人意。铁死亡在免疫功能和肿瘤发展中起关键作用。Lin等[49]研究发现,铁死亡可导致骨肉瘤后脂质过氧化和功能障碍,铁抑素-I可抑制铁死亡,促进骨肉瘤小鼠功能恢复。此外,NF-κB和MAPK通路与铁死亡有一定联系,铁抑素-I通过调节MAPK通路促进骨肉瘤细胞死亡,同时减少活性氧产生,从而治疗骨肉瘤。Lv等[50]发现β-苯乙基异硫氰酸酯是一种对抗肺癌和乳腺癌等癌症的有效药物,可通过调节MAPK信号通路干扰铁代谢,导致人类骨肉瘤细胞死亡。Shi等[51]研究首次证明替拉帕胺可以抑制骨肉瘤细胞的增殖和迁移,并通过抑制SLC7A11部分诱导铁死亡。综上,介导铁死亡发生可以在肿瘤治疗中发挥积极作用,为临床诊治提供新思路。
3.5 脊髓损伤
脊髓损伤通常是由直接或间接暴力导致的脊柱骨折或脱位引起的。容易导致下肢严重功能障碍,从而对患者自身造成严重的身心伤害,给社会造成巨大的经济负担。脊髓损伤的死亡率和致残率很高。目前,对于脊髓损伤的治疗和康复已成为当今医学界的研究热点。Galluzzi等[52]应用Fe2+对脊神经细胞进行实验,发现随着细胞中铁离子的增加,与神经元失活相关的脂质过氧化的程度和代谢物也增加。研究发现,去铁胺能抑制脊髓损伤大鼠铁死亡,同时促进运动功能的恢复[53]。Zhang等[54]发现腹膜内注射铁死亡抑制剂SRS16-86可以降低脊髓损伤大鼠的铁死亡标志物并上调GPX4和谷胱甘肽水平,从而减轻大鼠脊髓损伤,并预防脊髓损伤后出现更多并发症,使其成为脊髓损伤有前途的治疗策略。另有研究表明[55],细胞外调节蛋白激酶(extracellular-signal regulated kinase,ERK)通路与铁死亡有一定联系,铁死亡抑制剂U0126下调RAS/RAF/ERK通路可抑制神经炎症,保护神经元,减少局部氧化还原损伤,进而有助于脊髓损伤的恢复。Gong等[56]研究发现,海藻糖通过抑制脊髓损伤后脂质过氧化物的产生和铁死亡来减少神经元的变性,从而促进神经元的存活并改善脊髓损伤后运动功能的恢复,认为海藻糖的神经保护作用的机制与核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)/HO-1途径的激活有关。综上,铁死亡抑制剂对脊髓损伤后的治疗和康复具有重大意义,然而,由于目前的研究仍不足,与铁死亡相关的脊髓损伤的详细机制仍然知之甚少。
3.6 肌少症
肌少症是一种进行性全身性骨骼肌疾病,主要表现为肌肉量过少和功能丢失。可导致继发性肌少症的疾病包括恶性肿瘤、慢性阻塞性肺病、心力衰竭和肾衰竭。活性氧累积在肌少症进展中的具有重要作用,铁过载引起的骨骼肌萎缩与活性氧介导的System Xc-激活有关[57]。p53-SlC7A11下调后引起脂质过氧化物的积累诱导肌肉细胞的铁死亡,可能是肌少症的原因之一[58]。巨噬细胞介导的铁释放可以促进肌肉再生,而铁过载会导致氧化应激的发生和骨骼肌萎缩[59]。去铁胺能通过降低膈肌中氧化应激和炎症反应来缓解肌肉损伤和肌力的损失[60]。目前,与铁死亡相关的肌少症的详细机制和治疗仍待进一步研究。
4 中医药通过干预铁死亡途径防治肌肉骨骼系统疾病
中医药在骨骼肌肉系统疾病治疗上有着悠久历史,积累了丰富的经验。随着现代分子生物学的发展,挖掘中医药治疗手段对骨骼肌肉系统疾病在分子水平层面上的调控成为当前的研究热点。现根据中药单体/活性成分、中药复方、针灸等不同干预手段总结铁死亡途径防治肌肉骨骼系统疾病的进展。
4.1 中药单体/活性成分
杜仲是杜仲科植物杜仲的树皮,为我国补肝肾、强筋骨的名贵滋补药材。而续断是川续断属植物川续断的根,具有补肝肾、强筋骨、续折伤等功效。李新春等[61]采用杜仲-续断药对干预去卵巢骨质疏松大鼠后发现,杜仲-续断药对组可显著抑制尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1和p53蛋白表达水平,增加GPX4和铁蛋白重链(ferritin heavy chain1,FTH1)表达水平,同时增加股骨骨密度,进而减轻骨质疏松,认为其机制可能与抑制铁死亡有关。黄芩素是黄芩主要活性成分之一,具有抗氧化、抗炎、抗糖尿病、神经保护等多种药理作用[62]。研究发现,黄芩素可以有效预防糖尿病性骨质疏松的发生,其机制与上调SLC7A11/GPX4轴抑制骨髓间充质干细胞(bone marrow mesenchyml stem cell,BMSCs)铁死亡,促进BMSCs增殖和成骨分化有关[63]。淫羊藿苷为淫羊藿中的黄酮类化合物,广泛应用于骨代谢类疾病,具有抗骨质疏松、抗肿瘤等药理作用[64]。淫羊藿苷可以通过上调GPX4、下调FPN1抑制脂质过氧化和铁代谢,进而减少活性氧生成,抑制成骨细胞死亡,此外,还通过提高成骨细胞Runt相关转录因子2及碱性磷酸酶蛋白表达促进成骨增殖分化,从而延缓骨质疏松症的发生[65]。豆蔻明具有抗氧化和抗炎特性,豆蔻明可下调p53,上调SLC7A11、GPX4的表达,证实豆蔻明通过调节p53信号通路抑制铁死亡来改善骨关节炎软骨降解,表明豆蔻明在骨关节炎中具有潜在的治疗作用[66]。此外,Wan等[67]研究发现,黄芩素通过上调AMPK/ Nrf2/HO-1信号通路抑制软骨细胞铁死亡来发挥保护软骨的作用,同时还能降低骨关节炎相关的疼痛敏感性,缓解骨关节炎的发展。大戟具有散寒止痛、燥湿退肿等功效,其主要有效成分大戟脂总三萜能使RA模型大鼠ACSL4表达降低,谷胱甘肽和GPX4表达增加,Nrf2/HO-1/GPX4通路的Kelch样ECH相关蛋白1、HO-1表达升高,表明大戟脂总三萜可通过抑制脂质过氧化从而抑制细胞异常铁死亡发挥治疗抗RA作用[68]。金钗石斛多糖是从中国传统名贵中药金钗石斛中提取出的有效药用成分,具有抗脂质过氧化、抗炎、抗凋亡、调节免疫等多种作用[69-70]。张放[71]采用改良Allen法建立脊髓损伤模型,金钗石斛多糖克显著升高铁死亡相关标志物谷胱甘肽和GPX4的表达,表明金钗石斛多糖可通过抑制铁死亡,对脊髓损伤大鼠发挥神经保护作用,促进脊髓损伤的修复。川芎是行气活血类中药的代表性药物,其有效活性成分川芎嗪具有良好的神经保护作用,有利于脊髓损伤修复[72]。范筱等[73]研究发现川芎嗪促进损伤的脊髓组织中FTH1和铁蛋白轻链(ferritin light chain,FTL)的表达,从而调节脊髓损伤后铁代谢紊乱,发挥神经保护作用,促进脊髓损伤恢复。鼠尾草酸具有神经保护作用,研究发现,鼠尾草酸能够通过激活Nrf2通路,上调谷胱甘肽/GPX4轴,增加FTH1的表达水平,提高细胞内源性抗氧化能力,进而抑制铁死亡的发生,同时增加存活的神经元细胞,减轻脊髓损伤,促进神经功能的恢复[74]。黄芪具有益气固表和利水消肿等功效,黄芪甲苷IV作为黄芪的主要活性成分之一,通过促进转录因子EB(transcription factor EB,TFEB)表达并介导铁死亡缓解脊髓损伤,此外,还能抑制脊髓损伤引起的神经细胞凋亡[75]。研究发现,白藜芦醇通过激活Nrf2/GPX4途径抑制铁死亡,并具有改善脊髓损伤后的运动功能和一定的神经保护作用[76]。另有研究发现,黄芩苷通过调控Nrf2/GPX4轴抑制铁死亡,揭示了黄芩苷将来应用于骨肉瘤治疗的潜能[77]。
综上,杜仲-续断药对、黄芩素、淫羊藿苷、黄芪甲苷IV、姜黄素等的中药单体/活性成分均能够通过抑制铁死亡途径起到治疗相关肌肉骨骼系统疾病的作用,显示出各种中药有效成分在防治肌肉骨骼系统疾病方面的巨大潜力。中药单体与活性成分通过干预铁死亡途径防治肌肉骨骼系统疾病的分子机制见表1。
4.2 中药复方
骨骼的生长与肾密切相关,补骨生髓方由骨碎补、补骨脂、狗脊、人参、三七等中药组成,具有补益肝肾、益气活血的功效。章轶立等[78]研究发现,补骨生髓方干预能增加骨质疏松模型大鼠血清klotho蛋白含量和超氧化物歧化酶活性,此外,铁调素含量增加,铁蛋白含量降低,提示补骨生髓方可提高骨质疏松大鼠抗氧化能力,并在一定程度上纠正铁过载状态。金天格胶囊的主要成分为人工虎骨粉,具有行气活血、补肾壮骨的作用,研究发现,金天格胶囊可通过下调转铁蛋白、ACSL4表达,抑制脂质过氧化和铁过载,从而改善骨质疏松症大鼠的骨量减少和骨小梁微结构破坏[79]。恒古骨伤愈合剂在临床上被常被应用于治疗骨关节炎与骨质疏松症,其主要成分为黄芪、三七、人参、杜仲、红花、陈皮等,具有益气养血、滋补肝肾、接骨疗伤等功效。许智杰[80]通过高脂饮食与链脲佐菌素注射构建了糖尿病肌少症小鼠模型,采用恒古骨伤愈合剂和去铁胺干预后发现,谷胱甘肽和GPX4的表达水平升高,认为恒古骨伤愈合剂可抑制铁死亡,达到治疗肌少症的目的。补肾还精方由熟地黄、菟丝子、沙苑子、锁阳、女贞子、桑椹组成,具有补益肝肾、固精益精之功效。研究发现[81],补肾还精方能上调GPX4和SLC7A11的表达,下调p53及其下游蛋白p21的表达,且小鼠肌力提升,肌肉组织脂质过氧化程度降低,提示补肾还精方可通过调控肌肉组织铁死亡途径,有效干预治疗肌少症。

表1 中药单体与活性成分通过干预铁死亡途径防治肌肉骨骼系统疾病的分子机制
↓-降低 ↑-升高,下表同
↓-reduce ↑-rise, same as below table
综上,表明补骨生髓方、金天格胶囊、恒古骨伤愈合剂、补肾还精方等中药复方均能介导铁死亡途径治疗相关肌肉骨骼系统疾病。中药复方通过干预铁死亡途径防治肌肉骨骼系统疾病的分子机制见表2。

表2 中药复方通过干预铁死亡途径防治肌肉骨骼系统疾病的分子机制
4.3 针灸疗法
研究发现,夹脊电针通过抑制细胞死亡促进脊髓损伤恢复,其机制涉及细胞的自噬、凋亡及铁死亡等方面[82]。夹脊电针能够通过SRS16-86抑制铁死亡System Xc-促进脊髓损伤的修复,还可以激活继发性脊髓损伤的Nrf2活性,通过介导Nrf2/抗氧化反应元件通路增加谷胱甘肽的表达,发挥抗氧化作用,促进脊髓损伤修复[83]。艾灸作为治疗RA的传统中医疗法,通过温和火力对穴位的逐步渗透,具有温经散寒、行气活血、祛风通络的作用。彭传玉等[84]运用艾灸干预佐剂性关节炎大鼠14 d后发现,佐剂性关节炎大鼠滑膜组织p53和活性氧水平降低,滑膜组织中SLC7A11、GPX4、谷胱甘肽表达升高,表明艾灸能够调控铁死亡相关因子的表达,抑制佐剂性关节炎大鼠铁死亡。
综上所述,中药单体/活性成分、中药复方、针灸等中医药治疗方式可通过多途径、多靶点抑制铁死亡,发挥治疗肌肉骨骼系统疾病的作用,提示结合生物信息学技术发挥中医药论治肌肉骨骼系统疾病的优势已成为科学研究重要方向。
5 结语与展望
铁死亡是一种新型的细胞死亡形式,主要涉及铁、脂质和氨基酸,已成为当前的研究热点。铁死亡的发病机制非常复杂,各机制相互独立、相互关联,形成复杂的网络调控。诸多研究证实,铁死亡在肌肉骨骼系统疾病的发展中起关键作用,干预铁死亡的过程可以不同程度地改善相关疾病的发展。新型铁死亡抑制剂和激活剂已成为细胞生物学和化学生物学领域的研究热点,为肌肉骨骼系统疾病的靶向治疗提供了新的策略。然而,上述肌肉骨骼系统疾病病理状态下铁代谢紊乱和铁死亡的认识和探索仍处于初步阶段,许多重要的问题亟待解决。中医药是肌肉骨骼系统疾病治疗中极具潜力的选择。中医药包括多个组成部分,但目前有关于中医药调节铁死亡的途径主要以中药单体/活性成分为主,中药复方与针灸干预铁死亡的基础与临床研究的研究较少,此外,通过干预铁死亡途径防治肌肉骨骼系统疾病大多局限于细胞和动物层面。因此,相关临床研究的开展是未来研究发展方向,有利于积累高质量的循证证据以协助临床治疗方案的制订。其次中药活性成分和复方成分复杂,作用靶点众多,分子机制尚不确定,未来可利用网络药理学、高通量质谱分析、生物信息学、联合分析和分子对接等技术对中医药靶向铁死亡防治肌肉骨骼系统疾病的物质基础进一步研究,深入研究药效物质和作用机制。
总之,深入了解铁死亡在骨相关细胞中的科学意义及靶向临床试验的设计有助于多种肌肉骨骼系统疾病的精准治疗,并且为中医药调控铁死亡治疗肌肉骨骼系统疾病提供广阔的前景。
利益冲突 所有作者均声明不存在利益冲突
[1]D'Arcy M S. Cell death: A review of the major forms of apoptosis, necrosis and autophagy [J]., 2019, 43(6): 582-592.
[2]Su L J, Zhang J H, Gomez H,. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis [J]., 2019, 2019: 5080843.
[3]Li J, Cao F, Yin H L,. Ferroptosis: Past, present and future [J]., 2020, 11(2): 88.
[4]Dolma S, Lessnick S L, Hahn W C,. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells [J]., 2003, 3(3): 285-296.
[5]Yang W S, Stockwell B R. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells [J]., 2008, 15(3): 234-245.
[6]Yagoda N, von Rechenberg M, Zaganjor E,. RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels [J]., 2007, 447(7146): 864-868.
[7]Dixon S J, Lemberg K M, Lamprecht M R,. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]., 2012, 149(5): 1060-1072.
[8]李芳, 陈正君, 葛俊李, 等. 党参经PI3K/Akt干预溃疡性结肠炎黏膜细胞铁死亡-线粒体动力学失衡的机制研究 [J]. 中草药, 2023, 54(12): 3865-3877.
[9]Su Y W, Zhao B, Zhou L F,. Ferroptosis, a novel pharmacological mechanism of anti-cancer drugs [J]., 2020, 483: 127-136.
[10]Nakamura T, Naguro I, Ichijo H. Iron homeostasis and iron-regulated ROS in cell death, senescence and human diseases [J]., 2019, 1863(9): 1398-1409.
[11]van Swelm R P L, Wetzels J F M, Swinkels D W. The multifaceted role of iron in renal health and disease [J]., 2020, 16(2): 77-98.
[12]Torii S, Shintoku R, Kubota C,. An essential role for functional lysosomes in ferroptosis of cancer cells [J]., 2016, 473(6): 769-777.
[13]Liu J, Kuang F, Kroemer G,. Autophagy-dependent ferroptosis: Machinery and regulation [J]., 2020, 27(4): 420-435.
[14]Zhou R P, Chen Y, Wei X,. Novel insights into ferroptosis: Implications for age-related diseases [J]., 2020, 10(26): 11976-11997.
[15]Gaschler M M, Stockwell B R. Lipid peroxidation in cell death [J]., 2017, 482(3): 419-425.
[16]Shah R, Shchepinov M S, Pratt D A. Resolving the role of lipoxygenases in the initiation and execution of ferroptosis [J]., 2018, 4(3): 387-396.
[17]Yan H F, Zou T, Tuo Q Z,. Ferroptosis: Mechanisms and links with diseases [J]., 2021, 6(1): 49.
[18]Feng H Z, Stockwell B R. Unsolved mysteries: How does lipid peroxidation cause ferroptosis? [J]., 2018, 16(5): e2006203.
[19]Yang W S, Kim K J, Gaschler M M,. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis [J]., 2016, 113(34): E4966-E4975.
[20]Doll S, Proneth B, Tyurina Y Y,. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition [J]., 2017, 13(1): 91-98.
[21]Vučković A M, Bosello Travain V, Bordin L,. Inactivation of the glutathione peroxidase GPX4 by the ferroptosis-inducing molecule RSL3 requires the adaptor protein 14-3-3ε [J]., 2020, 594(4): 611-624.
[22]Stockwell B R, Friedmann Angeli J P, Bayir H,. Ferroptosis: A regulated cell death nexus linking metabolism, redox biology, and disease [J]., 2017, 171(2): 273-285.
[23]Zhou S Y, Cui G Z, Yan X L,. Mechanism of ferroptosis and its relationships with other types of programmed cell death: Insights for potential interventions after intracerebral hemorrhage [J]., 2020, 14: 589042.
[24]Vancassel S, Fanet H, Castanon N,. Tetrahydrobiopterin modulates the behavioral neuroinflammatory response to an LPS challenge in mice [J]., 2022, 105: 139-148.
[25]Proneth B, Conrad M. Ferroptosis and necroinflammation, a yet poorly explored link [J]., 2019, 26(1): 14-24.
[26]Jiang L, Hickman J H, Wang S J,. Dynamic roles of p53-mediated metabolic activities in ROS-induced stress responses [J]., 2015, 14(18): 2881-2885.
[27]Lei G, Zhang Y L, Hong T,. Ferroptosis as a mechanism to mediate p53 function in tumor radiosensitivity [J]., 2021, 40(20): 3533-3547.
[28]Sun X, Xia T, Zhang S,. Hops extract and xanthohumol ameliorate bone loss induced by iron overload via activating Akt/GSK3β/Nrf2 pathway [J]., 2022, 40(3): 375-388.
[29]Ge W W, Jie J, Yao J,. Advanced glycation end products promote osteoporosis by inducing ferroptosis in osteoblasts [J]., 2022, 25(4): 140.
[30]Tsay J, Yang Z W, Ross F P,. Bone loss caused by iron overload in a murine model: Importance of oxidative stress [J]., 2010, 116(14): 2582-2589.
[31]Qu X Z, Sun Z Q, Wang Y,. Zoledronic acid promotes osteoclasts ferroptosis by inhibiting FBXO9-mediated p53 ubiquitination and degradation [J]., 2021, 9: e12510.
[32]Lu J S, Yang J Z, Zheng Y S,. Extracellular vesicles from endothelial progenitor cells prevent steroid-induced osteoporosis by suppressing the ferroptotic pathway in mouse osteoblasts based on bioinformatics evidence [J]., 2019, 9(1): 16130.
[33]Lin Y, Shen X, Ke Y,. Activation of osteoblast ferroptosis via the METTL3/ASK1-p38 signaling pathway in high glucose and high fat (HGHF)-induced diabetic bone loss [J].. 2022, 36(3): e22147.
[34]Yang Y Q, Lin Y X, Wang M Q,. Targeting ferroptosis suppresses osteocyte glucolipotoxicity and alleviates diabetic osteoporosis [J]., 2022, 10(1): 26.
[35]Zhang J, Zheng L J, Wang Z Y,. Lowering iron level protects against bone loss in focally irradiated and contralateral femurs through distinct mechanisms [J]., 2019, 120: 50-60.
[36]Jia P, Xu Y J, Zhang Z L,. Ferric ion could facilitate osteoclast differentiation and bone resorption through the production of reactive oxygen species [J]., 2012, 30(11): 1843-1852.
[37]Liu P, Wang W Z, Li Z,. Ferroptosis: A new regulatory mechanism in osteoporosis [J]., 2022, 2022: 2634431.
[38]Simão M, Cancela M L. Musculoskeletal complications associated with pathological iron toxicity and its molecular mechanisms [J]., 2021, 49(2): 747-759.
[39]Yazar M, Sarban S, Kocyigit A,. Synovial fluid and plasma selenium, copper, zinc, and iron concentrations in patients with rheumatoid arthritis and osteoarthritis [J]., 2005, 106(2): 123-132.
[40]Miao Y, Chen Y W, Xue F,. Contribution of ferroptosis and GPX4’s dual functions to osteoarthritis progression [J]., 2022, 76: 103847.
[41]Guo Z, Lin J M, Sun K,. Deferoxamine alleviates osteoarthritis by inhibiting chondrocyte ferroptosis and activating the Nrf2 pathway [J]., 2022, 13: 791376.
[42]Yao X D, Sun K, Yu S N,. Chondrocyte ferroptosis contribute to the progression of osteoarthritis [J]., 2021, 27: 33-43.
[43]Zhou X M, Zheng Y C, Sun W T,.-mannose alleviates osteoarthritis progression by inhibiting chondrocyte ferroptosis in a HIF-2α-dependent manner [J]., 2021, 54(11): e13134.
[44]Luo H S, Zhang R. Icariin enhances cell survival in lipopolysaccharide-induced synoviocytes by suppressing ferroptosis via the Xc-/GPX4 axis [J]., 2021, 21(1): 72.
[45]Sandhu G, Thelma B K. New druggable targets for rheumatoid arthritis based on insights from synovial biology [J]., 2022, 13: 834247.
[46]Xie Z X, Hou H D, Luo D,. ROS-dependent lipid peroxidation and reliant antioxidant ferroptosis-suppressor-protein 1 in rheumatoid arthritis: A covert clue for potential therapy [J]., 2021, 44(1): 35-47.
[47]Wu J, Feng Z, Chen L,. TNF antagonist sensitizes synovial fibroblasts to ferroptotic cell death in collagen-induced arthritis mouse models [J]., 2022, 13(1): 676.
[48]Jhun J, Moon J, Ryu J,. Liposome/gold hybrid nanoparticle encoded with CoQ10 (LGNP-CoQ10) suppressed rheumatoid arthritis via STAT3/Th17 targeting [J]., 2020, 15(11): e0241080.
[49]Lin H Y J, Chen X T, Zhang C Y,. EF24 induces ferroptosis in osteosarcoma cells through HMOX1 [J]., 2021, 136: 111202.
[50]Lv H H, Zhen C X, Liu J Y,. PEITC triggers multiple forms of cell death by GSH-iron-ROS regulation in K7M2 murine osteosarcoma cells [J]., 2020, 41(8): 1119-1132.
[51]Shi Y H, Gong M, Deng Z M,. Tirapazamine suppress osteosarcoma cells in part through SLC7A11 mediated ferroptosis [J]., 2021, 567: 118-124.
[52]Galluzzi L, Vitale I, Aaronson S A,. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018 [J]., 2018, 25(3): 486-541.
[53]Yao X, Zhang Y, Hao J,. Deferoxamine promotes recovery of traumatic spinal cord injury by inhibiting ferroptosis [J]., 2019, 14(3): 532-541.
[54]Zhang Y, Sun C, Zhao C X,. Ferroptosis inhibitor SRS 16-86 attenuates ferroptosis and promotes functional recovery in contusion spinal cord injury [J]., 2019, 1706: 48-57.
[55]Sheng B, Li X, Zhou L,. Targeting miR-10a-5p/IL-6R axis for reducing IL-6-induced cartilage cell ferroptosis [J]., 2021, 118: 104570.
[56]Gong F, Ge T, Liu J,. Trehalose inhibits ferroptosis via Nrf2/HO-1 pathway and promotes functional recovery in mice with spinal cord injury [J]., 2022, 14(7): 3216-3232.
[57]Scicchitano B M, Pelosi L, Sica G,. The physiopathologic role of oxidative stress in skeletal muscle [J]., 2018, 170: 37-44.
[58]Huang Y, Wu B L, Shen D Z,. Ferroptosis in a sarcopenia model of senescence accelerated mouse prone 8 (SAMP8) [J]., 2021, 17(1): 151-162.
[59]Ikeda Y, Imao M, Satoh A,. Iron-induced skeletal muscle atrophy involves an Akt-forkhead box O3-E3 ubiquitin ligase-dependent pathway [J]., 2016, 35: 66-76.
[60]Moraes L H, de Burgos R R, Macedo A B,. Reduction of oxidative damage and inflammatory response in the diaphragm muscle of mdx mice using iron Chelator deferoxamine [J]., 2015, 167(1): 115-120.
[61]李新春, 胡万钧, 甘发荣, 等. 杜仲-续断药对通过调控铁死亡途径对去卵巢骨质疏松症大鼠的保护作用及机制研究 [J]. 中华中医药学刊, 2023, 41(9): 103-106.
[62]向净匀, 吴杰, 王琰, 等. 基于网络药理学的黄芩素、京尼平抗脑缺血作用机制研究 [J]. 中草药, 2019, 50(23): 5802-5811.
[63]张志达. 黄芩素调控SLC7A11/GPX4轴抑制铁死亡预防糖尿病性骨质疏松的机制 [D]. 广州: 广州中医药大学, 2021.
[64]王海坤, 吴娜, 李存明, 等. 口服淫羊藿类中成药治疗绝经后骨质疏松的贝叶斯网状Meta分析 [J]. 中草药, 2021, 52(20): 6309-6322.
[65]付殷, 刘宇洲, 胡晓阳, 等. 基于铁死亡通路研究淫羊藿苷对大鼠成骨细胞增殖分化的影响 [J]. 时珍国医国药, 2022, 33(9): 2100-2103.
[66]Gong Z H, Wang Y J, Li L,. Cardamonin alleviates chondrocytes inflammation and cartilage degradation of osteoarthritis by inhibiting ferroptosis via p53 pathway [J]., 2023, 174: 113644.
[67]Wan Y P, Shen K, Yu H Y,. Baicalein limits osteoarthritis development by inhibiting chondrocyte ferroptosis [J]., 2023, 196: 108-120.
[68]周茂杰, 谭为, 哈木拉提·哈斯木, 等.基于Nrf2/HO-1/GPX4通路探讨大戟脂总三萜抗类风湿性关节炎的作用[J]. 中国中药杂志, 2023, 48(18): 4834-4842.
[69]令狐楚, 谷荣辉, 秦礼康. 金钗石斛的化学成分及药理作用研究进展 [J]. 中草药, 2021, 52(24): 7693-7708.
[70]代国娜, 尚明越, 王嘉乐, 等. 金钗石斛多糖提取分离、结构解析及生物活性研究进展 [J]. 中草药, 2022, 53(12): 3821-3830.
[71]张放. 金钗石斛多糖抑制大鼠脊髓损伤铁死亡的实验研究 [D]. 赣州: 赣南医学院, 2022.
[72]杨倩, 吕莉莉, 孙蓉. 基于网络药理学的丹参川芎嗪注射液作用机制分析 [J]. 中草药, 2018, 49(11): 2606-2613.
[73]范筱, 陶经纬, 蒋昇源, 等. 川芎嗪对大鼠脊髓损伤后铁代谢的影响 [J]. 中国组织工程研究, 2023, 27(22): 3561-3566.
[74]Cheng J, Xu T, Xun C H,. Carnosic acid protects against ferroptosis in PC12 cells exposed to erastin through activation of Nrf2 pathway [J]., 2021, 266: 118905.
[75]Zhou Y, Li L, Mao C,. Astragaloside IV ameliorates spinal cord injury through controlling ferroptosis in H2O2-damaged PC12 cells[J]., 2022, 10(21): 1176.
[76]Ni C T, Ye Q, Mi X D,. Resveratrol inhibits ferroptosis via activating Nrf2/GPX4 pathway in mice with spinal cord injury [J]., 2023, 86(10): 1378-1390.
[77]Wen R J, Dong X, Zhuang H W,. Baicalin induces ferroptosis in osteosarcomas through a novel Nrf2/xCT/ GPX4 regulatory axis [J]., 2023, 116: 154881.
[78]章轶立, 方圣杰, 李秋月, 等. 补骨生髓方对骨质疏松症模型大鼠氧化应激及铁死亡相关指标的影响 [J]. 中国中医药信息杂志, 2022, 29(4): 75-79.
[79]张驰, 章晓云, 柴源, 等. 金天格胶囊治疗维甲酸诱导骨质疏松大鼠的蛋白质组学分析 [J]. 中国组织工程研究, 2023, 27(35): 5634-5641.
[80]许智杰. 恒古骨伤愈合剂对糖尿病肌肉减少症的治疗作用与机制研究 [D]. 沈阳: 中国医科大学, 2022.
[81]黄研, 邢三丽, 胡怡然, 等. 补肾还精方通过调节铁死亡干预小鼠肌少症的效应和机制研究 [J]. 上海中医药杂志, 2022, 56(7): 74-82.
[82]孙忠人, 栾逸先, 尹洪娜, 等. 夹脊电针通过调控细胞死亡治疗脊髓损伤的相关机制研究进展 [J]. 中华中医药杂志, 2021, 36(4): 2213-2215.
[83]李全, 栾逸先, 朱荟一, 等. 基于铁死亡Xc-/GPX4通路探究夹脊电针促进脊髓损伤修复机制 [J]. 针灸临床杂志, 2020, 36(6): 6-10.
[84]彭传玉, 胡玲, 吴子建, 等. 艾灸对佐剂性关节炎大鼠膝关节滑膜组织中调控铁死亡相关因子的影响 [J]. 针刺研究, 2022, 47(1): 21-26.
Overview of ferroptosis-related musculoskeletal system diseases and progress of traditional Chinese medicine intervention
DONG Pei1, YUAN Pu-wei1,2, KANG Wu-lin2, GAO Ya-li1, BAI Yuan-shuai1, YAO Bin1, WANG Zhen-kai1, LIU Yang1
1. Shaanxi University of Chinese Medicine, Xianyang 712000, China 2. Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712046, China
Ferroptosis is a new form of cell death, which is related to iron overload and lipid peroxidation, and plays an important role in the development of many diseases. Osteoporosis, osteoarthritis, rheumatoid arthritis, osteosarcoma, spinal cord injury, sarcopenia and other musculoskeletal diseases seriously affect the quality of life of patients and have become the main burden of the global public health system. Ferroptosis is closely related to the occurrence and development of the above musculoskeletal diseases, indicating that ferroptosis may become a new target for the treatment of musculoskeletal diseases. Traditional Chinese medicine has its unique advantages in the treatment of musculoskeletal diseases. A large number of studies have confirmed that traditional Chinese medicine participates in the regulation of musculoskeletal diseases through the ferroptosis pathway, showing good research prospects. By exploring the relationship between ferroptosis and musculoskeletal diseases, this paper summarizes the research progress of traditional Chinese medicine in preventing and treating musculoskeletal diseases by mediating ferroptosis, and provides ideas for the development of new treatment strategies and better treatment of musculoskeletal diseases by traditional Chinese medicine.
ferroptosis; osteoporosis; osteoarthritis; rheumatoid arthritis; spinal cord injury; osteosarcoma; sarcopenia
R285
A
0253 - 2670(2023)21 - 7202 - 11
10.7501/j.issn.0253-2670.2023.21.029
2023-05-01
陕西省中医药管理局“骨退行性疾病中西医结合防治‘双链融合’中青年科研创新团队”(2022-SLRH-LJ-001);陕西中医药大学学科建设创新团队(骨关节及脊椎退行性疾病中西医结合防治创新团队2019YL-02);长安医学关中李氏骨伤学术流派传承工作室建设项目(陕中医药发[2018]40号);陕西省骨退行性疾病中西医结合防治重点研究室建设项目(陕中医药发[2018]32号)
董 佩,硕士研究生,住院医师,研究方向为骨关节疾病的基础与临床。E-mail: m17393190475@163.com
通信作者:袁普卫,博士生导师,教授,主任医师,从事骨退行性疾病的基础与临床研究。E-mail: spine_surgeon@163.com
[责任编辑 赵慧亮]
