南方红壤侵蚀区芒萁对聚乙二醇6 000模拟干旱胁迫的响应
2023-11-01冯柳俊陈志强陈志彪罗立津
冯柳俊,陈志强*,陈志彪,罗立津,王 健
1.福建省湿润山地生态重点实验室—省部共建国家重点实验室培育基地,福建福州 350007;2.福建师范大学地理科学学院,福建福州 350007;3.福建省微生物研究所环境微生物学实验室,福建福州 350007)
干旱胁迫是降雨量不足或土壤水分不足的结果,是限制植物生长的最主要环境胁迫之一。干旱胁迫可以诱导植物产生各种生理生化反应,极大地限制了植物的生长[1-2]。已有研究表明,干旱胁迫破坏了活性氧(ROS)的合成和清除之间的平衡,如超氧阴离子自由基(O2-·)和过氧化氢(H2O2)等。过量的ROS可破坏细胞膜的结构和功能[3],导致脂质过氧化和丙二醛(MDA)的积累,DNA和细胞蛋白质的氧化损伤,以及细胞内电解质的泄漏,相对电导率(REC)的上升[3]。植物的抗氧化防御系统促进超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶的调节,降低活性氧的有害影响。SOD能够歧化O2-·,是植物抗氧化的第一道防线;POD和CAT能够分解H2O2,是植物抵御氧化损害的另一重要保护措施[4]。除了抗氧化防御系统外,渗透调节在植物抵抗干旱胁迫中同样发挥着关键作用,脯氨酸(Pro)在其中发挥着至关重要的作用[5]。Pro的积累能够降低细胞内的渗透势,增加细胞液的浓度,并提高细胞从外部吸收水分的能力,保持植物细胞的膨胀压力。因此,植物能够通过调节自身的抗逆生理活动,增强自身对干旱胁迫环境的适应。
南方红壤侵蚀区是我国仅次于黄土高原的第二大典型水土流失区。该区域土壤母岩主要为花岗岩,极易受到雨水飞溅和地表水流的侵蚀,尤其是在裸露的土地上;加上该区域降水时空分布不均、多暴雨、地势起伏等地理特征,水土流失严重。同时,人类不合理利用自然资源,进一步加剧了生态的破坏,极大制约了该区域的社会经济可持续发展[6]。植物在南方红壤侵蚀区水土保持和生态修复中起着关键作用[7]。芒萁[Dicranopterispedata(Thunb.) Berhn.]为多年生里白科蕨类植物,常见于我国南方低山丘陵地区以及日本、越南、印度等国家,其耐酸且耐贫瘠,在生态破坏和退化过程中最后退出,而在生态恢复过程中最先进入生态系统[8]。因此,芒萁是南方红壤侵蚀区重要的水土保持植物,其生长和覆盖对南方红壤侵蚀区具有重要意义。由于季节性降水分布不均且多暴雨,夏秋尤其是秋季气温高而蒸发量大;暴雨后红壤易板结,渗透性减弱,降水多形成地表径流而不补充地下水;红壤黏粒比例高,比表面积大,牢牢吸附水分子,从而制约了植物对土壤水分的吸收;人类活动对土壤结构的破坏,红壤蓄水能力下降[9]等,南方红壤侵蚀区虽然降水较多,但季节性土壤干旱现象常见。前人研究表明,土壤水分是限制芒萁生长的主要因素[6]。然而,目前有关芒萁的相关研究主要集中在生长特性、培育、化感作用、生态化学计量学、生态恢复、分布、植物修复和药用价值,鲜有关于芒萁如何抵御季节性土壤干旱胁迫的报道。因此,研究芒萁的抗旱性是利用芒萁治理南方红壤侵蚀区水土流失和生态破坏的关键之一。笔者设计PEG 6 000模拟不同程度的干旱胁迫试验,通过分析干旱胁迫下芒萁的生理特性及增强芒萁抵御干旱胁迫能力的主要因子,探讨芒萁的抗旱机制,以期为利用芒萁治理南方红壤侵蚀区水土流失和生态修复提供基础数据和科学依据。
1 材料与方法
1.1 干旱胁迫处理在福建师范大学地理科学学院采用盆栽方式种植60株生长状况相似的芒萁幼苗(43 cm×19 cm×14 cm),每株幼苗保留15 cm的地下茎和足够的细根,以确保存活。该试验所用土壤来自典型的红壤侵蚀区福建省长汀县河田镇。土壤经风干、过筛、充分混合后装入盆中,土壤养分情况:碳含量为5.50 g/kg,氮含量为0.60 g/kg,磷含量为0.16 g/kg,速效磷含量为1.73 mg/kg,铵态氮含量为16.16 mg/kg,硝态氮含量为5.79 mg/kg,速效氮含量为21.95 mg/kg,pH为4.68。每个花盆装7 kg土壤,每盆移栽1株幼苗。培养90 d后,选择45株生长状况较好且相似的植株,在福建省微生物研究所环境微生物实验室的光照培养箱中进行PEG 6 000模拟干旱胁迫试验。将芒萁转移到透明玻璃盆(25 cm×10 cm×10 cm)中,置于光照培养箱内,昼夜光照时间和温度设置分别为18 h/8 h和25 ℃/20 ℃。设计不同浓度的PEG 6 000(10%、20%、30%和40%)和对照(不含PEG 6 000的纯水)对45株芒萁植株进行处理,每种措施3个重复。10%、20%、30%和40%浓度PEG 6 000处理组和对照组分别命名为P10、P20、P30、P40和CK。干旱胁迫后,剪下叶片样品用液氮速冻,并储存在冰箱-80 ℃下待测。
1.2 样品处理试验方法参照《植物生理学实验指南》[10-11]。采用氮蓝四唑法检测SOD,采用愈创木酚法检测POD,采用紫外分光光度计法检测CAT,采用磺基水杨酸法检测Pro,采用电导仪检测REC,采用硫代巴比妥酸法检测MDA。
1.3 数据分析数据由MS EXCEL 2010收集和整理;采用IBM SPSS Statistics 22.0(IBM Corp.,Armonk,NY,USA)对试验数据进行分析;采用单因素方差分析(One-way ANOVA)统计显著性差异水平;在显著性水平P<0.05时,使用最小显著性差异检验组间平均值的差异;采用Pearson相关分析法对各指标进行相关分析,并采用主成分分析法评价不同PEG 6 000 浓度下芒萁的抗旱性;采用Origin 9.0制图。
2 结果与分析
2.1 REC和MDA含量比较随着PEG 6 000浓度的升高,芒萁叶片MDA和REC逐渐增大。P10、P20、P30和P40处理的MDA含量和REC均显著高于CK(P<0.05)。P10、P20、P30和P40处理MDA含量分别是CK的1.39、1.64、1.62和1.60倍,REC分别比CK高61.93%、66.56%、69.27%和73.25%。然而,各处理间的MDA和REC均无显著差异(图1)。

注:不同小写字母表示处理间差异显著(P<0.05)。Note:Different lowercase letters indicate significant difference among treatments(P<0.05).图1 PEG模拟干旱胁迫下芒萁MDA含量和RECFig.1 MDA content and REC in Dicranopteris pedata subjected to drought stress induced by PEG 6 000
2.2 抗氧化酶活性比较随着PEG 6 000浓度的升高,SOD和POD活性呈先升高后降低的趋势。相反,CAT活性先降低后升高。与CK相比,不同浓度PEG 6 000处理显著提高了芒萁SOD活性(P<0.05),且P20处理达到最高(1 588.11 U/g),且高于P10、P30和P40处理。P10处理POD活性[0.74 U/(g·min)]显著高于CK(P<0.05),但P20、P30和P40处理显著低于CK(P<0.05)。P10、P20处理CAT活性与CK无显著差异(P<0.05);P30和P40处理显著低于CK(P<0.05);P40处理CAT活性显著高于P30处理(P<0.05)(图2)。

注:不同小写字母表示处理间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences among treatments(P<0.05).图2 PEG模拟干旱胁迫下芒萁抗氧化酶活性Fig.2 Antioxidase activities of Dicranopteris pedata in response to drought stress induced by PEG 6 000
2.3 Pro含量比较随着PEG 6000浓度的增加,芒萁叶中Pro含量先缓慢增加,然后急剧上升再下降。方差分析结果表明,P10处理Pro含量与CK无显著差异,P20、P30和P40处理显著高于CK和P10处理(P<0.05)。P30处理Pro浓度达到最高,为CK的4.20倍(图3)。

注:不同小写字母表示处理间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences among treatments(P<0.05).图3 PEG模拟干旱胁迫下芒萁脯氨酸含量Fig.3 Proline levels in Dicranopteris pedata in response to drought stress induced by PEG 6 000
2.4 相关性分析由表1可知,除SOD与POD、CAT,REC与POD、CAT、MDA无相关性外,其他生理指标间均显著或极显著相关(P<0.05,P<0.01)。

表1 各生理指标相关性分析
2.5 主成分分析主成分分析结果显示,有2个主成分的特征根大于1,其中第1个主成分的特征值为3.73,第2个主成分的特征值为1.16(表2)。前2个主成分的累积贡献率达到81.36%,因此前2个主成分可以解释芒萁抗旱指标的大部分信息。Yi代表芒萁抗旱能力的第i个综合指数,Zx1、Zx2、Zx3、Zx4、Zx5和Zx6分别表示SOD、POD、CAT、Pro、REC和MDA的标准值。主成分表达式如下:
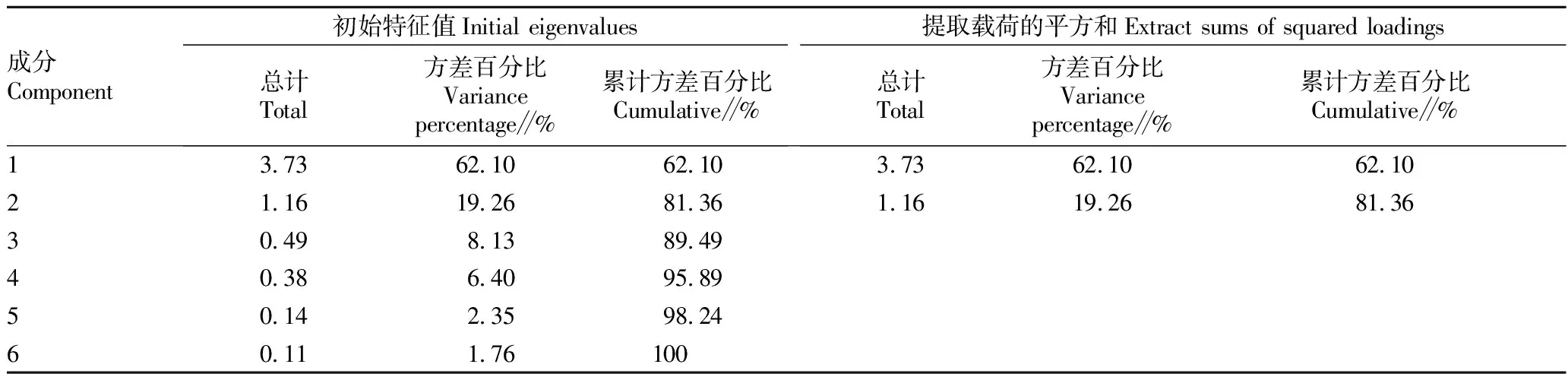
表2 总方差解释
Y1=0.38Zx1- 0.37Zx2- 0.38Zx3+0.46Zx4+0.43Zx5+0.42Zx6
(1)
Y2=0.55Zx1+0.36Zx2+0.51Zx3-0.32Zx4+0.40Zx5+0.22Zx6
(2)
将6项胁迫生理指标进行标准化,并逐一纳入式(1)、(2),计算各主成分得分。然后,对主成分得分进行加权求和,得到芒萁抗旱能力的综合评价结果。根据芒萁的抗旱性得分,从高到低依次为P30、P40、P20、P10和CK。P20、P30和P40处理芒萁的抗旱性评分分别为0.94、1.11和1.10,远高于CK和P10处理(表3)。

表3 抗旱性综合得分
3 讨论
3.1 干旱胁迫对芒萁细胞膜的损害干旱胁迫减弱了植物的碳同化过程和光系统 Ⅱ 复合体活性,导致激发能增加和能量过剩。因此,植物体内ROS的合成和清除之间的平衡被破坏,导致ROS的积累和质膜过氧化,并增加MDA含量。此外,质膜过氧化会破坏植物细胞膜的通透性,导致细胞内电解质的泄漏。因此,MDA和REC常被用作评价细胞膜脂质损伤程度的指标[12]。该研究中,随着PEG 6 000浓度的升高,REC和MDA逐渐升高。P10、P20、P30和P40处理的芒萁REC和MDA水平显著高于CK。这表明干旱胁迫已经造成了芒萁体内ROS积累,质膜氧化导致MDA的大量产生。同时,干旱胁迫破坏了质膜的选择性通透性,导致大量无机离子、氨基酸和可溶性糖等小分子的泄漏,导致REC的显著提高。然而,不同PEG 6 000处理的REC值和MDA含量差异不大。这说明遇到干旱胁迫时,芒萁能够调节生理活动,提高ROS清除能力,快速应对干旱胁迫。即使在极严重干旱胁迫下,芒萁也能有效减轻胁迫的危害,该研究中P30和P40处理REC和MDA的增量无显著性差异便是最佳证据。有学者对沙棘[13]、烟草[14]和花生[15]的研究结果表明,随着干旱胁迫程度的提升,植物体内MDA含量显著增加,大丽花[16]的研究也揭示了干旱条件下MDA和REC的增加,都与该研究的结果相似。不同之处在于,尽管各处理的值都显著高于CK组,芒萁MDA和REC的水平也不会随着PEG 6 000浓度的升高继续激增。可见,与普通植物相比,芒萁具有较强的抗旱性。
3.2 芒萁的抗氧化酶活性随着干旱胁迫的加剧,芒萁的SOD和POD活性先升高后降低。虽然SOD活性在P20处理达到最大值,然后持续下降,但P10、P20、P30和P40处理组的酶活性仍高于CK。POD活性在P10处理达到最高水平,此后显著下降。CAT活性随PEG 6 000浓度的增加而降低,但在浓度为40%时有所反弹。芒萁CAT活性高于POD活性。因此,在干旱胁迫下,芒萁可以诱导3种抗氧化酶的表达以清除ROS。相关分析表明,SOD与REC、SOD与MDA之间存在极显著相关(P<0.01),表明干旱胁迫后芒萁细胞膜由于O2-·的过度积累而被氧化,于是SOD活性提高,减少了对质膜的氧化损伤。POD和CAT水平与MDA呈负相关,表明POD和CAT活性影响了芒萁对干旱胁迫的反应。当干旱胁迫程度较低时,POD和CAT共同清除H2O2。然而,在较高的干旱胁迫下,POD的合成受到限制,POD活性下降。在这种情况下,H2O2的主要清除剂为CAT。P40处理芒萁CAT活性显著增加是有力证据。对沙棘[13]、烟草[14]、花生[15]以及大丽花[16]的研究均证明了干旱胁迫诱导ROS的积累,使植物体内SOD、POD和CAT的酶活性先升高后降低的结论。该研究中,SOD和POD活性的变化与前人研究结果相似。然而,不同的是芒萁CAT活性随干旱强度增强呈先下降后上升趋势。番茄幼苗CAT活性[17]和蓟叶[18]的研究结果表明,CAT对干旱胁迫反应缓慢,在早期或轻度胁迫下较低,但随着胁迫时间和胁迫水平的增加而增加,这与该研究P30和P40处理的结果相似。然而,低胁迫处理CAT活性也较高,这与前人的研究结果相矛盾。这种变化特征可能是由于干旱胁迫下,芒萁的POD活性很低,从而刺激了CAT活性以清除H2O2。因此,SOD和CAT是芒萁酶促抗氧化系统中ROS的主要清除剂。
3.3 Pro对干旱胁迫的响应渗透调节是植物适应干旱和盐胁迫等恶劣环境的一种生理活动。植物细胞在胁迫条件下积累有机和无机物质,以降低细胞内渗透势,试图减少水分损失,维持膨压,以适应干旱恶劣环境[19]。因此,渗透调节物质对植物应对干旱胁迫至关重要。Pro是一种重要的渗透调节物质,可以平衡植物细胞的渗透势。该研究中,P10处理的Pro含量略有增加,然后急剧上升,并在P30处理达到峰值。因此,干旱胁迫显著诱导了芒萁的渗透调节机制,降低水势,促进水分吸收。这维持了芒萁的生理活动,如细胞膨胀和生长、光合作用和气孔功能等,并最终缓解了干旱胁迫的危害。这与前人对冬小麦[20]、毛白杨[21]、大叶槭、臭椿、黄连木[22]的研究结果相似。然而,P40处理Pro水平下降,这是由于过度干旱胁迫影响了关键酶二氢吡咯-5-羧酸合酶,导致Pro含量下降。前人研究表明,植物在过度干旱胁迫后合成Pro的能力降低,导致Pro水平下降[23]。如水稻抗旱性研究报道了过度应激后Pro含量的下降[24]。值得注意的是,P30处理的Pro含量达到最大值,而CAT活性也在P30处理开始增加。因此,低干旱胁迫下CAT活性的降低与Pro的积累有关,Pro可以减少ROS,尤其是H2O2,防止质膜过氧化,此时无需高活性CAT清除ROS。此外,Pro的变化趋势与主成分抗旱性评价得分的排序相似。主成分分析结果表明,芒萁的抗旱性得分随着PEG 6 000浓度的增加而增加,在PEG 6 000浓度为30%时达到峰值,在PEG 6 000浓度为40%时下降,呈现单峰趋势。Pro同样显示出单峰趋势,在30% PEG 6 000 时达到峰值,随后下降。因此,芒萁的强抗旱性与Pro有密切关系。Pro与其他5个指标均存在显著的相关关系也证明了该结论。这一结果表明,在干旱胁迫后,芒萁合成并积累Pro,并与抗氧化酶SOD、POD和CAT协同作用,增强抗旱性。因此,Pro的合成和积累对芒萁干旱胁迫的响应中极为重要。
4 结论
该研究揭示了南方红壤侵蚀区芒萁抵御干旱胁迫的生理机制。芒萁在干旱缺水的恶劣环境中的生存与其抗逆生理特性有关,包括抗氧化酶活性的快速诱导和渗透调节物质的积累。然而,当干旱胁迫较为严重时,抗旱机制受到影响,抗旱能力减弱。其中,抗氧化酶SOD和CAT以及渗透调节因子Pro是芒萁抵抗干旱胁迫的关键生理因子。因此,作为一种优良的水土保持植物,芒萁能够适应季节性土壤干旱,是其能够在我国南方红壤侵蚀区生态修复和水土保持方面发挥重要作用的重要原因。
