补体C3对儿童脓毒症患者预后的预测价值
2023-10-31彭智慧颜海鹏卢秀兰张新萍黄娇甜肖政辉
彭智慧 颜海鹏 卢秀兰 张新萍 黄娇甜 肖政辉
(1.南华大学儿科学院,湖南长沙 410007;2.湖南省儿童医院重症医学科,湖南长沙 410007;3.湖南省儿童医院急诊综合病房,湖南长沙 410007)
脓毒症是机体对感染反应失调导致的危及生命的器官功能障碍,是儿科重症监护病房常见的危急重症,也是导致危重症患儿死亡的主要原因之一[1]。脓毒症患儿可出现免疫功能紊乱[2],研究发现,脓毒症免疫紊乱在疾病进展中发挥重要作用,深入了解脓毒症免疫指标变化情况及其机制对脓毒症疾病诊治具有重要作用[3]。补体系统是固有免疫的重要组成部分,脓毒症发生时,机体产生损伤相关分子模式和病原体相关分子模式,诱导补体系统激活,进一步刺激中性粒细胞和淋巴细胞产生免疫应答,分泌抗体及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、γ-干扰素(γ-interferon, IFN-γ)等炎症因子,对抗病原体入侵。但补体系统的过度活化会导致炎症反应失调,使脓毒症疾病进展恶化。研究表明,补体C3水平降低是脓毒症患儿进展为多器官功能障碍和死亡的危险因素[4],脓毒症期间补体C3消耗与病情严重程度及预后相关[5],但以上研究[4-5]均只是定性地表明补体C3改变与脓毒症预后的关系。本研究进一步分析补体C3在脓毒症中的作用,并探讨早期判断脓毒症严重程度及预后的界值,为临床提供参考。
1 资料与方法
1.1 研究对象
收集2019年11月—2021年9月湖南省儿童医院重症医学科收治的529例脓毒症患儿为研究对象,所有患儿符合儿童脓毒症休克(感染性休克)诊治专家共识[6]中的诊断标准。排除标准:(1)年龄小于28 d或大于18岁;(2)本次起病接受免疫抑制治疗;(3)患有自身免疫性疾病;(4)化疗或血液系统疾病和实体肿瘤缓解期患儿;(5)临床资料不完整者。
1.2 分组
根据患儿入院诊断脓毒症24 h内补体C3的中位数(0.77 g/L)水平分为C3正常组和C3降低组。根据诊断脓毒症后28 d预后情况分为存活组和死亡组。死亡组包括抢救无效死亡或积极抢救无法恢复自主呼吸和心跳而放弃治疗的患儿。
本研究经湖南省儿童医院伦理委员会批准(HCHLL-2020-04),并获得患儿家属的知情同意。
1.3 资料收集
回顾性收集529例脓毒症患儿的病例资料。(1)人口学资料:性别、年龄、体重指数;(2)入院24 h内的生命体征、呼吸机使用情况,并进行病情严重程度评分[包括儿童快速序贯器官衰竭评分(pediatric Sequential Organ Failure Assessment, p-SOFA)和儿童器官功能障碍评分2(Pediatric Logistic Organ Dysfunction 2, PELOD 2)];(3)诊断脓毒症24 h内淋巴细胞亚群、体液免疫、补体C3、补体C4、血常规、降钙素原(procalcitonin, PCT)、C反应蛋白(C reactive protein, CRP)、白细胞介素(interleukins, IL)-6、IL-10、肝功能、肾功能、心肌酶、凝血功能等检查结果。
1.4 统计学分析
采用SPSS 25.0软件进行统计学分析。非正态分布的计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验;计数资料以例数和率(%)表示。Spearman秩相关分析补体C3与脏器损伤指标的相关性。采用logistic回归分析影响脓毒症预后的因素。采用受试者操作特征曲线(receiver operating characteristic curve, ROC曲线)评价预后相关危险因素对脓毒症预后的预测价值。使用PASS 11.0软件进行样本量估算。使用MedCalc v19.2.6软件Z检验对预测指标的曲线下面积(area under the curve,AUC)进行比较。P<0.05认为差异具有统计学意义。
2 结果
2.1 存活组和死亡组一般临床资料比较
529例脓毒症患儿中,存活组471例(89.0%),死亡组58例(11.0%)。死亡组呼吸机使用率、PCT水平、病情严重程度评分(p-SOFA评分及PELOD 2评分)均高于存活组,差异均有统计学意义(P<0.05)。见表1。
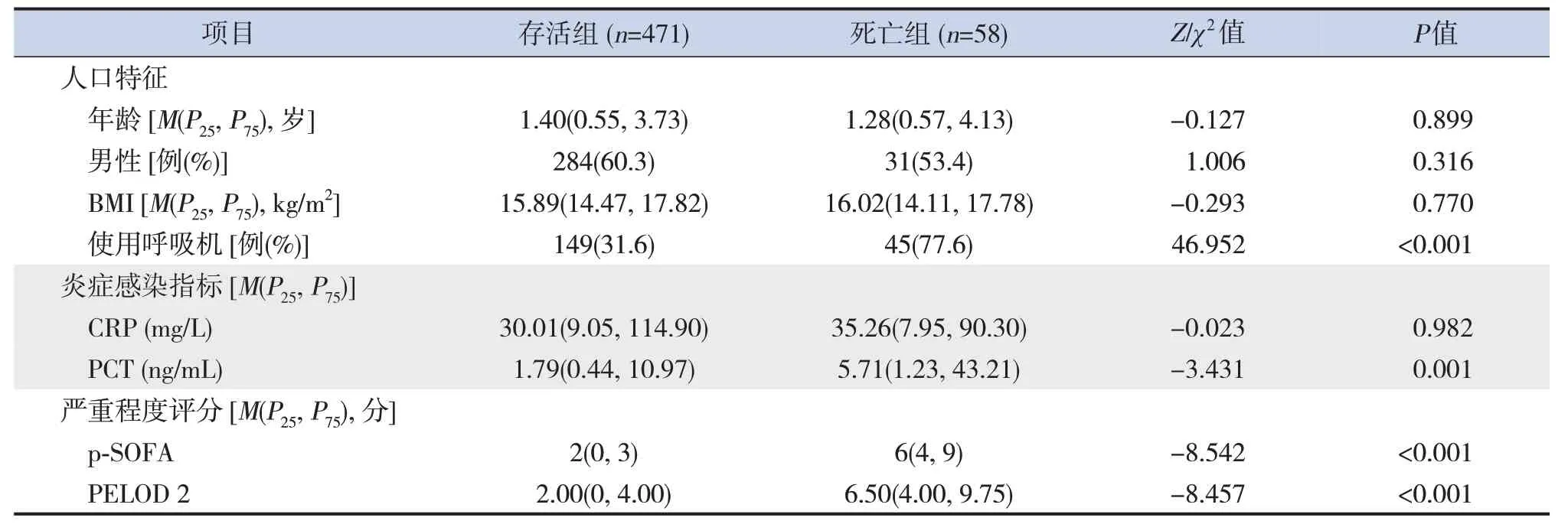
表1 存活组和死亡组一般临床资料比较
2.2 存活组和死亡组免疫学相关指标比较
死亡组补体C3、补体C4、IgM、辅助性T细胞/抑制性T细胞、辅助/诱导性T淋巴细胞、总T淋巴细胞、T淋巴细胞+B淋巴细胞+NK细胞、单核细胞比值低于存活组,IL-6和IL-10水平高于存活组(P<0.05),见表2。
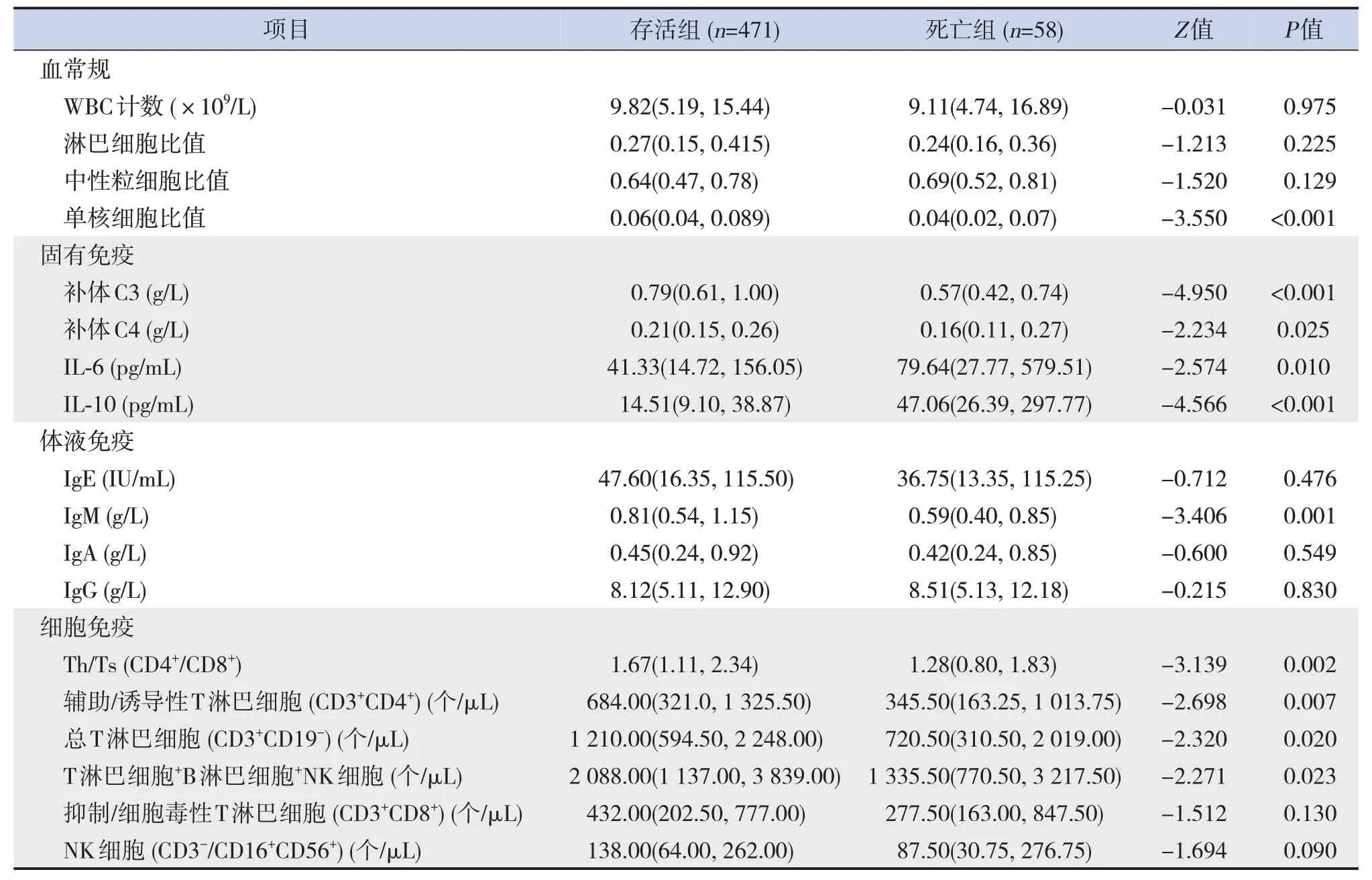
表2 存活组和死亡组免疫学相关指标比较 [M(P25,P75)]
2.3 C3降低组和C3正常组一般临床资料比较
C3降低组呼吸机使用率、PCT水平,以及p-SOFA及PELOD 2评分高于正常组(P<0.05),CRP水平低于C3正常组(P<0.05),见表3。

表3 C3降低组和C3正常组一般临床资料比较
2.4 补体C3与脓毒症患儿脏器损伤指标的相关分析
补体C3与p-SOFA评分、PCT水平呈负相关(分别rs=-0.26、-0.41,P<0.001)。在脏器损伤指标中,补体C3与谷草转氨酶、谷丙转氨酶、尿素氮、肌酸激酶同工酶均呈负相关(分别rs=-0.42、-0.35、-0.20、-0.46,P<0.001)。在凝血功能指标中,补体C3与凝血酶原时间、凝血酶时间、国际标准化比值均呈负相关(分别rs=-0.24、-0.36、-0.24,P<0.001),与纤维蛋白原、抗凝血酶Ⅲ及血小板计数呈正相关(分别rs=0.52、0.37、0.28,P<0.001)。
2.5 脓毒症患儿死亡的危险因素分析
对C3正常组与C3降低组间基线差异有统计学意义的指标(年龄、性别、体重指数)进行单因素logistic回归分析,结果显示3个因素与死亡均无显著关联(均P>0.05),因此未纳入多因素logistic回归模型。多因素logistic回归分析结果显示,p-SOFA得分高(OR=1.504,95%CI:1.351~1.673,P<0.001)、补体C3低(OR=0.261,95%CI:0.082~0.833,P=0.023)与脓毒症患儿死亡密切相关。见表4。
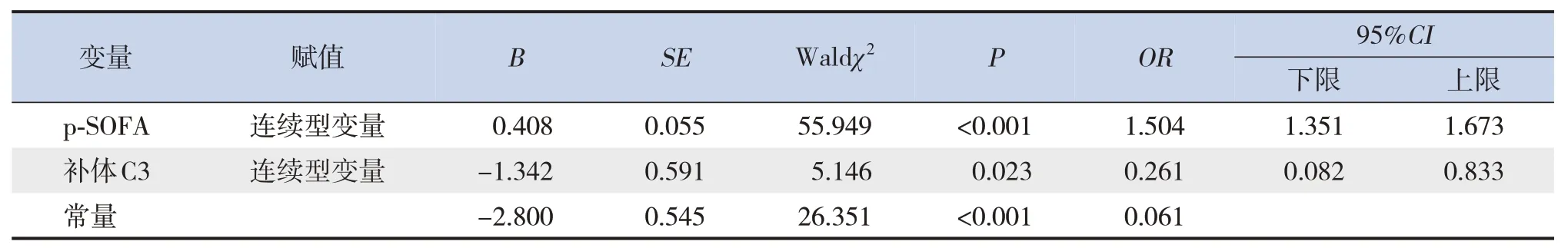
表4 脓毒症死亡危险因素的多因素logistic回归分析
2.6 p-SOFA和补体C3对脓毒症患儿死亡的预测价值
当p-SOFA的截断值取3.5分时,AUC为0.839(95%CI:0.787~0.891),灵敏度为75.9%,特异度为76.0%,约登指数为0.519;当补体C3的截断值取0.685 g/L时,AUC为0.699(95%CI:0.623~0.775),灵敏度为66.2%,特异度为69.0%,约登指数为0.352;p-SOFA和补体C3联合的AUC为0.852(95%CI:0.801~0.902),灵敏度为77.6%,特异度为83.2%,约登指数为0.608。p-SOFA和补体C3联合的AUC显著高于p-SOFA及补体C3单项指标的AUC(分别Z=3.193、4.245,分别P=0.003、P<0.05)。见图1。
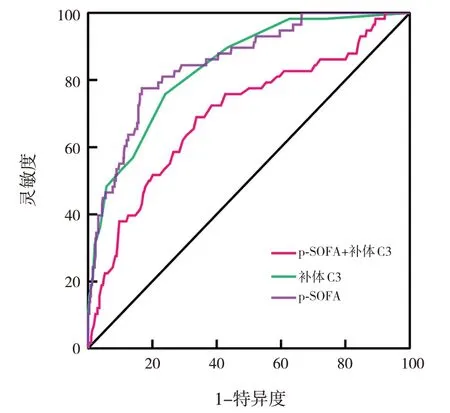
图1 p-SOFA和补体C3预测脓毒症患儿死亡的ROC曲线
3 讨论
脓毒症是全世界儿童死亡的主要原因之一[7],可能会导致休克和多器官功能障碍[8],脓毒症存在全身炎症反应和免疫抑制,但目前对于脓毒症机体免疫功能紊乱的机制及具体作用认识不足,缺乏有效的免疫监测和治疗措施[9]。
免疫系统在脓毒症疾病过程中发挥重要作用,脓毒症患儿免疫学指标有明显改变,可作为评估病情和预后的参考指标[10]。补体系统的激活途径均形成C3转化酶,将补体C3转化为C3a和C3b,发挥促炎作用,可见补体C3在补体系统中的核心地位[11]。研究发现,与野生型小鼠相比,补体C3缺陷的小鼠无法形成膜攻击复合物,导致无法进一步介导靶细胞坏死凋亡,使得脓毒症组小鼠病死率明显升高,证明补体C3在脓毒症发病机制和病情进展中发挥重要作用[12]。
在本研究中,死亡组补体C3、C4水平低于存活组,而IL-6和IL-10水平高于存活组,表明在脓毒症早期,补体系统活化可能参与了脓毒症炎症反应和免疫抑制过程,导致不良预后。Lei等[13]研究结果显示,在诊断脓毒症的第1天和第2天,死亡组补体C3水平均显著低于存活组,并发现补体C3降低是脓毒症患者死亡的危险因素。也有学者研究发现革兰氏阴性杆菌感染所致的脓毒症患者,补体C3降低和IL-10升高往往预示着不良预后[14]。
本研究结果提示脓毒症中补体消耗与疾病严重程度有关。PCT被认为是细菌感染的特异标志物,补体C3消耗与PCT水平呈负相关,与Ren等[15]研究结果一致。同时,本研究结果也显示补体C3参与了脓毒症器官功能损伤,与孙杭等[4]研究结果一致。其机制可能是脓毒症期间补体系统的强烈激活,活化的中性粒细胞和巨噬细胞,以及补体激活产物C5b-9等刺激炎症因子过度释放,导致全身炎症反应综合征,使得正常组织器官受损[16]。
本研究发现,脓毒症补体活化与凝血功能异常存在相关性。研究证实,补体消耗与脓毒症凝血功能障碍密切相关[15,17],补体系统和凝血系统有着复杂的关联[18]。凝血系统可影响补体的转化,凝血酶、纤溶酶和凝血因子可以作为补体C3、C5的天然转化酶,将补体C3、C5裂解成C3a和C5a,介导后续炎症反应的发生[19],过度的炎症反应可能损伤血管内皮细胞,进一步激活凝血系统。而补体在脓毒症凝血功能障碍中也发挥重要作用,使用补体C3转化酶抑制剂可以有效防止脓毒症诱导的补体激活,并减少凝血酶的激活,阻断凝血激活的级联反应[20]。有学者对脓毒症并发弥散性血管内凝血的患者血标本进行检测,发现合并弥散性血管内凝血的患者体内补体C3水平更低[21]。C5a也被认为可直接诱导凝血系统激活[22]。
在许多严重的疾病如脓毒症、休克、创伤等疾病中常常伴随有补体活化,在重症监护室住院患者中监测补体水平有利于及时对病情进行判断[23],甚至可通过干预补体水平对疾病进行治疗。研究发现,对缺血性脑卒中小鼠使用补体C3转化酶抑制剂可减小梗死面积,改善神经功能和提高生存率[24]。但有学者对209例脓毒症患者补体C3水平进行分析,发现在重症脓毒症患者中,SOFA得分、脓毒症休克发生率及病死率均与补体水平无相关性,认为当疾病进展到严重脓毒症或脓毒症休克时,补体系统已被深度激活,与失调的炎症反应不再相关,对临床结局影响甚微,提示重症脓毒症患者体内的补体激活对临床结局没有预测价值[25]。
本研究尚存在一些不足之处:为单中心研究,仅关注补体C3在一个时间点的改变情况,但补体系统激活程度会随脓毒症疾病进展发生改变,后续可对补体系统其他指标进行检验,并针对不同时间点进行分析。
综上所述,脓毒症患儿存在补体消耗,联合补体C3与p-SOFA对脓毒症患儿死亡结局有良好的预测价值,补体C3降低可作为脓毒症患儿死亡结局的风险预测因子,并确定补体C3截断值为0.685 g/L,该截断值有待于在更大规模数据中进一步验证,有助于临床识别高风险患者,并在临床决策时提供参考价值。
利益冲突声明:所有作者均声明无利益冲突。
