大型艾美耳球虫重组蛋白GAPDH对兔的免疫保护效果评价
2023-10-29郑若愚蒲家艳任永军杨光友
郑若愚,肖 洁,白 鑫,陈 浩,蒲家艳,任永军,杨光友*
(1.四川农业大学动物医学院,成都 611130;2.四川省畜牧科学研究院,成都 610066;3.动物遗传育种四川省重点实验室,成都 610066)
大型艾美耳球虫(Eimeriamagna)具有明显的致病性,是兔球虫中的常见虫种之一[1-2]。在大型艾美耳球虫裂殖生殖时期,裂殖子进入肠上皮细胞内发育繁殖,新的裂殖子产生后逸出,再进入新的上皮细胞内,如此反复,严重破坏肠道组织,损坏绒毛结构,导致疾病发作[3-4]。药物预防是目前兔业生产中防治兔球虫的主要手段[5-7],但由于球虫耐药性增强以及药物在兔肉中残留等问题,免疫防控越来越受到人们的关注。目前已选育出大型艾美耳球虫的早熟株[8-9],并建立了大型艾美耳球虫转基因虫株[10]。同时,采用基因工程技术来研制安全、有效的兔球虫新型疫苗也是一个很有吸引力的研究方向。其中,重组亚单位疫苗的表达系统较为成熟,该系统具有生产周期短、产量高和生产成本相对较低等优点,而筛选具有良好免疫保护效果的疫苗抗原蛋白,无疑是重组亚单位疫苗研制的关键[11]。
三磷酸甘油醛脱氢酶(GAPDH)是催化糖酵解反应中的一个关键酶,该酶在真核生物以及原核生物中广泛存在,且表达水平高[12-13]。日本血吸虫(Schistosomajaponicum)[14-17]、曼氏血吸虫(Schistosomamansoni)[18-20]、旋盘尾丝虫(Onchocercavolvlus)[21-22]、捻转血矛线虫(Haemonchuscontortus)[23]和鸡巨型艾美耳球虫(Eimeriamaxima)[24]的GAPDH可作为重组亚单位疫苗候选抗原。目前尚无有关兔大型艾美耳球虫GAPDH的研究报道,本研究基于实验室测定的大型艾美耳球虫转录组数据,筛选出Em-GAPDH基因,通过原核表达获得了重组蛋白rEm-GAPDH,通过动物保护试验评价了rEm-GAPDH的免疫保护效果,为兔大型艾美耳球虫重组亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 实验动物许可与伦理声明
本实验所有程序均按照四川农业大学动物伦理委员会(中国,雅安)实验动物福利与使用规则的要求进行(批准号:2019-189)。
1.2 材料
1.2.1 实验用虫株、cDNA及实验动物 大型艾美耳球虫不同发育阶段的cDNA(未孢子化卵囊、孢子化卵囊、裂殖体和配子体)由四川农业大学动物寄生虫病研究中心提供。
实验动物为四川农业大学动物寄生虫病研究中心自繁自养的无球虫新西兰兔50只(雌雄各半),体重为1.1 kg±0.2 kg。幼兔在18日龄断奶,使用人用婴儿奶粉饲喂至30日龄。实验兔雌雄分开,每2只饲养于不锈钢笼具中,饲养笼经火焰喷烧处理,在底部放置塑料隔板,减少实验兔与粪便的接触。期间提供煮沸的饮水和80 ℃烘烤后的兔饲料,并轮换使用抗球虫药物地克珠利和癸氧喹酯,攻虫前1周实验兔停药并进行检测,后续使用专门定制的未添加抗球虫药物的兔饲料进行饲喂。
1.2.2 主要试剂与仪器 限制性内切酶(BamH I/EcoR I)、pMD19-T载体、T4 DNA Ligase购自宝生物工程(大连)有限公司;大肠杆菌DH5α和BL21(DE3)感受态购自天根生化科技(北京)有限公司;HRP标记羊抗兔IgG抗体购自武汉博士德生物工程有限公司;pET32a(+)质粒由四川农业大学动物寄生虫病研究中心提供;Rabbit IFN-γ ELISA development kit (HRP)试剂盒,购自瑞典Mabtech 公司;Rabbit IL-2、IL-4、IL-10、IL-17 ELISA Kit试剂盒,Rabbit Transforming Growth factor β1(TGF-β)ELISA Kit试剂盒,购自武汉CUSABIO BIOTECH公司。
PCR仪:Mastercycler Gradient,eppendorf,美国;中高压层析系统:NGCTM10,Bio-Rad,美国;半干转印槽:SEMIDRYBLOT,Bio-Rad,美国;McMaster计数板,富士平工业株式会社。
1.3 方法
1.3.1Em-GAPDH基因的克隆测序与生物信息学分析 根据实验室测定的转录组数据筛选出的Em-GAPDH基因,用Primer Premier 5.0软件设计引物:(上游5′-CGGGATCCATGCTCTACGCTGACGTGTAC-3′,BamHI;下游5′-CGGAATTC-TTAGTTGCCGTCTTTCTGAGACA-3′,EcoRI)。克隆测序后利用生物信息学软件对氨基酸序列进行分析,使用ExPASy ProtParam工具预测分子量(MW)和等电点(pI),使用SignalP5.0 Server和TMHMM Server v. 2.0.预测该基因信号肽和跨膜区的存在。
1.3.2Em-GAPDH的表达与纯化 取不同发育阶段虫体cDNA混合液为模板,对目的片段进行PCR扩增。将目的条带与pMD19-T载体连接,以测序结果正确的重组质粒为模板再次进行PCR扩增,产物和pET32a(+)质粒一起双酶切、T4连接后转入感受态BL21(DE3)中,培养阳性菌至菌液OD590 nm至0.6后,加入1.0 mmol·L-1IPTG,37 ℃诱导表达8 h(110 r·min-1);菌液7 000 r·min-1离心10 min,在菌体沉淀中加入裂解液(50 mmol·L-1Tris-HCl,pH=8.0)重悬菌体,反复冻融3次后超声破碎。取上清和尿素溶解的沉淀进行SDS-PAGE判断原核表达重组蛋白的可溶性。用镍离子亲和层析的方法纯化重组蛋白,并将纯化后的重组蛋白用PBS进行透析,SDS-PAGE分析纯化效果。
1.3.3 rEm-GAPDH的蛋白免疫印迹分析 人工感染大型艾美耳球虫阳性兔血清与球虫阴性兔血清由四川农业大学动物寄生虫病研究中心提供。所有血清样品均储存于-20 ℃。
样品(40 μL蛋白质和10 μL负载缓冲液)煮沸10 min,12%十二烷基硫酸钠-PAGE分离,在室温下转移到硝酸纤维素膜35 min。膜在Tris-Buffed生理盐水-吐温-(TBST)(20 mmol·L-1Tris-HCl,150 mmol·L-1氯化钠,0.05%v/v吐温-20,pH 7.4)中清洗3次,每次5 min,包被5%脱脂牛奶2 h,然后与阳性血清孵育过夜(用0.01 mol·L-1PBS稀释1∶200)。再用辣根过氧化物酶(HRP)标记的羊抗兔抗体(1∶1 000稀释)孵育2 h,再清洗4次,用二氨基联苯胺试剂检测信号。
1.3.4 rEm-GAPDH的稳定性试验 选择纯化后的重组蛋白rEm-GAPDH,分别保存于4 ℃、-20 ℃和-80 ℃,每周固定时间分别制样,持续7周。SDS-PAGE分析对比7周的蛋白浓度变化。
1.3.5 大型艾美耳球虫rEm-GAPDH对兔的免疫保护效果观察
1.3.5.1 分组和免疫程序:本试验中,50只45日龄的无球虫感染幼兔分组情况如表1。免疫方式为颈部皮下注射,免疫接种2次,两次免疫时间间隔14 d。加强免疫后14 d,除空白对照组外,其余实验兔均口服感染1×105个孢子化卵囊。

表1 实验动物的分组和免疫程序
1.3.5.2 免疫保护效果评价:观察首免、二免及攻虫后各组实验兔的精神状态、食欲及粪便形状等临床表现。
在首免前、二免前及宰杀前对实验兔逐只称重,免疫后攻虫前平均增重=攻虫前体重-首免前体重;攻虫后平均增重=剖杀前体重-攻虫前体重;相对增重率=(实验各组平均增重/不感染不免疫平均增重)×100%;料肉比=(饲喂前饲料总量-剖杀后剩余饲料总量)/感染后增重总量;试验结束时收集实验兔肠道进行病变计分,ACI=(相对增重率+存活率)-(病变值+卵囊值)。效果判定标准如下:ACI≥180 保护效果优秀,160≤ACI<179保护效果良好,120≤ACI<160保护效果中等,ACI<120无保护效果[25-27]。
参考动物球虫病诊断技术国家标准(GB/T18647—2020),剖检时,从每只实验兔直肠中收集2 g粪便,使用麦克马斯特法计算每克粪便中的卵囊排出量(oocyst per gram, OPG),并计算卵囊减少率。卵囊减少率=[(不免疫攻虫组OPG-免疫组OPG)/不免疫攻虫组OPG]×100%。
1.3.6 细胞因子及抗体水平的检测 从首免前开始,到攻虫后直至剖杀,每周定时采集实验兔血清。对攻虫前血清中不同细胞因子(IL-2、IL-4、IL-10、IL-17、TGF-β、IFN-γ)水平进行测定,具体操作方法参照试剂盒说明书。使用基于重组蛋白rEm-GAPDH的间接ELISA方法检测实验兔每周的血清中特异性IgG抗体水平(蛋白稀释比1∶100,二抗稀释比1∶3 000)。
1.3.7 数据处理 使用GraphPad软件(GraphPad Prism版本5.0)制作生成所有图形。使用SPSS Statistics 20.0确定组间的统计学差异,对每个因变量(平均增重、卵囊排出量)的重复测量进行方差分析。
2 结 果
2.1 Em-GAPDH基因克隆、生物信息学分析及原核表达
以大型艾美耳球虫cDNA为模板扩增出Em-GAPDH基因,经克隆测序分析,扩增片段与大型艾美耳球虫转录组数据中的序列相似性达100%(GenBank:OQ128328)。Em-GAPDH序列长度为1 149 bp(图1a),编码382个氨基酸。预测相对分子量为41.19 ku,计算等电点(PI)为7.01。
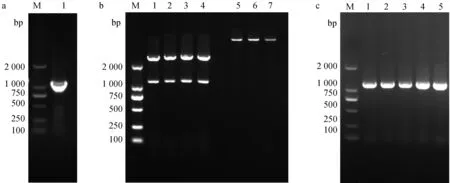
泳道: M. DNA分子质量标准。a. Em-GAPDH的扩增:1:基因Em-GAPDH扩增结果。b. 双酶切鉴定:1~4. Em-GAPDH的双酶切;5~7. pET32a(+)载体质粒的双酶切。c. 成功构建表达载体:1~5. Em-GAPDH表达载体菌液PCRLane: M. DNA marker; a. Amplification of Em-GAPDH: 1. Em-GAPDH; b. Double-restriction digestion identification: 1-4. Em-GAPDH; 5-7. pET32a(+) vector; c. Successful construction of expression vector; 1-5. Identification by bacterial liquid PCR图1 基因Em-GAPDH的克隆(a)、双酶切鉴定(b)与菌液PCR鉴定(c)Fig.1 Cloning, enzymatic cleavage and PCR identification of the gene Em-GAPDH
以测序成功的菌液扩增培养后提取质粒,将基因克隆菌的质粒与pET32a(+)质粒一起在37 ℃条件下进行双酶切30 min。酶切反应完成后,其产物进行琼脂糖凝胶电泳(图1b),并成功与pET-32a(+)载体连接,经转化、涂板及单菌落鉴定,成功构建重组质粒pET-32a(+)-Em-GAPDH(图1c)。
2.2 rEm-GAPDH的蛋白纯化和免疫印迹分析
重组蛋白rEm-GAPDH在诱导剂IPTG终浓度为1.0 mmol·L-1,37 ℃ 130 r·min-1诱导表达12 h的条件下表达量最高,大小在59 ku左右,且大部分表达在包涵体。重组蛋白经镍离子亲和层析后的纯化效果良好,无明显杂条带(图2)。同时,rEm-GAPDH能识别兔大型艾美耳球虫阳性血清(图3),具有良好的免疫反应性。
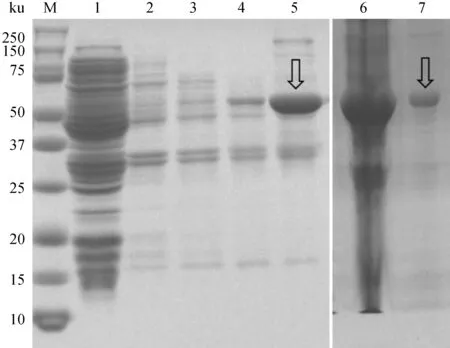
泳道:M.蛋白质分子量标记(ku);1. 重组菌诱导表达后菌体裂解物上清;2~5. 菌体裂解物先后溶解于2、4、6、8 mol·L-1尿素;6. 诱导表达后未经纯化的rEm-GAPDH;7. 经纯化的rEm-GAPDHLanes: M. protein molecular weight markers (in ku);1. soluble protein;2-5.inclusion body in 2,4,6,8 mol·L-1 urea;6. non-purified rEm-GAPDH; 7. purified rEm-GAPDH图2 重组蛋白rEm-GAPDH的可溶性分析及纯化后效果Fig.2 SDS-PAGE of solubility analysis of recombinant protein rEm-GAPDH
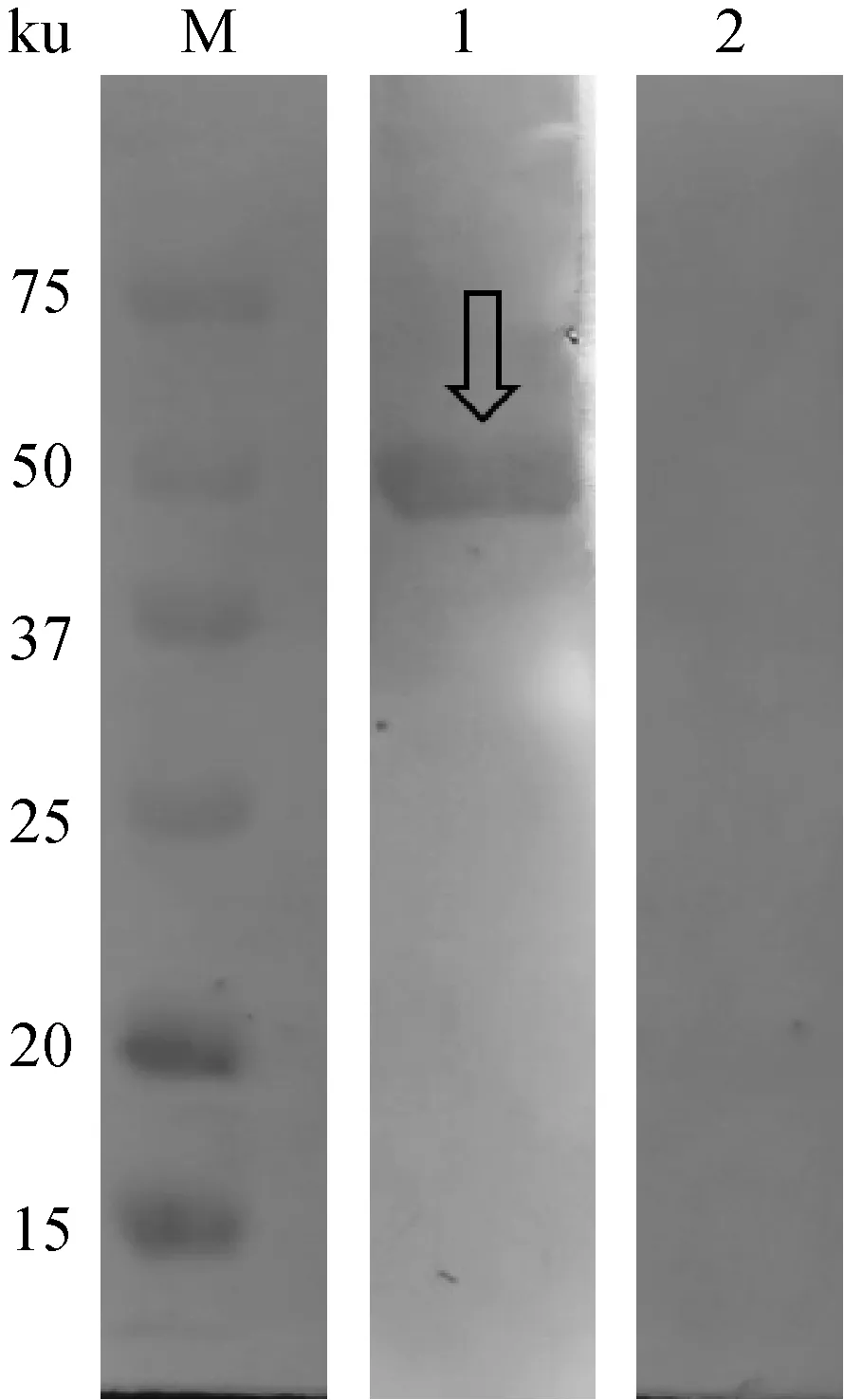
泳道:M.蛋白质分子量标记(ku);1.经纯化的rEm-GAPDH与人工感染大型艾美耳球虫兔血清识别反应;2.经纯化的rEm-GAPDH与无球虫感染健康兔血清识别反应Lanes: M.protein molecular weight markers (in ku); 1.purified rEm-GAPDH detected by serum from naturally infested with Eimeria magna; 2.purified rEm-GAPDH detected by healthy rabbit′s serum图3 纯化后重组蛋白rEm-GAPDH的蛋白免疫印迹分析Fig.3 Western blotting of purified recombinant protein
2.3 重组蛋白rEm-GAPDH稳定性试验
纯化后重组蛋白各加5%的甘油,混匀后分别保存于-80 ℃、-20 ℃、4℃三种温度下,持续观察7周。由SDS-PAGE结果可知,重组蛋白在7周内浓度恒定,没有出现明显的降低情况(图4)。所以重组蛋白rEm-GAPDH的稳定性良好。

泳道:M.蛋白质分子量标记(ku);1~7,保存于-80℃下纯化后蛋白0~7周的制样;8~14,保存于-20℃下纯化后蛋白0~7周的制样;15~21,保存于4℃下纯化后蛋白0~7周的制样Lanes: M.protein molecular weight markers (in ku); 1-7. stored at -80℃ for 0-7 weeks of purified protein preparation; 8-14. stored at -20℃ for 0-7 weeks of purified protein preparation; 15-21. stored at 4℃ for 0-7 weeks of purified protein preparation图4 纯化后重组蛋白rEm-GAPDH在不同温度下0~7周制样的SDS-PAGE图Fig.4 SDS-Page of purified recombinant protein rEm-GAPDH samples prepared at different temperatures for 0-7 weeks
2.4 rEm-GAPDH对家兔的免疫保护效果
2.4.1 临床表现及剖检病变 在攻虫前各组实验兔体况表现正常,在经口感染1×105个孢子化卵囊后,第1周未有明显症状,感染后第2周不免疫攻虫组出现大型艾美耳肠球虫病的典型症状:食欲轻微减退,精神沉郁,粪便变软不成形;而rEm-GAPDH免疫组症状不明显。
剖检观察肠道病变发现,rEm-GAPDH免疫组整体病变程度相较三个攻虫对照组更轻,病变计分(1.30±0.95)低于不免疫攻虫组(1.70±0.67)、Trx-His-S tag攻虫对照组(1.60±0.97)和Quil-A saponin攻虫对照组(1.60±0.70),但不存在显著差异(P>0.05)。
2.4.2 相对增重 初次免疫、二次免疫和攻虫时各组体重无明显差异。感染14 d后空白对照组平均增重(423.75±39.72 g),与不免疫攻虫组(平均增重183.33±168.39 g)、Trx-His-S tag攻虫对照组(平均增重205.50±72.62 g)和Quil-A saponin攻虫对照组(平均增重191.81±76.98 g)的三个组间呈现显著差异(P<0.05)。rEm-GAPDH免疫组平均增重288.00±41.24 g,与其他对照组之间也存在明显差异(P<0.05)。其中,不免疫攻虫组的相对增重率仅为空白对照的43.26%,感染后第二周甚至有个别试验兔体重出现负增长;而rEm-GAPDH免疫组的相对增重率为67.96%(表2)。

表2 rEm-GAPDH对兔感染大型艾美耳球虫的保护效果统计
2.4.3 卵囊排出量 感染后14 d结束试验并检测每只实验兔的卵囊排出量,空白对照组的粪便样本中未检查到大型艾美耳球虫卵囊;不免疫攻虫组平均OPG达3.15×104,Trx-His-S tag攻虫对照组平均OPG达3.09×104,Quil-A saponin攻虫对照组平均OPG达3.11×104,均不存在显著差异(P>0.05)。而rEm-GAPDH免疫组的平均OPG为1.34×104,与不免疫攻虫组相比显著减少(P<0.05),免疫组的卵囊减少率达57.16%(表2)。综合上述指标,得到rEm-GAPDH免疫组的ACI值为144.96,具有中等保护效果。
2.4.4 血清中特异性IgG抗体水平的变化 免疫接种后,rEm-GAPDH免疫组实验兔的血清平均特异性IgG抗体水平升高,其平均水平极显著的高于各个对照组的抗体水平(P<0.01);rEm-GAPDH免疫组的血清平均特异性IgG抗体水平在加强免疫后1周达到最高水平,但后续抗体水平未维持在较高水平,在第7周出现较明显的下降(图5)。
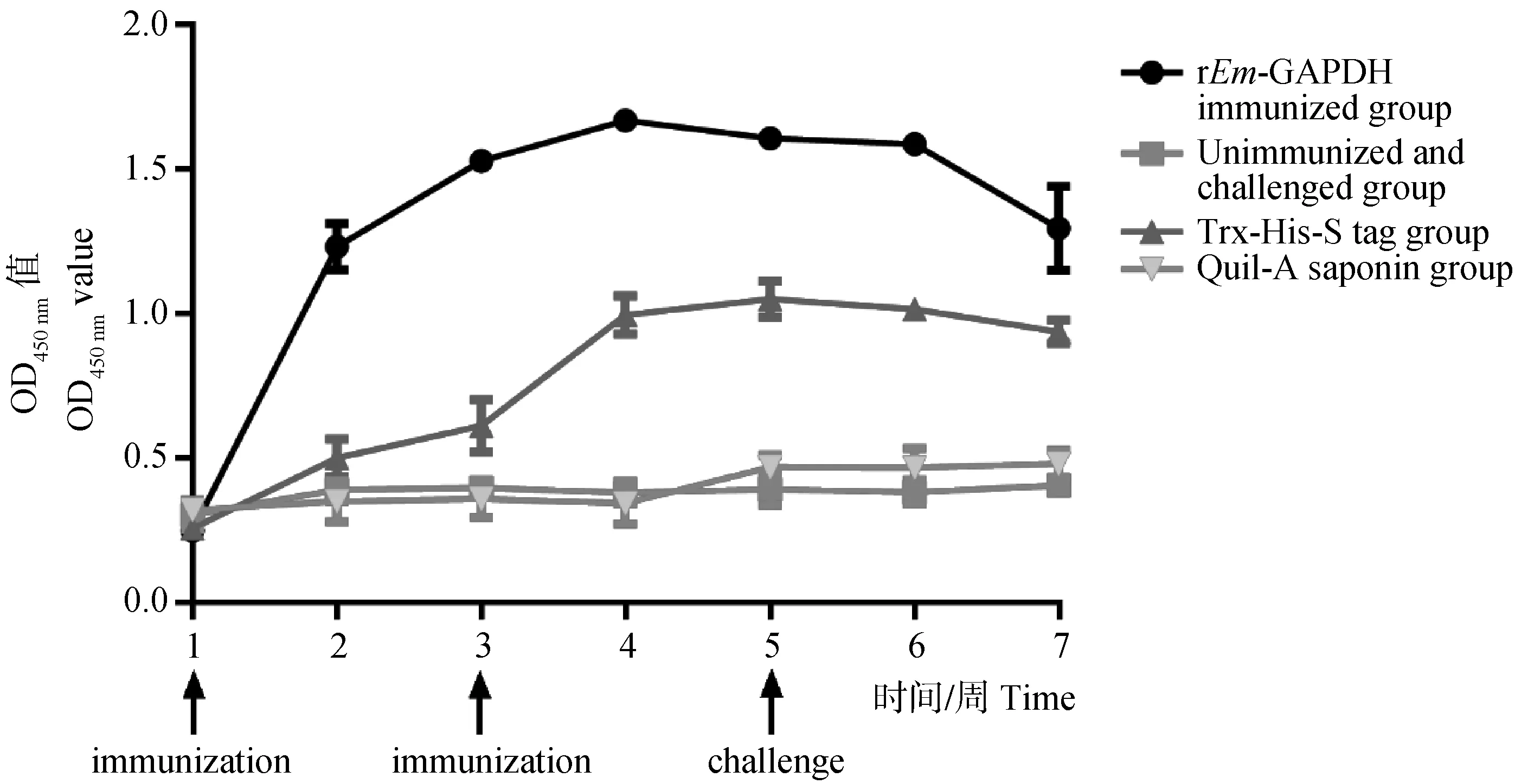
Immunization:第一次和第二次免疫蛋白;challenge:大型艾美耳球虫攻虫Immunization: first and second immunization with vaccine; challenge: challenge with Eimeria magna图5 实验兔血清中特异性IgG抗体水平的变化情况Fig.5 Variation of specific IgG antibody levels in sera of immunized rabbits
2.4.5 细胞因子 免疫组除IL-17水平无明显变化外,其他细胞因子(IL-2、IL-4、IL-10、TGF-β和IFN-γ)水平均显著高于不免疫攻虫组及Quil-A saponin攻虫对照组(图6)。
3 讨 论
兔球虫基因工程苗的研究主要集中在核酸疫苗[28]、活载体疫苗[29-30]和重组亚单位疫苗[31-32]上,而这些研究的关键在于筛选具有良好免疫保护作用的候选抗原。目前已有研究表明,大型艾美耳球虫重组亚单位疫苗能为家兔提供良好的抗感染保护效果[33-35]。
GAPDH除了在糖酵解反应中起到关键作用外,还具有其他多种生物学功能[36-37]。比如与基质蛋白结合,调节宿主免疫反应,在病原毒力和表面定位中发挥作用等[38-40]。GAPDH在鸡的柔嫩艾美耳球虫(Eimeriatenella)子孢子入侵鸡肠上皮细胞的过程中起到正向调控作用[41]。同时,包括恶性疟原虫(Plasmodiumfalciparum)在内的几种致病原虫不存在三羧酸循环,只依赖糖酵解产生能量,其代谢过程所需的ATP完全来自糖酵解反应,并且进一步通过试验证明了疟原虫子孢子GAPDH与宿主肝细胞相识别,作用于抑制子孢子穿越和感染肝[42-43]。研究表明,GAPDH可以作为预防细菌和寄生虫病的疫苗候选抗原[38]。本研究中动物保护试验表明,重组蛋白rEm-GAPDH免疫实验兔能够有效抵抗大型艾美耳球虫的感染,产生中等保护效果,卵囊减少率达57.16%,为兔的大型艾美耳球虫重组亚单位疫苗的研制提供了候选抗原。
细胞免疫在预防艾美耳球虫感染的保护性免疫反应中发挥着关键作用[44]。鸡体内的IFN-γ可以通过抑制鸡球虫子孢子的生长发育、参与抗原呈递等过程增强宿主的抗球虫感染能力[45]。IL-2可以抑制鸡球虫子孢子和裂殖子的活化增殖[46-47]。如果抑制鸡体内的IL-2产生,其抵抗球虫的能力会下降,因此将IL-2与候选抗原进行融合表达可以增强疫苗效果,其产生的免疫反应特异性更佳,持续时间更长,抗球虫的效果也更好[48]。IL-4、IL-10是介导Th2型反应的细胞因子,在弓形虫感染中,它们能够降低炎症反应,减少宿主的病理变化[49]。TGF-β是一种抗炎性的细胞因子,参与修复受损伤的黏膜上皮细胞,降低宿主的炎性反应[50]。本研究中检测了rEm-GAPDH免疫组细胞因子(IL-2、IL-4、IL-10、IL-17、 TGF-β、IFN-γ),除IL-17的浓度水平与对照组无显著差异外,免疫组其余细胞因子水平都存在统计学差异,说明免疫组的重组蛋白能引发细胞因子水平的变化,其中IFN-γ、IL-2水平的上调,可能在抗大型艾美耳球虫感染的过程中起到了一定作用。
本试验检测到免疫组的特异性IgG抗体水平较对照组显著上升。重组蛋白rEm-GAPDH诱发产生的特异性IgG抗体可能引起宿主的免疫保护作用。在鸡球虫重组亚单位疫苗研究中,GAPDH已经被证明是鸡的堆型艾美耳球虫(Eimeriaacervulina)和巨型艾美耳球虫(Eimeriamaxima)的共同抗原[24]。在鸡的柔嫩艾美耳球虫、堆型艾美耳球虫、巨型艾美耳球虫分别感染及三种球虫混合感染的情况下呈现出较好的保护效果(ACI>160),其中卵囊减少率最高可达79%[51]。而本研究结果显示rEm-GAPDH引发了宿主(兔)体内的细胞免疫和体液免疫应答,免疫组的卵囊减少率达57.16%,具有一定免疫保护作用。Em-GAPDH能否成为对多种兔球虫产生共同保护效果的疫苗抗原,未来还需深入研究。
4 结 论
对大型艾美耳球虫GAPDH基因进行了克隆和原核表达获得了重组蛋白,免疫保护试验结果显示,rEm-GAPDH免疫兔后能显著减少增重损失和卵囊排出,可以引发宿主体内的细胞免疫和体液免疫应答。试验结果表明rEm-GAPDH可以作为大型艾美耳球虫重组亚单位疫苗的候选抗原。
