大家畜多能干细胞的研究进展与应用前景
2023-10-29罗睿杰曹素英
罗睿杰,曹素英
(北京农学院动物科学技术学院,北京 102206)
干细胞广泛存在于动物生长发育的各个阶段,按其分化潜能分为五类,全能干细胞、多能干细胞、多潜能干细胞、寡能干细胞、专能干细胞,这五类干细胞起源于动物生长发育的不同时期,其分化潜力依次下降[1]。全能干细胞一般可以分化成完整个体和胎盘等胚外组织;多能干细胞具有发育成胚胎全部三胚层各种细胞的能力,但一般不能形成胚外组织;多潜能干细胞能分化成单一胚层的多种细胞;寡能或专能干细胞只能分化为生理功能相近的几种(寡能)或一种(专能)细胞[1-2]。其中,多能干细胞由于具有在无限增殖中保持稳定及在一定诱导条件下分化为各种细胞的能力即具有较强的分化潜能,在生物医药、动物育种等领域拥有广阔的应用前景,成为干细胞领域研究的热点。
1 依据小鼠多能干细胞建立干细胞鉴定标准
1.1 由小鼠胚胎干细胞建立多能性鉴定标准
各种哺乳动物早期胚胎发育过程中,关键事件和细胞多能性变化规律大致相同。对于大部分哺乳动物,受精卵及其最初两次卵裂形成的卵裂球一般被认为是全能干细胞;在八细胞期之后,发生致密化和极化,产生内细胞团(inner cell mass, ICM)和滋养层(trophectoderm, TE),此过程为哺乳动物早期胚胎的第一次谱系分化[3];随后,第二次谱系分化开始,ICM中进一步产生上胚层(epiblast, EPI)和下胚层(hypoblast, HYPO),胚胎细胞的全能性在两次谱系分化过程中逐渐丧失,到胚胎附植前后,其中各种细胞均已不具备同时产生完整胚胎和胚外组织的能力[4]。
小鼠是经典的生物实验模式动物,在早期胚胎及多能干细胞领域,小鼠的研究进展明显快于其他物种,很多干细胞的状态和相关概念最初也是根据小鼠的干细胞特征被定义。最早的胚胎干细胞(embryonic stem cells, ESCs)于1981年从小鼠ICM中分离得到[5],随后几十年内,大量研究着眼于获得更接近体内早期胚胎状态,且能在体外稳定维持这种状态的多能干细胞[6-8]。对小鼠早期胚胎及小鼠ESCs的研究发现,随着胚胎发育的进行,来自不同时期ICM的ESCs多能性状态有所不同,由此定义了小鼠多能干细胞的初始(naive)和始发(primed)状态,以及后来定义的介于二者之间的形成(formative)状态[9]。其中,naive状态的ESCs来自小鼠妊娠第4天(简记为E4,下同)前早期胚胎,这类细胞与体内胚胎附植前EPI高度类似,能形成隆起、边缘清晰的克隆,能进行单细胞传代,能产生嵌合体后代,能得到四倍体补偿个体,被认为是最理想的多能干细胞[8,10]。primed状态定义为小鼠胚胎附植后到原节前期胚胎的EPI(约E7后逐渐产生)所处的状态,通常称为上胚层干细胞(epiblast stem cells, EpiSCs);在formative状态被定义后,primed干细胞的定义变为原肠早期至原节前期胚胎(约E6-8)中分离出的EpiSCs[11]。小鼠的primed状态干细胞一般克隆形态扁平,不能进行单细胞传代,不能产生生殖系嵌合和四倍体补偿个体[12]。formative状态于2021年被正式定义,是介于naive和primed之间的一种过渡状态,存在于小鼠约E5.5~E6.5体内胚胎中,其分化潜力、基因甲基化程度、嵌合体形成能力也介于naive和primed之间[13-15]。研究表明,不同状态的多能干细胞在细胞形态[16]、基因表达[17]、表观遗传特征[18]、发育潜力[2]等方面存在区别。
干细胞多能性的鉴定标准也在早期研究的基础上建立,包括六个层面[18]:1)体外分化,在体外诱导条件下分化为三胚层细胞,通过检测三胚层特异性蛋白进行鉴定;2)畸胎瘤实验,将多能干细胞注入免疫缺陷鼠皮下,使其在体内条件下自发分化,在所得畸胎瘤中检测三胚层特异性蛋白;3)嵌合体实验,将供体干细胞注入桑椹胚或早期囊胚阶段的胚胎中,待嵌合胚胎形成后,检测供体细胞对胚胎和胎儿发育的贡献;4)生殖系嵌合,在形成嵌合胚胎的基础上,在生殖器官中检出供体细胞的贡献,并产生功能性配子;5)四倍体补偿,将供体干细胞注入四倍体囊胚,产生完全由供体发育成的胚胎;6)单细胞嵌合,多能性是每一个多能干细胞都应该具有的性质,将单个多能干细胞注入四倍体囊胚,令单个供体干细胞发育成完整胚胎,是目前干细胞多能性最严格的标准。这六个层面严格程度依次递进,一般认为至少通过生殖系嵌合实验的干细胞可以被称为naive干细胞,其中一些naive干细胞已经可以通过四倍体补偿实验;primed干细胞一般需要通过畸胎瘤形成实验,少数primed干细胞注入囊胚后,嵌合体中可以检出极微量的供体干细胞贡献[19]。
1.2 由小鼠诱导多能干细胞建立重编程鉴定标准
直接研究和使用早期胚胎中的干细胞面临两项最重要的问题:第一,难以从早期胚胎中获取状态良好的干细胞,这是因为胚胎发育是一个连续的过程,细胞的多能性在整个过程中逐渐衰退,这一过程非常迅速,理想的多能干细胞仅存在于一个极小的时间窗口中[13-14,20];第二,获取和研究人ESCs涉及对人类胚胎的采集和破坏,存在医学伦理问题,因此在动物上得出的试验结果难以迁移到人上进行测试[21-22]。
哺乳动物体细胞克隆最早于1996年成功,这一技术的诞生证明了高度分化的细胞可以通过重编程重获多能性[23]。受到哺乳动物克隆的启发,研究人员开始关注如何利用体细胞重编程等技术,将体细胞去分化以产生多能性细胞。2006年,Takahashi和Yamanaka[24]将OCT4、SOX2、KLF4、C-MYC(OSKM) 4种转录因子导入小鼠胚胎成纤维细胞,从中分离得到了最早的诱导多能干细胞(induced pluripotent stem cells, iPSCs)。该细胞系具有和ESCs相似的增殖能力、分化潜力等特性。随后,人[25]、大鼠[26]、猴[27]、猪[28-30]、牛[31]、羊[32-33]、马[34]等的iPSCs先后建立。诱导体系也由最初的逆转录病毒载体逐渐改进,产生了非整合型载体诱导[35]和化学重编程[36]等非转基因重编程体系,为iPSCs的获取和应用提供了更加安全、高效的途径。采用类似的思路,针对其它干细胞特点设计因子组合,也可以获得诱导滋养层干细胞、诱导胚外内胚层干细胞等不同类型的干细胞[37]。
虽然iPSCs不是直接取自早期胚胎,但由于其具有和ESCs相似的特征,可以按其与各状态ESCs的相似性定义iPSCs的多能性状态。鉴定iPSCs是否完全重新编程的几个标准已经确立,包括4个方面[38]:1)与ESCs高度相似的形态特征和自我更新能力;2)遗传和表观遗传学特征与ESCs高度相似,可通过免疫荧光染色等方法从iPSCs中检出ESCs特异性关键多能性因子和表面抗原;3)外源基因沉默,多能性的维持不依赖于转基因表达;4)分化潜力,包括“1.1”中所述多能性鉴定的六个层面。不同于多能性鉴定,完全重编程的四种判断标准是平行的,即只有同时符合这4点要求的干细胞才是“真正的iPSCs”。小鼠iPSCs已经通过上述验证,而多数大家畜iPSCs存在诱导效率低[13]、致瘤性[39]、多能性维持依赖于外源因子[40]等问题,与体内胚胎中的多能干细胞还存在较大的差距。
2 大家畜多能干细胞研究进展
大家畜既可以为人类提供食物、毛皮,也可供役使、休闲旅游、体育竞赛等活动,一些家畜还可以用于人类医学研究。大家畜干细胞在动物育种、人造肉生产、医学研究模型建立等方面有广阔的应用前景。目前,大家畜干细胞的研究进展落后于小鼠,大部分家畜干细胞仍存在一些显著缺陷,大规模生产优质家畜多能干细胞的有效方法尚未建立。
2.1 种间差异限制家畜干细胞研究与应用
所有哺乳动物胚胎发育过程大致相似,但大量研究已经证明,大家畜在生殖周期[41]、早期胚胎发育[42-43]、胚胎着床时间[44]、多能性调控机制[45]、表观遗传[42]等方面与小鼠有显著不同,这些不同是将产生小鼠多能干细胞的方法直接迁移到大家畜上难以得到优质干细胞的主要原因[17,46]。
与小鼠等经典实验动物相比,大家畜的生殖周期长,繁殖率低[41],因此,很难根据在小鼠实验中得到的结果准确推导出猪、牛、羊等动物体内胚胎的生长发育规律。与小鼠相比,家畜早期胚胎中多能干细胞的多能性维持机制更复杂,需要更多因子的支持[47]。此外,家畜外胚层发育方面与小鼠也存在明显不同[42],在这些方面,家畜与人类更加接近[43,48],因此在近几年的涉及干细胞的医学研究中,猪等家畜作为模式动物的比例明显增加。然而大家畜与人也存在很多种间差异,例如猪和人的胎盘结构、早期胚胎代谢调控、细胞膜蛋白等方面存在明显不同[17]。
以上种间差异使得直接借鉴小鼠的研究成果进行家畜多能干细胞的分离是不可行的,因此,获得高质量家畜干细胞以期用于家畜育种研究的进展缓慢。同时,种间差异也导致很多在大家畜上得到的结论在推广到人类医学领域时面临许多障碍,限制了家畜干细胞在人类医学领域的应用。
2.2 家畜干细胞多能性调控
研究干细胞多能性调控机理是建立多能干细胞系的基础,干细胞建系的尝试也可以进一步推动对多能性调控的研究。大家畜干细胞多能性维持机制较为复杂,有关的信号通路包括JAK/STAT、Activin/Nodal、FGF/ERK、Wnt/β-catenin等。通过阻断或抑制相关信号通路,可以使早期胚胎发育停滞在特定时期[49-51],这是从动物胚胎中获取多能干细胞的主要方法;强制表达某些关键因子,可以改变细胞的多能性,实现不同类型、不同状态干细胞之间的相互转换[52-53],还可以将已分化的体细胞去分化制备不同类型的诱导多能干细胞[24]。对体细胞与干细胞之间、不同类型干细胞之间相互转化的研究,可以帮助人们更好地理解细胞命运决定以及多能性转变的机理。
JAK/STAT信号通路中的核心因子是STAT3,该通路的激活使得STAT3形成同质或异质二聚体,二聚体入核后可激活TFCP2L1、KLF4、ESRRB、GBX2等对naive ESCs维持有重要作用的基因;白血病抑制因子(leukemia inhibitory factor, LIF)是JAK/STAT信号通路的重要激活因子,LIF可以与细胞表面LIFR-GP130受体结合,激活JAK,进一步使STAT3磷酸化,促使STAT3二聚体形成[54]。通过在培养体系中添加LIF,充分激活JAK/STAT信号通路是小鼠ESCs维持多能性的重要条件[6];在一些大家畜干细胞建系的研究中,撤去LIF不利于猪和羊干细胞维持多能性状态[55-56],另一些研究表明,LIF对猪干细胞多能性的获得有重要作用,但不是多能性维持的必要条件[57];Kim等[58]通过微阵列测序分析发现STAT3的活化是建立牛ESCs的关键因素。
Activin/Nodal信号通路作用广泛,调控包括早期胚胎细胞命运决定、器官发生、成体组织稳态等在内的很多过程[59]。Activin和Nodal与跨膜受体结合,激活转录调控因子SMAD蛋白,SMAD入核后诱导染色体特定位点的表观遗传修饰发生改变,从而激活或抑制相应基因的表达[60]。小鼠EpiSCs和人ESCs依赖Activin A维持多能性[61-62];在家畜中,抑制Activin/Nodal信号通路会导致猪多能干细胞克隆形态无法维持[57]。
FGF/ERK信号通路受成纤维细胞生长因子(fibroblast growth factor, FGF)调控,FGF与细胞膜上受体结合,引发MEK和ERK级联磷酸化,ERK入核激活下游靶基因[63]。FGF/ERK信号通路对不同物种干细胞的作用不同。对于小鼠,激活FGF/ERK信号通路诱导ESCs分化[64],FGF受体抑制剂PD0325901有助于维持小鼠ESCs的多能性[65-66];对于人ESCs和人EpiSCs,在培养体系中添加FGF以激活FGF/ERK通路,可以促进干细胞自我更新[12,62];对于牛,PD0325901对ESCs维持没有显著作用[67];对于猪,外源FGF可以促进ESCs原代克隆产生[68],从EpiSCs培养体系中撤去FGF会导致其无法正常增殖和传代[57];对于羊ESCs和iPSCs,撤去FGF都会导致多能性无法维持[69-70]。
Wnt/β-catenin信号通路受干细胞自分泌或旁分泌的Wnt控制,当Wnt存在时,具有分解β-catenin功能的“降解复合物”招募至细胞膜,其中GSK3活性受到抑制,无法促进β-catenin降解,细胞质中的β-catenin可以稳定转移入核,从而调控细胞分化;当缺少Wnt配体时,细胞内“降解复合物”中的GSK3和CK1促进β-catenin磷酸化,使其在细胞质中降解[51]。Wnt信号在多能性调控中具有双重作用[71],通过添加Wnt3a或GSK3α/β抑制剂CHIR99021激活信号通路,并添加LIF激活JAK/STAT,可以促进小鼠ESCs维持和自我更新[8,72],对Wnt/β-catenin信号通路进行调节可使小鼠ESCs向EPI样干细胞转化[20];在人ESCs和EpiSCs中,激活Wnt/β-catenin信号通路会导致干细胞分化[73],缺乏Wnt通路活性可以使人ESCs向滋养层干细胞转化[74];在家畜中,抑制Wnt/β-catenin信号通路可能是多能干细胞维持的一个必要因素,猪、牛、羊ESCs的维持均依赖于Wnt/β-catenin通路抑制剂IWP2、IWR1或XAV939[75-77]。
2.3 家畜多能干细胞系的建立
2.3.1 家畜ESCs建系的尝试 早期的家畜ESCs大部分参考小鼠或人ESCs建系的方法,从家畜早期胚胎中分离建系。1990年前后,研究人员进行了猪[78]、牛[79]、羊[80]ESCs体外培养的最早尝试。由于对干细胞维持机理的研究不够深入,当时的家畜ESCs多数不能长期维持,分化潜力也存在明显的缺陷,只能称为“类ESCs”。
随着对多能性调控通路的研究开展,一些具有调节信号通路活性功能的因子被用于家畜干细胞建系,家畜干细胞系的质量也得到了明显提升。2009年,Cao等[67]在牛ESCs建系的过程中使用了FGF,结果发现添加FGF有助于牛ESCs的维持。次年,Vassiliev等[19]尝试用LIF、Activin A、FGF2稳定猪ESCs,得到了1株ESCs,并得到了嵌合体,但该细胞系仍不能在体外长期稳定维持。2011年,Zhao等[70]从绵羊E6-E8胚胎ICM中分离ESCs,在添加CHIR99021和FGF的培养体系中获得了能传30代的绵羊ESCs,该绵羊ESCs表达多种多能干细胞标志物,注入免疫缺陷小鼠体内观察到畸胎瘤产生,但仅能从畸胎瘤中找到外胚层和中胚层组织。2012年,在含有GSK3β抑制剂CHIR99021和MEK抑制剂PD184352的培养体系下,1株可传100代的猪ESCs成功建系[81]。2013年,两项关于牛ESCs的研究表明,CHIR99021和PD0325901能有效促进牛ESCs表达干细胞标志物[82-83]。2018年,Bogliotti等[84]在牛ESCs建系上取得了重大进展,该研究参考了人ESCs的培养方法,使用添加FGF2和IWR-1的“CTFR”培养体系,从体外胚胎中获取了具有primed状态多能性特征的牛ESCs。该细胞系能进行中长期传代,70代后仍具有多能干细胞的正常形态、核型、转录组及表观遗传学特征,并能产生畸胎瘤,没有产生嵌合体。随后,Vilarino等[77]基于该培养体系获得了绵羊ESCs,该细胞系能稳定传代40代以上,形态、核型、多能性标志物表达稳定,能形成包含三胚层组织的畸胎瘤,未能形成嵌合体。这些研究同时也表明牛和羊ESCs的产生与维持依赖于培养基中IWR1和FGF的添加。2021年,Yu等[14]在含有FGF、Activin A、CHIR99021和PD0325901的培养体系中获得了马ESCs和非转基因马iPSCs。
这些早期研究表明,对于各种大家畜,干细胞多能性维持所依赖的信号通路相对保守,对JAK/STAT、Activin/Nodal、FGF/ERK、Wnt/β-catenin等通路的调节是大家畜ESCs成功建系的关键。
2.3.2 家畜iPSCs建系的尝试 在家畜iPSCs的早期研究中,除传统的OSKM四因子外,NANOG、LIN28、TERT等因子也常被补充到诱导体系中。综合相关文献报道,在OSKM的基础上增补因子对牛[31,85]、羊[33]iPSCs诱导效率有明显影响,但对iPSCs多能性的影响有限;外源因子的物种来源对iPSCs的诱导效率和质量有一定影响,使用同种因子诱导iPSCs通常具有较高的效率和比较理想的多能性状态[86]。
后期关于iPSCs的研究多围绕诱导体系的开发与优化[87]、改进培养条件以提高iPSCs产生效率[88]和减少iPSCs凋亡[89]等问题开展研究。2021年,Yoshimatsu等[76]通过化学小分子诱导法,在大家畜中实现了非转基因诱导、内源基因维持的重编程,诱导猪等多种哺乳动物成纤维细胞重编程,获得了iPSCs,并成功诱导其分化为三胚层组织。非转基因iPSCs具有与ESCs相似的特征,来源比ESCs更广泛,且被认为比转基因iPSCs更安全,有望成为干细胞研究、医学研究等领域新的有力工具。
2.3.3 建立稳定的猪多能干细胞系 虽然关于建立猪ESCs和猪iPSCs的报道很多,但前者不能长期稳定传代,后者缺乏naive干细胞的一些特性,如TBX3和KLF4的表达等,很多iPSCs外源因子无法沉默[90-91],二者都未达到体内多能干细胞的多能性状态,大部分只能称作“类ESCs”、“类iPSCs”。为了在大家畜中产生“真正的多能干细胞”,需要对胚胎发育早期的多能性变化规律进行深入研究。近年来,一些研究揭示了猪早期胚胎转录组的谱系特异性、干细胞多能性变化和X染色体失活的特征[2,43,92],报道了猪与人或猴早期胚胎的种间差异[17]。2021年,Yoshimatsu等[76]报道了一种不含转基因的猪多能干细胞,该细胞能在含有Wnt信号通路抑制剂IWP2的培养基中长期保持多能性,表明抑制Wnt信号通路可能是猪多能干细胞维持的关键。
在这些研究的基础上,稳定的猪原肠化前上胚层干细胞(pre-gastrulation epiblast stem cells, pgEpiSCs)成功建系[57]。该研究使用Wnt抑制剂IWR-1-endo和GSK3β抑制剂CHIR99021对Wnt信号通路进行综合调节,抑制早期胚胎向原肠胚发育,并促进干细胞稳定增殖,用SRC抑制剂WH-4-023阻断上皮-间充质自发转化,使用人源LIF(L)、Activin A(A)、FGF(F)稳定并增强干细胞的多能性,开发了包含三种抑制剂和三种细胞因子的新型“3i/LAF”培养体系。基于该培养体系,从猪E10外胚层细胞中建立了可稳定传代240代以上,核型和分化潜能仍保持稳定的多能干细胞系,并对其进行了3次连续基因编辑,产生了多基因编辑仔猪。随后,不依赖外源基因的猪iPSCs也在该体系中成功产生,该细胞系与pgEpiSCs具有相似性,能够在体外长期稳定维持多能性[93]。
稳定猪多能干细胞的成功建系是大家畜干细胞研究的重要突破,多基因编辑的成功可以降低复杂动物模型制作的成本和难度。此外,牛和羊ESCs的多能性相关通路与猪具有相似性,稳定猪多能干细胞系首先成功建立,对其它大家畜稳定多能干细胞的建系有指导和启发的作用。
3 大家畜多能干细胞的应用前景与展望
多能干细胞因具有多向分化潜力,且易于进行基因编辑,在生物学基础研究、动物育种、医学、食品生产等方面有广阔的应用前景(图1)。目前,多能干细胞的应用还处在研究和探索阶段,尚未大规模应用于实际生产。
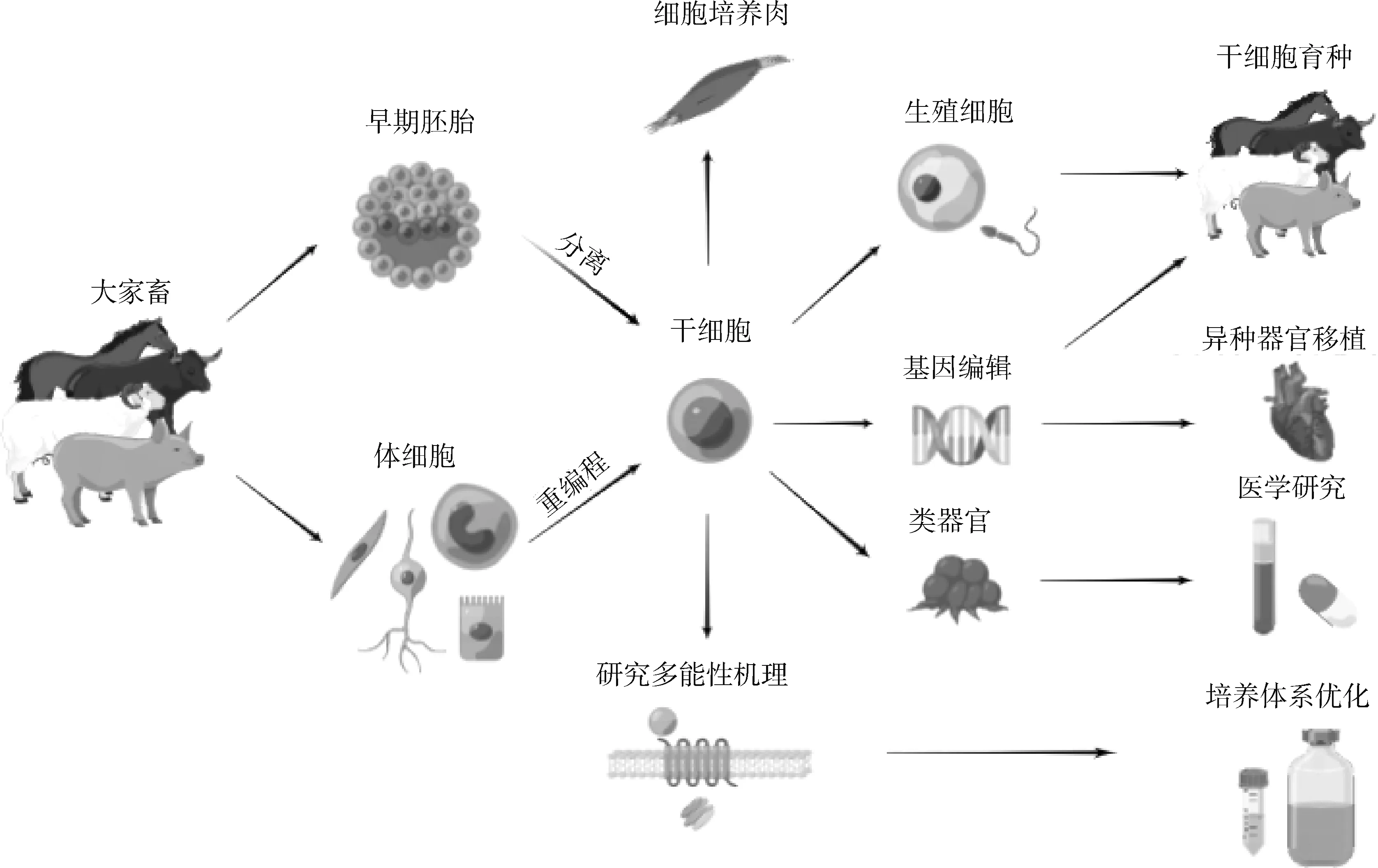
图1 家畜多能干细胞的应用前景Fig.1 Application prospects of livestock pluripotent stem cells
3.1 在家畜育种与繁殖中的应用前景
传统家畜育种方法要求将每一代家畜饲养到能稳定产生配子,这通常需要一年以上的时间。为了绕过这一耗时很长的过程,有科学家提出了干细胞育种概念。干细胞育种的核心技术是在体外获得家畜多能干细胞,将所获得的多能干细胞诱导分化为生殖细胞,再结合体外受精、单精子显微注射等技术产生受精卵。通过这种方式,可以有效缩短世代间隔、提高育种效率,加速家畜育种进程,还能增加每个个体产生的配子数目,快速获得大量遗传物质相同的个体,有利于良种扩繁[94]。
哺乳动物的精子由精原细胞经多级分裂和分化产生[95]。目前,小鼠多能干细胞向精原干细胞的体外分化诱导研究最成熟,已经可以在体外获得功能性生殖细胞,并由此产生生殖功能正常的后代[96]。在大家畜中,已有多项关于精原细胞增殖、精子发生和活性维持等的研究[97-98],但从干细胞建立的生殖细胞仍存在一些不足,培养体系有待改进和完善[94]。
哺乳动物的卵子来源于卵巢中的卵原细胞。卵子的发生依靠卵巢和卵泡组织的调控,这种复杂的调控系统难以在体外模拟[15,22]。由人和小鼠多能干细胞产生卵巢组织或卵原细胞的研究已经成功[22,99],为大家畜卵子的体外建立提供了思路。
3.2 在人类医学中的应用前景
基因编辑是制作疾病模型的一种方法,多能干细胞易于进行基因编辑,且具有强大的增殖和分化能力,因此长期以来一直是基础医学研究的热点。多能干细胞与基因编辑、转基因等技术结合,在病理学研究、再生医学等领域有广阔应用前景[45]。多年来,小鼠、人和非人灵长类动物多能干细胞在心脏疾病[100]、血液系统疾病[101]、神经系统疾病[102]等领域的研究已经取得一定进展,在药物试验方面也有应用。但由于体外试验难以建立完全符合真实动物机体环境的条件,很多干细胞治疗方法在临床上遭遇失败[45]。
与小鼠、犬等实验动物相比,猪在进化上距离人类更近[103],并且在解剖结构[104-105]、生理机能[105-106]、早期胚胎发育[48]等方面与人类更接近;与猴等非人灵长类动物相比,猪的繁殖率更高,性成熟更早[103],适合作为医学研究中的模式动物。目前,猪已开始成为基础医学领域新的实验动物,猪多能干细胞现已被应用于心血管疾病、结肠癌、骨肉瘤、糖尿病、囊性纤维化、杜氏肌营养不良症、阿尔茨海默病、亨廷顿病、免疫系统疾病等人类疾病研究中的动物模型建立[42,106-108]。牛、羊和马也开始成为研究人类疾病的模式动物。奶牛与人具有相似的生殖周期,具备成为研究人类卵巢和子宫疾病模型的可能[42]。绵羊体型较大,天性温驯,便于手术操作,可用于手术技术优化;呼吸系统与人类相似,可作为哮喘等呼吸道疾病的模型,也被用于鼻喷疫苗研发[109]。马与人在运动机能、肌腱组成及结构、肌腱损伤方式上具有相似性,将马多能干细胞在体外诱导分化为肌腱组织,可以作为研究人类骨骼与肌肉损伤的模型[110]。除制作疾病模型外,多能干细胞已经可以被诱导分化为肝[111]、胰腺[112]、神经组织[113-114]、肌肉组织[110]、内耳组织[115]、肠道[116]等器官(类器官)和组织,与动物体内试验相比,这些由干细胞诱导分化形成的组织便于观察、检测和操作;与细胞试验相比,这些组织可以更有效地模拟体内复杂的环境,为病理研究、药物开发领域提供一种新的体外模型。若能进一步将多能干细胞诱导分化为具有正常结构和功能,并且体积与真实人体器官相近的体外器官,可以填补移植用器官的需求缺口;另一种思路是对动物多能干细胞进行基因编辑,产生基因编辑动物,从动物体内获取不会引起人免疫排斥的异种器官。后者的相关研究已取得初步成果[117-118]。
3.3 作为细胞培养肉种子细胞
进入21世纪以来,随着世界各国经济和人口规模迅速增长,对肉类食品的需求也在持续上升。在市场需求的拉动下,畜牧业快速发展,不仅带来了大量的碳排放和其他污染,还增大了人畜共患病传播等公共卫生的潜在风险;过快的发展导致很多养殖场饲养密度大、饲养环境差,也伴随着动物福利方面的问题。为减少畜牧业对地球环境的污染,同时更好地提升动物福利、减少人畜共患病的传播,迫切需要开发一种绿色、低碳、安全的肉类替代品。
细胞培养肉是一项新兴生物技术,主要原理是通过从家畜体内直接提取或其他方法获得具有产生肌肉能力的干细胞,通过细胞工程手段,在发酵罐等工业设备中使其生长,从培养基上而不是畜禽体内获得肉类。与传统畜牧业相比,细胞培养肉预计可以节约7%~45%的能源、82%~96%的用水、近99%的用地,污染物排放预计减少78%~96%,且由于培养过程在洁净工厂、密闭设备中进行,基本可以杜绝人畜共患病传播的风险[119]。
作为一项新兴技术,细胞培养肉仍面临很多重大技术瓶颈,如用于培养的干细胞大规模生产、培养基成分设计、工业生产用大型生物反应器设计、3 D组织支架生产、肌肉与脂肪等不同组织之间组装等[119-120],这些技术难题都是细胞培养肉发展需要攻克的重要障碍。
目前,能稳定传代的猪和牛多能干细胞系已经建立,为细胞培养肉提供了可能的细胞来源[57,90]。由猪iPSCs诱导产生骨骼肌的研究已经成功[121],包含肌肉纤维、脂肪组织和毛细血管的细胞培养牛肉也已经在实验室成功获得[122]。虽然细胞培养肉技术距离向市场大规模推广还有很长的距离,但已经可以预见,细胞培养肉具有在未来成为低碳、节能、安全、营养的新型食品的潜力。
4 总 结
目前,猪的稳定ESCs已经成功建系,牛、羊、马等常见家畜ESCs的建系也取得了一定进展,但后者在稳定性方面仍存在不足,无法产生嵌合体或ESCs对嵌合体贡献极低,未见产生四倍体补偿胚胎的报道。不同物种的多能性调控机制存在差异,想要更好地建立各种家畜的稳定ESCs系,需要对这些家畜早期胚胎中多能性调节过程进行深入研究。此前的一些研究已经发现猪、牛、羊等家畜在多能性调节通路方面存在相似性,参考稳定猪ESCs的建系方法,并结合其它大家畜的早期胚胎发育特点,可能有助于其它家畜ESCs的建立。
在iPSCs方面,各种大家畜的iPSCs均已建立,并具备比较稳定的多能性,但很多家畜iPSCs的维持依赖外源基因表达,外源基因不能沉默是家畜iPSCs研究中亟待解决的问题。在家畜iPSCs产生嵌合体的尝试中,iPSCs对嵌合后代的贡献较低,反映这些iPSCs的多能性仍有不足。此外,对于iPSCs的应用,安全性问题仍是主要疑虑之一。化学诱导的非转基因iPSCs已经在小鼠上取得成功,有望成为一种更安全的多能干细胞来源,而大家畜仍需要继续探索不依赖转基因的诱导方法。
家畜多能干细胞在生命科学基础研究、动物育种、再生医学、食品生产等多领域有巨大的应用潜力,但很多领域还无法将研究结果应用到实际生产,对家畜多能干细胞开展深入的研究有重要意义。随着对于家畜干细胞多能性调控机理的深入解析,相信在不久的将来,多能干细胞可以在各领域大放异彩。
