A1 类清道夫受体通过促进M2 型巨噬细胞极化增加脂肪组织产热能力
2023-10-29张天天李金杰柏雪雅朱旭冬
张天天,李金杰,柏雪雅,柏 惠,陈 琪,朱旭冬
江苏省心血管病靶向干预研究重点实验室,南京医科大学基础医学院病理生理学系,江苏 南京 211166
心血管疾病发病率和死亡率在世界范围内仍在逐年上升。肥胖、高血压和糖尿病等多种危险因素都与心血管疾病发生相关[1]。其中,肥胖可归因于能量摄入与消耗失衡,表现为过多脂质在脂肪组织的异常积聚,并伴随有大量免疫细胞浸润。肥胖可导致2型糖尿病、高血压、脑卒中和多种类型癌症(胃癌、肝癌、胆囊癌、卵巢癌等)的发生[2]。与主要负责能量存储的白色脂肪细胞不同,棕色脂肪细胞由于富含有大量的线粒体,具备较强的产热能力[3]。近年的研究表明,白色脂肪细胞在特殊条件刺激下可以转化为具有产热能力的米色脂肪细胞[4]。米色脂肪细胞可能成为治疗糖尿病、慢性炎症和肥胖等代谢紊乱疾病的新型靶细胞[5]。
A1 类清道夫受体(macrophage scavenger receptor 1,MSR1)是一类巨噬细胞表面的模式识别受体,可以介导巨噬细胞多种功能,包括脂质摄取、细胞凋亡、细胞趋化和极化分型等[6]。MSR1在动脉粥样硬化、心肌梗死和肥胖诱导的高血压等心血管疾病发生发展中发挥重要保护作用。已有研究表明,慢性低温刺激诱导下,皮下白色脂肪组织(subcutaneous white adipose tissue,scWAT)中的M2 型巨噬细胞大量积聚,并促进脂肪细胞的活化和产热[7-8]。本课题组前期研究发现,MSR1 可以促进肥胖小鼠附睾脂肪组织中巨噬细胞的M2 型分化,发挥拮抗炎症的作用,提示MSR1 也可能调控脂肪细胞的产热能力。因此,本研究拟探讨MSR1 在低温刺激诱导脂肪产热进程中的作用及其机制,寻找新的肥胖相关性疾病干预靶点。
1 材料和方法
1.1 材料
C57BL/6 背景的MSR1 基因敲除小鼠(MSR1-/-)购自美国Jackson 动物研究中心。C57BL/6 小鼠购自江苏省医药动物实验中心。
UCP1抗体(Abcam公司,英国);牛血清白蛋白、HEPES 酸(Biosharp 公司,美国);BCA Protein Assay Reagent Kit(Pierce 公司,美国);Electrochemi Luminescence(ECL)(Amersham Biosciences 公司,美国);免疫组化ABC染色试剂盒(Santa Cruz Biotechnology公司,美国);RNA 提取试剂(TaKaRa 公司,日本);实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)试剂盒(Roche公司,美国);各种qRT-PCR引物序列由美国Invitrogen公司合成。
1.2 方法
1.2.1 实验动物模型及分组
选取8 周龄正常饮食(common diet,CD)的雄性MSR1+/+小鼠作为野生型对照组,MSR1-/-小鼠作为敲除型实验组,分别将两种小鼠置于室温(25 益)或低温条件(6 益)下持续刺激1 d或者14 d,或给予两种小鼠连续12 周的高脂饮食(high fat diet,HFD)后置于室温或低温条件下持续刺激7 d(HFD 喂养的肥胖小鼠因代谢紊乱,冷刺激14 d 后整体状态不佳,故采用冷刺激7 d 方案)。正常饮食实验模型分为4 组:MSR1+/+25 益组、MSR1-/-25 益组、MSR1+/+6 益组、MSR1-/-6 益组;高脂饮食实验模型分为4 组:MSR1+/+HFD 25 益组、MSR1-/-HFD 25 益组、MSR1+/+HFD 6 益组、MSR1-/-HFD 6 益组。所有实验操作均获得南京医科大学动物伦理委员会批准(IACUC-2009003)。
1.2.2 MSR1-/-小鼠基因型鉴定
提取MSR1-/-小鼠鼠尾DNA,设定PCR 反应体系扩增产物,配制3%琼脂糖凝胶,待胶凝固后上样,插上电极,DNA 由负极向正极电泳,电压为200 V。当条带电泳至胶2/3 处时,观察DNA 成像,其中MSR1+/+为154 bp;MSR1-/-为202 bp。
1.2.3 小鼠巨噬细胞清除实验
给予野生型小鼠尾静脉注射氯膦酸盐脂质体(clodronate liposomes)或对照脂质体(PBS liposomes)(200 μL/只),用以清除巨噬细胞。
1.2.4 造模小鼠体重监测与代谢笼检测
每周检测对照组与实验组小鼠体重并做好记录。CD 和HFD 小鼠造模结束后,送至南京医科大学实验动物中心进行代谢笼检测,包括小鼠耗氧量、产热量。
1.2.5 小鼠造模标本收取与处理
造模结束后麻醉小鼠,进行眼球后静脉丛取血,并收取小鼠scWAT 和棕色脂肪组织(brown adipose tissue,BAT),经液氮速冻,置于-80 益保存,部分标本置于4%多聚甲醛溶液中进行固定。
1.2.6 冰冻组织免疫荧光染色
选取小鼠脂肪组织冰冻切片,室温放置30 min后,PBS 清洗,10%牛血清封闭,加入巨噬细胞标志物F4/80抗体(Abcam公司,英国)4 益孵育过夜。清洗,二抗室温避光孵育1~2 h,PBS 清洗,封片,滴加1~2 滴DAPI 覆盖组织切片,盖上盖玻片,荧光显微镜下观察。
1.2.7 免疫组织化学染色
选取小鼠脂肪组织进行石蜡切片,将切片脱蜡至水,依次用3%H2O2消除内源性过氧化物酶活性,10%牛血清封闭,加入UCP1 抗体(Abcam 公司,英国)4 益孵育过夜。清洗,生物素标记工作液室温避光孵育20 min,PBS清洗,碱性磷酸酶标记的工作液室温孵育20 min,PBS冲洗,显色剂显色15 min,充分清洗,复染,脱水,透明,封片,荧光显微镜下观察。
1.2.8 qRT-PCR实验
TRIzol 法提取小鼠脂肪组织总RNA,测定RNA浓度,随后逆转录为cDNA。通过qRT-PCR 扩增目的基因,指标18S作为内参,校正每个样本目的基因的Ct 值,以2-ΔΔCt值表示基因的相对表达水平,引物序列见表1。

表1 qRT-PCR引物序列Table 1 Primer sequences used in qRT-PCR
1.2.9 Western blot实验
提取小鼠脂肪组织总蛋白,通过BCA法测定蛋白浓度,每个样品孔按40 μg蛋白总量上样,随后进行电泳、转膜、封闭、一抗4益孵育过夜、二抗室温孵育2 h,最后进行显色成像。
1.2.10 流式细胞术检测小鼠脂肪组织中血管基质成分
收取小鼠scWAT置于1%FBS中,滤纸吸干,充分剪碎组织,移至离心管中。使用Ⅱ型胶原酶消化60 min。200 目筛网过滤至EP 管,离心。加入1 mL红细胞裂解液,离心,PBS洗3遍。加入200 μL PBS重悬,加入相应抗体,室温避光孵育60 min,离心,PBS洗3遍。加入250 μL PBS重悬并上机检测。
1.2.11 小鼠原代白色前脂肪细胞分离并诱导分化
小鼠处死后75%乙醇浸泡,收取小鼠scWAT置于预冷的PBS中。消化、过滤、种板。细胞生长完全融合后进行诱导分化。
1.2.12 小鼠原代腹腔巨噬细胞分离与培养
小鼠处死后75%乙醇浸泡,用注射器将含有100 μg/mL 肝素的PBS 注入小鼠腹腔中进行冲洗,将冲洗液吸取入针管内,注入离心管中。离心后弃上清,加入培养液重悬,放置在37 益培养箱中培养。
1.3 统计学方法
使用GraphPad Prism 8 软件进行数据分析。数据均用均数±标准误()表示。在统计分析前对数据的分布进行假设检验后,对满足正态性和方差齐性的数据采用两样本独立t检验或单因素方差分析,对不满足正态性或方差齐性的数据采用Kruskal-WallisH检验。P<0.05为差异有统计学意义。
2 结果
2.1 清除巨噬细胞可以抑制低温刺激诱导的scWAT产热能力且低温刺激促进小鼠scWAT中MSR1的表达
为了研究巨噬细胞在低温刺激诱导的脂肪组织产热中的作用,给予8 周龄雄性野生型小鼠氯膦酸盐脂质体处理,清除巨噬细胞。免疫荧光结果显示F4/80+巨噬细胞清除成功(图1A)。随后置于室温或寒冷条件下处理14 d,期间正常饮食喂养。造模结束后,提取小鼠scWAT总RNA。qRT-PCR结果显示,野生型小鼠清除巨噬细胞后scWAT产热能力标志物(UCP1、Cidea、Cox8b)基因的表达明显低于对照小鼠(图1B~D)。为了进一步探究低温刺激对小鼠脂肪组织MSR1 表达的影响。将8 周龄雄性野生型小鼠置于室温或寒冷条件下处理14 d,期间正常饮食喂养。造模结束后,提取小鼠scWAT 总RNA。qRT-PCR结果显示,小鼠给予寒冷刺激后scWAT中MSR1表达量明显高于对照小鼠(图1E)。
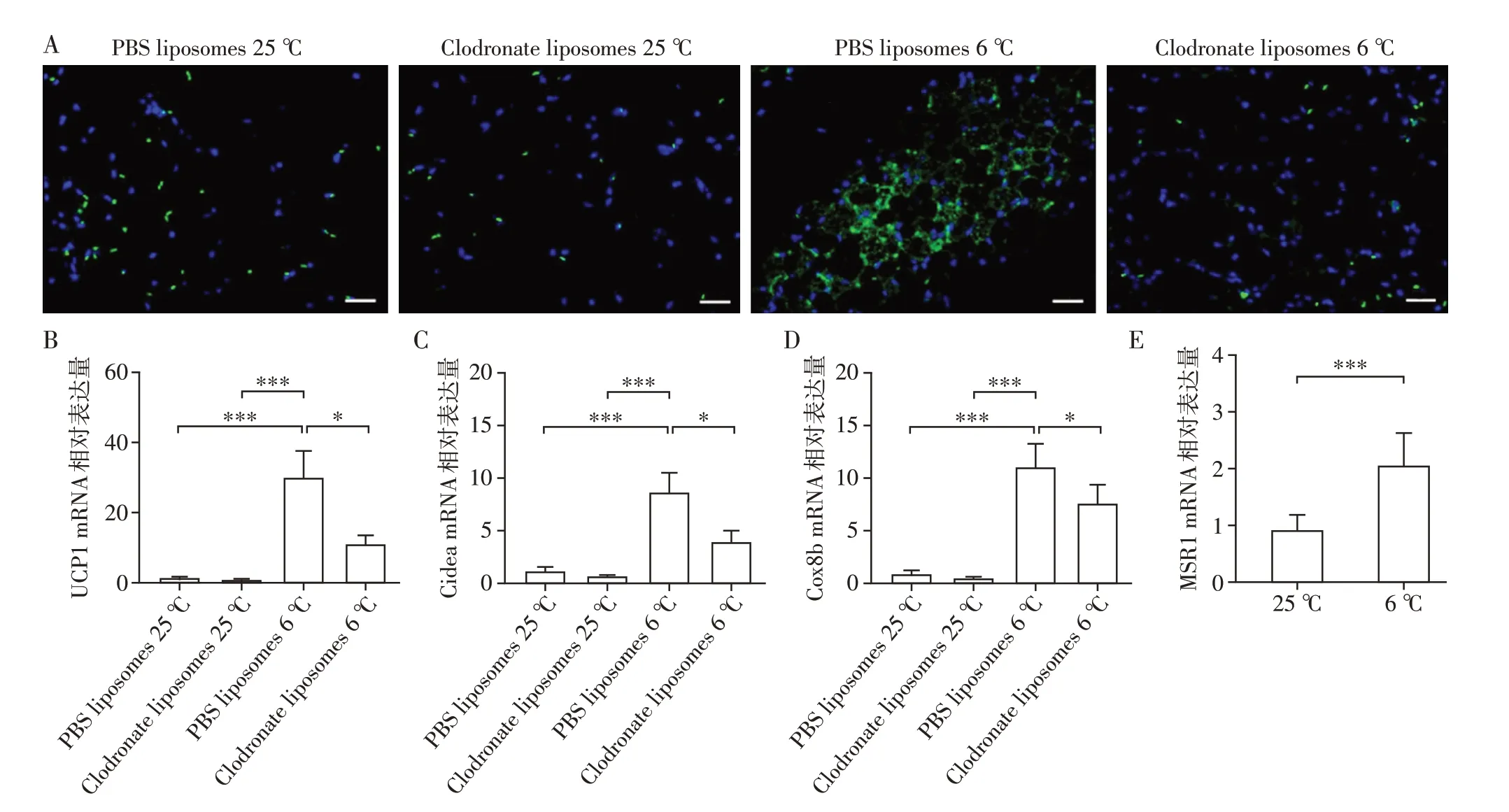
图1 清除野生型小鼠巨噬细胞并低温刺激14 d后小鼠scWAT的产热能力以及低温刺激14 d后小鼠scWAT中MSR1的表达Figure 1 The thermogenic capacity of scWAT of WT mice after macrophages clearance and 14 days of cold exposure,and MSR1 expression in adipose tissue of mice after 14 days of cold exposure
2.2 MSR1不影响急性低温刺激情况下小鼠脂肪组织的产热能力
为了探究MSR1 在小鼠脂肪产热过程中的作用,使用MSR1-/-小鼠进行研究。首先对MSR1-/-小鼠进行基因型鉴定(图2A),并通过Western blot 检测了小鼠脂肪组织中MSR1的表达情况(图2B)。将8 周龄雄性MSR1+/+和MSR1-/-小鼠置于室温或寒冷条件下处理1 d(短期急性冷刺激),期间正常饮食喂养。造模结束后,提取4组小鼠scWAT和BAT总RNA。qRT-PCR 结果显示,置于6 益条件下小鼠scWAT 和BAT中产热指标(UCP1、Cidea和Cox8b)表达量均高于室温条件下小鼠(部分指标未达到统计学差异);MSR1表达缺失小鼠与野生型对照小鼠相比差异无统计学意义(图2C~H),说明在短期(1 d)寒冷刺激条件下MSR1不影响脂肪组织产热能力。

图2 低温刺激MSR1+/+和MSR1-/-小鼠1 d后小鼠脂肪组织的产热能力Figure 2 The thermogenic capacity of adipose tissue of MSR1+/+and MSR1-/-mice after 1 day of cold exposure
2.3 低温刺激14 d 后MSR1-/-小鼠脂肪组织的产热能力显著降低
将8 周龄雄性MSR1+/+和MSR1-/-小鼠置于室温或寒冷条件下处理14 d(长期慢性冷刺激),期间正常饮食喂养。14 d后,提取小鼠scWAT和BAT总RNA以及小鼠scWAT总蛋白。qRT-PCR结果显示,置于低温条件下,小鼠脂肪组织中UCP1、Cidea 和Cox8b表达量明显高于室温条件下小鼠;MSR1-/-小鼠给予6 益处理,scWAT 和BAT 中UCP1、Cidea 和Cox8b 表达量明显低于MSR+/+6 益小鼠(图3A~F)。Western blot 结果同样显示,置于低温环境下MSR1+/+和MSR1-/-小鼠脂肪组织中UCP1 表达水平显著高于室温条件下小鼠;与MSR+/+6 益小鼠相比,MSR1-/-6 益小鼠scWAT中UCP1表达水平明显降低(图3G、H),说明MSR1 可以促进慢性冷刺激诱导的脂肪组织产热。
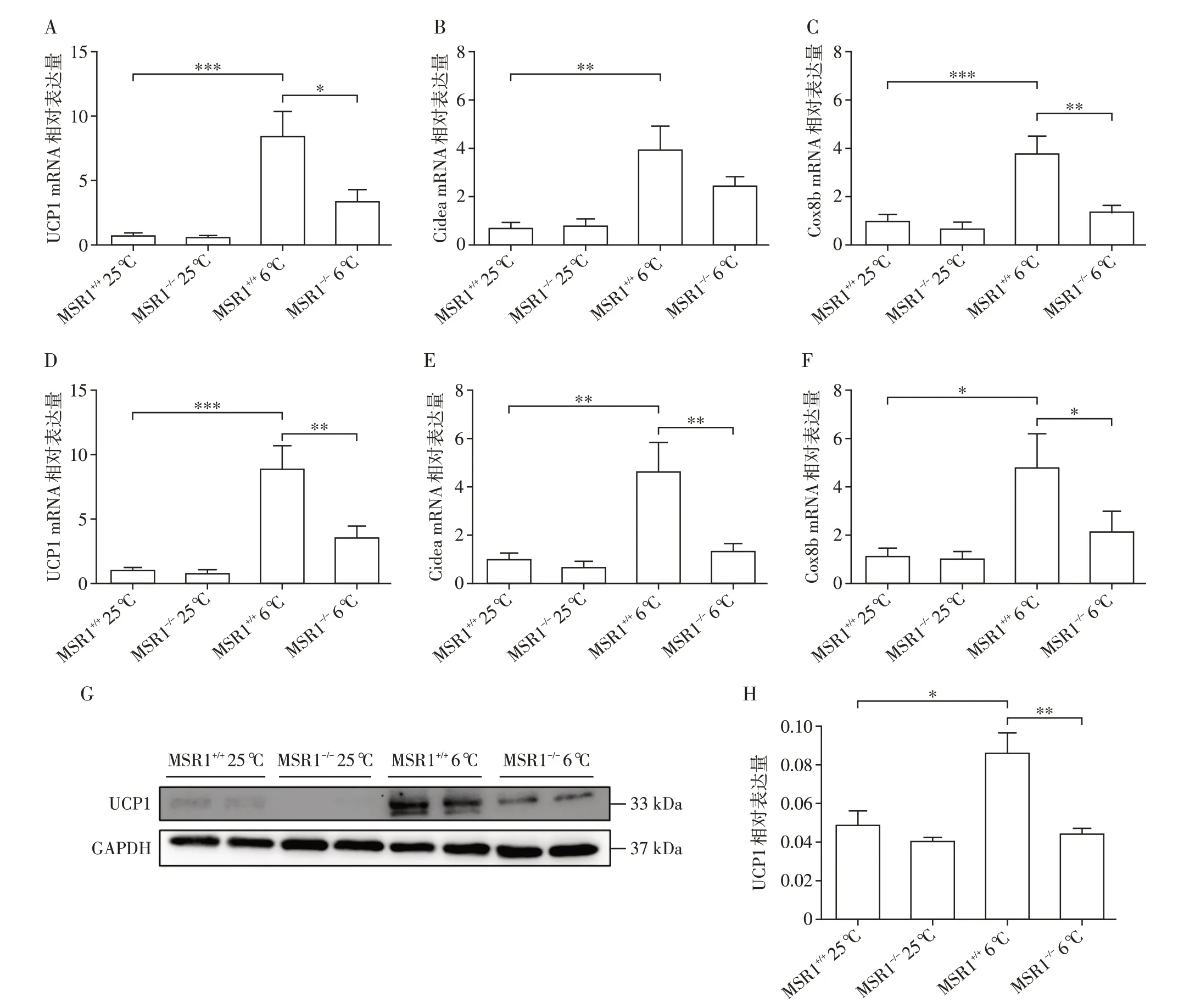
图3 低温刺激MSR1+/+和MSR1-/-小鼠14 d后小鼠脂肪组织的产热能力Figure 3 The thermogenic capacity of adipose tissue of MSR1+/+and MSR1-/-mice after 14 days of cold exposure
2.4 低温刺激情况下,与对照组相比MSR1-/-小鼠scWAT中M2型巨噬细胞数量降低
为了探究低温刺激下MSR1对小鼠脂肪组织巨噬细胞极化的影响,进一步检测了给予小鼠低温刺激14 d 后,小鼠脂肪组织中M2 型巨噬细胞的数量情况。14 d低温刺激后,提取小鼠scWAT总RNA和基质血管成分(stromal vascular fraction,SVF),qRTPCR 结果显示,MSR1-/-6 益小鼠scWAT 中Mrc2 和Mgl1 的表达量均明显低于MSR+/+6 益小鼠(图4A、B)。对scWAT中的SVF进行流式细胞术检测,结果同样显示,与MSR+/+6 益小鼠相比,MSR1-/-6 益小鼠F4/80+CD11b+CD206+M2 型巨噬细胞比例明显降低,F4/80+CD11b+CD11c+M1 型巨噬细胞比例增高(图4C、D)。以上结果表明,低温刺激下,MSR1 促进小鼠脂肪组织产热是通过诱导脂肪组织M2型巨噬细胞的极化实现的。

图4 低温刺激14 d MSR1+/+和MSR1-/-小鼠scWAT中M2型巨噬细胞数量Figure 4 The numbers of M2 macrophage in scWAT of MSR1+/+and MSR1-/-mice after 14 days of cold exposure
2.5 MSR1-/-肥胖小鼠脂肪组织产热能力显著降低
为了进一步探究MSR1对肥胖小鼠脂肪组织产热的影响。给予6 周龄雄性MSR1+/+和MSR1-/-小鼠CD 或HFD 连续喂养12 周,每周监测小鼠体重变化。12周后,使用代谢笼法监测小鼠耗氧量和产热量变化。将高脂造模MSR1+/+和MSR1-/-小鼠分别置于常温或低温环境刺激7 d 后,提取小鼠scWAT 和BAT 总RNA。结果显示,HFD 12 周后,与野生型对照组相比,MSR1-/-小鼠体重增加更为显著(图5A),耗氧量和产热量降低(图5B、C)。qRT-PCR 结果显示,低温刺激情况下,HFD 喂养的MSR1-/-小鼠脂肪组织中产热标记物(UCP1、Cidea和Cox8b)含量明显低于MSR+/+HFD 6 益小鼠(图5D~I)。免疫组化结果显示,置于6 益条件下小鼠scWAT 中UCP1 表达量明显高于室温条件下小鼠;而MSR1-/-HFD 6 益小鼠scWAT 中UCP1 表达量明显低于MSR1+/+HFD 6 益小鼠(图5J)。结果表明,MSR1能促进肥胖小鼠脂肪组织的产热能力。
2.6 MSR1表达缺失显著抑制巨噬细胞条件培养基诱导小鼠前脂肪细胞分化的脂肪细胞产热能力
为了进一步确认MSR1表达缺失巨噬细胞可以降低脂肪细胞产热能力,使用了巨噬细胞条件培养基(PEM)进行了离体细胞实验。应用PEM 分别培养3~4 周龄雄性MSR1+/+或MSR1-/-小鼠scWAT 中的前脂肪细胞,诱导分化为成熟脂肪细胞,并提取脂肪细胞总RNA。qRT-PCR 结果显示,PEM 诱导的MSR+/+成熟脂肪细胞中UCP1 和Cox8b 表达量明显高于DMEM对照组;PEM诱导的MSR1-/-成熟脂肪细胞中UCP1 和Cox8b 表达量明显低于PEM 诱导的MSR1+/+成熟脂肪细胞,说明巨噬细胞MSR1 可以促进脂肪细胞产热能力(图6A、B)。
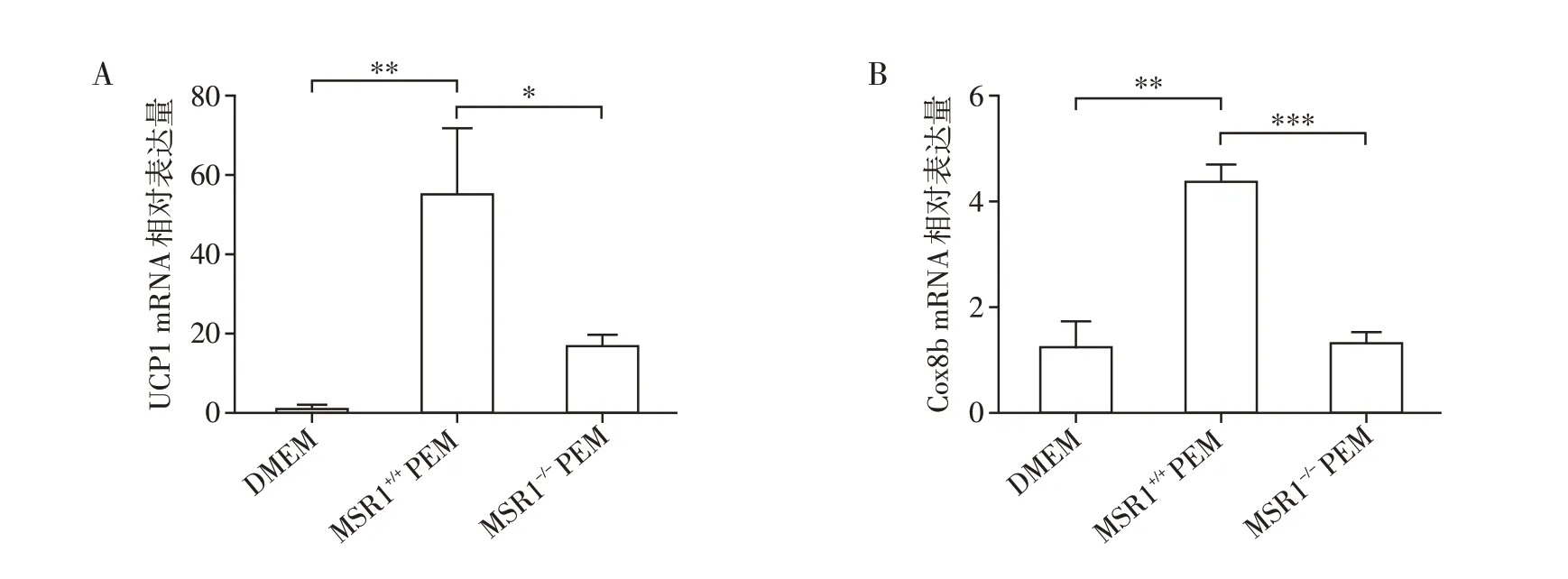
图6 MSR1表达缺失巨噬细胞条件培养基诱导小鼠前脂肪细胞分化,检测脂肪细胞的产热能力Figure 6 MSR1 expression deficient macrophage conditioned medium induced differentiation of mouse preadipocytes and measured the thermogenic capacity of adipocytes
3 讨论
巨噬细胞是免疫系统的重要组成部分,具有许多重要功能。它可以通过吞噬作用清除病原体,还可以通过抗原摄取和处理来调节各种病原体的适应性免疫反应[9-11]。已有研究指出,巨噬细胞的这些功能与其极化状态密切相关[12]。巨噬细胞M1极化的特征是产生促炎细胞因子(IFN-γ、TNF-α和IL-1β等)参与调节机体炎症反应,而巨噬细胞的M2极化则与免疫抑制、肿瘤发生、伤口修复和清除寄生虫有关。M1/M2 巨噬细胞平衡极化决定了器官在炎症或损伤中的命运[13-14]。因此,巨噬细胞极化分型的动态平衡对治疗相关疾病具有重要意义。
巨噬细胞在脂肪组织产热过程中起到关键作用。已有研究表明,钠-葡萄糖共转运体(SGLT2)抑制剂通过提高脂肪利用率和促进脂肪棕色化来抑制体重增加,并通过在scWAT 和肝脏中极化M2 型巨噬细胞来减弱肥胖引起的炎症和胰岛素抵抗[15]。因此,调节巨噬细胞的M1/M2极化分型是代谢相关疾病治疗的重要靶点。
在单核细胞分化为巨噬细胞进程中,大量清道夫受体得以表达。其中,MSR1 是一种主要在巨噬细胞中表达的模式识别受体,参与调控巨噬细胞的多种生物学功能,如参与巨噬细胞趋化募集和与其他先天受体的相互作用,以及抗原摄取、处理和呈现,调节T 细胞和B 细胞激活[16]。本课题组前期研究表明,MSR1 缺失加剧了HFD 诱导的肥胖小鼠机体的胰岛素抵抗,伴随有小鼠附睾脂肪组织中F4/80+CD11b+CD11c+的M1 型巨噬细胞比例明显增加,F4/80+CD11b+CD206+的M2型巨噬细胞比例明显降低,机体炎症反应加重。于是,本研究推测MSR1 可能参与脂肪组织产热功能,并且这一作用与调控巨噬细胞极化状态相关。
本研究应用MSR1 全身性敲除小鼠,通过给予小鼠急性和慢性的低温刺激,观察脂肪组织产热情况。结果显示在慢性低温刺激下MSR1-/-小鼠脂肪组织产热能力明显低于MSR1+/+小鼠,而在急性低温刺激下,两组无明显差异。进一步在肥胖小鼠模型中观察到类似结果。同时,本研究检测小鼠脂肪组织中不同类型巨噬细胞的极化情况。结果显示,MSR1对脂肪组织产热能力的作用可能与其促进小鼠白色脂肪组织M2型巨噬细胞的极化有关。
综上所述,MSR1 在低温刺激下可能通过调控巨噬细胞的M2型极化进而增强脂肪组织产热。
