不同预处理对热风干燥山药片品质特性及微观结构的影响
2023-10-19谭宏渊凌玉钊黄丽琪熊光权魏凌云
谭宏渊,凌玉钊,黄丽琪,熊光权,乔 宇,,魏凌云
(1.武汉工程大学环境生态与生物工程学院,湖北武汉 430205;2.湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064)
山药属薯蓣科山药属,为一年生或多年生缠绕性藤本植物[1],富含淀粉、蛋白质、维生素等多种营养成分,且大量研究已经证实山药具有免疫调节、抗肿瘤、抗氧化、抗衰老、降血糖、降血脂以及调脾胃等多种功效[2]。因此,山药既可食用又可入药,是保健食品中的重要原材料之一[3]。但新鲜山药含水量较高,若储存不当,易出现褐变、腐烂、发芽等情况。将山药制成干燥切片或干粉后储存或运输是最有效的方法之一,且有利于实现山药的综合开发及利用、提高其附加值,具有重要意义。
热风干燥具有操作简单、成本低、产量大等优点,是农产品生产加工中的常用的方法[4],但此方法干燥时间较长,易造成物料表面硬化、营养成分流失、色泽褐变。干燥前进行预处理可有效改善这些问题,提高干制品品质[5-6]。干燥预处理技术是指通过物理、化学、生物等技术手段对物料进行处理,从而使物料干燥速率加快、提高产品的外观和营养价值[7]。目前常用的干燥预处理方法有:冻融、超高压、超声、高压脉冲电场、化学试剂处理、热烫等[8]。Yucel 等[9]使用100 MPa 以下压力对胡萝卜、苹果和青豆进行预处理再进行热风干燥,发现物料的干燥时间从145 min 缩短至126 min,而且细胞通透性增强,传质传热过程加快。吴亚丽等[10]在研究高压脉冲电场对土豆真空冷冻干燥的影响时发现,经高压脉冲电场处理后能够缩短干燥时间,减少由于干燥时间过长引起的色泽变化和营养成分的流失破坏。Ramírez等[11]比较了冻融、烫漂两种方式预处理对干燥苹果片的影响,发现冻融处理后的苹果片干燥速率最快。郭婷等[12]在研究冻融对甘薯变温压差膨化干燥品质影响时发现,冻融预处理可以改变果蔬原料细胞结构从而改善变温压差膨化干燥果蔬的品质。
虽然干燥方式对山药品质影响的研究不少,但比较不同干燥预处理下对山药品质及微观结构的影响鲜有报道。因此,本实验选取了超高压、冷冻、高压静电场三种方式对新鲜山药进行预处理,然后热风干燥。通过微观结构观察揭示山药片水分迁移和品质的变化规律,并对其理化性质进行研究和评价,以期筛选出适合山药进行热风干燥的方式预处理,为山药的高值开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
新鲜铁棍山药 挑选长度为45~50 cm,直径为2~2.5 cm 的山药,且无病虫害,无机械损伤,购自于武汉市武商量贩(农科城店);无水乙醇、氢氧化钠、壳聚糖、氯化钠、氯化钙、抗坏血酸、柠檬酸、浓盐酸、乙醚、蔗糖、蒽酮、乙酸乙酯、浓硫酸、半乳糖醛酸、咔唑试剂、氯化钾、硫酸钠、乙酸铅、硫酸铜、酒石酸钾钠、亚甲基蓝 均为分析纯,国药集团化学试剂有限公司。
UV-3802 分光光度计 上海尤尼科仪器有限公司;HE53/Z02 水分含量测定仪 梅特勒-托利多仪器(上海)有限公司;LabMASTER-aw 型水分活度仪瑞士Novasina 公司;DHG9123A 电热恒温鼓风箱上海精宏试验设备有限公司;NMI20-025V-I 核磁共振成像分析仪 苏州纽曼分析仪器股份有限公司;DC(SC-PME)电场发生器 台湾COSMI 公司;PEN3便携式电子鼻 德国Airsense 公司;MS7890A 气相色谱-质谱联用仪 美国Agilent 公司;Ta.XT2i/50质构仪 英国StableMicroSystem 公司;CR-400 型色差仪 KonicaMinolta(柯尼卡美能达);HPPL2-600MPa/2L 超高压实验机 天津华泰森淼生物工程技术股份有限公司;SU8010 场发射扫描电子显微镜 日本东京日立。
1.2 实验方法
1.2.1 山药处理工艺和操作要点 工艺流程:原料筛选→清洗→去皮→切片→护色剂处理→沥干→预处理→热风干燥→成品。
根据前期实验,确定了预处理方法的具体工艺条件以及各步骤操作要点。
预处理方法:a.对照组:护色剂处理后不进行处理;b.高压静电场处理组:护色剂处理后置于电极距离9 cm、40 kV 高压静电场下处理20 min;c.超高压处理组:护色剂处理后置于150 MPa 超高压处理,保压5 min;d.冷冻处理组:护色剂处理后置于-17 ℃冰柜,冷冻保存72 h 后直接干燥(不解冻)。
操作要点:a.选择新鲜山药,防止山药褐变对实验结果产生影响;b.山药切片厚度为4 mm,且保持切口角度一致[13];c.护色剂为1.5 g 壳聚糖、0.6 g 抗坏血酸、0.4 g 柠檬酸、0.5 g 氯化钠、0.6 g 氯化钙每升,现配现用,浸泡1 h;d.应保证测量同一指标的山药为同一批次。
1.2.2 水分分布及迁移分析 自旋-自旋弛豫特性分析(低场核磁):将样品置于永久磁场中心位置的射频线圈中心检测,利用CPMG 脉冲序列测定样品的自旋-自旋弛豫时间(T2)。CPMG 试验参数:P909(μs)=17,P180(μs)=3400,TD=1120160,SW(kHz)=100,RG1=3,NS=32,TW(ms)=1000,cTE(ms)=0.300,NECH=2000,使用CPMG 序列采集样品T2信号,每个样品重复3 个平行。利用自旋回波(SE)成像序列获得山药样品的T1和T2加权图像。对所有图像,视场(FOV)为(200×300)mm,切片宽度为5.0 mm。读取大小为256,相位大小为192。T1加权图像的回波时间(TE)和重复时间(TR)分别为20 ms 和700 ms,T2加权图像的回波时间分别为50 ms 和3000 ms[14]。
1.2.3 干燥曲线绘制 参考徐馨等[15]的方法绘制干燥曲线。将4 组样品置于托盘上放入烘箱中干燥,热风温度 60 ℃。样品下底面与纱布接触,其余表面均接触热风,每隔30 min 取样称量。干燥至每个样品的水分含量为2%左右时即可认为干燥完毕。干基含水量(M,g/g),水分比(MR),干燥速率(DR,g/g·h)计算公式[16]如下:
式中:m0为初始干物料的质量(g);mt为干燥t 时刻的质量(g);M0为初始干基含水量(g/g);Me为干燥到平衡时的干基含水量(g/g);Mt为干燥t 时刻的干基含水量(g/g);Δt 为相邻两次测定的时间间隔(min);Mt+Δt为干燥至t+Δt 时刻山药片的干基含水量(g/g)。
1.2.4 扫描电子显微镜观察 新鲜样品组织结构观察:新鲜组织经4%多聚甲醛固定24 h 以上,乙醇梯度脱水,石蜡包埋后于-20 ℃冷冻,切片,片厚4 μm。切片入摊片机,将组织展平后贴于载玻片捞起,置于60 ℃烘箱中充分烤干,二甲苯脱蜡,梯度乙醇水化。番红染色:切片入番红染液中染色1~2 h,蒸馏水漂洗,乙醇梯度脱色。固绿染色:切片入固绿染液中染色30~60 s,无水乙醇三缸脱水。透明封片:切片入干净的二甲苯透明5 min,中性树胶封片。最后进行显微镜镜检以及图像采集分析[17]。
干燥样品组织结构观察:取大小相近的干燥样品,切段,纵剖,以FAA 固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,纵向显微径向切片,脱蜡,粘贴于扫描电镜样品台上,真空溅射法喷金,用日立SU8010场发射扫描电子显微镜对样品进行观察[18],其中设置扫描电镜的放大倍数为300×,并调整焦距得到清晰的SEM 图片。
1.2.5 硬度的测定 取大小相近的干燥样品[19],利用物性分析仪测定山药样品的硬度值。使用P/2 圆柱探针,设置测试前速率2.0 mm/s、测试速率1.0 mm/s、返回速率10.0 mm/s、压缩距离3.0 mm。每组平行测定8 次,结果取平均值。
1.2.6 细胞壁组成测定 纤维素含量的测定:参照徐欣然等[19]的方法进行测定,并稍做修改。称取2.00 g样品与30 mL 60%硫酸混合,煮沸30 min,过滤,利用60%硫酸定容滤液于50 mL,之后在冷水浴上加蒸馏水稀释至100 mL。采用蒽酮比色法(630 nm)对滤液中的纤维素含量进行测量。纤维素标准液测定量在20~200 g/mL 浓度范围有良好的线性关系,线性回归方程为y=0.0077x-0.0042,相关系数为0.9997。
果胶含量的测定:参照马丽等[20]的方法进行测定,并稍做修改。称取1.00 g 样品,在液氮的保护下研成匀浆,加入25 mL 95%乙醇溶液,沸水加热15 min,冷却至室温,8000 r/min 离心15 min,除去上清液,往沉淀中再加入95%乙醇溶液,沸水浴加热,重复3 次。沉淀与20 mL 混合于50 ℃保温30 min,溶解果胶。冷却至室温于8000 r/min 离心15 min,用蒸馏水定容上清液至100 mL,该液为水溶性果胶;在沉淀中加入25 mL 0.5 mol/L 的硫酸溶液,沸水加热1 h,取出冷却至室温,于8000 r/min 离心15 min,上清液用蒸馏水定容至100 mL,该液为原果胶。测定时吸取1 mL 提取液,加入6 mL 浓硫酸,沸水加热20 min,冷却室温后,加入0.2 mL 1.5 g/L 咔唑-乙醇溶液,暗处放置30 min 后,测定反应液在530 nm处的吸光度,重复3 次。以D-半乳糖醛酸标准品质量浓度为横坐标(x),以吸光度为纵坐标(y),绘制标准曲线,得到标准曲线回归方程为y=0.0039x-0.0415,R2=0.9998。通过标准曲线查出相应的半乳糖醛酸质量,计算果胶含量,以生成的半乳糖醛酸的质量百分数表示果胶含量。
1.2.7 复水比测定 将干燥后的山药片恒温60 ℃浸泡2 h,取出放在无风处沥水20 min,再用滤纸去除表面水分,称重[21]。计算如公式(4)所示
式中:m1为干制品复水沥干水分后的质量(g);m2为脱水山药干制品的质量(g)。
1.2.8 气味测定 电子鼻分析:准确称取样品2.00 g,加入2 mL 0.25 g/mL NaCl 溶液,置于20 mL 进样瓶中。顶空平衡温度40 ℃,平衡时间30 min。电子鼻测定条件:测定时间120 s,清洗时间100 s,传感器流速600 mL/min,特征值提取时间点设定为118~120 s。每个样品做3 次平行。PEN3 电子鼻传感器阵列及其主要特征见表1。
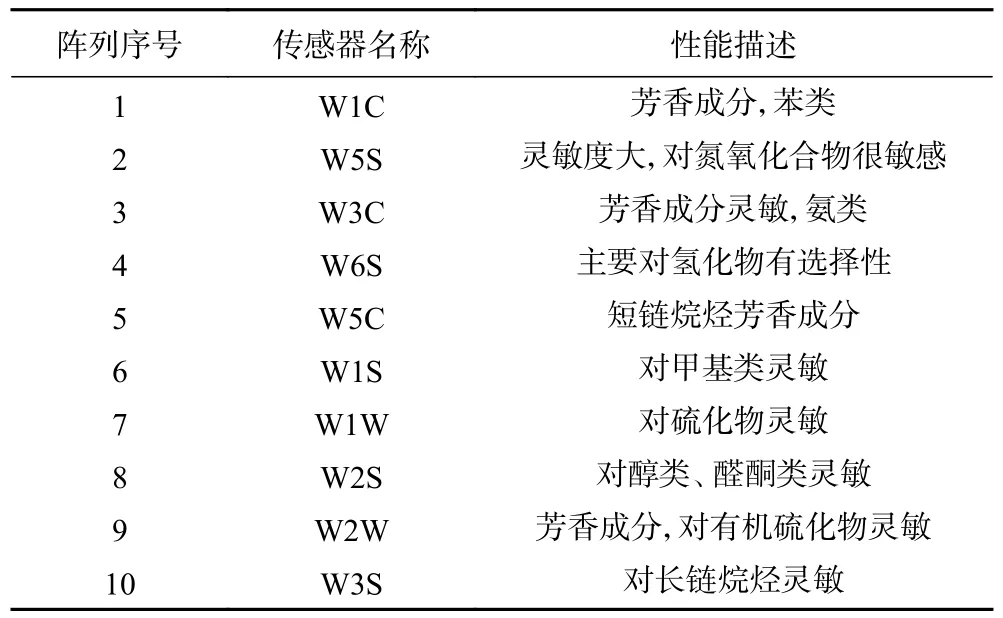
表1 PEN3 电子鼻传感器阵列及其主要特征Table 1 PEN3 electronic nose sensor array and its main characteristics
1.2.9 色差测定 色泽分析:采用色差仪测定亮度值(L*)、红度值(a*)和黄度值(b*)。每组样品重复测定6 次,通过式(5)计算总色差(ΔE)。
式中:L0*、a0*、b0*分别是干燥前对照组铁棍山药的明暗度、红绿值和黄蓝值;L*、a*、b*代表经过预处理及干燥后山药样品的明暗度、红绿值和黄蓝值。
1.3 数据处理
所有实验均重复测定3 次,实验结果以平均值±标准差表示。应用SPSS 26 和Excel 2021 进行方差和显著性分析,P<0.05 时认为差异显著,利用Origin 2021 软件作图。
2 结果与分析
2.1 不同预处理对山药片水分状态的影响
山药中的水分状态和分布可以运用LF-NMR和MRI 技术进行评估。一般来说,水的弛豫时间与组织中的含水率、组织中不同区域的水分属性,以及水分与大分子和溶质之间的相互作用有关[22]。从图1a低场核磁共振T2反演图可观察到,在1~1000 ms 的弛豫时间内分布有3 个峰,其分别对应3 种状态的水:结合水T21(0~10 ms,与大分子物质如细胞壁多糖紧密结合的水),不易流动水T22(10~100 ms,截留在高度组织化的结构中的水),自由水T23(>100 ms,存在于液泡中或细胞外空间中的水分)[23],所对应的的核磁信号强度(时间点的积分面积)分别为A21、A22、A23。如图1a 所示,未干燥的山药以自由水为主,且经预处理后,横向弛豫时间的三个峰均向更短的时间移动,表明水分子的迁移率逐渐降低;经高压静电场预处理后山药片中自由水的峰面积明显增加,而经冷冻预处理后山药片中自由水峰面积明显减少,这可能是因为在高压静电场下,会增加水分子的能量,减小水分子与溶质之间的阻力,从而使得自由水增多[24],而在冷冻处理下,细胞中部分水发生冻结,自由水减少,除此之外,此处理方式下结合水最少,说明,冷冻造成了山药中水分存在方式的改变,即结合水向自由水的不断转变,在冷冻过程中,小冰晶聚集成大冰晶,破坏细胞结构[25]。如图1b,经热风干燥后,山药中自由水含量明显降低,结合水比例增加。结合水通过氢键与蛋白质、多糖等大分子物质紧密结合,形成组织结构物质,表现出较短T23弛豫时间。三个处理组的自由水对应的峰面积皆低于对照组,且趋近于零,这表明经过预处理后的山药片干燥后更加耐储[26]。对照组的图谱显示T22、T23部分存在多个峰,这是半结合水和结合水之间的转化所呈现的峰,因为山药富含多糖,而且对照组细胞完整度较高,因此会阻碍水分成分之间转化,导致半结合水和结合水之间出现多个峰[27]。冷冻组在结合水部分出现两个峰,0.1~1 ms 对应的为强结合水,1~10 ms 为弱结合水,干燥结束时,还有部分弱结合水未转化为强结合水。
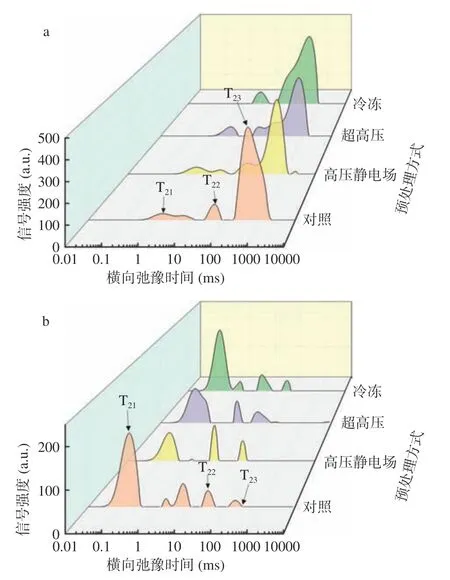
图1 不同预处理对山药片干燥前(a)后(b)横向弛豫时间T2 的影响Fig.1 Effect of different pretreatment methods on transverse relaxation time T2 of yam slices before (a) and after (b) drying
2.2 不同预处理对鲜山药片水分分布的影响
为了更直观地反映不同方式预处理对山药片水分变化,分析不同预处理山药片的低场核磁共振成像情况。伪彩图从红色到黄色到浅蓝色的颜色变化表明质子密度逐渐降低,信号越弱,山药的水分含量越低。如图2 所示,未经预处理的对照组成像颜色偏黄,内部还有少量红点;冷冻组为绿色,且内部无红点;超高压组和高压静电场组均为淡蓝色。这表明经过预处理之后,样品的水分含量与未处理组相比有一定程度上的降低,且经过超高压和高压静电场两种方式预处理后,山药中水分流失更多。

图2 不同预处理对鲜山药片水分分布的影响(干燥前)Fig.2 Imaging analysis of yam slices after different pretreatment (before drying)
2.3 不同预处理对山药片干燥特性的影响
山药片经过不同方式预处理后进行干燥的干燥曲线如图3 所示。在固定时间内称量山药的质量变化,将失重量转换为水分比,其变化与时间的关系展示如图。山药片的含水率不断下降,直至达到其平衡含水量。从图中可以看出,经过冷冻、超高压、高压静电场预处理后以及对照组干燥至水分比0.10 以下的时间分别为160、180、200、220 min 左右,与对照组相比,经过预处理后,山药的干燥时间显著(P<0.05)减少,冷冻组最为明显。这主要是由于在冷冻的情况下,山药中的水会转化为冰,体积膨胀,使得细胞结构受到机械性损伤,甚至不再完整,从而有利于山药内部水分迁移出来,进而缩短干燥时间[28];超高压处理减短干燥时间与细胞渗透性有关[29],经该方式处理后,细胞变形,细胞间隙变大,从而会增加细胞的通透性,促进水由样品内部向外部转移,因此降低了样品的含水率,减少干燥时长;在电场力的作用下,水分子会加速脱离物料[20],同时电场促进了对流传热,进而促使水分迁移。
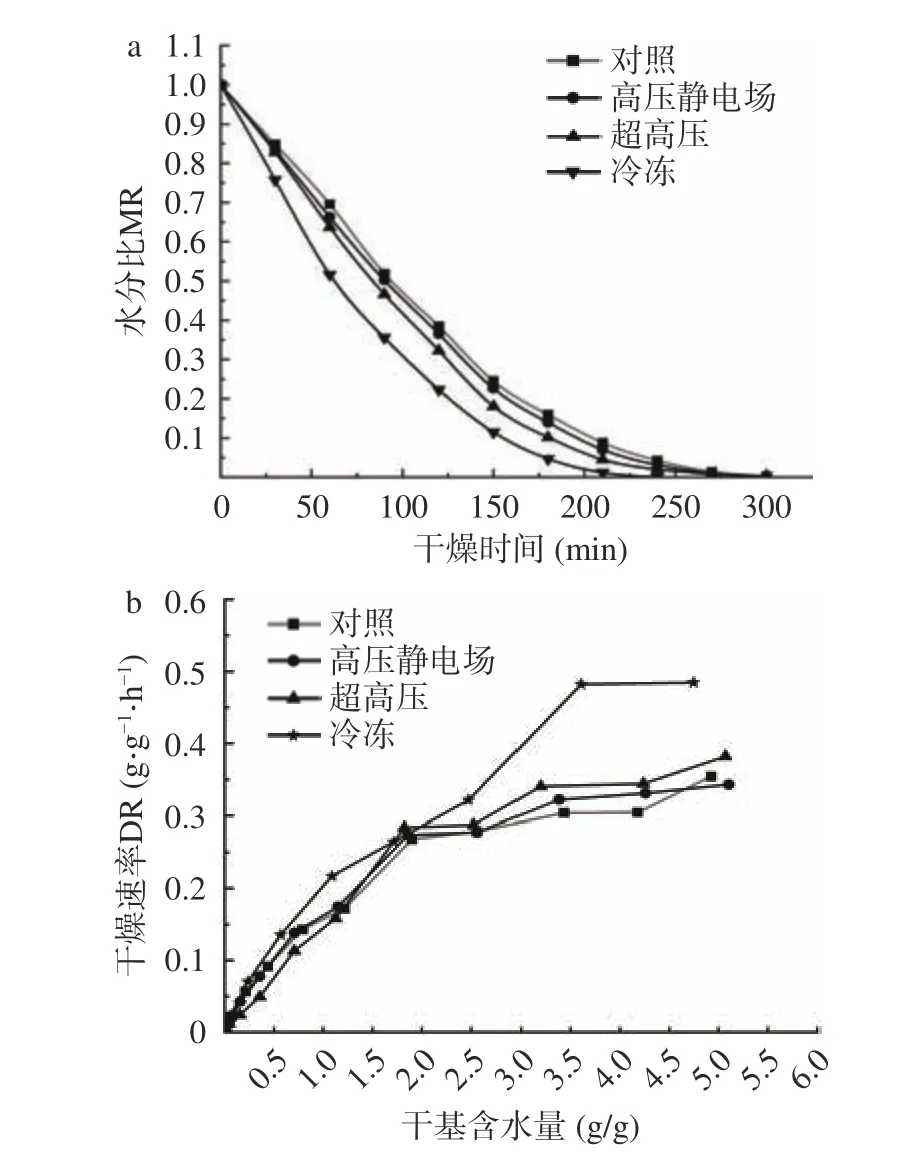
图3 山药片不同预处理下的干燥曲线(a)和干燥速率曲线(b)Fig.3 Drying curves (a) and drying rate curves (b) of yam slices at different pretreatment
2.4 不同预处理对山药微观结构的影响
2.4.1 干燥前山药片微观结构 山药经不同方式预处理后的组织结构如图4 所示。干燥前未经处理的山药组织细胞壁、细胞膜以及胞内的液泡结构比较完整,细胞排列紧密。而经过冷冻和超高压处理后的样品组细胞壁破损,细胞间距变大,但冷冻组细胞内的液泡保存相对完整。经过高压电场处理的山药样品细胞结构破坏程度较小,但细胞排列间距变大。冷冻处理使细胞内外的水形成冰晶,造成原来相互结合的细胞发生分离,从而细胞间距变大。较大的冰晶体会刺破或胀破细胞,使细胞受到破裂损伤,有利于物料内部水分迁移出来,提高干燥速率;超高压处理导致山药组织细胞体积压缩,细胞结构受到损伤,同时细胞壁果胶多糖发生酶促和非酶促反应降解,从而影响细胞壁完整性[30];高压静电场可以导致植物细胞膜穿孔,降低细胞组织的膨压,细胞间隙变大,这与武新慧[31]观察高压脉冲电场预处理后苹果组织扫描电镜图像的结果一致,其发现经高压脉冲电场预处理后苹果的细胞结构变形、细胞间隙增大、细胞壁穿孔及细胞膨压下降。

图4 不同预处理对鲜山药片组织结构的影响(干燥前)Fig.4 Plot of tissue sections of yam slices after different pretreatment (before drying)
2.4.2 干燥后山药片微观结构 不同方式预处理后进行干燥对山药组织结构的影响如图5 所示。通过扫描电镜观察,对照组山药样品干燥后,其细胞排列紧密,大致分布于一个较为完整的平面,而经过三种不同方式预处理后再进行干燥,山药细胞排列的完整性均遭到破坏,主要表现为孔隙的增大和增多。经冷冻处理后,山药的孔隙度明显增大,细胞形态破环较为明显,会导致干燥后的山药有较低的硬度;超高压处理对山药的细胞破坏也较大,孔隙多,可能是因为液泡失水过多引起皱缩,而细胞壁适应液泡体积减小时发生破裂而造成[32];高压静电场处理的山药孔隙较为均匀,说明对细胞的破环较小[33],因此可以获得较高的硬度及复水率。

图5 山药片干燥后SEM 图(300×)Fig.5 Scanning electron microscope micrographs of yam slices after drying (300×)
2.5 不同预处理对山药片硬度的影响
不同预处理对热风干燥山药硬度的影响见图6。硬度是果蔬干制产品的重要质地结构特性,对产品品质起决定性作用。由图6 可以看出,干燥前,经过高压电场和超高压处理后,山药硬度与对照组无明显差异,而冷冻组硬度显著(P<0.05)下降。干燥后,对照组山药片的硬度为1455.34 g,经过高压电场预处理后,热风干燥的山药硬度为1621.22 g,较对照组稍有增加。但经超高压和冷冻预处理后,热风干燥的山药硬度明显下降。高压电场处理会导致山药内水的结构以及水与酶的结合状态发生改变,钝化酶活力[34],如羧甲基纤维素酶以及果胶甲酯基酶等,从而导致山药干燥后硬度增加。超高压和低温处理都会破环了山药的细胞膜、细胞壁等结构,使得其细胞结构变形或破裂,从而影响果蔬的质构[35]。这与扫描电镜观察到的细胞结构图相一致。
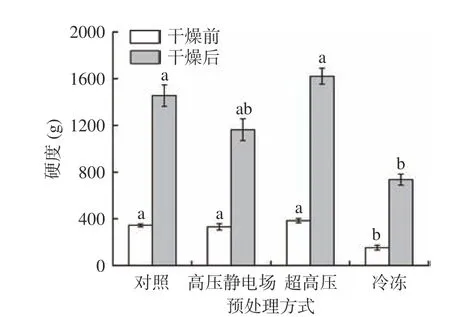
图6 不同预处理对山药片硬度的影响Fig.6 Changes in hardness of yam before and after drying with different pretreatment methods
2.6 不同预处理对山药片细胞壁成分含量的影响
植物细胞壁的主要成分是纤维素和果胶,细胞壁的主要作用是控制细胞的生长、增加细胞的机械强度并承受着内部原生质体由于液泡吸水而产生的膨压[36]。图7 表示经过不同预处理后山药片细胞壁中果胶的变化,在干燥前,经过预处理后果胶的含量与对照组差异不明显。干燥后,超高压处理样品果胶含量显著(P<0.05)低于其它两个实验组,冷冻组和高压静电场处理组的果胶含量高于对照组,这可能是因为经过冷冻和高压电场处理后抑制了有关酶的活性,如果胶甲酯基酶,从而减少了在干燥过程中果胶的损失,提高了果胶含量[37]。图8 是山药经不同预处理后,山药样品细胞壁中纤维素含量的变化,经过不同预处理后,细胞壁中纤维素的含量要低于对照组,在干燥前,高压静电场和超高压处理后的纤维素的含量显著(P<0.05)低于对照组,分别为8.43%和8.51%,在干燥后,经冷冻处理的山药纤维素含量最少,为13.17%,显著(P<0.05)低于对照组。由此可以推断出,预处理对山药细胞壁的有着一定的破坏作用,增加了细胞的通透性,促进了干燥过程中水分的流失,从而提高干燥速率。
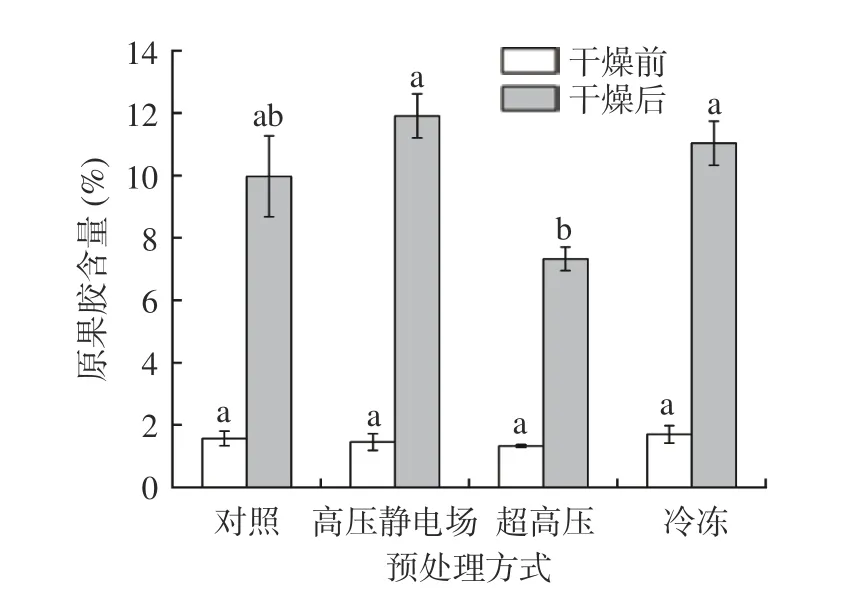
图7 不同预处理对山药片原果胶含量的影响Fig.7 Changes in propectin before and after drying of yam slices with different pretreatment methods
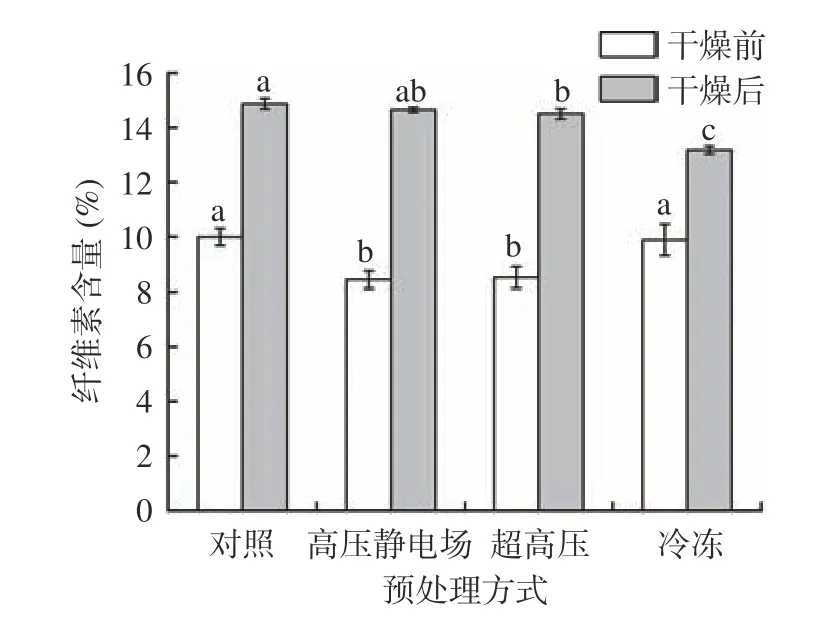
图8 不同预处理对山药片纤维素含量的影响Fig.8 Changes of cellulose in yam slices before and after drying with different pretreatment methods
2.7 不同预处理的干燥山药片复水比变化
不同方式预处理后热风干燥得到的山药片复水比如图9 所示。经过高压静电场预处理后的山药片复水比(3.53)优于对照组,且为最高,代表复水能力最强;经超高压和冷冻预处理后的山药片复水率较对照组明显降低,冷冻组最小,说明该方式对山药片进行预处理复水能力最差。导致此结果的原因是超高压和冷冻处理严重破坏了山药的组织结构,干燥后收缩率较大,降低了山药片的持水能力,从而减小了山药片复水能力;而经高压静电场处理对山药组织结构破环较小,且可以提高渗透脱水和溶质渗入的速率,因此山药的复水性与对照组相比更胜一筹,这与组织切片中观察到的结果一致。同样的Parniakov 等[38]发现高压脉冲电场处理可以提高苹果片的冷冻干燥效率,增加其孔隙率和复水性。
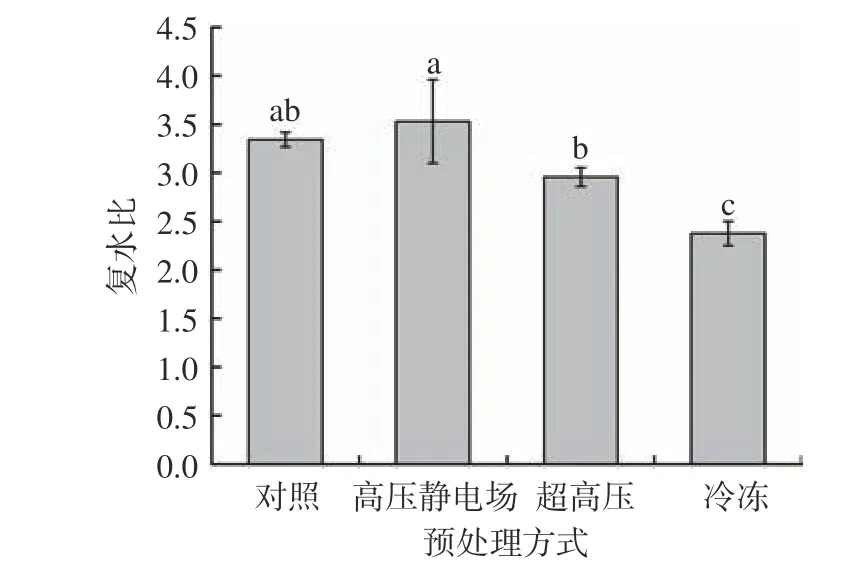
图9 不同方式预处理后山药片的复水比Fig.9 Rehydration ratio of yam slices dried by different pretreatment methods
2.8 电子鼻气味分析
为了更直观比较分析不同方式预处理山药片香气特征,将样品在10 个不同传感器下的响应强度峰值绘制成雷达图(图10)。样品主要对W1W、W1S、W2W 有显著响应值,它们分别对应的敏感类物质为硫化物、甲基类、有机硫化物等,但不同预处理方式之前的样品响应值存在差异,因此,通过从传感器信号响应的强弱可以初步判断样品间气味成分含量存在不同。
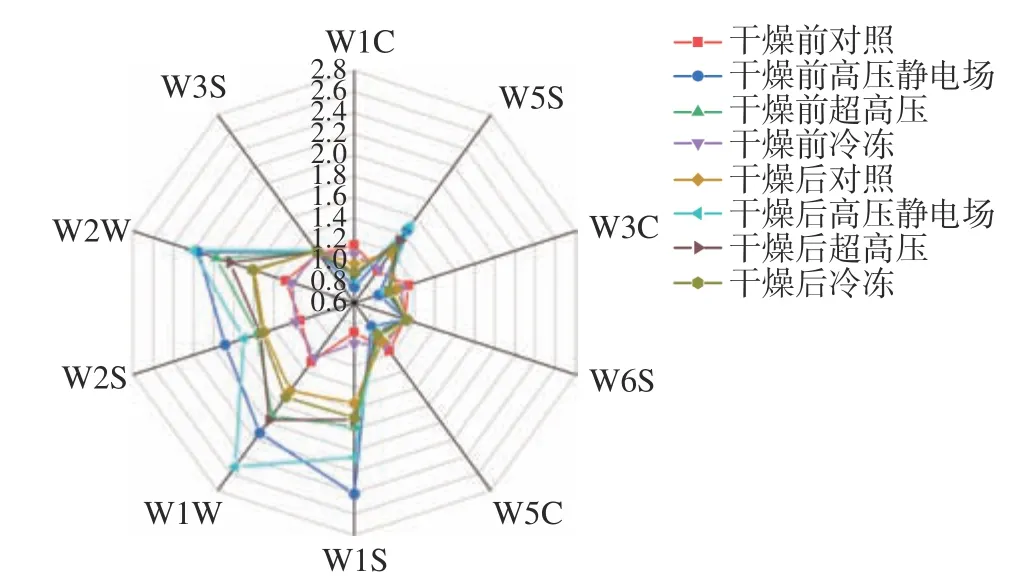
图10 不同方式预处理山药片干燥前后的雷达图Fig.10 Radar map of yam slices before and after drying by different pretreatment methods
通过不同方式对山药进行预处理,其干燥前及干燥后主成分分析(PCA)结果如图11 所示,第一主成分(PC1)的贡献率为86.2%,第二主成分(PC2)的贡献率为5.9%,累计贡献率达到92.1%,因此,故选取前2 个PC,可反映出样本间的大部分关系。对照组、冷冻组以及高压静电场组三种方式在干燥前和干燥后,各自均有其归属区域,没有明显重叠,说明这三种预处理会使山药干燥后的气味明显不同;超高压处理干燥前后距离较近且有重叠,由此可见通过此方式对山药进行预处理后再干燥,不会过多改变山药的气味,这一结果与黄欢[29]的观察结果相似,小分子风味化合物的结构不会直接受到高压的影响,因此超高压预处理能够较好地保留果蔬的风味物质,有时甚至能够使其风味更加突出。干燥前,对照组、冷冻组以及高压静电场组距离较近,但干燥后分布距离较远,表明仅对山药进行预处理,对样品的风味影响较小,差异不明显,但经热风高温干燥后,会使山药产生不同于新鲜山药的焦香味,且由于不同处理方式对山药组织结构破环的程度不一样,山药中的水分蒸发的快慢不一致,但干燥时间相同,因此风味差异显著。徐欣[39]的研究发现,冻融预处理会使细胞收缩,细胞膜破裂,挥发性成分溢出,从而影响黄秋葵的风味。Neri 等[40]研究藏红花的干燥过程中发现脉冲电场预处理降低了藏红花柱头的香气,这种下降可归因于脉冲电场诱导细胞膜穿孔,从而导致挥发性成分散失,香气下降。因此,经过不同方式的预处理及干燥过程,均会对新鲜山药的气味产生不同程度的影响。
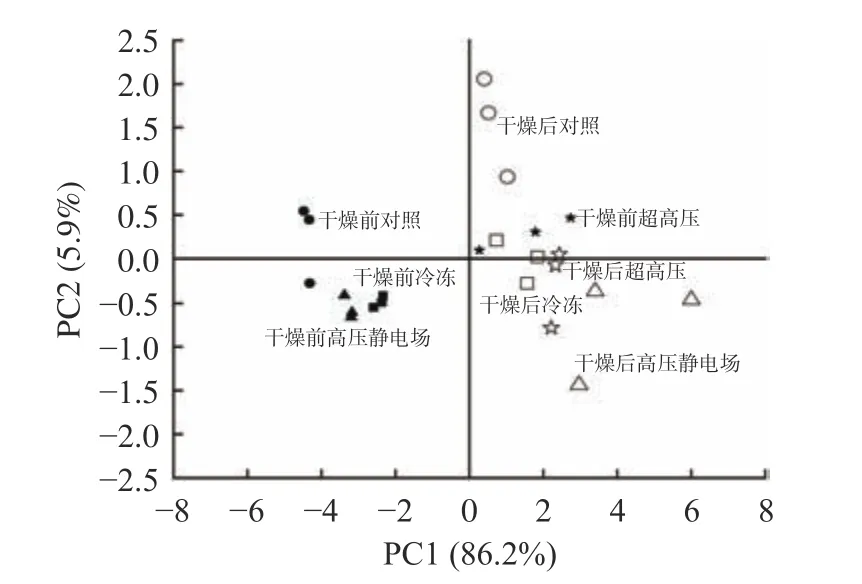
图11 不同方式预处理山药片干燥前后的PCAFig.11 PCA of yam slices before and after drying by different pretreatment methods
2.9 色泽分析
由表2 可知,在经过不同预处理后,样品白度值L*存在差异。干燥前,亮度从高到低的方式预处理为高压静电场>对照>冷冻>超高压,经超高压预处理后,山药的白度明显低于对照组。干燥后,山药的白度均有不同程度的增加,这是因为干燥前山药含水量高,因此相对于干品未表现出鲜亮的颜色,亮度从高到低的方式预处理为超高压>高压静电场>对照>冷冻,冷冻组亮度较对照组显著(P<0.05)降低。从红度a*来看,干燥前,不同方式预处理之间差异明显,其中超高压组最高,冷冻组a*值为负值,经过干燥后,各处理组a*值均降为负值,超高压组a*值最低,这可能与预处理以及干燥过程中导致细胞内结构的降解有关[41]。从黄度值b*来看,干燥后,不同处理组山药样品的黄色度均有增加,这主要是因为非酶褐变及收缩变化所致[42-43]。
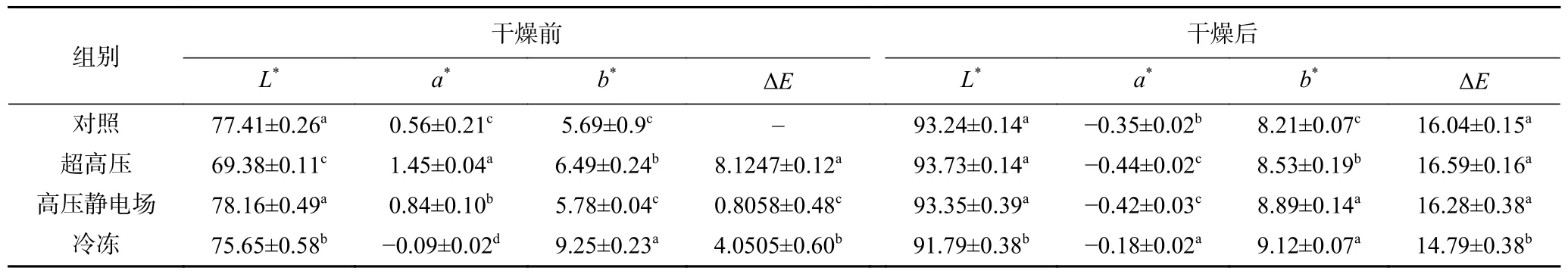
表2 不同预处理后对山药的色泽影响Table 2 Effects of different pretreatment methods on the color of yam
利用色差值ΔE比较山药片与仅做护色处理的新鲜山药样品之间的差异,ΔE越高表示样品颜色变化越大。与新鲜样品相比,所有热风干燥的样品均显示出明显差异。超高压处理组表现出最高的L值和色差(ΔE=16.59),说明超高压处理能够明显提高样品的白度,这与郝启栋等[44]的研究结果一致,由于超高压会使过氧化物酶及多酚氧化酶失活,从而抑制了干燥过程中蒜片发生褐变。冷冻处理组色差(ΔE=14.79)最低,且小于对照组,可能是由于冷冻导致细胞破裂最为严重,营养物质流失,尤其是糖分、蛋白质等在冻结时会溢出物料表面[45],热风干燥时,在高温条件下对山药的色泽产生影响。
3 结论
利用不同的方式对山药进行预处理,经热风干燥后比较山药片品质特性及微观结构的差异。结果表明,未干燥的山药以自由水为主,预处理后山药样品的水分流失,弛豫时间减少,经热风干燥后,自由水含量明显降低,结合水比例增加,直至稳定;冷冻预处理对山药组织结构影响较大,但可显著减短干燥时间,水分比最早(160 min)降至0.10 以下,相较于对照组减少了27.27%;高压静电场预处理使得干燥后的山药具有较高的硬度,复水性好,且色泽也有所提升;山药经超高压预处理再热风干燥,可以较好的保留风味物质,且色泽得以显著(P<0.05)改善,但会降低山药的复水性。因此,具体的工业生产应用仍需结合实际需求及生产成本综合考虑。
