全反式维甲酸联合三氧化二砷治疗急性早幼粒细胞白血病的临床有效性及安全性探讨
2023-10-16石晶
石 晶
(邹城市人民医院血液风湿免疫科,山东 济宁 273500)
安以FAB 为标准进行分型急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)又被称为急性髓细胞白血病(AML)M3,在急性白血病患者中占比约为27%,发作后APL 患者骨髓及其他造血组织中无限制地、大量地生成白血病细胞,同时抑制机体生成正常的血细胞,染色体在遗传学标志中的易位为t(15∶17)(q22;q21),早幼粒细胞白血病- 维甲酸受体α(PMLRARα)融合基因是诱发APL 的特有基因[1]。APL 患者的典型特征如下:①骨髓正常形态发生变化,机体中增生的早幼粒细胞发生异常变化;②患者普遍存在多种不良症状;③多数患者特异性染色体为t(15∶17);④对化疗药物较为敏感,基本不会出现耐药性,达到完全缓解状态后,能获得较长时间的生存期[2]。ATRA 与As2O3的作用机制有显著差异,As2O3作用机制是促使细胞快速凋亡,ATRA 作用机制是诱导细胞分化。基于此,本研究旨在分析了APL 患者联合使用ATRA 与As2O3的效果,现报道如下。
1 资料和方法
1.1 一般资料回顾性分析2018 年9 月至2020 年8 月邹城市人民医院收治的82 例APL 患者的临床资料,按治疗方法分为A 组和B 组,各41 例。A 组患者男26例,女15 例;年龄21~65 岁,平均年龄(32.56±3.14)岁;体质量48.62~85.49 kg,平均体质量(68.23±4.67)kg;临床表现:单纯肝肿大11 例、单纯脾肿大9 例、肝脾皆肿大5 例;15:17 染色体易位和PML/RARa 融合基因33 例。B 组患者男25 例,女16 例;年龄23~67 岁,平均年龄(32.84±3.21)岁;体质量48.78~85.56 kg,平均体质量(68.64±4.52)kg;临床表现:单纯肝肿大12 例、单纯脾肿大8 例、肝脾皆肿大4 例;男、女性分别为25、16 例;15:17 染色体易位和PML/RARa 融合基因31 例。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。本研究经邹城市人民医院医学伦理委员会批准。纳入标准:符合临床诊断APL 标准《中国急性早幼粒细胞白血病诊疗指南(2018 年版)》[3]且经血常规、细胞学、骨髓细胞学检查确诊。排除标准:①合并精神类疾病;②合并重要器官功能障碍。
1.2 治疗方法A 组口服ATRA。①诱导阶段:口服ATRA(重庆华邦制药有限公司,国药准字H20010126,规格:10 mg)25 mg/(m2·d),治疗4~6 周直至完全缓解(CR)。②巩固阶段:达到完全缓解(CR)后,联合化疗[静脉滴注1 周高三尖杉酯碱(杭州民生药业有限公司,国药准字H33020007,规格:1 mL∶1 mg)3~4 mg/d,阿糖胞苷(国药一心制药有限公司,国药准字H20055127,规格:100 mg)100 mg/(m2·d);静脉滴注5 d 依托泊苷(四川升和药业股份有限公司,国药准字H20045483,规格:5 mL∶100 mg)100 mg/(m2·d)]巩固。停药3 周后进行下个疗程。每次化疗后检查PML-RARα,结果呈阳性继续下个疗程的巩固阶段治疗,直至转阴;结果呈阴性,开展维持阶段治疗方式。③维持阶段:口服ATRA,25~45 mg/(m2·d),治疗2 周,停药2 周。静脉滴注高三尖杉酯碱3~4 mg/d、阿糖胞苷100 mg/(m2·d),治疗1 周。同时静脉滴注依托泊苷100 mg/(m2·d),治疗3 d 直至CR 再重复上述用药(从诱导阶段开始)。持续上述维持治疗2 年。B 组在A 组的诱导阶段静脉滴注0.15 mg/kgAs2O3(北京双鹭药业股份有限公司,国药准字H20080664,规格:5 mg/瓶),1 次/d。其他阶段治疗方法同A 组。
1.3 观察指标①临床指标[CR 达标时间、CR 达标率、白细胞峰值、PML-RARα 转阴率、早期病死率、1 年生存率、复发率、2 年生存率]。CR:无临床症状和体征,中性粒细胞绝对值和血小板检测结果≥1.5×109/L、≥100×109/L,巨核细胞、红细胞处于正常状态。②临床体征评分。使用自制量表评价治疗前后患者临床体征改善情况,本次纳入高热、肺浸润、肾功能衰竭、浆膜腔积液等4 个项目,10 分/项,分数与严重程度呈正比。③不良反应(头痛、乏力,转氨酶升高,消化道反应,下肢静脉血栓,浆膜腔积液和水肿等)发生率。④凝血参数。采集5 mL 空腹静脉血使用全自动凝血分析仪(希森美康公司,型号:CA-1500)和配套试剂检验不同时间点(治疗前、治疗4 d、治疗7 d)的凝血参数[凝血酶原时间(PT)(乏血小板血浆,浊度法)、活化部分凝血活酶时间(APTT)(乏血小板血浆,浊度法)、纤维蛋白原(FIB)(血浆,比浊法)]。⑤输注血小板、血浆、冷沉淀物的数量。
1.4 统计学分析使用SPSS 20.0 统计学软件处理数据,以(±s)与[例(%)]分别表示计量与计数资料,分别用t与χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两种患者临床指标对比B 组患者CR 达标时间短于A 组,CR 达标率、PML-RARα 转阴率、2 年生存率均高于A组,白细胞峰值、复发率均低于A 组,差异均有统计学意义(P<0.05);两组患者早期病死率、1 年生存率比较,差异均无统计学意义(均P>0.05),见表1。
表1 两种患者临床指标对比[例(%)]/(±s)

表1 两种患者临床指标对比[例(%)]/(±s)
CR:完全缓解;PML-RARα:早幼粒细胞白血病-维甲酸受体α。
?
2.2 两组患者临床体征评分对比治疗后,两组患者各项临床体征评分均降低,且B 组均低于A 组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者临床体征评分对比(分,±s)

表2 两组患者临床体征评分对比(分,±s)
注:与治疗前对比,*P <0.05。
?
2.3两组患者不良反应发生情况对比B 组患者头痛、乏力和下肢静脉血栓发生率均低于A 组,差异均有统计学意义(P<0.05),见表3。
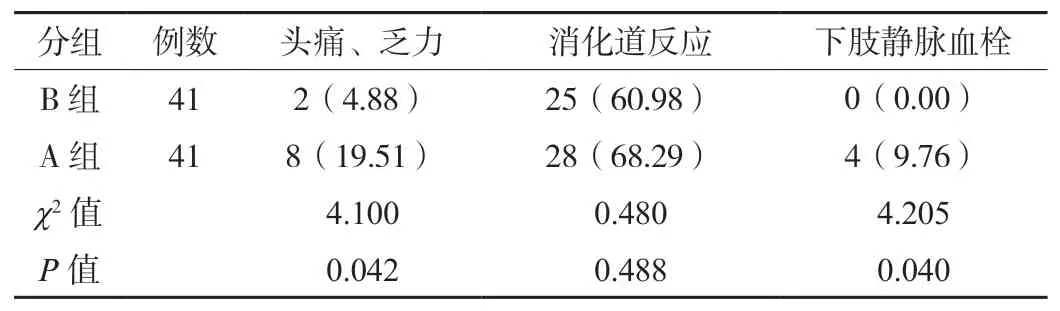
表3 两组患者不良反应发生情况对比[例(%)]
2.4两组患者凝血参数对比治疗4、7 d,B 组患者PT、APTT 均高于A 组,FIB 均低于A 组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者凝血参数对比(±s)
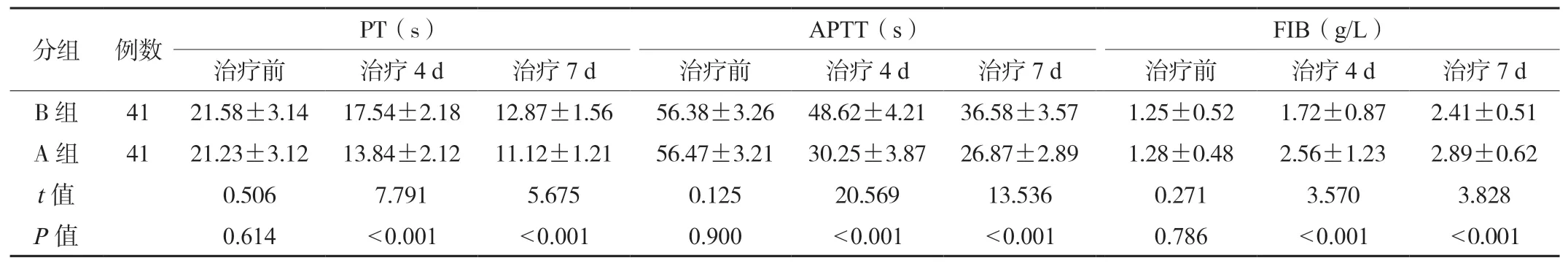
表4 两组患者凝血参数对比(±s)
PT:凝血酶原时间;APTT:活化部分凝血活酶时间;FIB:纤维蛋白原。
?
2.5两组患者输注血小板、血浆、冷沉淀物数量对比治疗4 d、治疗7 d,B 组患者输注血小板、血浆、冷沉淀物数量均高于A 组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者输注血小板、血浆、冷沉淀物数量对比(U,±s)

表5 两组患者输注血小板、血浆、冷沉淀物数量对比(U,±s)
?
3 讨论
急性早幼粒细胞白血病具有发病急、病程短的特点,主要在中青年人群中较为常见。患者主要的症状表现以反复发热、眼底出血、牙龈出血、心悸及乏力为主。ATRA是临床针对急性早幼粒细胞白血病患者诱导缓解治疗的典型药物,不仅可直接通过细胞受体发挥作用,还可对患者骨髓造血细胞功能产生影响。该药物可直接通过在PMLRARα 融合蛋白RARα 部位来刺激,进而诱导早幼粒细胞更快地转化为成熟细胞,进而发挥出干预作用。虽然应用ATRA 对肿瘤细胞有较强的杀伤力,诱导肿瘤细胞的分化与凋亡。但单一应用ATRA 治疗,患者可能会出现骨髓抑制等不良反应,长时间应用不仅会产生耐药,同时还会增加疾病复发风险。As2O3其可促进线粒体DNA 突变,同时还具有加快线粒体DNA 突变、推进急性早幼粒细胞凋亡的效果。其还可通过干扰巯基酶的辅助作用,对肿瘤恶性细胞的繁殖进行破坏,最终降低该病的致死率。另外,该药物能降解PML/RARα 融合蛋白,进而发挥对疾病的治疗效果[4]。
当前临床尚未明确该病的发病病因,认为可能与血液疾病、环境及遗传因素的影响存在相关性。诱发该病的机制是17 号染色体上的维甲酸受体基因与15 号染色体上的早幼粒细胞基因共同产生PML-RAR 融合基因。应用联合使用ATRA、As2O3后,能够靶向性针对PML-RAR 融合基因产生作用,进而提升患者疾病的治愈率水平。为验证ATRA 联合As2O3治疗急性早幼粒细胞白血病的临床有效性及安全性,特设计了本次研究,结果显示:B 组CR 时间、CR 率、白细胞峰值、转阴率、复发率、2 年生存率优于A 组;治疗4 d、治疗7 d,B 组患者输注血小板、血浆、冷沉淀物数量均高于A 组,提示APL 患者联合使用ATRA、As2O3,改善相关指标的效果更佳。
APL 患者使用ATRA 能使CR 率达到80%以上,ATRA的优势是在改善凝血功能障碍的基础上不会导致骨髓抑制,但是如果单一使用ATRA 易诱发致死性药物相关综合征。目前临床针对APL 细胞系或新鲜的APL 细胞联合使用ATRA、As2O3治疗,经临床研究证实,两种药物同时使用不会发生交叉耐药性,同时还能相互提升敏感,从而缩短达到CR 时间[5]。在化疗诱导阶段将患者达CR 时间有效缩短,才能使其在化疗强化阶段维持更长的CR 时间,从而使患者无病生存时间显著延长,提高长期生存率。联合使用ATRA、As2O3的优势是在化疗诱导阶段将达CR 时间有效缩短,为APL 患者达CR 后的强化和维持阶段治疗奠定良好基础[6]。
本研究显示:治疗4、7 d,B 组患者PT、APTT 均高于A 组,FIB 均低于A 组,提示APL 患者联合使用ATRA、As2O3,改善凝血系统功能的效果更佳。分析原因如下:临床相关研究结果显示,在治疗前APL 患者普遍表现为血小板、抗凝血和纤溶系统活性显著提升,大量消耗抗凝物质的问题,而ATRA、As2O3联合治疗,能降低组织因子mRNA(APL 细胞溶解产物)的总体数量,从而改善机体凝血、继发性纤溶、其他凝血障碍表现,最终降低早期APL 患者的死亡率[7]。因此,APL 患者治疗中联合使用ATRA、As2O3两种药物,能在短时间内纠正凝血状态,从而有效提高治疗APL 的效果。本研究显示,B 组患者头痛乏力、下肢静脉血栓发生率均低于A 组,表明APL 患者联合使用ATRA、As2O3发生的不良反应更少。ATRA使用后常见的药物毒性反应有头痛、乏力,转氨酶升高,消化道反应,下肢静脉血栓和水肿等,而联合用药后能在一定程度上降低头痛、乏力,转氨酶升高,消化道反应等不良反应的发生率[8]。
本研究显示:治疗后,两组患者各项临床体征评分均降低,且B 组均低于A 组,提示APL 患者联合使用ATRA、As2O3,改善临床症状的效果更佳。有研究提出,针对影响APL 患者预后效果的因素进行分析发现,如果治疗前检验患者白细胞计数超过10×109/L,提示导致预后不良的概率更高,如果使用ATRA 治疗后第5 d、10 d、15 d 白细胞计数分别>6.0×109/L、10×109/L、15×109/L,提示患者发作高白细胞综合征和维甲酸综合征的风险更高,针对这些患者需要调整化疗方案,使用联合标准化疗方案[9]。本次研究严格坚持上述原则,针对治疗前或治疗过程中检测白细胞计数>10×109/L 的APL 患者,在ATRA 治疗的基础上联合使用As2O3,从而获得了理想的疗效。
综上所述,APL 患者联合使用ATRA、As2O3,改善临床体征、凝血系统功能的效果更佳,安全性高,值得应用。
