白藜芦醇对氧化应激刺激MC3T3-E1细胞增殖、衰老和成骨分化的影响
2023-10-13薛芸张静爽周游石锐
薛芸,张静爽,周游,石锐
·论著·
白藜芦醇对氧化应激刺激MC3T3-E1细胞增殖、衰老和成骨分化的影响
薛芸,张静爽,周游,石锐
100035 北京,北京市创伤骨科研究所/国家骨科医学中心/首都医科大学附属北京积水潭医院
研究白藜芦醇对 H2O2诱导的衰老成骨细胞的细胞增殖和成骨分化作用的影响。不同浓度 H2O2处理 MC3T3-E1 细胞,采用 CCK8 实验检测细胞增殖活性;检测衰老相关 β-半乳糖苷酶活性,明确 H2O2诱导成骨细胞衰老合适浓度。不同浓度白藜芦醇处理 MC3T3-E1 细胞,采用 CCK8实验检测其对细胞增殖活性的影响;不同浓度白藜芦醇处理成骨诱导培养基诱导的成骨细胞,检测碱性磷酸酶(ALP)活性和成骨基因(Col1、Runx2、Ocn)表达;不同浓度白藜芦醇处理H2O2诱导的成骨细胞,检测 ALP 和 β-半乳糖苷酶活性。CCK8 检测结果显示,高浓度(200、400 μmol/L)H2O2显著抑制细胞增殖(< 0.05);β-半乳糖苷酶染色结果显示,100 μmol/L H2O2衰老细胞数量增多,后续诱导衰老模型使用 100 μmol/L H2O2;CCK8 检测结果显示,10、100 μmol/L 白藜芦醇显著抑制细胞增殖;ALP 活性和 β-半乳糖苷酶染色检测结果显示,与对照组相比,0.1 μmol/L 白藜芦醇显著增强正常成骨细胞和 H2O2诱导的衰老成骨细胞 ALP 活性和衰老细胞数量,RT-qPCR 结果显示,0.1 μmol/L 白藜芦醇 + H2O2组的 Col1、Runx2、Ocn mRNA表达高于 H2O2处理组(< 0.01)。适宜浓度的白藜芦醇可提高 H2O2诱导的衰老成骨细胞成骨分化能力。
白藜芦醇; 细胞活性; 衰老; 成骨分化
骨质疏松症是一种与年龄相关的退行性疾病,以骨量减少和骨组织结构恶化为特征,随着全球人口老龄化的加剧已成为一个社会问题。由于低矿物质密度和骨组织微结构的改变,骨质疏松症表现为骨折风险增加[1]。骨质疏松患者终生骨折的风险高达 40%,骨折最常发生在脊柱、髋关节或手腕,但其他骨骼如转子、肱骨或肋骨也会受到影响[2]。为了预防骨质疏松性骨折,针对骨质疏松症的诊断和治疗进行了许多尝试。包括热量限制、基于端粒酶的疗法、抗氧化补充剂、抗衰老药物疗法、细胞重编程和给药表观遗传调节剂(sirtuins 激活剂、组蛋白去乙酰酶抑制剂、非编码 miRNAs 调节剂等)在内的治疗方法已被报道具有整体抗衰老作用,但这些疗法的疗效和生物相容性仍不确定[3]。对于年龄相关性骨质疏松症的治疗,FDA 和欧洲批准的以双膦酸盐和重组人甲状旁腺激素为代表的治疗方法通过合成代谢或抗吸收功能发挥其治疗效果。然而,由于它们的不良反应,如骨肉瘤、颌骨骨坏死和非典型性股骨骨折,限制了其在长期治疗中的应用[4]。虽然出现了一些新药,如 romosozumab、abaloparatide、cathepsin K inhibits 等,但缺乏疗效和相应副作用的发生阻碍了其在骨质疏松治疗中的应用[5-6]。
氧化应激和自由基的产生与许多慢性疾病有关。人们提出了许多理论来解释衰老过程的本质,如自由基理论、基因组突变和有毒代谢物的积累、糖化作用下大分子的交联等。其中氧化应激理论被广泛研究,其中包括超氧阴离子(O2-)、过氧化氢(HO-)和光自由基在内的活性氧(reactive oxygen species,ROS)的产生,可以引发线粒体功能障碍和细胞损伤,从而导致细胞衰老[7]。白藜芦醇(3,4,5-三羟基二苯乙烯)是一种天然多酚,存在于红葡萄、花生、浆果、石榴等[8-9]中,因其具有还原性的酚羟基而在抗氧化、抗癌和抗衰老领域引起了广泛的关注[10-13]。白藜芦醇是蛋白质去乙酰化酶 sirtuin1(Sirt1)的激活剂,Sirt1 通过过氧化物酶体增殖物激活受体 γ 辅激活剂-1(peroxisome proliferator-activated receptor γ coactivator-1,Pgc-1)在营养控制下通过代谢调节衰老[14-16]。因此,本研究通过过氧化氢(H2O2)刺激建立小鼠胚胎成骨细胞前体(MC3T3-E1)细胞诱导的成骨细胞衰老模型,检测细胞活性、β-半乳糖苷酶染色、碱性磷酸酶(alkaline phosphatase,ALP)和 Col1、Runx2、Ocn mRNA 变化。观察白藜芦醇对 H2O2诱导的衰老成骨细胞增殖分化的影响,探讨相关机制,为骨质疏松症的治疗提供一定的理论依据。
1 材料和方法
1.1 材料
小鼠 MC3T3-E1 细胞购于武汉普诺赛生命科技有限公司;白藜芦醇购于美国 Sigma 公司;α-MEM 培养基购于美国 Hyclone 公司;胎牛血清和胰酶购于美国 Gibco公司;青霉素-链霉素-两性霉素 B 混合溶液(100 ×)购于北京索莱宝科技有限公司;CCK8 购于日本同仁公司;BCA 蛋白测定试剂盒购于美国 Thermo Fisher Scientific 公司;ALP/AKP 测定试剂盒购于南京建成生物工程研究所;细胞衰老特异性 β-半乳糖苷酶染色原位染色试剂盒购于杰美基因医药科技有限公司;cDNA 反转录试剂盒、RT-qPCR 试剂盒购于日本 Takara 公司;H2O2购于北京化工厂;二氧化碳培养箱购于美国 Thermo Fisher Scientific 公司;多功能酶标仪购于德国 Molecular Devices 公司;荧光显微镜购于日本奥林巴斯公司;RT-qPCR 检测仪器购于 Applied Biosystems 公司。
1.2 方法
1.2.1 白藜芦醇配制 白藜芦醇用二甲基亚砜溶解,完全培养基(含体积分数 10% 胎牛血清)配制所需浓度。
1.2.2 MC3T3-E1 培养 MC3T3-E1 细胞在37 ℃和 5% CO2条件下培养,使用含 5% FBS 的 α-MEM 培养液(100 U/ml 青霉素 G 和100 μg/ml 链霉素)进行培养。用含有 10 mmol/L β-甘油磷酸钠和 50 mg/L 抗坏血酸的培养基诱导分化。细胞密度达到 90% 左右后,用含有不同浓度白藜芦醇(0.1、1 和 10 μmol/L)的培养基处理细胞24 h,然后用 H2O2(最终浓度为 100 μmol/L)处理 2 h。
1.2.3 CCK8 检测不同浓度 H2O2或白藜芦醇处理 MC3T3-E1 细胞的细胞活性 MC3T3-E1 细胞以 1 × 105个/孔的密度种于 96 孔培养板上,细胞孵育过夜。移去培养基,为检测不同浓度 H2O2对MC3T3-E1 细胞的细胞活性,加入 0.2、2、20 和100 μmol/L 的 H2O2孵育 2 h 后换成普通培养基培养 24 h。为检测不同浓度白藜芦醇对 MC3T3-E1 细胞的细胞活性,0.1、1 和 10 μmol/L 的白藜芦醇孵育 3 d,处理结束时,每孔加入 10 μl CCK8 溶液,37 ℃孵育 3 h,在酶标仪 570 nm 处测定细胞的值,数据用与对照组值的比值(%)表示。
1.2.4 衰老标志物 β-半乳糖苷酶染色活性检测 去除培养板中培养基,每孔加入 1 ml 清理液,清洗细胞表面;每孔加入 1 ml 固定液,室温孵育5 min;每孔加入 1 ml 酸性液,重复使用酸性液清洗一次;之后每孔加入 800 μl 预热染色工作液,37 ℃孵育过夜,显微镜下观察并计数。
1.2.5 ALP 活性检测 MC3T3-E1 细胞的总 ALP 活性使用 ALP 活性测定试剂盒,根据说明书进行实验。MC3T3-E1 细胞成骨诱导培养基诱导7 d 后,预冷 PBS 洗 3 次,加入细胞裂解液冰上裂解 15 min,4 ℃ 12 000 r/min 离心 10 min,收集上清后,MC3T3-E1 细胞 ALP 活性以 U/g 蛋白表达,蛋白含量采用 BCA 蛋白测定试剂盒测定。
1.2.6 RT-qPCR 成骨相关基因的表达 将 MC3T3-E1 细胞在细胞密度为 2 × 105个/ml 的分化培养基中培养 14 d。之后,用 PBS 洗涤细胞2 次,提取总 RNA,并使用反转录试剂盒反转录成互补 DNA。用 SYBR Premix Ex TaqII 检测 Col1、Runx2 和 Ocn,基于 β-actin 归一化。引物序列如表1 所示。

表1 基因引物序列
1.3 统计学处理


图1 H2O2诱导 MC3T3-E1 细胞衰老的适宜浓度(A:不同浓度 H2O2对细胞活力的分析;B:不同浓度 H2O2处理细胞衰老相关β-半乳糖苷酶染色)
Figure 1 The optimal concentration of H2O2induced MC3T3-E1 cell senescence (A: The analysis of cell viability with different concentration of H2O2; B: Cell senescence related β-galactosidase staining was treated with different concentrations of H2O2)
2 结果
2.1 筛选 H2O2诱导 MC3T3-E1 衰老的合适条件
通过检测 MC3T3-E1 的细胞存活率和 β-半乳糖苷酶活性来筛选诱导 MC3T3-E1 细胞衰老的合适条件。结果显示,随着 H2O2浓度的增加,MC3T3-E1 细胞活性降低,当 H2O2浓度≤ 100 μmol/L 时,对细胞增殖基本上无影响,当 H2O2浓度达到 200 μmol/L 时,显著抑制 MC3T3-E1 的细胞活性,见图1A。β-半乳糖苷酶染色结果显示,β-半乳糖苷酶阳性率随着 H2O2浓度的增加而增加,H2O2浓度为 100 μmol/L 时阳性率最高,见图1B。因此,后续实验使用 100 μmol/L H2O2干预 MC3T3-E1 细胞 2 h 诱导 MC3T3-E1 细胞衰老模型。
2.2 不同浓度白藜芦醇对 MC3T3-E1 细胞增殖活性的影响
使用不同浓度白藜芦醇(0、0.1、1、10、100 μmol/L)处理 MC3T3-E1 细胞,采用 CCK8 检测白藜芦醇处理 3 d 的细胞活力。与无白藜芦醇处理组相比,10 和 100 μmol/L 白藜芦醇显著性抑制细胞增殖(< 0.01),见图2。根据以上实验结果,选择 0.1、1、10 μmol/L 浓度的白藜芦醇进行后续实验。
2.3 白藜芦醇对 MC3T3-E1 细胞成骨分化能力的影响
在成骨诱导 7 d 后,检测细胞 ALP 活性。与对照组相比,0.1 μmol/L 白藜芦醇促进ALP 活性,1 μmol/L 白藜芦醇对 ALP 活性没有影响,而10 μmol/L 白藜芦醇明显抑制 ALP 活性,见图3A。为研究白藜芦醇对衰老成骨细胞的影响,MC3T3-E1细胞成骨诱导 7 d 后,H2O2诱导成骨细胞衰老,检测白藜芦醇处理后 ALP 活性变化;结果显示,H2O2抑制成骨细胞 ALP 活性,而 0.1 μmol/L 白藜芦醇促进 H2O2抑制的 ALP 活性,见图3B。

图2 不同浓度白藜芦醇(0.1、1、10、100 μmol/L)对细胞活力的影响
Figure 2 Effect of resveratrol at different concentrations (0.1、1、10、100 μmol/L) on cell viability
2.4 不同浓度白藜芦醇对 H2O2处理后细胞成骨基因的影响
为了进一步在基因水平上评价成骨活性,采用 RT-qPCR 检测成骨诱导 14 d 后 Col1、Runx2 和 Ocn 的表达水平。与 H2O2处理组相比,0.1 μmol/L 白藜芦醇处理组中成骨基因 Col1、Runx2 和 Ocn 基因表达明显增加,见图4

图3 ALP 活性分析(A:不同浓度白藜芦醇对 ALP 活性分析,无白藜芦醇预处理细胞与不同浓度白藜芦醇预处理细胞差异有统计学意义,**P < 0.01;B:不同浓度白藜芦醇对 H2O2处理后细胞 ALP 活性分析,无H2O2处理细胞与H2O2处理细胞差异有统计学意义,**P < 0.01;白藜芦醇预处理的细胞与H2O2刺激的细胞差异有统计学意义,##P < 0.01)
Figure 3 ALP activity analysis (A: ALP activity analysis of resveratrol with different concentrations, the difference between non-resveratrol pretreated cells and resveratrol pretreated cells with different concentrations was statistically significant,**< 0.01; B: Analysis of ALP activity of cells treated with H2O2by resveratrol at different concentrations, the difference between H2O2-free and H2O2-treated cells was statistically significant,**< 0.01; and the difference between resveratrol-pretreated and H2O2-stimulated cells was statistically significant,##< 0.01)

图4 不同浓度白藜芦醇对 H2O2处理后对细胞成骨基因(A:Col1;B:Runx2;C:Ocn)的影响(*P < 0.01;##P < 0.01)
Figure 4 Effects of different concentrations of resveratrol on osteoblastic genes after H2O2treatment (A: mRNA expression of Col1; B: mRNA expression of Runx2; C: mRNA expression of Ocn) (*< 0.01;##< 0.01)
2.5 不同浓度白藜芦醇对 H2O2处理后细胞 β-半乳糖苷酶染色活性的影响
和对照组相比,加入 100 μmol/L H2O2后,H2O2组中β-半乳糖苷酶活性增强,与对照组相比,β-半乳糖苷酶阳性细胞(染色呈蓝色)增多,表明衰老 MC3T3-E1 细胞明显增加。分别用 0.1、1 和 10 μmol/L 白藜芦醇预处理 MCETE-E1 细胞后加入 H2O2刺激细胞,0.1 μmol/L 白藜芦醇处理组中β-半乳糖苷酶活性降低,表明衰老 MC3T3-E1 细胞减少,且不减少总体细胞数量,而1 μmol/L 和 10 μmol/L 白藜芦醇处理组β-半乳糖苷酶活性降低,但总体细胞数量减少。提示白藜芦醇逆转 H2O2诱导的细胞衰老,见图5。
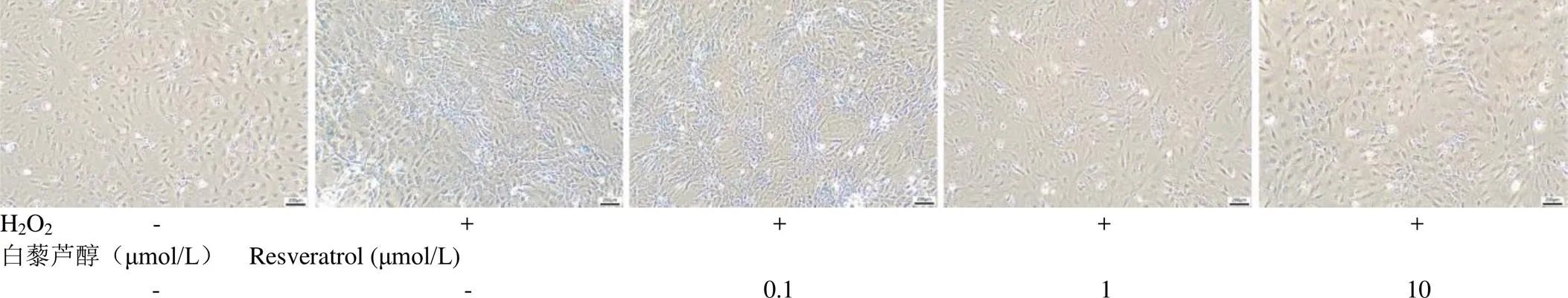
图5 不同浓度白藜芦醇对H2O2处理后细胞β-半乳糖苷酶染色变化
Figure 5 Changes in β-galactosidase staining in H2O2treated cells with different concentrations of resveratrol
3 讨论
细胞衰老与包括骨在内的组织老化密切相关[17]。骨稳态是通过骨形成和骨吸收之间的紧密平衡来维持的,但随着年龄的增长,这种平衡会被打破,导致与年龄相关的骨质疏松症,其中一个主要原因是成骨细胞功能障碍[18]。随着年龄的增长,骨组织中 ROS 的积累引起的氧化应激可加速成骨细胞的衰老和功能障碍[19]。大量研究表明,骨质疏松症是由衰老和雌激素缺乏引起的,氧化应激增加与骨质疏松症有关[20]。几乎所有的氧化应激源都能产生 H2O2,已经证明 H2O2在绝经后骨质疏松症中起着至关重要的作用[21]。成骨细胞衰老加剧导致成骨细胞年龄相关功能下降,同时细胞凋亡增加,成骨细胞分化受损[22]。过量 ROS 引起的氧化应激是细胞衰老的主要原因之一,可对骨稳态产生不利影响,包括抑制成骨细胞活性和增强破骨细胞活性,从而导致骨质减少[17]。本研究发现 H2O2浓度过高会导致 MC3T3-E1 细胞死亡率增高,细胞几乎全部死亡;≤ 100 μmol/L H2O2能够保证细胞存活率;MC3T3-E1 细胞经 100 μmol/L H2O2干预后衰老 β-相关半乳糖苷酶活性增加。
白藜芦醇在衰老相关疾病中起着重要作用,我们之前的研究表明白藜芦醇具有心血管保护作用[23],白藜芦醇作用于不同类型的细胞系后,表现出不同的药理和生物学特性。白藜芦醇被证明可以减弱与氧化损伤相关应激,并上调 foxO1 的转录活性。此外,有研究表明,使用高剂量的白藜芦醇会使大鼠骨量和骨骼强度增加[24]。尽管越来越多的研究支持白藜芦醇刺激成骨细胞分化,但白藜芦醇是否能阻止氧化应激诱导的骨衰老尚不清楚。本研究显示,白藜芦醇能够促进成骨细胞碱性磷酸酶活性。且可逆转 H2O2抑制的碱性磷酸酶活性和成骨基因的表达。表明白藜芦醇不仅促进成骨分化,还能逆转受损的成骨细胞分化。
综上所述,本研究显示,白藜芦醇对 H2O2诱导的成骨细胞衰老具有一定保护作用,并能对衰老的成骨细胞具有增殖分化的作用。
[1] Fang H, Deng Z. The mechanism of bone remodeling after bone aging. Clin Interv Aging, 2022, 17:405-415.
[2] Zhao Y, He J, Qiu T, et al. Epigenetic therapy targeting bone marrow mesenchymal stem cells for age-related bone diseases. Stem Cell Res Ther, 2022, 13(1):201.
[3] Pignatti C, D’adamo S, Stefanelli C, et al. Nutrients and pathways that regulate health span and life span. Geriatrics (Basel), 2020, 5(4):95.
[4] Cui Y, Guo Y, Kong L, et al. A bone-targeted engineered exosome platform delivering siRNA to treat osteoporosis. Bioact Mater, 2022, 10:207-221.
[5] Wang Y, Deng P, Liu Y, et al. Alpha-ketoglutarate ameliorates age-related osteoporosis via regulating histone methylations. Nat Commun, 2020, 11(1):5596.
[6] Barnsley J, Buckland G, Chan PE, et al. Pathophysiology and treatment of osteoporosis: challenges for clinical practice in older people. Aging Clin Exp Res, 2021, 33(4):759-773.
[7] Wang L, Chen Q, Zhuang S, et al. Effect of anoectochilus roxburghii flavonoids extract on H2O2-Induced oxidative stress in LO2cells and D-gal induced aging mice model. J Ethnopharmacol, 2020, 254: 112670.
[8] Farzaei MH, Rahimi R, Nikfar S, et al. Effect of resveratrol on cognitive and memory performance and mood: A meta-analysis of 225 patients. Pharmacol Res, 2018, 128:338-344.
[9] Zhang LX, Li CX, Kakar MU, et al. Resveratrol (RV): a pharmacological review and call for further research. Biomed Pharmacother, 2021, 143:112164.
[10] Sharifi-Rad J, Quispe C, Durazzo A, et al. Resveratrol biotechnological applications: enlightening its antimicrobial and antioxidant properties. J Herb Med, 2022, 32:100550.
[11] Tian B, Liu J. Resveratrol: a review of plant sources, synthesis, stability, modification and food application. J Sci Food Agr, 2020, 100(4):1392-1404.
[12] Dhalaria R, Verma R, Kumar D, et al. Bioactive compounds of edible fruits with their anti-aging properties: a comprehensive review to prolong human life. Antioxidants (Basel), 2020, 9(11):1123.
[13] Khattar S, Khan SA, Zaidi SA, et al. Resveratrol from dietary supplement to a drug candidate: an assessment of potential. Pharmaceuticals (Basel), 2022, 15(8):957.
[14] Guo YJ, Dong SY, Cui XX, et al. Resveratrol alleviates MPTP-induced motor impairments and pathological changes by autophagic degradation of α-synuclein via SIRT1-deacetylated LC3. Mol Nutr Food Res, 2016, 60(10):2161-2175.
[15] Suwa M, Nakano H, Radak Z, et al. Endurance exercise increases the SIRT1 and peroxisome proliferator-activated receptor γ coactivator-1α protein expressions in rat skeletal muscle. Metabolism, 2008, 57(7): 986-998.
[16] Zhao Y, Ling F, Griffin TM, et al. Up-regulation of the Sirtuin 1 (Sirt1) and peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α) genes in white adipose tissue of Id1 protein-deficient mice: implications in the protection against diet and age-induced glucose intolerance. J Biol Chem, 2014, 289(42):29112-29122.
[17] Kim HJ, Kim WJ, Shin HR, et al. ROS-induced PADI2 downregulation accelerates cellular senescence via the stimulation of SASP production and NFκB activation. Cell Mol Life Sci, 2022, 79(3): 155.
[18] Hadjidakis DJ, Androulakis II. Bone remodeling. Ann NY Acad Sci, 2006, 1092:385-396.
[19] Li X, Li B, Shi Y, et al. Targeting reactive oxygen species in stem cells for bone therapy. Drug Discov Today, 2021, 26(5):1226-1244.
[20] Marcucci G, Domazetovic V, Nediani C, et al. Oxidative stress and natural antioxidants in osteoporosis: Novel preventive and therapeutic approaches. Antioxidants (Basel), 2023, 12(2):373.
[21] Zhang JK, Yang L, Meng GL, et al. Protective effect of tetrahydroxystilbene glucoside against hydrogen peroxide-induced dysfunction and oxidative stress in osteoblastic MC3T3-E1 cells. Eur J Pharmacol, 2012, 689(1-3):31-37.
[22] Kassem M, Marie PJ. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging cell, 2011, 10(2):191-197.
[23] Xue Y, Chen H, Zhang S, et al. Resveratrol confers vascular protection by suppressing TLR4/Syk/NLRP3 signaling in oxidized low-density lipoprotein-activated platelets. Oxid Med Cell Longev, 2021, 2021: 8819231.
[24] Ornstrup MJ, Brüel A, Thomsen JS, et al. Long-term high-dose resveratrol supplementation reduces bone mass and fracture strength in rats. Calcif Tissue Int, 2018, 102(3):337-347.
Effect of resveratrol on proliferation, senescence and osteogenic differentiation of MC3T3-E1 cells stimulated by oxidative stress
XUE Yun, ZHANG Jing-shuang, ZHOU You, SHI Rui
Author Affiliation:Beijing Research Institute of Traumatology and Orthopaedics/ National Center for Orthopaedics / Beijing Jishuitan Hospital, Beijing 100035, China
To investigate the effect of resveratrol on the cell proliferation and osteogenic differentiation of senescent osteoblasts induced by H2O2.MC3T3-E1 cells were treated with different concentrations of H2O2, and cell proliferation activity was detected by CCK8 assay. The activity of senescence-associated β-galactosidase (SA-β-gal) was detected to determine the optimal concentration of H2O2to induce osteoblast senescence. The effects of resveratrol at different concentrations on cell proliferation activity were detected by CCK8 assay. Alkaline phosphatase (ALP) activity and the expression of osteogenic genes (Col1, Runx2, Ocn) were detected after osteoblasts were treated with different concentrations of resveratrol. H2O2-induced osteoblasts were treated with different concentrations of resveratrol and the activity of ALP and β-galactosidase were assessed.CCK8 assay showed that high concentration of H2O2(200 and 400 μmol/L) significantly inhibited cell proliferation (< 0.05). SA-β-gal staining showed that the number of senescent cells increased in 100 μmol/L H2O2treated group, and 100 μmol/L H2O2was used in subsequent senescence models. CCK8 results showed that 10 and 100 μmol/L resveratrol significantly inhibited cell proliferation. The results of ALP activity and SA-β-gal staining showed that 0.1 μmol/L resveratrol significantly increased the ALP activity and the number of senescent cells in normal and H2O2-induced senescent osteoblasts compared with the control group. RT-qPCR results showed that the expressions of Col1, Runx2 and Ocn mRNA were significantly higher in 0.1 μmol/L resveratrol + H2O2group compared with that in the H2O2treatment group (< 0.01).An optimal concentration of resveratrol could improve the osteogenic differentiation ability of senescent osteoblasts induced by H2O2.
resveratrol; cell viability; senescence; osteogenic differentiation
SHI Rui, Email: sharell@126.com
10.3969/j.issn.1673-713X.2023.05.004
国家自然科学基金面上项目(82072406);北京市卫生健康委改革与发展专项(BJRITO-RDP-2023);北京积水潭医院院级科研基金(ZR-202106)
石锐,Email:sharell@126.com
2023-05-31
