NaI/TBHP催化氧化芳基磺酰肼与取代苯乙炔合成炔基砜
2023-10-13陈碧海王知情江国防
陈碧海,王知情,江国防
(1. 湖南南岭民用爆破器材股份有限公司,湖南 长沙,410013;2. 湖南大学 化学化工学院,湖南 长沙,410082)
砜基是许多药物的关键结构部分,许多临床药物中含有磺酰基。将磺酰基(如抑制细菌生长和繁殖的磺胺嘧啶[1]、治疗风湿性关节炎药物塞来昔布[2]、治疗心律失常药物多菲利特[3]、利尿剂托拉塞米[4]、抗糖尿病药物格列美脲[5]、抗痛风药物丙磺舒[6])引入药物分子中能够明显改善药物分子的生物活性以及代谢动力学特性,产生更强的药理活性。近年来,芳基磺酰肼主要是作为芳基[7-16]、砜基[17-26]和巯基[27-36]提供者参与反应。在磺酰肼参与的反应中,研究者对磺酰肼作为砜基来源参与磺酰化反应的研究较多。磺酰肼在叔丁基过氧化氢(TBHP)、过氧化氢(H2O2)和碘化物、铜盐或铁盐存在时被广泛用作磺酰自由基。磺酰肼作为磺酰自由基的重要来源具有不腐蚀、无气味、与水相容性好、合成方便等优点。为此,在NaI/TBHP催化氧化体系下,以芳基磺酰肼为磺酰基自由基前体,对取代苯乙炔进行磺酰化反应生成炔基砜,这为炔基砜的合成提供了新的方法和策略。
1 实验
1.1 条件优化
取0.7 mmol 对甲基苯磺酰肼1a、0.5 mmol 的苯乙炔2a、2.0 mmol 的叔丁基过氧化氢、4.0 mL无水乙醇作为催化剂,在80 ℃搅拌反应8 h,探究催化剂的种类对该反应的影响,结果如表1 所示。从表1可见:加入碘化钠1.0 mmol时,反应得到的目标产物的产率最高(系列1);用0.25 mmol碘作催化剂时,目标产物的产率很低(系列2);当催化剂为1.0 mmol 碘化铵或碘化钾或四丁基碘化铵时,目标产物的产率都有所下降(系列3~5);当催化剂为1.0 mmol碘化亚铜时,产物收率为0(系列6)。最终确定用碘化钠为反应的催化剂,用量为1.0 mmol。

表1 条件优化Table 1 Condition optimization
1.1.1 氧化剂种类对于反应产率的影响
加入2.0 mmol 叔丁基过氧化氢时,反应产率最高,为68%(系列1);当加入1.25 mmol 二叔丁基过氧化物或过氧化氢时(系列7 和系列8),反应产率都明显下降;以过硫酸钾或醋酸碘苯作为氧化剂时,产物收率为0(系列9 和系列10)。基于以上结果,确定叔丁基过氧化氢为氧化剂,用量为2.0 mmol。
对反应溶剂进行筛选,发现当以乙醇为反应溶剂时,得到的产率最高。
1.1.2 对反应温度的筛选
在室温条件下,反应无法进行(系列19);当反应温度为60 ℃时,产率降低(系列18);当反应温度为80 ℃时,产率最大,为68%(系列1);当反应温度为100 ℃时,产率有所下降(系列17)。所以,确定反应温度为80 ℃。
当催化剂碘化钠用量依次为0.75、0.50、0.25和0 mmol时,反应的产率也依次降低(系列20~23);当碘化钠的量为1.0 mmol 时,产率最大,为68%(系列1)。所以,确定碘化钠的用量为1.0 mmol。
1.1.3 对氧化剂叔丁基过氧化氢的用量筛选
当叔丁基过氧化氢的量为2.0 mmol 时,反应的产率达到最大(系列1);当叔丁基过氧化氢的量增至2.5 mmol 时,反应的产率并没有增加(系列24);当叔丁基过氧化氢的量分别为1.50、1.25、1.00和0 mmol时,反应产率逐渐下降(系列25~28)。为此,确定叔丁基过氧化氢的用量为2.0 mmol。
将原料1a的量依次降低为0.6 mmol和0.5 mmol时,反应的产率也逐渐降低(系列29和系列30);当1a的量为0.7 mmol时,反应的产率最大,为68%,所以,确定原料1a的量为0.7 mmol。
1.2 底物的扩展
以对甲苯磺酰肼为反应底物,探究带不同取代基的苯乙炔对该反应的影响,结果如表2所示。
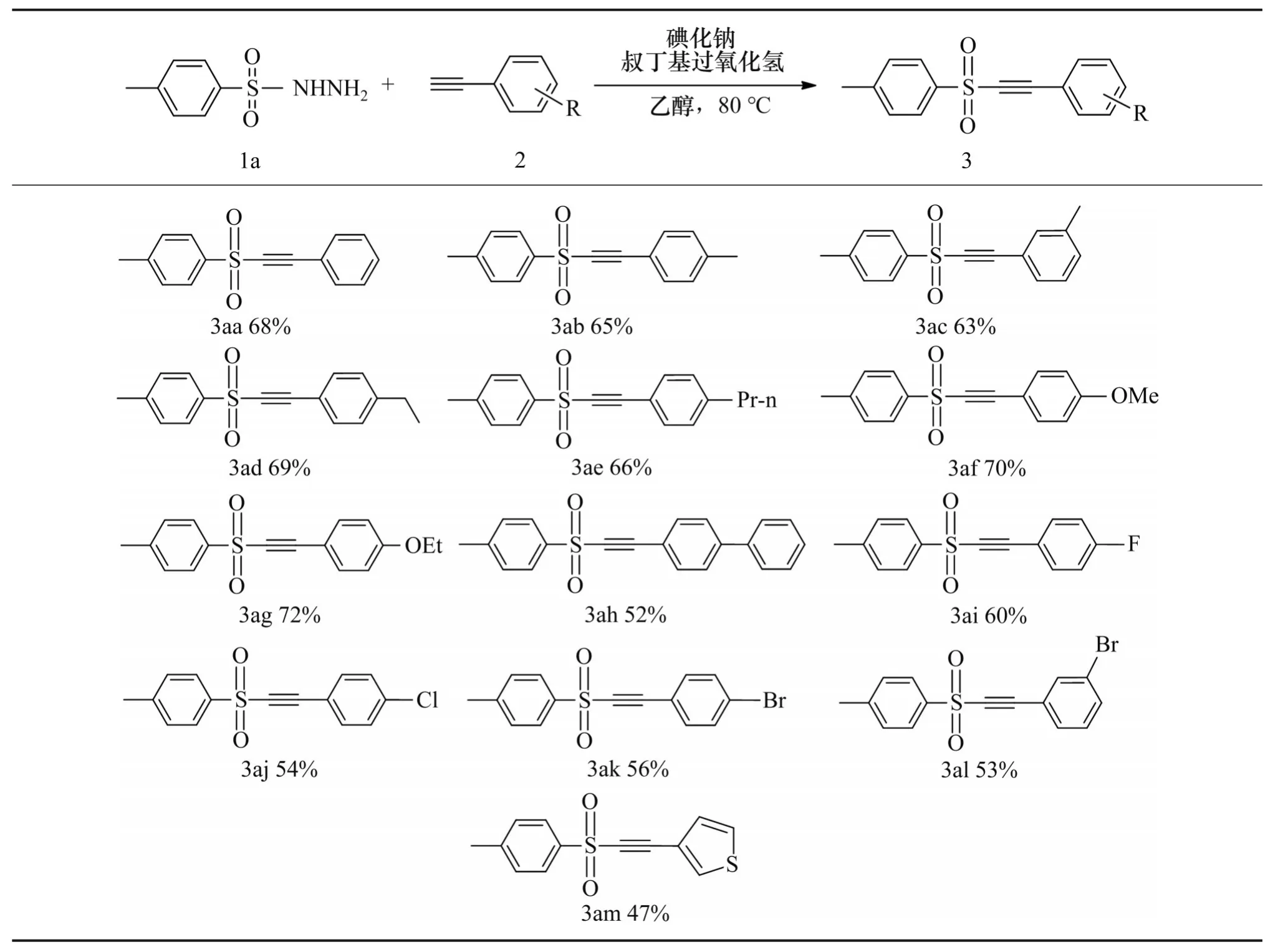
表2 对甲基苯磺酰肼与取代苯乙炔反应的底物拓展Table 2 Substrate expansion of the reaction between methylbenzenesulfonyl hydrazine and substituted phenylacetylene compoundst
从表2可见:带有各种取代基团的苯乙炔类底物2 都能与对甲基苯磺酰肼1a 反应,得到的炔基砜类化合物的产率为中等或较高;取代苯乙炔底物在苯环的对位、间位或邻位上有不同的基团,如供电子基团(Me、Et、n-Pr、OMe、OEt、Ph)和吸电子基团(F、Cl、Br),这些基团的取代苯乙炔都具有良好的耐受性。在标准条件下,产物3aa-3am 的分离产率为47%~72%,表明该反应不存在明显的电子和空间效应;3-乙基噻吩2m 也适用于这个反应体系,产物3am的产率为47%。然而,当使用环丙乙炔或1-辛炔或1-庚炔与对甲基苯磺酰肼1a 反应时,无法得到目标产物,说明脂肪族的末端炔烃不适用于该反应。
以苯乙炔为反应底物,探究不同取代基取代的苯磺酰肼对该反应的影响,其结果如表3所示。

表3 取代苯磺酰肼类化合物与苯乙炔反应的底物拓展Table 3 Substrate expansion of the reaction between substituted benzenesulfonyl hydrazine compounds and phenylacetylene
给电子取代基(Me、OMe、t-Bu)和吸电子取代基(F、Cl、Br)的芳基磺酰肼对苯乙炔的磺酰化反应均有良好的耐受性,能顺利生成相应的炔基砜,产率为55%~68%,表明该反应不存在明显的电子效应。然而,丙基磺酰肼与苯乙炔不能反应得到目标化合物,说明脂肪族的磺酰肼无法适用于该反应。
1.3 芳基磺酰肼与取代苯乙炔的放大实验
对优化条件下的该反应进行等比例放大实验,芳基磺酰肼与取代苯乙炔的放大反应如图1 所示。采用7.0 mmol对甲苯磺酰肼1a、5.0 mmol苯乙炔、10.0 mmol NaI、20.0 mmol 叔丁基过氧化氢、40.0 mL乙醇在80 ℃时反应8 h。最终得到产物3aa产率为63%。实验结果表明,该反应可以在标准反应条件下进行放大,证明了该反应的实用性和合成价值。

图1 芳基磺酰肼与取代苯乙炔的放大反应Fig. 1 Scaled up reaction of arylsulfonyl hydrazide with substituted phenylacetylene
1.4 反应机理研究
为了探索该反应的历程,进行了一系列验证实验,所得实验结果如下。
加入1.0 mmol 自由基捕捉剂2, 2, 6, 6-四甲基哌啶氧化物或2, 6-二叔丁基-4-甲基苯酚,在标准条件下,反应无法进行,说明该反应是自由基机理。
在标准条件下,当对甲苯磺酰肼1a 与对甲苯乙炔2b 反应1~7 h 时,检测到目标产物主要是(E)-β-碘代烯基砜4aa,而3ab 非常少,如图2所示。

图2 对照实验Fig. 2 Control test
反应1~12 h时,(E)-β-碘代烯基砜4aa与目标产物3ab 的产率的变化关系如图3 所示。从图3 可见:随着反应时间增加,4aa 的产率不断减少,3ab 的产率不断增加;反应8 h 时,3ab 的产率最大,说明(E)-β-碘代烯基砜4aa 是该反应的中间产物。
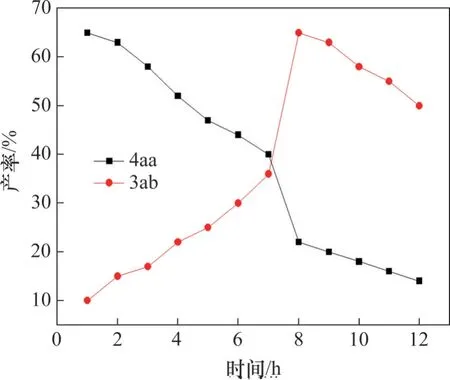
图3 产率与反应时间的关系Fig. 3 Relationship between yield and reaction time
结合文献[37-38]报道和实验结果,得出芳基磺酰肼与末端炔烃反应可能的机理如图4所示。从图4可见:叔丁基过氧化氢在碘离子的作用下分解成叔丁氧基自由基和氢氧根离子,而碘离子被氧化生成碘单质;碘单质将过氧叔丁基负离子氧化成过氧叔丁基自由基,在叔丁氧自由基或过氧叔丁基自由基的作用下,磺酰肼脱掉肼基,产生氮气和水,得到磺酰基自由基,磺酰基自由基与芳基乙炔2进行自由基加成得到烯基自由基,然后夺取碘自由基,生成(E)-β-碘代烯基砜4。在氢氧负离子的作用下,(E)-β-碘代烯基砜4 脱掉碘化氢得到炔基砜5。

图4 芳基磺酰肼与末端炔烃反应可能的机理Fig. 4 Possible mechanism of the reaction between arylsulfonyl hydrazine and terminal alkynes
2 产物数据表征
1) 1-甲基-4-((苯乙炔基)磺酰基)苯(3aa):淡黄色固体,产率为68%,熔点为84~85 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.88(双峰,J=7.7 Hz,2H),7.43(双峰,J=7.8 Hz,2H),7.38(三重峰,J=7.3 Hz,1H),7.30(多重峰,J=14.5,7.5 Hz,4H),2.39(单峰,3H)。
13C NMR(101 MHz,CDCl3):化学位移δ分别为145.4、 139.0、 132.7、 131.5、 130.0、 128.7、127.5、118.0、93.0、85.6和21.8。
MS:C15H12NaO2S[M+Na]+质谱相对分子质量为279.1,在相对分子质量为278.9处存在实际峰。
2) 1-甲基-4-(对甲苯乙炔基)磺酰基)苯(3ab):白色固体,产率为65%,熔点为105~106 ℃。
1H NMR (400 MHz, CDCl3):化学位移δ分别为7.95 (双峰,J=7.8 Hz,2H),7.38(三重峰,J=7.5 Hz,4H),7.16(双峰,J=7.8 Hz,2H),2.45(单峰,3H),2.36(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.1、 142.2、 138.9、 132.5、 129.8、 129.3、127.2、114.6、93.5、85.0、21.6和21.5。
MS:C16H14NaO2S [M+Na]+质谱相对分子质量为293.1,在相对分子质量为292.9处存在实际峰。
3) 1-甲基-3-[2-[(4-甲基苯基)磺酰基]乙炔基]苯(3ac):白色固体,产率为63%,熔点为79~80 ℃。
1H NMR (400 MHz, CDCl3):化学位移δ分别为8.00(双峰,J=8.1 Hz,2H),7.43(双峰,J=8.0 Hz,2H),7.35(双峰,J=5.9 Hz,2H),7.30(三重峰,J=7.3 Hz,2H),2.50(单峰,3H)和2.35(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.1、 138.8、 138.4、 132.9、 132.2、 129.8、129.6、128.4、127.2、117.5、93.2、85.1、21.5和20.9。
MS:C16H14NaO2S[M+Na]+质谱相对分子质量为293.1,在相对分子质量为292.9处存在实际峰。
4) 1-甲基-4-(对乙基乙炔基)磺酰基)苯(3ad):黄色固体,产率为69%,熔点为85~89 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.87(双峰,J=7.7 Hz,2H),7.34(双峰,J=7.8 Hz,2H),7.29(双峰,J=7.8 Hz,2H),7.10(双峰,J=7.7 Hz,2H),2.57(四重峰,J=7.6 Hz,2H),2.37(单峰,3H)和1.12(三重峰,J=7.6 Hz,3H)。
13C NMR(101 MHz,CDCl3):化学位移δ分别为148.5、 145.3、 139.1、 132.8、 130.0、 128.3、127.4、115.0、93.8、85.2、29.0、21.7和15.1。
MS:C17H16NaO2S [M+Na]+质谱相对分子质量为307.1,在相对分子质量为306.9 处相存在实际峰。
5) 1-甲基-4-(((4-丙基苯基)乙炔基)磺酰基)苯(3ae):浅黄色固体,产率为66%,熔点为64~65 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.87(双峰,J=7.8 Hz,2H),7.33(双峰,J=7.7 Hz,2H),7.29(双峰,J=7.8 Hz,2H),7.08(双峰,J=7.8 Hz,2H),2.50(三重峰,J=7.6 Hz,2H),2.37(单峰,3H),1.58~1.47(多重峰,2H)和0.82(三重峰,J=7.2 Hz,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为146.8、 145.1、 139.0、 132.5、 129.8、 128.7、127.2、 114.8、 93.6、 85.0、 37.9、 23.9、 21.5和13.5。
MS:C18H18NaO2S [M+Na]+质谱相对分子质量为321.1,在相对分子质量为320.9处存在实际峰。
6) 1-甲氧基-4-(甲苯基乙炔基)苯(3af):浅黄色固体,产率为70%,熔点为74~75 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.87(双峰,J=7.8 Hz,2H),7.38(双峰,J=8.1 Hz,2H),7.30(双峰,J=7.8 Hz,2H),6.78(双峰,J=8.1 Hz,2H),3.74(单峰,3H),2.38(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为162.0、 145.0、 139.1、 134.5、 129.8、 127.2、114.3、109.5、94.0、84.7、55.3和21.6。
MS:C16H14NaO3S[M+Na]+质谱相对分子质量为309.1,在相对分子质量为302.9处存在实际峰。
7) 1-乙氧基-4-(甲苯乙炔基)苯(3ag):淡黄色固体,产率为72%,熔点为77~78 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.94(双峰,J=7.8 Hz,2H),7.45(三重峰,J=10.0 Hz, 2H), 7.37( 双峰,J=7.8 Hz, 2H),6.84(双峰,J=8.1 Hz,2H),4.04(四重峰,J=6.8 Hz,2H),2.45(单峰,3H),1.41(三重峰,J=6.9 Hz,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为161.4、 145.0、 139.1、 134.5、 129.8、 127.2、114.7、94.2、84.7、63.7、21.6和14.5。
MS:C17H16NaO3S[M+Na]+质谱相对分子质量为323.1,在相对分子质量为324.8处存在实际峰。
8) 1-甲基-4-(对苯乙炔基)磺酰基)苯(3ah):淡黄色固体,产率为52%,熔点为119.9~121.3 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.90 (双峰,J=7.6 Hz,2H),7.50(双峰,J=12.0 Hz,6H),7.40~7.30(多重峰,5H),2.40(单峰,3H)。
13C NMR (101MHz,CDCl3):化学位移δ分别为145.3、 144.1、 139.3、 138.8、 133.1、 129.9、128.9、127.4、127.2、127.0、116.5、93.0、86.0和21.6。
MS:C21H16NaO2S[M+Na]+质谱相对分子质量为332.1,在相对分子质量为332.8处存在实际峰。
9) 1-氟-4-(甲苯乙炔基)苯(3ai):浅黄色固体,产率为60%,熔点为86~87 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.95 (双峰,J=8.2 Hz,2H),7.52(dd峰,J=8.6,5.3 Hz,2H),7.39(双峰,J=8.1 Hz,2H),7.06(三重峰,J=8.6 Hz,2H),2.47(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为165.5、162.94、145.4、138.7、135.0(双峰,J=9.0 Hz)、129.9、127.4、116.3、116.1、91.7、85.5和21.6。
19F NMR(376 MHz,CDCl3):化学位移δ为-104.6~-104.9(多重峰,1F)。
MS:C15H11FNaO2S[M+Na]+质谱相对分子质量为274.1,在相对分子质量为273.8处存在实际峰。
10) 1-氯-4-(甲苯乙炔基)苯(3aj):白色固体,产率为54%,熔点为98~99 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.94(双峰,J=7.7 Hz,2H),7.44 (双峰,J=7.8 Hz,2H),7.39(双峰,J=7.7 Hz,2H),7.34(双峰,J=7.7 Hz,2H),2.46(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.4、 138.5、 137.8、 133.7、 129.9、 129.0、127.4、116.3、91.4、86.3和21.6。
MS:C15H11ClNaO2S[M+Na]+质谱相对分子质量为290.1,在相对分子质量为289.7 处存在实际峰。
11) 1-溴-4-(甲苯乙炔基)苯(3ak):白色固体,产率为56%,熔点为113~114 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.94(双峰,J=8.3 Hz,2H),7.50(双峰,J=8.5 Hz,2H),7.39(双峰,J=8.4 Hz,2H),7.36(双峰,J=8.5 Hz,2H)和2.46(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.4、 138.5、 133.8、 132.0、 129.9、 127.4、126.3、116.8、91.4、86.4和21.6。
MS:C15H11BrNaO2S[M+Na]+质谱相对分子质量为359.0,在相对分子质量为360.7 处存在实际峰。
12) 1-甲基-3-((溴乙炔基)磺酰基)苯(3am):白色固体,产率为53%,熔点为125~126 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.87(双峰,J=7.6 Hz,2H),7.56(单峰,1H),7.51(双峰,J=7.9 Hz,1H),7.37(双峰,J=7.6 Hz,1H),7.32(双峰,J=7.7 Hz,2H),7.17(三重峰,J=8.0 Hz,1H),2.40(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.5、138.4、135.0、134.5、131.1、130.0(双峰,J=5.4 Hz)、127.5、122.3、119.8、90.5、86.4和21.6。
MS:C15H11BrNaO2S[M+Na]+质谱相对分子质量为334.3,在相对分子质量为333.7 处存在实际峰。
13) 3-(甲苯乙炔基)噻吩(3an):棕色固体,产率为47%,熔点为74.2~75.3 ℃。
1H NMR(400 MHz,CDCl3):化学位移δ分别为7.94(双峰,J=7.8 Hz,2H),7.74(单峰,1H),7.38(双峰,J=7.8 Hz,2H),7.32(单峰,1H),7.17(双峰,J=4.8 Hz,1H),2.46(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为145.2、 138.8、 134.4、 129.9、 129.6、 127.4、126.4、117.1、88.5、85.4和21.62。
MS:C13H10NaO2S2[M+Na]+质谱相对分子质量为261.9,在相对分子质量为262.3处存在实际峰。
14) (苯磺酰基)苯乙炔(3ba):淡黄色固体,产率为65%,熔点为55.4~55.1 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为8.08 (双峰,J=7.8 Hz,2H),7.69(三重峰,J=7.3 Hz,1H),7.60(三重峰,J=7.5 Hz,2H),7.52(双峰,J=7.7 Hz,2H),7.47(三重峰,J=7.5 Hz,1H),7.37(三重峰,J=7.5 Hz,2H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为 141.62、 134.05、 132.60、 131.45、 129.25、128.55、127.25、117.68、93.36和85.16。
MS:C14H10NaO2S[M+Na]+质谱相对分子质量为265.0,在相对分子质量为264.9处存在实际峰。
15) 1-甲基-2-[(2-苯基乙炔基)磺酰基]苯(3bb):淡黄色固体,产率为65%,熔点为65.3~68.7 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为8.13(双峰,J=7.9 Hz,1H),7.55(三重峰,J=8.3 Hz,3H),7.48(三重峰,J=7.5 Hz,1H),7.39(dd 峰,J=16.0,8.4 Hz,4H),2.83(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为139.6、 138.3、 134.0、 132.7、 132.6、 31.4、128.6、126.4、117.8、91.8、85.0和20.0。
MS:C15H12NaO2S[M+Na]+质谱相对分子质量为256.1,在相对分子质量为255.8处存在实际峰。
16) 1-甲氧基-4-[(2-苯基乙炔基)磺酰基]苯(3bc):白色固体,产率为68%,熔点为77~78 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.91(双峰,J=8.4 Hz,2H),7.41(双峰,J=7.6 Hz,2H),7.37(三重峰,J=7.6 Hz,1H),7.26(三重峰,J=7.5 Hz,2H),6.96(双峰,J=8.4 Hz,2H),3.80(单峰,3H)。
13C NMR(101 MHz,CDCl3):化学位移δ分别为164.0、 133.1、 132.5、 131.2、 129.6、 128.5、117.82、114.4、92.3、85.6和55.6。
MS:C15H12NaO3S[M+Na]+质谱相对分子质量为295.1,在相对分子质量为294.9处存在实际峰。
17) 1-(1,1-二甲基乙基)-4-[(2-苯基乙炔基)磺酰基]苯 (3bd):淡黄色固体,产率为63%,熔点为83~87 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.91(双峰,J=8.2 Hz,2H),7.52(双峰,J=8.2 Hz,2H),7.45(三重峰,J=8.7 Hz,2H),7.38(三重峰,J=7.5 Hz,1H),7.28(三重峰,J=7.4 Hz,2H),1.27(单峰,9H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为158.1、 138.6、 132.6、 131.3、 128.5、 127.1、126.3、117.8、92.8、85.4、35.2和30.9。
MS:C18H18NaO2S[M+Na]+质谱相对分子质量为298.1,在相对分子质量为297.9处存在实际峰。
18) 1-氟-4-[(2-苯基乙炔基)磺酰基]苯(3be):白色固体,产率为55%,熔点为78~79 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为8.13(dd 峰,J=7.8,5.5 Hz,2H),7.55(双峰,J= 7.7 Hz,2H),7.50(双峰,J=7.3 Hz,1H),7.40(三重峰,J=7.6 Hz,2H),7.30(三重峰,J=8.2 Hz,2H)。
13C NMR(101 MHz,CDCl3):化学位移δ分别为 167.22、 164.66、 137.81、 132.64、 131.56、130.31(双峰,J=9.8 Hz)、128.61、117.60、116.74、116.51、93.57、85.09、77.22和76.58。
19F NMR (376 MHz,CDCl3):化学位移δ分别为-102.23(dd峰,J=7.6,3.3 Hz)。
MS:C14H9NaFO2S [M+Na]+质谱相对分子质量为259.9,在相对分子质量为259.7处存在实际峰。
19) 1-溴-4-[(2-苯基乙炔基)磺酰基]苯(3bf):白色固体,产率为57%。熔点为107~108 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.94(双峰,J=8.4 Hz,2H),7.74(双峰,J=8.4 Hz,2H),7.53(双峰,J= 7.3 Hz,2H),7.48(双峰,J=7.4 Hz,1H),7.38(三重峰,J=7.5 Hz,2H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为140.7、132.7、132.6、131.64、129.48、128.85、128.63、117.53、93.95和84.91。
MS:C14H9BrNaO2S[M+Na]+质谱相对分子质量为345.0;在相对分子质量为344.7 处存在实际峰。
20) 1, 3, 5-三甲基-2-[(2-苯基乙炔基)磺酰基]苯(3bj):黄色固体,产率为63%,熔点为115~117 ℃。
1H NMR (400 MHz,CDCl3):化学位移δ分别为7.52(双峰,J=7.5 Hz,2H),7.46(三重峰,J=7.4 Hz,1H),7.37(三重峰,J=7.5 Hz,2H),7.00(单峰,2H),2.78(单峰,6H),2.33(单峰,3H)。
13C NMR (101 MHz,CDCl3):化学位移δ分别为143.8、 139.7、 135.5、 132.5、 132.0、 131.1、128.5、118.0、90.5、86.3、22.3和20.9。
MS:C17H16NaO2S [M+Na]+质谱相对分子质量为284.1,在相对分子质量为283.8处存在实际峰。
3 结论
1) 以芳基磺酰肼和取代苯乙炔为反应底物,在NaI/TBHP构成的催化氧化体系下,芳基磺酰肼形成磺酰基自由基,对取代苯乙炔进行磺酰化反应,获得最优的反应条件。该反应对芳基磺酰肼和取代苯乙炔有良好的耐受性,但脂肪族的磺酰肼与脂肪族末端炔烃无法进行反应。
2) 该反应的可能机理是一个自由基加成-消除反应。该反应可一步合成炔基砜,具有环境友好、副产物少、操作方便等优点。
