调节miR-27b-3p和Nrf2对人RPE细胞代谢记忆形成的抑制作用
2023-10-11赖巧玲谢婷黄焱
赖巧玲 谢婷 黄焱
福建医科大学医学技术与工程学院眼视光学系,福州 350004
谢婷现在福建医科大学附属第一医院,福州 350004
对于长期血糖控制欠佳的糖尿病视网膜病变(diabetic retinopathy,DR)患者,即使后期严格控制血糖,既往高血糖对视网膜的损伤仍可持续进展,即存在代谢记忆现象[1]。可见高血糖及其代谢产物所致的代谢记忆现象可继续损伤视网膜并抑制其自我修复能力,这可能是DR持续进展的原因之一。核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)及其靶基因血红素加氧酶-1(heme oxygenase-1,HO-1)、醌氧化还原酶1(NAD(P)H dehydrogenase[quinone]1,NQO1)是体内强抗氧化因子[2]。研究发现,DR发展过程中随着高血糖及其代谢产物的刺激可能会破坏Nrf2信号转导功能,而保护Nrf2可恢复并改善视网膜色素上皮(retinal pigment epithelium,RPE)细胞、血管内皮细胞、神经节细胞的正常生理功能[3-5]。另有研究发现,Nrf2是微小RNA-27b-3p(microRNA-27b-3p,miR-27b-3p)的下游靶基因[6],后者不仅与DR的发生和发展相关,还参与糖脂代谢、调节葡萄糖耐量及胰岛素敏感性[7-9]。在糖尿病小鼠模型中发现利拉鲁肽可促进Nrf2及下游靶基因表达增加,可能对Nrf2起到激活和保护作用[10]。因此,推测利拉鲁肽可能通过调节miR-27b-3p/Nrf2减轻代谢记忆损伤。本研究拟探讨miR-27b-3p/Nrf2对人RPE细胞代谢记忆损伤的影响及其调控机制。
1 材料与方法
1.1 材料
1.1.1细胞来源 人RPE细胞系ARPE-19购自上海翼和应用生物技术有限公司。
1.1.2主要试剂及仪器 青-链霉素(美国HyClone公司);DMEM培养基(美国Gibco公司);蛋白Marker(美国Thermo公司);胎牛血清、0.25%胰蛋白酶(德国PAN公司);D-葡萄糖、BSA粉剂(美国Sigma公司);Bluge-LooPTMmiRNA qRT-PCR Starter Kit、miR-27b-3p/U6引物(广东锐博生物科技有限公司);TB GreenTMPremix Ex TaqTM、PrimeScriPtTMRT Reagent Kit with gDNA(日本TaKaRa公司);Nrf2、NQO1、HO-1、β-actin PCR扩增引物,兔抗人β-actin多克隆抗体(上海生工生物工程股份有限公司);慢病毒载体miR-27b-3p抑制剂(上海吉凯基因化学技术有限公司);RIPA蛋白裂解液、Trizol细胞裂解液、SDS-PAGE凝胶试剂盒、脱脂奶粉、HRP标记的羊抗兔二抗(EM-35111-01)、HRP标记的羊抗鼠二抗(EM-35110-02)(北京依玛博科技有限公司);核蛋白提取试剂盒、抗荧光衰减封片剂(含DAPI)(北京索莱宝科技有限公司);超强显色液(美国Genview公司);PVDF膜(美国Merck公司);兔抗人Nrf2单克隆抗体(ab62352)、兔抗人NQO1多克隆抗体(ab80588)、兔抗人HO-1多克隆抗体(ab13243)、Alexa fluor标记羊抗兔多克隆抗体IgG(ab150083)(英国Abcam公司);鼠抗人H3多克隆抗体(100005-MM01,北京义翘神州科技股份有限公司);细胞计数试剂盒8(cell counting kit-8,CCK-8)(上海碧云天生物科技有限公司);二氢乙锭(dihydroethidium,DHE)/PD-MY 003(美国MCE生物科技有限公司);利拉鲁肽(大连美仑生物技术有限公司)。7500型实时荧光定量PCR仪(美国ABI公司);凝胶成像仪(美国Bio-Rad公司);荧光显微镜(BX53,日本Olympus公司);多功能酶标仪(美国Thermo公司)。
1.2 方法
1.2.1细胞培养及分组处理 将ARPE-19细胞株置于含有10%胎牛血清、100 IU/ml(商品单位)青霉素和100 μg/ml链霉素的DMEM培养基中培养,待细胞生长至80%融合时用0.25%胰蛋白酶消化细胞,加入培养基制备细胞悬液并接种于培养板中,将细胞置于5.5 mmol/L葡萄糖培养基中培养6 d作为正常对照组;于30 mmol/L高糖培养基中培养3 d后,换成5.5 mmol/L葡萄糖培养基继续培养3 d作为代谢记忆组;经慢病毒miR-27b-3p抑制剂转染成功,将其置于30 mmol/L葡萄糖培养基培养3 d后换成5.5 mmol/L葡萄糖培养基继续培养3 d作为miR-27b-3p抑制剂组;细胞于30 mmol/L高糖+利拉鲁肽培养基培养3 d后换成5.5 mmol/L葡萄糖培养基继续培养3 d作为利拉鲁肽组。
1.2.2CCK-8法检测细胞增生率 调整细胞密度为2×104个/ml,按每孔200 μl置于96孔板中,每组设置3个复孔,加入过滤除菌后的D-葡萄糖溶液,调整培养基糖浓度为5.5、25、30、35、40 mmol/L,并设置无细胞培养基作为空白组,培养3 d后加入CCK-8试剂10 μl/孔继续孵育2 h,采用多功能酶标仪在450 nm波长处读取吸光度(absorbance,A)值,以细胞增生率降至接近正常对照组一半的糖浓度为最适高糖浓度。此外,将细胞分为正常对照组、代谢记忆组和利拉鲁肽组(10、20、30 nmol/L),即细胞分别置于培养基糖浓度为5.5 mmol/L、30 mmol/L和30 mmol/L+不同浓度利拉鲁肽中培养3 d,细胞活力检测操作步骤同上,选取细胞活力最佳组为最适利拉鲁肽给药浓度。随后将细胞分为正常对照组、代谢记忆组、利拉鲁肽组(20 nmol/L)于96孔板中培养,6 d后根据上述步骤检测A值并计算各组细胞增生率。细胞增生率=(A检测组-A空白组)/(A对照组-A空白组)。
1.2.3慢病毒miR-27b-3p转染细胞 构建含有嘌呤霉素抗性基因的慢病毒载体miR-27b-3p抑制剂(1×108TU/ml),取原液10 μl加入90 μl培养基配成稀释液,ARPE-19常规培养并以4×104个/ml细胞悬液100 μl接种于96孔板,8 h后加入慢病毒稀释液4、8、12、16 μl及HitransG P增强剂,使感染复数(multiplicity of infection,MOI),即感染时病毒与细胞数量的比值梯度达到10、20、30、40,转染96 h,绿色荧光蛋白(green fluorescent protein,GFP)表达丰度较高时用荧光显微镜观察,转染效率为80%左右且细胞生长良好组所对应的最适MOI和转染条件即为后续实验依据。配制嘌呤霉素,使终质量浓度为1 μg/ml。将细胞分为正常对照组、miR-27b-3p对照组和miR-27b-3p抑制剂组,调整细胞密度为5×105个/ml接种于培养瓶中,转染72 h后慢病毒转染效率达80%且细胞生长状态良好,加入嘌呤霉素,筛选转染成功、含抗性基因的细胞,未被转染细胞大量破裂死亡,继续培养24 h后收集细胞传代。将转染细胞诱导为代谢记忆空载病毒模型、代谢记忆病毒模型,并设置正常对照组、代谢记忆组进行后续实验。
1.2.4实时荧光定量PCR检测miR-27b-3p、Nrf2、NQO1、HO-1 mRNA水平 调整细胞密度为3×105个/孔并置于6孔板中分组处理培养6 d,收集各组细胞后使用Trizol提取RNA,引物序列见表1。参照逆转录试剂盒说明书合成cDNA,采用TB GreenTM Premix Ex TaqTM实时荧光定量PCR检测Nrf2、NQO1、HO-1 mRNA水平,以β-actin为内对照,反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火/延伸34 s,40个循环。根据Bluge-LoopTMmiRNA qRT-PCR试剂盒说明书进行miRNA逆转录及实时荧光定量PCR检测,以U6为内源性对照,反应条件:95 ℃预变性10 min;95 ℃变性2 s,60 ℃退火/延伸30 s,40个循环。采用2-ΔΔCt法计算各目的基因相对表达量。

表1 逆转录PCR引物序列Table 1 Primer sequences of reverse transcription PCR引物名称引物序列Nrf2正向:5'-ATCAACTACCCGTTCGAGAAG-3'反向:5'-ACTTGGTCATGTCGATTCATA-3'NQO1正向:5'-AGTATCCTGCCGAGTCTGTTCTGG-3'反向:5'-AATATCACAAGGTCTGCGGCTTCC-3'HO-1正向:5'-CCTCCCTGTACCACATCTATGT-3'反向:5'-GCTCTTCTGGGAAGTAGACAG-3'β-actin正向:5'-CTCGCCTTTGCCGATCC-3'反向:5'-GAATCCTTCTGACCCATGCC-3'miR-27b-3p正向:5'-GCGCGTTCACAGTGGCTAAG-3'反向:5'-AGTGCAGGGTCCGAGGTATT-3'U6正向:5'-AGAGAAGATTAGCATGGCCCCTG-3'反向:5'-ATCCAGTGCAGGGTCCGAGG-3' 注:PCR:聚合酶链式反应;Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶;β-actin:β-肌动蛋白;miR:微小RNA Note:PCR:polymerase chain reaction;Nrf:nuclear factor-E2-related fac-tor;NQO:NAD(P)H ehydrogenase[quinone];HO:heme oxygenase;miR:microRNA
1.2.5Western blot法检测Nrf2核蛋白和总蛋白表达水平 调整细胞密度为5×105个/孔,置于培养皿中分组培养6 d,收集各组细胞并在预冷RIPA裂解液和核蛋白试剂盒中分别提取总蛋白和核蛋白并配置成5倍蛋白上样缓冲液。取等蛋白量缓冲液在SDS-PAGE中电泳并转印至PVDF膜上,经脱脂牛奶封闭后与Nrf2、H3和β-actin抗体(均1∶1 000稀释)稀释液在4 ℃下孵育过夜,充分漂洗后加入二抗(1∶1 000)在室温下孵育2 h,加入ECL混合液,暗室曝光、显影。β-actin和H3蛋白水平分别作为总蛋白及核蛋白的内参。采用ImageJ软件分析各目的条带的灰度值。
1.2.6细胞免疫荧光染色检测Nrf2、NQO1和HO-1蛋白表达水平 调整细胞密度为3×104个/孔,在专用爬片培养6 d,收集爬片后加入4%多聚甲醛固定15 min,用1% Triton X-100破膜15 min,加入5%牛血清白蛋白封闭1 h,加入Nrf2、NQO1和HO-1抗体(1∶500)稀释液,4 ℃孵育过夜,充分漂洗后在室温下加入荧光二抗(1∶500)避光孵育2 h。置于载玻片上,将荧光猝灭剂覆盖表面,暗室中于正置荧光显微镜下观察并拍照,每片不少于6个视野(200倍),采用ImageJ软件分析目的蛋白荧光强度。
1.2.7DHE检测细胞活性氧含量 将细胞以4×104个/孔接种于12孔板中分组培养6 d后去除培养基,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤3次,将配制好的2 μmol/L DHE反应液1 ml加入细胞中,继续培养30 min后PBS洗涤3次,在倒置荧光显微镜下任意选取6个视野(100倍),采用ImageJ分析活性氧簇(reactive oxygen species,ROS)荧光强度。
1.3 统计学方法
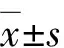
2 结果
2.1 糖浓度及药物浓度筛选
CCK-8法检测结果显示,正常对照组和25、30、35、40 mmol/L高糖组的细胞增生率分别为1.000±0.000、0.832±0.040、0.582±0.042、0.548±0.048、0.444±0.031,组间总体比较差异有统计学意义(F=115.611,P<0.001),其中25、30、35、40 mmol/L高糖组细胞增生率均低于正常对照组,差异均有统计学意义(均P<0.001);葡萄糖浓度为30 mmol/L时细胞增生率明显下降,选择最低有效葡萄糖浓度30 mmol/L进行后续实验(图1A)。正常对照组、高糖组和利拉鲁肽10、20、30 nmol/L组细胞增生率分别为1.000±0.000、0.480±0.030、0.445±0.021、0.621±0.023、0.562±0.025,组间总体比较差异有统计学意义(F=303.883,P<0.001),其中高糖组细胞增生率低于利拉鲁肽20 nmol/L、30 nmol/L组,差异均有统计学意义(均P<0.001);利拉鲁肽20 nmol/L组细胞增生率最高,因此选择利拉鲁肽20 nmol/L为最佳浓度(图1B)。
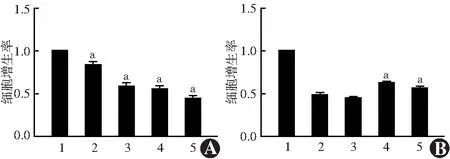
图1 不同葡萄糖和利拉鲁肽浓度干预下人RPE细胞增生率的比较 A:不同葡萄糖浓度干预下人RPE细胞增生率比较 F=115.611,P<0.001.与正常对照组比较,aP<0.001(单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:25 mmol/L高糖组;3:30 mmol/L高糖组;4:35 mmol/L高糖组;5:40 mmol/L高糖组 B:不同利拉鲁肽浓度干预高糖诱导的人RPE细胞增生率比较 F=303.883,P<0.001.与高糖组比较,aP<0.001(单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:高糖组;3:利拉鲁肽10 mmol/L组;4:利拉鲁肽20 mmol/L组;5:利拉鲁肽30 mmol/L组Figure 1 Comparison of human RPE cell proliferation rate treated with different glucose and liraglutide concentrations A:Comparison of human RPE cell proliferation rate treated with different glucose concentrations F=115.611,P<0.001.Compared with normal control group,aP<0.001 (One-way ANOVA,LSD-t test,n=3) 1:normal control group;2:25 mmol/L high glucose group;3:30 mmol/L high glucose group;4:35 mmol/L high glucose group;5:40 mmol/L high glucose group B:Comparison of human RPE cell proliferation rate induced by high glucose with different liraglutide concentrations F=303.883,P<0.001.Compared with high glucose group,aP<0.001 (One-way ANOVA,LSD-t test,n=3) 1:normal control group;2:high glucose group;3:Liraglutide 10 mmol/L group;4:Liraglutide 20 mmol/L group;5:Liraglutide 30 mmol/L group
2.2 慢病毒转染条件筛选
在荧光显微镜下观察GFP绿色荧光表达的细胞,转染条件为miR-27b-3p对照组MOI=40、miR-27b-3p抑制剂组MOI=30时荧光最强,此为最佳转染条件(图2A)。miR-27b-3p抑制剂组慢病毒载体包含嘌呤霉素抗性基因,慢病毒转染72 h加入1.0 μg/ml嘌呤霉素继续培养至96 h,筛选已转染成功的细胞,GFP表达效率超过80%(图2B)。
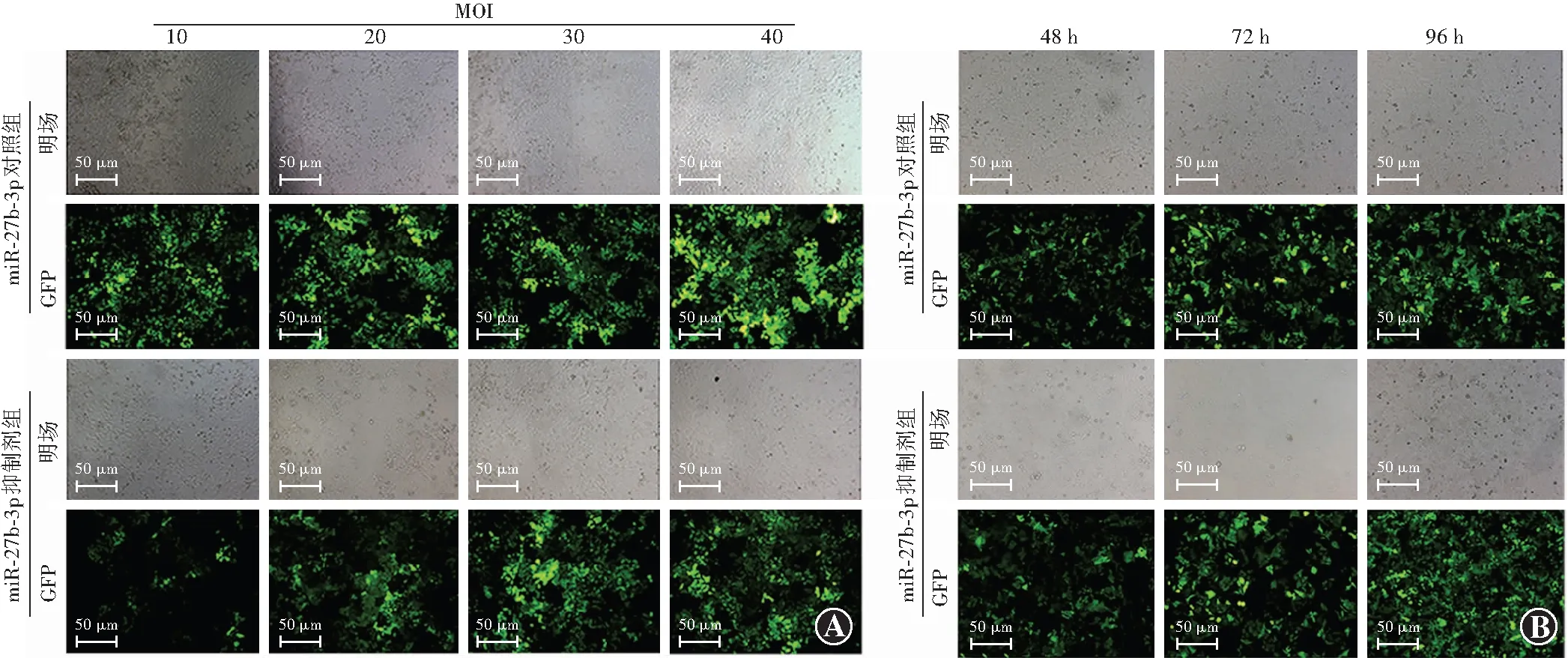
图2 慢病毒miR-27b-3p转染细胞荧光图(×200,标尺=50 μm) A:MOI:10、20、30、40条件下人RPE细胞转染慢病毒miR-27b-3p抑制剂和miR-27b-3p对照组的明场和GFP绿色荧光图 B:人RPE细胞转染慢病毒miR-27b-3p抑制剂和miR-27b-3p对照组48、72、96 h后的明场和GFP绿色荧光图 MOI:感染复数;miR:微小RNA;GFP:绿色荧光蛋白Figure 2 Cell fluorescence images of miR-27b-3p lentivirus transfection (×200,bar=50 μm) A:Bright field and GFP green fluorescence images of human RPE cells transfected with miR-27b-3p-inhibitor and miR-27b-3p-control lentivirus in MOI (10,20,30,40) B:Bright field and GFP green fluorescence images of human RPE cells transfected with miR-27b-3p-inhibitor and miR-27b-3p-control lentivirus at 48,72,and 96 hours after transfection MOI:multiplicity of infection;miR:microRNA;GFP:green fluorescent protein
2.3 转染后各组miR-27b-3p、Nrf2、NQO1、HO-1 mRNA和蛋白表达量比较
实时荧光定量PCR检测结果显示,正常对照组、代谢记忆组、miR-27b-3p对照组、miR-27b-3p抑制剂组miR-27b-3p、Nrf2、NQO1、HO-1 mRNA相对表达量组间总体比较差异均有统计学意义(F=850.815、329.653、876.195、439.192,均P<0.001),其中代谢记忆组miR-27b-3p mRNA相对表达量高于正常对照组,Nrf2、NQO1、HO-1 mRNA相对表达量均低于正常对照组,差异均有统计学意义(均P<0.01);miR-27b-3p抑制剂组miR-27b-3p mRNA相对表达量明显低于miR-27b-3p对照组,Nrf2、NQO1、HO-1 mRNA相对表达量均高于miR-27b-3p对照组,差异均有统计学意义(均P<0.01)(表2)。
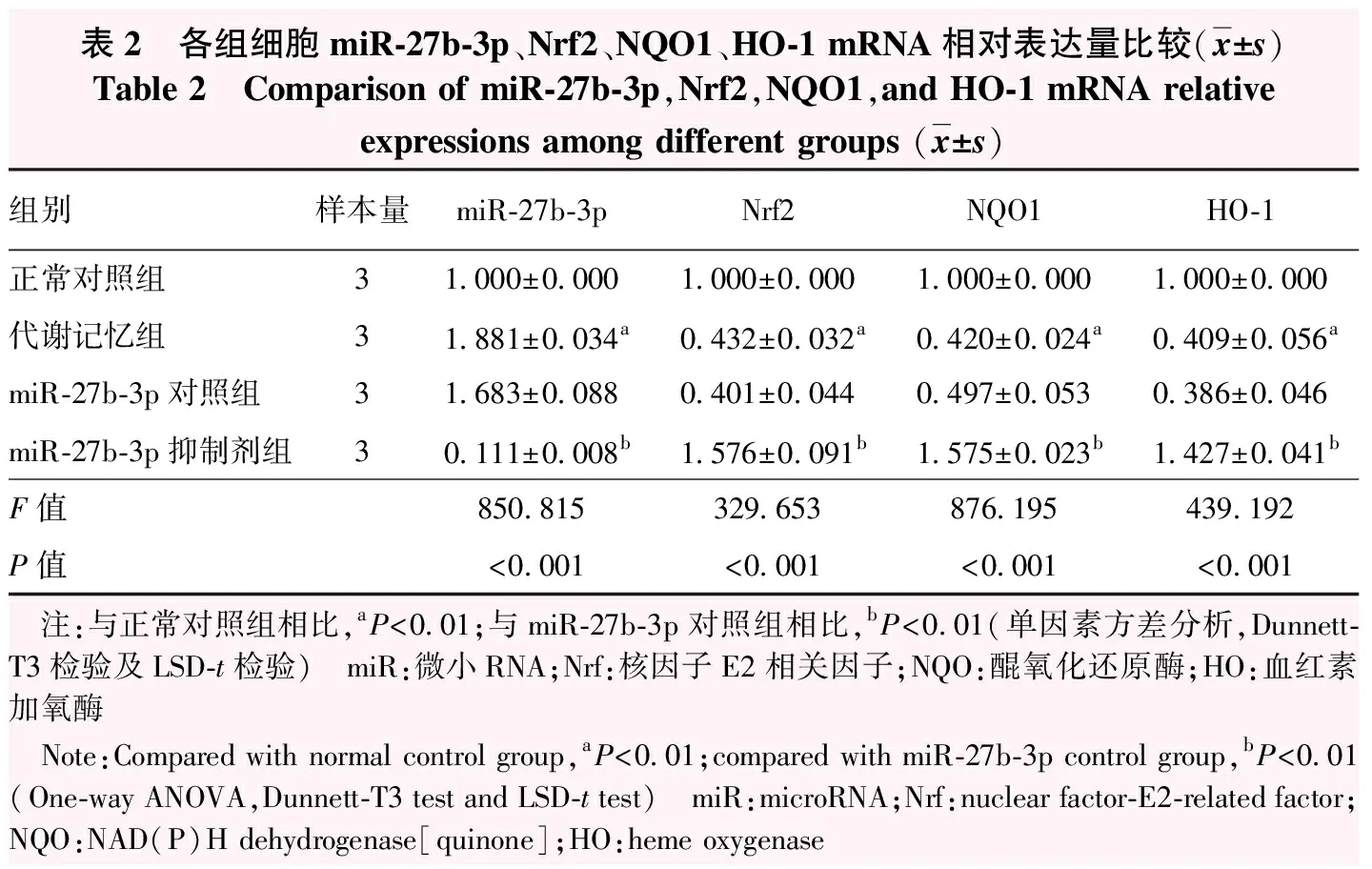
表2 各组细胞miR-27b-3p、Nrf2、NQO1、HO-1 mRNA相对表达量比较(x±s)Table 2 Comparison of miR-27b-3p,Nrf2,NQO1,and HO-1 mRNA relative expressions among different groups (x±s)组别样本量miR-27b-3pNrf2NQO1HO-1正常对照组31.000±0.0001.000±0.0001.000±0.0001.000±0.000代谢记忆组31.881±0.034a0.432±0.032a0.420±0.024a0.409±0.056amiR-27b-3p对照组31.683±0.0880.401±0.0440.497±0.0530.386±0.046miR-27b-3p抑制剂组30.111±0.008b1.576±0.091b1.575±0.023b1.427±0.041bF值850.815329.653876.195439.192P值<0.001<0.001<0.001<0.001 注:与正常对照组相比,aP<0.01;与miR-27b-3p对照组相比,bP<0.01(单因素方差分析,Dunnett-T3检验及LSD-t检验) miR:微小RNA;Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶 Note:Compared with normal control group,aP<0.01;compared with miR-27b-3p control group,bP<0.01 (One-way ANOVA,Dunnett-T3 test and LSD-t test) miR:microRNA;Nrf:nuclear factor-E2-related factor;NQO:NAD(P)H dehydrogenase[quinone];HO:heme oxygenase
代谢记忆组Nrf2总蛋白、核蛋白表达条带均较正常对照组减弱,miR-27b-3p抑制剂组各条带较miR-27b-3p对照组明显增强(图3)。正常对照组、代谢记忆组、miR-27b-3p对照组、miR-27b-3p抑制剂组Nrf2总蛋白、核蛋白相对表达水平总体比较差异均有统计学意义(F=86 757.666、11 504.213,均P<0.001),其中代谢记忆组Nrf2总蛋白、核蛋白相对表达水平较正常对照组下降,miR-27b-3p抑制剂组较miR-27b-3p对照组明显上升,差异均有统计学意义(均P<0.01)(表3)。
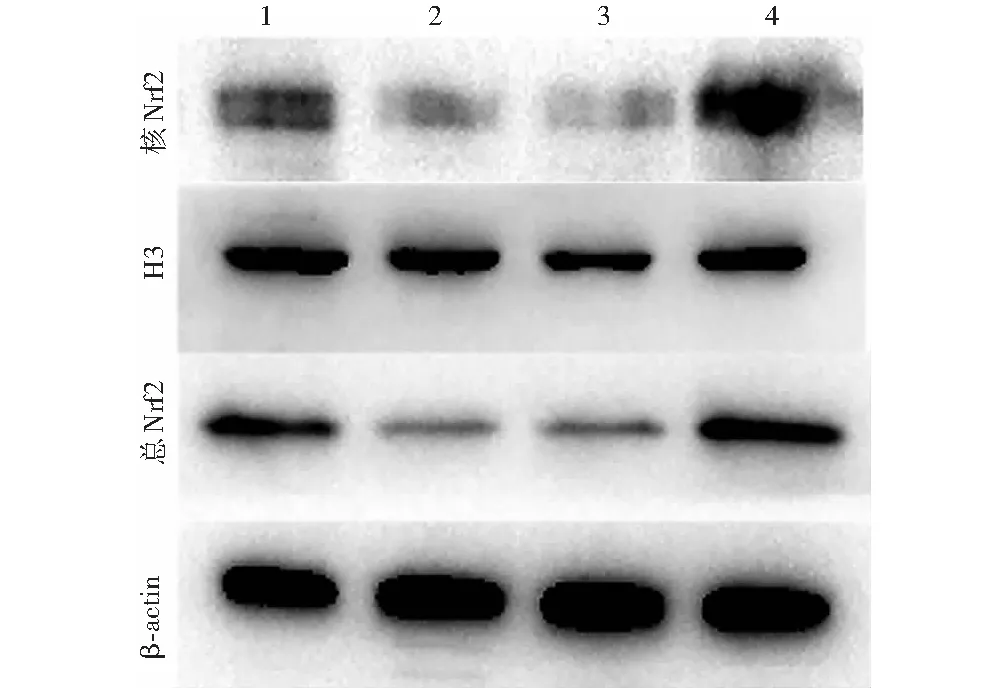
图3 Western blot检测总蛋白及核蛋白Nrf2蛋白电泳图 1:正常对照组;2:代谢记忆组;3:miR-27b-3p对照组;4:miR-27b-3p抑制剂 Nrf:核因子E2相关因子;H3:组蛋白3Figure 3 Electrophoretogram of total and nuclear Nrf2 protein expressions by Western blot 1:normal control group;2:metabolic memory group;3:miR-27b-3p control group;4:miR-27b-3p inhibitor group Nrf:nuclear factor-E2-related factor;H3:histone 3
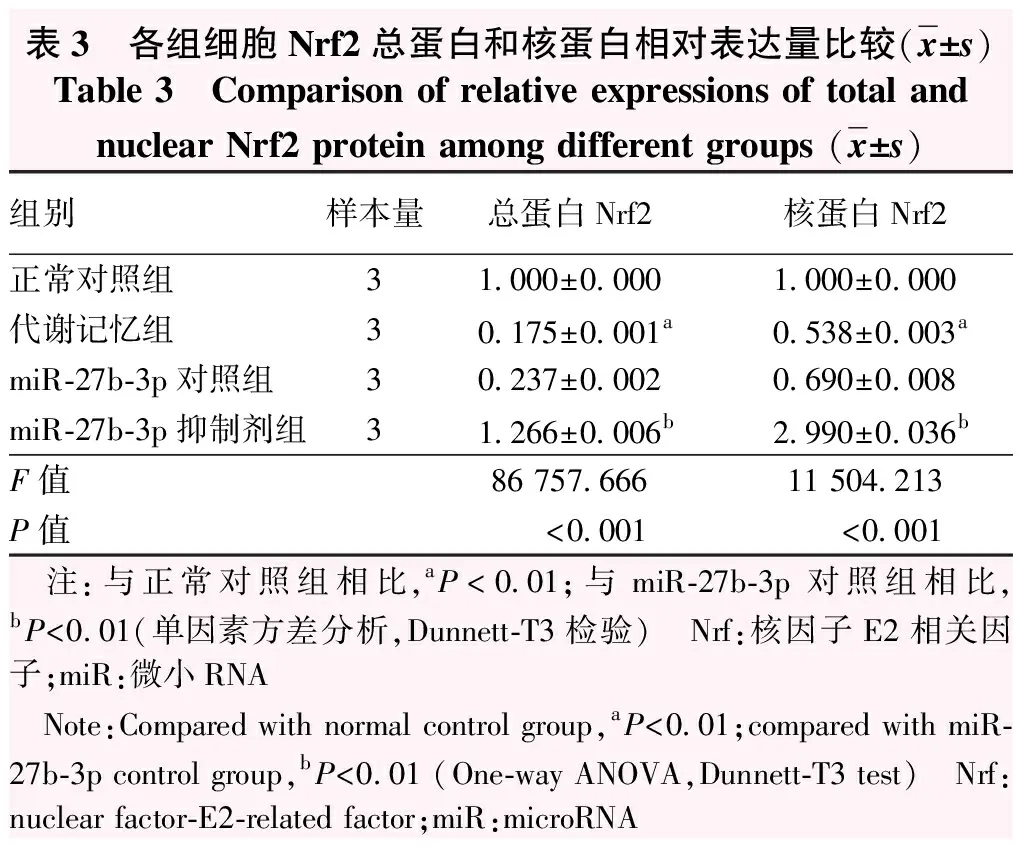
表3 各组细胞Nrf2总蛋白和核蛋白相对表达量比较(x±s)Table 3 Comparison of relative expressions of total and nuclear Nrf2 protein among different groups (x±s)组别样本量总蛋白Nrf2核蛋白Nrf2正常对照组31.000±0.0001.000±0.000代谢记忆组30.175±0.001a0.538±0.003amiR-27b-3p对照组30.237±0.0020.690±0.008miR-27b-3p抑制剂组31.266±0.006b2.990±0.036bF值86 757.66611 504.213P值<0.001<0.001 注:与正常对照组相比,aP<0.01;与miR-27b-3p对照组相比,bP<0.01(单因素方差分析,Dunnett-T3检验) Nrf:核因子E2相关因子;miR:微小RNA Note:Compared with normal control group,aP<0.01;compared with miR-27b-3p control group,bP<0.01 (One-way ANOVA,Dunnett-T3 test) Nrf:nuclear factor-E2-related factor;miR:microRNA
细胞免疫荧光图显示Nrf2、NQO1、HO-1在细胞核细胞质均可见表达,相较正常对照组及miR-27b-3p抑制剂组,代谢记忆组Nrf2、NQO1、HO-1细胞免疫荧光强度均明显减弱(图4)。正常对照组、代谢记忆组、miR-27b-3p对照组、miR-27b-3p抑制剂组Nrf2、NQO1、HO-1细胞免疫荧光强度总体比较,差异均有统计学意义(F=464.178、83.959、37.831,均P<0.001),其中代谢记忆组Nrf2、NQO1、HO-1荧光强度均低于正常对照组,miR-27b-3p抑制剂组Nrf2、NQO1、HO-1荧光强度均高于miR-27b-3p对照组,差异均有统计学意义(均P<0.01)(表4)。
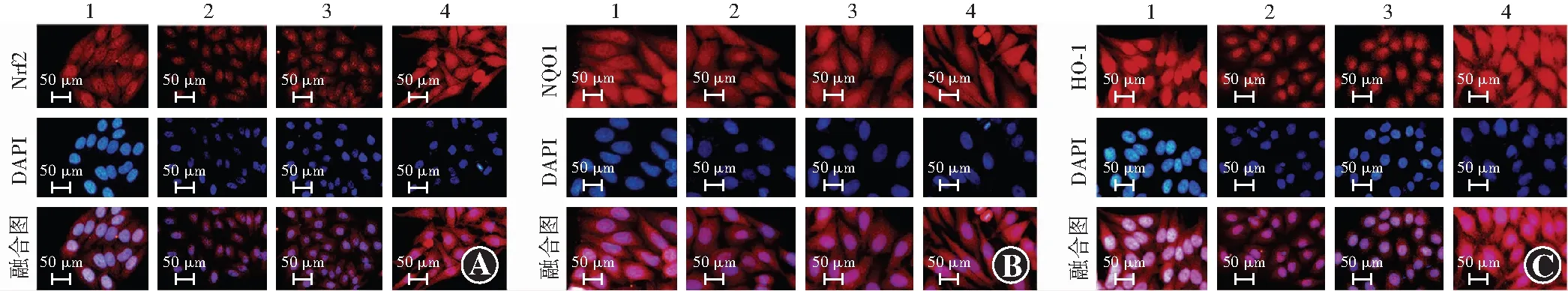
图4 各组细胞Nrf2、NQO1、HO-1免疫荧光图(×200,标尺=50 μm) 相较正常对照组及miR-27b-3p抑制剂组,代谢记忆组Nrf2、NQO1、HO-1细胞免疫荧光强度均明显减弱 Nrf2、NQO1、HO-1表达于胞核胞质中,呈红色荧光;细胞核呈蓝色荧光(含DAPI) A:Nrf2 B:NQO1 C:HO-1 1:正常对照组 2:代谢记忆组;3:miR-27b-3p对照组;4:miR-27b-3p抑制剂组 Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶Figure 4 Cellular immunofluorescence pictures of Nrf2,NQO1,and HO-1 in different groups (×200,bar=50 μm) Compared with normal control group and miR-27b-3p inhibitor group,the immunofluorescence intensity of Nrf2,NQO1 and HO-1 in metabolic memory group was significantly decreased.Nrf2,NQO1,and HO-1 were expressed in cytoplasm and nuclei,showing red fluorescence.The nuclei showed blue fluorescence (containing DAPI) A:Nrf2 B:NQO1 C:HO-1 1:normal control group 2:metabolic memory group 3:miR-27b-3p control group 4:miR-27b-3p inhibitor group Nrf:nuclear factor-E2-related factor;NQO:NAD(P)H dehydrogenase[quinone];HO:heme oxygenase
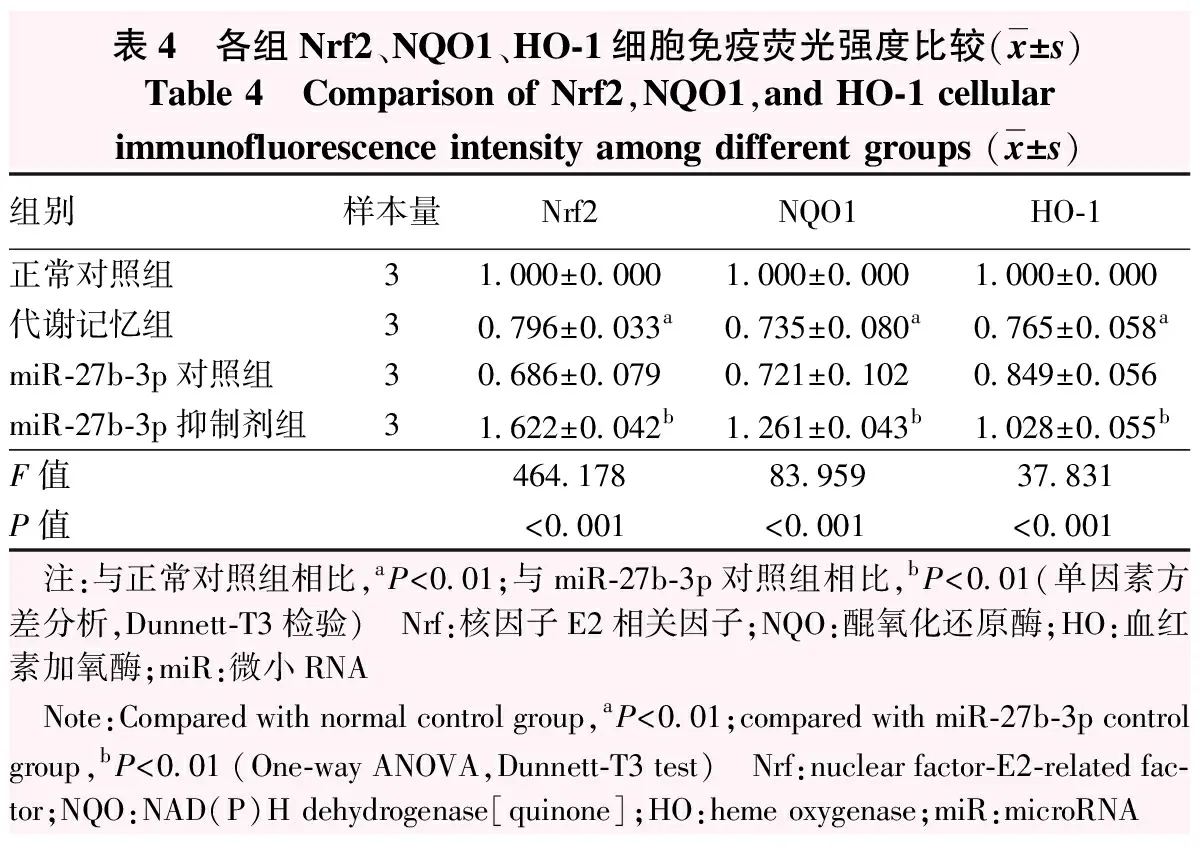
表4 各组Nrf2、NQO1、HO-1细胞免疫荧光强度比较(x±s)Table 4 Comparison of Nrf2,NQO1,and HO-1 cellular immunofluorescence intensity among different groups (x±s)组别样本量Nrf2NQO1HO-1正常对照组31.000±0.0001.000±0.0001.000±0.000代谢记忆组30.796±0.033a0.735±0.080a0.765±0.058amiR-27b-3p对照组30.686±0.0790.721±0.1020.849±0.056miR-27b-3p抑制剂组31.622±0.042b1.261±0.043b1.028±0.055bF值464.17883.95937.831P值<0.001<0.001<0.001 注:与正常对照组相比,aP<0.01;与miR-27b-3p对照组相比,bP<0.01(单因素方差分析,Dunnett-T3检验) Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶;miR:微小RNA Note:Compared with normal control group,aP<0.01;compared with miR-27b-3p control group,bP<0.01 (One-way ANOVA,Dunnett-T3 test) Nrf:nuclear factor-E2-related fac-tor;NQO:NAD(P)H dehydrogenase[quinone];HO:heme oxygenase;miR:microRNA
2.4 利拉鲁肽干预后各组miR-27b-3p、Nrf2、NQO1、HO-1 mRNA及蛋白表达量比较
利拉鲁肽干预后正常对照组、代谢记忆组、利拉鲁肽组miR-27b-3p、Nrf2、NQO1、HO-1 mRNA相对表达量总体比较差异均有统计学意义(F=300.050、657.987、33.092、500.841,均P<0.001),其中代谢记忆组miR-27b-3p相对表达量高于正常对照组,Nrf2、NQO1、HO-1 mRNA相对表达量低于正常对照组,差异均有统计学意义(均P<0.05);利拉鲁肽组miR-27b-3p相对表达量低于代谢记忆组,Nrf2、NQO1、HO-1 mRNA相对表达量高于代谢记忆组,差异均有统计学意义(均P<0.05)(表5)。
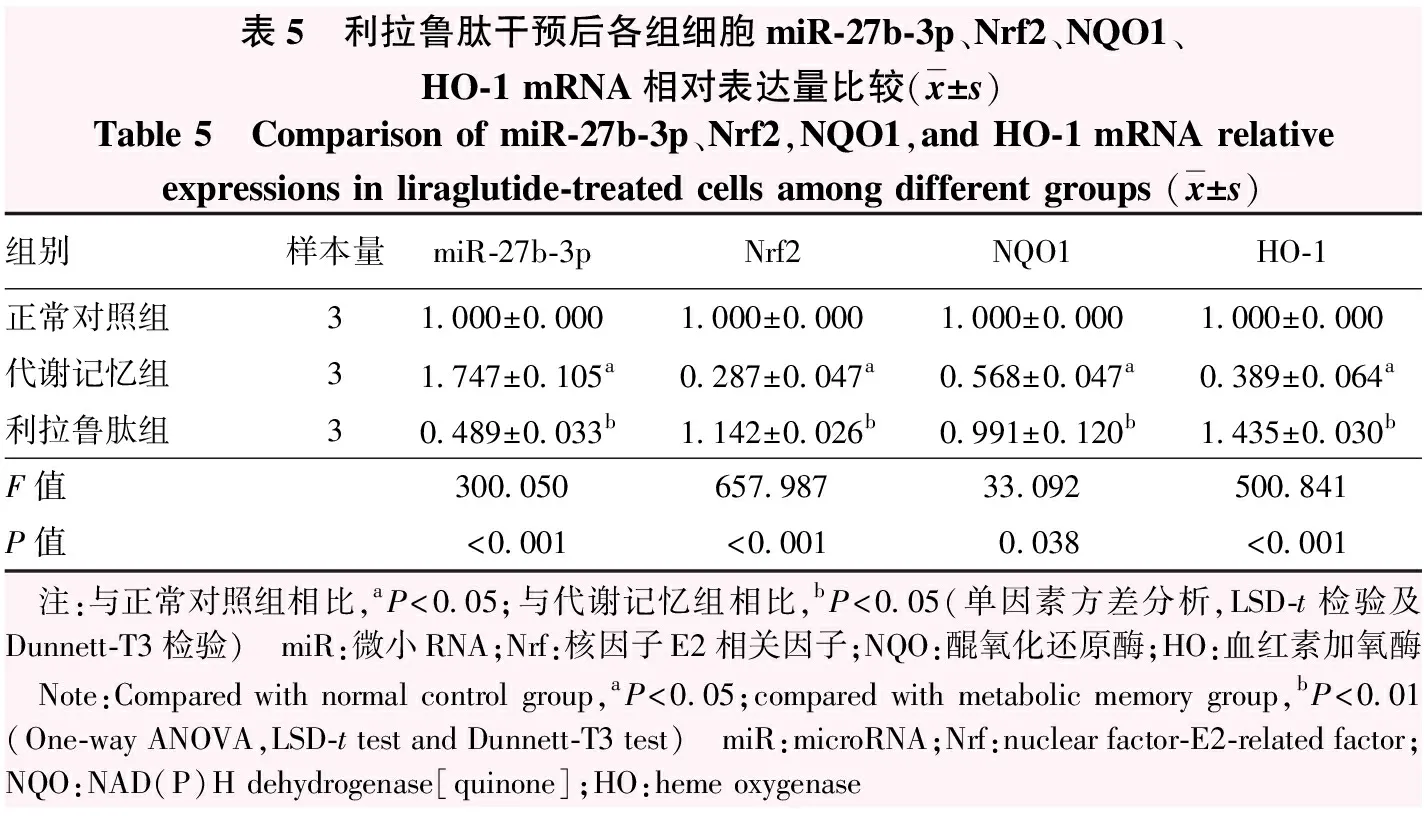
表5 利拉鲁肽干预后各组细胞miR-27b-3p、Nrf2、NQO1、HO-1 mRNA相对表达量比较(x±s)Table 5 Comparison of miR-27b-3p、Nrf2,NQO1,and HO-1 mRNA relative expressions in liraglutide-treated cells among different groups (x±s)组别样本量miR-27b-3pNrf2NQO1HO-1正常对照组31.000±0.0001.000±0.0001.000±0.0001.000±0.000代谢记忆组31.747±0.105a0.287±0.047a0.568±0.047a0.389±0.064a利拉鲁肽组30.489±0.033b1.142±0.026b0.991±0.120b1.435±0.030bF值300.050657.98733.092500.841P值<0.001<0.0010.038<0.001 注:与正常对照组相比,aP<0.05;与代谢记忆组相比,bP<0.05(单因素方差分析,LSD-t检验及Dunnett-T3检验) miR:微小RNA;Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶 Note:Compared with normal control group,aP<0.05;compared with metabolic memory group,bP<0.01 (One-way ANOVA,LSD-t test and Dunnett-T3 test) miR:microRNA;Nrf:nuclear factor-E2-related factor;NQO:NAD(P)H dehydrogenase[quinone];HO:heme oxygenase
与正常对照组相比,代谢记忆组Nrf2总蛋白、核蛋白条带较弱,利拉鲁肽组Nrf2总蛋白、核蛋白条带明显增强(图5)。正常对照组、代谢记忆组、利拉鲁肽组Nrf2总蛋白、核蛋白相对表达量总体比较差异均有统计学意义(F=12 391.714、458.465,均P<0.001),其中代谢记忆组Nrf2总蛋白、核蛋白相对表达量均低于正常对照组,利拉鲁肽组Nrf2总蛋白、核蛋白相对表达量均较代谢记忆组升高,差异均有统计学意义(均P<0.01)(表6)。
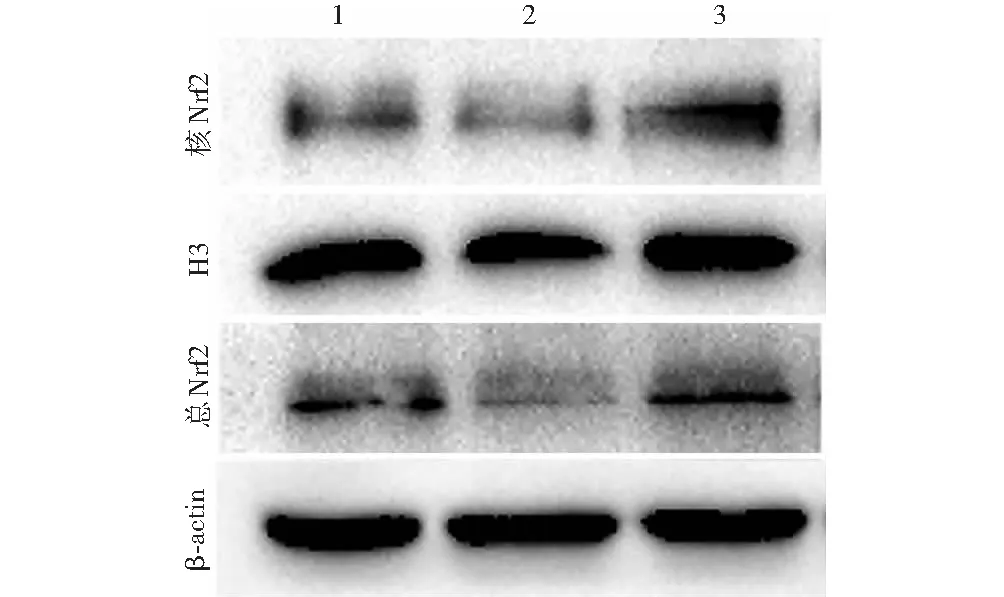
图5 利拉鲁肽干预后各组总蛋白及核蛋白Nrf2蛋白电泳图 1:正常对照组;2:代谢记忆组;3:利拉鲁肽组 β-actin:β-肌动蛋白;Nrf:核因子E2相关因子;H3:组蛋白3Figure 5 Electrophoretogram of total and nuclear Nrf2 protein expressions after liraglutide treatment 1:normal control group;2:metabolic memory group;3:liraglutide group Nrf:nuclear factor-E2-related factor;H3:histone 3
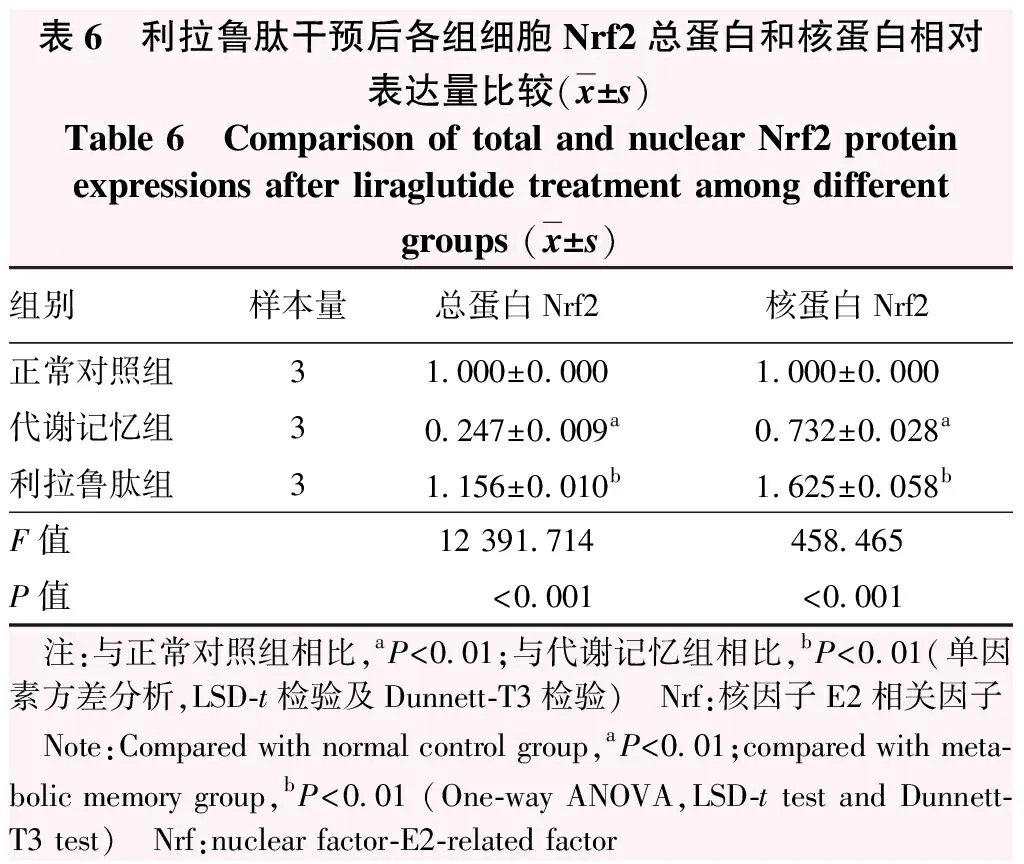
表6 利拉鲁肽干预后各组细胞Nrf2总蛋白和核蛋白相对表达量比较(x±s)Table 6 Comparison of total and nuclear Nrf2 proteinexpressions after liraglutide treatment among differentgroups (x±s)组别样本量总蛋白Nrf2核蛋白Nrf2正常对照组31.000±0.0001.000±0.000代谢记忆组30.247±0.009a0.732±0.028a利拉鲁肽组31.156±0.010b1.625±0.058bF值12 391.714458.465P值<0.001<0.001 注:与正常对照组相比,aP<0.01;与代谢记忆组相比,bP<0.01(单因素方差分析,LSD-t检验及Dunnett-T3检验) Nrf:核因子E2相关因子 Note:Compared with normal control group,aP<0.01;compared with meta-bolic memory group,bP<0.01 (One-way ANOVA,LSD-t test and Dunnett-T3 test) Nrf:nuclear factor-E2-related factor
细胞免疫荧光染色可见,Nrf2、NQO1、HO-1在细胞核、细胞质中均有表达,与正常对照组相比,代谢记忆组Nrf2、NQO1、HO-1荧光均减弱,代谢记忆组荧光均明显增强(图6)。正常对照组、代谢记忆组、利拉鲁肽组Nrf2、NQO1、HO-1荧光强度总体比较差异均有统计学意义(F=10.392、44.351、47.217,均P<0.01),其中代谢记忆组Nrf2、NQO1、HO-1荧光强度均低于正常对照组,利拉鲁肽组荧光强度均高于代谢记忆组,差异均有统计学意义(均P<0.05)(表7)。
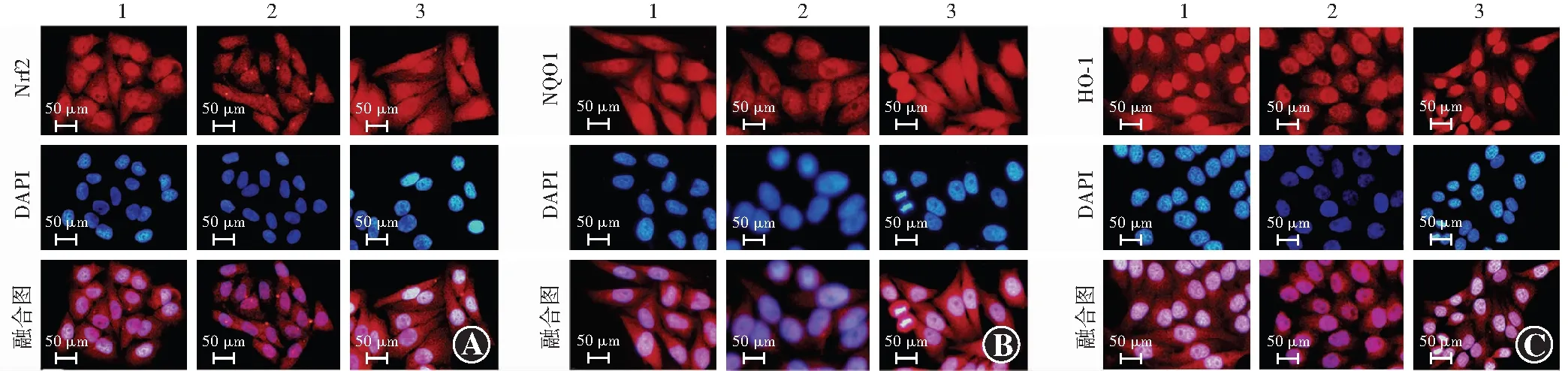
图6 利拉鲁肽干预后各组Nrf2、NQO1、HO-1免疫荧光图(×200,标尺=50 μm) 与正常对照组相比,代谢记忆组Nrf2、NQO1、HO-1荧光均减弱,利拉鲁肽组荧光均明显增强 Nrf2、NQO1、HO-1表达于细胞核、细胞质中,呈红色荧光;细胞核呈蓝色荧光(含DAPI) A:Nrf2 B:NQO1 C:HO-1 1:正常对照组;2:代谢记忆组;3:利拉鲁肽组 Nrf:核因子E2相关因子;NQO:醌氧化还原酶;HO:血红素加氧酶Figure 6 Nrf2,NQO1,and HO-1 immunofluorescence images of liraglutide-treated cells (×200,bar=50 μm) Compared with the normal control group,the fluorescence of Nrf2,NQO1 and HO-1 in metabolic memory group was decreased,and the fluorescence of the liraglutide group was significantly enhanced.Nrf2,NQO1,and HO-1 were expressed in cytoplasm and nuclei,showing red fluorescence.The nuclei showed blue fluorescence (containing DAPI) A:Nrf2 B:NQO1 C:HO-1 1:normal control group;2:metabolic memory group;3:liraglutide group Nrf:nuclear factor-E2-related factor;NQO:NAD(P)H dehydrogenase[quinone];HO:heme oxygenase
2.5 利拉鲁肽干预后各组细胞增生率及ROS含量比较
CCK-8法检测结果显示,正常对照组、代谢记忆组、利拉鲁肽组细胞增生率总体比较差异有统计学意义(F=73.209,P<0.001),其中与正常对照组相比,代谢记忆组细胞增生率下降,利拉鲁肽组细胞增生率高于代谢记忆组,差异均有统计学意义(P<0.01)(表8)。DHE检测结果显示,代谢记忆组ROS荧光强度较正常对照组及利拉鲁肽组增强(图7)。正常对照组、代谢记忆组、利拉鲁肽组ROS荧光强度总体比较差异有统计学意义(F=739.668,P<0.001),其中代谢记忆组ROS相对含量高于正常对照组和利拉鲁肽组,差异均有统计学意义(均P<0.01)(表8)。
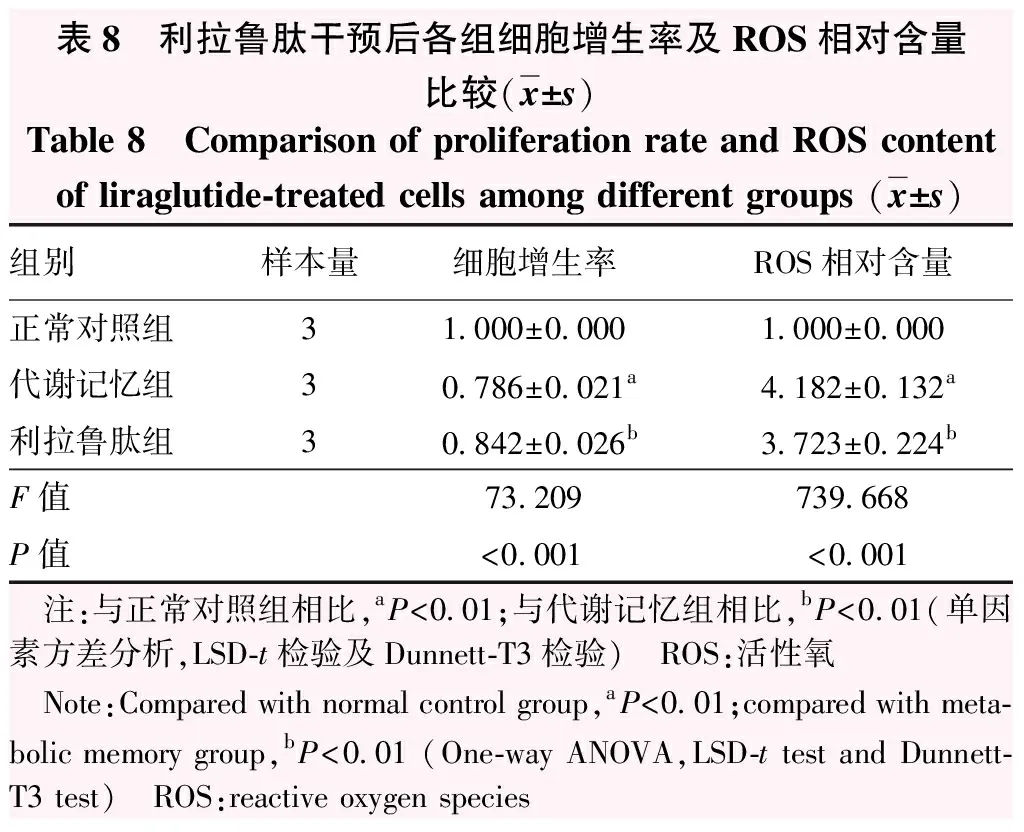
表8 利拉鲁肽干预后各组细胞增生率及ROS相对含量比较(x±s)Table 8 Comparison of proliferation rate and ROS contentof liraglutide-treated cells among different groups (x±s)组别样本量细胞增生率ROS相对含量正常对照组31.000±0.0001.000±0.000代谢记忆组30.786±0.021a4.182±0.132a利拉鲁肽组30.842±0.026b3.723±0.224bF值73.209739.668P值<0.001<0.001 注:与正常对照组相比,aP<0.01;与代谢记忆组相比,bP<0.01(单因素方差分析,LSD-t检验及Dunnett-T3检验) ROS:活性氧 Note:Compared with normal control group, aP<0.01;compared with meta-bolic memory group,bP<0.01 (One-way ANOVA,LSD-t test and Dunnett-T3 test) ROS:reactive oxygen species
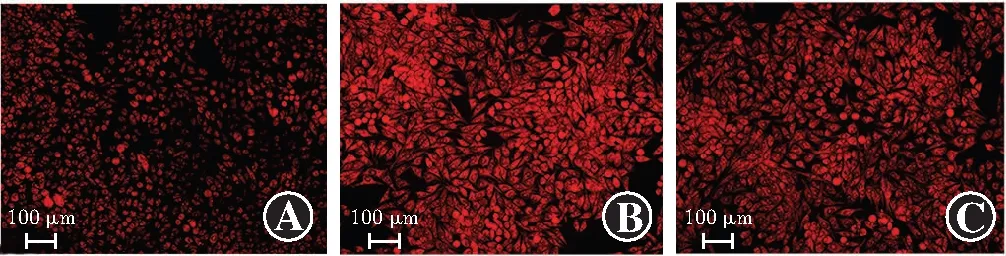
图7 利拉鲁肽干预后各组细胞ROS荧光图(×100,标尺=100 μm) 代谢记忆组ROS荧光强度较正常对照组及利拉鲁肽组增强 A:正常对照组 B:代谢记忆组 C:利拉鲁肽组Figure 7 ROS fluorescence images of liraglutide-treated cells (×100,bar=100 μm) The fluorescence intensity of ROS was stronger in metabolic memory group than in normal control group and liraglutide group A:Normal control group B:Metabolic memory group C:Liraglutide group
3 讨论
代谢记忆是高血糖的延续性损伤现象,参与氧化应激、糖代谢异常等病理过程[11-12]。本研究发现代谢记忆引起人RPE细胞中ROS大量堆积,ROS是氧自由基的主要成分之一。大量研究已证实氧自由基可引起氧化应激损伤,抑制细胞的正常代谢功能及活性,其机制涉及Nrf2、NF-κB、GLP1R、PI3K/AKT等相关通路,其中Nrf2是体内强抗氧化因子,可激活HO-1、NQO1、GCLC等相关抗氧化靶基因,降低细胞中ROS水平,清除代谢产物[13-16]。本研究发现人RPE细胞在去除高糖后,Nrf2表达仍受到抑制,对下游靶基因激活作用减弱。Bollong等[17]研究发现,Nrf2在细胞质中主要与Keap1结合失活,受到内外源刺激后立即与Keap1解离,并转入胞核内激活下游靶基因,完成信号转导。本研究证实Nrf2在细胞核、细胞质中均有表达,代谢记忆可抑制总蛋白及核蛋白Nrf2表达水平。细胞形成代谢记忆后,细胞核内Nrf2含量减少,对HO-1和NQO1的激活作用也相应减弱。HO-1是清除氧自由基的主要酶之一,NQO1主要清除外源性代谢产物,当HO-1和NQO1表达水平不足以清除ROS及糖代谢产物时,将引起氧化应激反应,RPE细胞的代谢功能也随之减弱。
在长期高血糖状态下,糖与蛋白质或脂质结合产生难以降解的代谢产物,刺激细胞释放氧自由基,形成代谢记忆后仍继续促进糖代谢产物堆积,导致细胞持续性氧化损伤,影响细胞代谢功能[18-20]。因此,在代谢记忆形成过程中,促进Nrf2表达并维持活性状态可能有利于清除代谢产物、对抗代谢记忆损伤。本实验评估了代谢记忆对miR-27b-3p的作用,结果证明miR-27b-3p与Nrf2呈现相反趋势,可见miR-27b-3p极有可能通过调节Nrf2参与代谢记忆形成。通过慢病毒转染抑制miR-27b-3p表达,结果验证了在人RPE细胞中Nrf2是miR-27b-3p的下游靶基因之一。在此基础上,本研究发现抑制miR-27b-3p不仅解除了代谢记忆对细胞核、细胞质中Nrf2表达的抑制,也促进了Nrf2对HO-1和NQO1的激活,一定程度上保护细胞免受代谢记忆损伤。
临床随访病例显示利拉鲁肽可延缓DR进展[21]。本研究发现采用利拉鲁肽干预高糖诱导的RPE细胞,细胞活性有所恢复,所释放的ROS也相应减少,可见利拉鲁肽具有清除氧自由基,改善细胞增生活力的作用,因此,我们推测利拉鲁肽具有抗氧化作用,其机制可能与miR-27b-3p/Nrf2途径相关。本研究结果证实了这一假设,利拉鲁肽干预后细胞中miR-27b-3p表达受到抑制,对下游靶基因Nrf2的负性调节作用减弱,促进细胞核、细胞质中Nrf2表达,这可能与减少Nrf2与Keap1结合或促进两者解离相关[17]。利拉鲁肽提高了细胞核中Nrf2含量,也相应增强了对下游靶基因NQO1、HO-1的激活作用。随着NQO1、HO-1表达增加,细胞清除高糖和代谢记忆所产生的代谢产物能力增强,修复并改善细胞功能及活性,缓解了细胞的持续性氧化损伤。清除氧自由基还可保护RPE细胞的线粒体酶活性[22],因此利拉鲁肽不仅具有降糖作用,还可通过miR-27b-3p/Nrf2途径激活抗氧化通路,改善人RPE代谢功能,达到抑制代谢记忆形成的目的。
综上所述,在人RPE细胞中Nrf2是miR-27b-3p的下游靶基因之一,代谢记忆对人RPE细胞的损伤可能与miR-27b-3p上调促进了Nrf2失活或抑制其解离相关。而利拉鲁肽可逆转这一现象,其抗氧化机制可通过抑制miR-27b-3p同时提高细胞核中Nrf2含量进而逆转细胞代谢记忆现象。因此,miR-27b-3p和Nrf2有可能成为DR的治疗靶点,本研究也为利拉鲁肽的临床治疗提供理论基础及实验依据。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明赖巧玲:酝酿和设计实验、实施研究、采集数据、统计分析、分析/解释数据、起草文章;谢婷:实施研究、采集数据、统计分析;黄焱:指导实验、文章审阅、修改及定稿
