基于核酸适配体的细胞外囊泡分离分析方法*
2023-10-10郑美玉王宇林袁丽杰池彩星吴玲玲杨朝勇
朱 琳 郑美玉 王宇林 袁丽杰 伊 雪 池彩星 王 汇 吴玲玲 杨朝勇 2,
(1)厦门医学院基础医学部,机能与临床转化福建省高校重点实验室,厦门医学院呼吸疾病研究所,厦门 361023;2)厦门大学化学化工学院,福建省化学生物学重点实验室,谱学分析与仪器教育部重点实验室,厦门 361005;3)上海交通大学医学院,仁济医院,分子医学研究院,上海 200127)
细胞外囊泡(extracellular vesicles,EVs)是细胞分泌于胞外的脂质囊性小泡[1],广泛存在于大多数体液(如血液、尿液、唾液、泪液等)以及组织中。EVs在细胞间通讯与生物活性分子运输中发挥重要作用,参与神经传导[2]、免疫调节[3]、细胞代谢[4]等生物学过程,并与恶性肿瘤[5]、神经退行性疾病[6]、心血管疾病[7]等的发生和进展密切相关。根据EVs的尺寸、形成与分泌机制的差异,EVs可分为多种亚群,包括微泡、外泌体等[8],其中,微泡直径为100~1 000 nm,以细胞质膜向外出芽方式形成[9];外泌体直径为40~160 nm,由细胞内吞运输途径形成[10]。除了细胞膜表面蛋白,EVs还包含有来自亲本细胞的胞内核酸、蛋白质等物质,可为诸多生理病理学机制研究及疾病诊疗提供丰富的基因型和表型信息。此外,由于具有低免疫原性和归巢效应,EVs作为药物运输载体时,可延长药物的半衰期,增加药物递送的靶向性[11-12]。因此,基于上述众多的生物医学价值,EVs已成为近年的研究热点。而EVs的高效分离和分析是探究其生物学机制以及发挥其临床应用价值的重要前提。
核酸适配体(aptamers)是从体内或体外筛选获得的单链寡核苷酸(DNA或RNA)[13-14],通过折叠成独特的三级结构,对靶标具有高特异性和亲和力。与其他类型的识别配体相比,核酸适配体有诸多优势。首先,核酸适配体筛选方法高度灵活,通过改变筛选靶标,可获得众多类型的核酸适配体,如针对蛋白质[15]、聚糖[16]、细胞[17]、外泌体[18-19]、细菌[20]、组织[21]等。其次,核酸适配体可通过固相合成进行批量化生产、成本低、批次间差异小,且核酸适配体稳定性好,对运输及储存条件要求低。此外,核酸适配体尺寸较小(5~10 ku),在固相界面的修饰密度更高。核酸适配体可定点修饰功能基团,在高性能捕获平台和生物传感器设计中具有独特优势。最后,核酸适配体可编程性强。基于碱基互补配对原则,通过程序化的序列设计,结合纳米技术,可实现灵活多样的信号转导与放大。核酸适配体的上述特征为EVs的分离和分析提供了众多有效策略。
本综述首先讨论了核酸适配体的筛选方法,包括传统筛选方法,以及核酸适配体筛选新方法,从提高核酸适配体的筛选效率以及获得高性能的核酸适配体两方面阐述该领域的发展。其次,总结比较了用于EVs分离的不同核酸适配体修饰界面或材料,以及不同亚型EVs的分离方法。在EVs检测方面,根据核酸适配体的识别信号的输出方式的不同,总结了基于核酸适配体的EVs电化学、可视化、表面增强拉曼散射(surface-enhanced Raman scatting,SERS)、荧光检测法,并比较了直接信号放大方法以及竞争性放大方法。最后讨论基于核酸适配体的EVs研究面临的挑战,并展望该领域未来的发展方向。
1 核酸适配体筛选方法
核酸适配体的传统筛选方法为指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)。为进一步提高核酸适配体的筛选效率,研究者们发展了高效核酸适配体筛选技术,以简化筛选步骤,提高核酸适配体甄定效率。此外,通过改变筛选条件,可以提高核酸适配体性能。目前用于细胞外囊泡分离和分析的核酸适配体的筛选主要以EVs表面蛋白质为靶标,利用上述筛选方法,研究者们筛选出多种结合EVs表面不同蛋白质的核酸适配体,可用于EVs的分离和分析(表1)。

Table 1 Aptamers used in EV isolation and analysis表1 用于EVs分离和分析的核酸适配体
1.1 传统筛选方法
核酸适配体筛选采用SELEX,该技术于1990年由Tuerk和 Gold首次提出[13,44]。经典的 SELEX流程包括:a.文库构建,化学合成库容量为1010~1016量级的随机寡核苷酸(DNA或RNA)文库;b.筛选富集,将靶标与文库共孵育,选择性分离、富集与靶标结合的寡核苷酸序列;c.扩增,通过PCR扩增与靶标结合的寡核苷酸序列,生成次级文库,用于下一轮富集;d.重复上述富集与扩增步骤,结合正筛选以及负筛选,通过多轮筛选获得与靶标高亲和力的寡核苷酸文库;e.甄定与表征,对最终富集的文库测序,甄定可与靶标高亲和力、高特异性结合的寡核苷酸序列,即核酸适配体序列。
传统SELEX往往需要10~20轮的富集才能获得候选核酸适配体序列,步骤繁琐,耗时长,效率低。此外,PCR扩增具有序列偏好性,尤其是当靶标序列在文库中丰度较低时,扩增偏差可能会掩盖高亲和力的靶标序列,降低筛选的成功率。最后,传统SELEX文库结构单一、并且在缓冲液中进行,获得的核酸适配体对工作环境(如溶液中Mg2+浓度等)要求较高,适用性差,限制了核酸适配体的广泛应用。因此,简化筛选步骤、优化筛选方法,获取结构稳定、亲和力高、适用性好的核酸适配体,是核酸适配体筛选的重要发展方向。
1.2 核酸适配体筛选新方法
针对传统SELEX存在的不足,研究者们发展了多种核酸适配体筛选新方法,提高核酸适配体的筛选效率及性能。一方面,高效的核酸适配体筛选技术,如自动化筛选平台、高效核酸适配体甄定技术以及生物信息学技术被提出,以简化筛选步骤,规避扩增偏差,提高核酸适配体甄定效率。另一方面,通过改变筛选环境,以及提高文库多样性,提高核酸适配体性能。
1.2.1 高效核酸适配体筛选技术
传统的SELEX技术操作繁琐、耗时长,限制了高性能核酸适配体的快速、大规模筛选。另外,核酸序列扩增偏差可能会导致错失最佳核酸适配体序列。因此,发展SELEX的集成化方法,简化筛选步骤,降低核酸序列扩增偏差,是当前SELEX技术发展热点之一。例如,Mendonsa等[45]和Takao等[46]基于游离寡核苷酸和靶标-寡核苷酸复合物的电荷/质量比的差异,提出毛细管电泳SELEX法。将靶标与寡核苷酸文库孵育,由于电荷/质量比的差异,毛细管电泳可产出不同的电泳迁移率,自动化分离游离的寡核苷酸和靶标-寡核苷酸复合物,无需靶标分子的固定,无需手动清除游离的寡核苷酸序列,简化了筛选步骤。另外,由于靶标免固定,靶标与寡核苷酸接触效率更高,非特异性吸附更少[47-48]。然而,靶标-寡核苷酸复合物在高电压下易解离,影响筛选结果。Lou等[49]发展了一种基于磁分离的微流控SELEX方法,利用微流控芯片中的磁场梯度,自动地将游离的寡核苷酸与结合在靶标修饰磁珠上的寡核苷酸分离。Hong等[50]报道了一种高度集成化的镍阵微流控芯片,利用连续流提高核酸适配体的筛选效率,同时减少与靶标非特异或弱结合的寡核苷酸。该平台集成了正筛选、负筛选以及分选过程,并采用荧光原位实时监测筛选过程,增强了筛选的可控性(图1a)。该平台的高度集成化缩短了筛选时间,降低了试剂消耗量,同时筛选效率提高了约10倍。在此基础上,Hong等[51]发展了可同时筛选两种核酸适配体的微流控筛选平台。上述筛选平台的简化了筛选流程,节约了筛选成本,大大提高了核酸适配体的筛选效率。Chang等[52]采用高性能微流控分选技术,发展了筛选可编程结合亲和力核酸适配体的筛选技术Pro-SELEX。将单链寡核苷酸库展示在微珠上,产生微珠文库,并与磁性纳米颗粒结合,根据磁性含量将核酸适配体颗粒分选到微流控芯片的不同隔间中,不但简化了筛选步骤,还可筛选获得具有特定亲和力的核酸适配体。
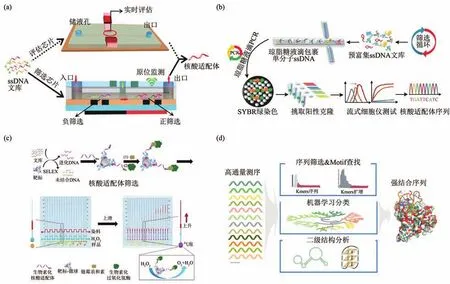
Fig.1 Efficient selection platforms for aptamers图1 核酸适配体高效筛选平台
富集文库中核酸适配体的甄定对于提高筛选效率至关重要。传统SELEX通过多轮筛选将文库缩小到相对少量的序列,再通过Sanger测序选出高频重复的序列作为核酸适配体候选序列,化学合成后实验验证候选核酸适配体的结合性能。PCR扩增中的序列偏好容易丢失结合性能较高、但扩增效率较低的序列,造成筛选失败。为解决这一问题,Zhang等[53]发展了单分子扩增方法,通过液滴微流控将核酸序列物理分割,创造无竞争的反应条件,实现单分子的扩增,消除整体扩增的偏好性。在此基础上,Zhang等[54]发展了基于琼脂糖液滴核酸适配体筛选技术(图1b)。利用液滴微流控技术将富集文库序列以单分子形式分隔至大量琼脂糖液滴,序列在琼脂糖液滴中进行单分子扩增,获得每个文库分子的单克隆产物。随后利用琼脂糖液滴的“液-固”相态转换,获得包含有单克隆序列的琼脂糖微球。通过表征每个微球中序列的结合性能,获得目标核酸适配体序列。该方法简化了核酸适配体甄定步骤,并且克服了整体扩增的偏差。随后,为了简化液滴生成操作,克服液滴生成过程对仪器的依赖,Li等[55]开发了按压式阵列微流控芯片。以手动按压的方式,将加热的液态琼脂糖分布于聚二甲基硅氧烷阵列芯片中,利用加热的硅油生成琼脂糖液滴,该过程不依赖大型仪器,液滴生成过程简单。然而,逐一表征大量的单克隆微球的过程较为繁琐、耗时。为进一步提高核酸适配体甄定效率,Zhu等[56]发展了单克隆表面展示核酸适配体筛选新方法。将扩增引物偶联于微球,利用液滴产生单分子反应体系,经单分子扩增将单分子序列复制至微球表面,获得单克隆微球文库。通过单克隆微球文库与靶标结合可视化地表征单克隆微球中序列与细胞的结合性能。该方法通过单分子液滴扩增不但克服了整体扩增的偏好,还避免了对富集文库进行克隆测序及结合力表征步骤,因此更加经济、高效。传统SELEX甄定核酸适配体依赖大型仪器,限制了其应用范围。Song等[57]开发了一种快速、便携的核酸适配体表征微流控平台Afi-Chip(图1c)。将候选核酸适配体进行生物素化标记,与靶标孵育后,再与链霉亲和素标记的过氧化氢酶结合,置于Afi-Chip中。基于酶催化H2O2分解产生的气体推动墨条移动,从而产生距离读数,以监测核酸适配体的进化,表征核酸适配体的亲和力。该方法无需复杂设备、快速、成本低,通用性强。
传统SELEX对最后一轮富集文库中的少量克隆进行Sanger测序,选出高频重复的序列为候补核酸适配体序列,但该策略只能检测到高拷贝的序列,可能错失扩增效率低、结合性能好的序列。高通量测序(high-throughput sequencing,HTS)可分析每轮富集库中的数百万个序列,并提供序列在筛选进化过程中动态变化信息,能够克服拷贝数依赖性,有助于发现高性能核酸适配体[59-60]。此外,生物信息学为从HTS数据库中高效甄定性能优越的核酸适配体提供了有力工具[61-62]。Soh等[63]将微流控筛选技术与HTS结合,仅通过3轮筛选及文库进化分析,即从千万级序列中甄定出高亲和力的核酸适配体。此外,通过比较不同富集轮次的序列发现,序列的亲和力与拷贝数无关。因此,常规序列分析法仅考虑拷贝数,可能无法获得性能最佳的核酸适配体[64]。除了富集轨迹,家族大小以及二级结构也是HTS数据库中用于核酸适配体甄定的重要序列信息。聚类分析算法基于序列共性学习[65]以及迭代比较[66]将序列聚类,将大家族中的序列作为候选序列。然而,聚类分析忽略了核酸适配体的二级结构,而二级结构决定了核酸适配体与靶标的结合性能。为此,研究者们开发多种结构基序分析方法,用于鉴定序列的二级结构[67]。例如,Song等[68]发展了序列多维分析算法SMARTAptamer(图1d)。结合多级结构分析以及无监督机器学习,综合分析基序富集、家族大小、二级结构,成功筛选出高效结合上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)的核酸适配体、波形蛋白的核酸适配体[58],以及严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)受体结合域的核酸适配体[68]。Li等[69]发展了“In Silico”筛选策略。通过结构预测模型构建单链DNA的3D结构,通Autodock Vina交叉验证、分子动态(molecular dynamic,MD)模拟以及分子力学模拟预测聚糖-核酸适配体复合物的结合模式和能量,筛选获得对巴龙霉素具有较高亲和力的核酸适配体。随着测序成本的降低及生物信息学的快速发展,高通量测序将推动核酸适配体的高效发现以及其生物医学中的应用。
1.2.2 高性能核酸适配体筛选
随着核酸适配体高效筛选平台的开发,大量核酸适配体被发现。然而,仅有少数核酸适配体具有较好的性能,限制了临床中的应用。因此,研究者们致力于优化SELEX技术以获得高性能的核酸适配体。吉布斯自由能(ΔG)可用于评估核酸适配体的亲和力,其由熵分量以及焓分量组成。与熵驱动的配体相比,焓驱动的配体与靶标之间可产生丰富的结合键,如氢键、离子键,从而提高配体的结合亲和力。Huang等[70]提出了一种分子拥挤SELEX策略,以血浆作为分子拥挤的筛选基质,降低靶蛋白和核酸适配体的自由度,抑制熵的贡献,以筛选焓驱动核酸适配体(图2a)。与缓冲液体系SELEX相比,分子拥挤SELEX进化的EpCAM核酸适配体的亲和力提高了6.5倍;筛选获得的针对SARS-CoV-2受体结合域(RBD)野生型及突变型核酸适配体的平衡解离常数分别降低了约41%和61%,对SARS-CoV-2假病毒的检测限低了约79%[71]。

Fig.2 Approaches for selecting aptamers with high properties图2 高性能核酸适配体筛选方法
核酸适配体的结合功能依赖于其折叠的三级结构,即结构决定功能。因此,文库结构多样性能够提高筛选的成功率及核酸适配体的性能。抗体由20多种氨基酸作为基本单元组成,且氨基酸侧链具有疏水、亲水或带电荷等不同特征,可利用多种相互作用与其靶标结合。相比而言,核酸适配体仅由4种核苷酸组成,其结构多样性和化学多样性都十分有限,对高效筛选高性能的核酸适配体是不利的[72]。化学修饰法是提高文库多样性的直接方法,使用化学修饰的非天然碱基从头进化,可获得化学修饰的核酸适配体[73]。例如,在嘧啶的C5和嘌呤的C8位置化学修饰蛋白样侧链或疏水基团,提高核酸适配体的亲和力[74]。该修饰还具有核酸酶耐受性,可增加核酸适配体在血清中的稳定性[75]。此外,核糖2'位置的修饰,如甲氧基取代会增加寡核苷酸和氨基酸残基之间的空间位租,从而减少核酸酶和核酸适配体之间的亲和力,增加核酸适配体的核酸酶耐受性,提高在临床样本中的稳定性[76]。然而,大多数化学修饰的核苷酸不能被传统的DNA聚合酶有效识别,限制了候选核酸适配体的扩增和测序。此外,需要大量的试验才能在核酸适配体序列中确定合适的修饰位置与基团[77]。
除了通过化学修饰获得非天然的碱基,还可通过设计非线性的核酸文库、加入结构调控分子等提高文库的多样性。例如,Liu等[78]以环状DNA文库进行进化,获得对谷氨酸脱氢酶不同表位具有高亲和力的环状核酸适配体。与线性DNA核酸适配体相比,环状DNA核酸适配体抵抗核酸酶降解,生物稳定性更高,在生物样本中有更高的应用潜力[79]。此外,环状结构易被用于设计滚环扩增(rolling circle amplification,RCA),用于组装生物传感器。Zhou等[80]采用结合抑制有机反应(BINOR)SELEX,发展了区域选择性核酸适配体筛选方法。使用羧基功能化磁珠结合高半胱氨酸表面的氨基,去除识别半胱氨酸氨基的序列,通过多轮筛选可获得只与高半胱氨酸的烷烃硫醇链侧链结合而不与氨基结合的核酸适配体序列。Huang等[81]提出“卡夹核酸适配体(clipped aptamers)”概念,在筛选文库中加入DNA错配结合小分子Z-NCTS,Z-NCTS与核酸序列中预设的CGG/CGG序列之间产生“别针”样特异性相互作用,调节其结合亲和力(图2b)。因此,筛选获得EpCAM核酸适配体,能够被Z-NCTS调控从非活性状态到活性状态的有效转变,调节细胞的黏附能力。该核酸适配体的结构多样性使其在生物传感、细胞行为调节和药物递送方面具有巨大的潜力。
传统的SELEX技术获得的核酸适配体通常是单价的。与多价相互作用相比,单价作用因明显的“协同缺陷”,结合亲和力较低[83]。通过支架将单价核酸适配体组装为多价核酸适配体的策略是目前常用的多价策略,但需要精确控制核酸适配体之间的距离和取向,并预先获得匹配靶标的核酸适配体对[84]。对于没有匹配的核酸适配体对的靶分子,体外筛选策略能快速获得多价核酸适配体。例如,Tang等[82]受抗体和抗原之间自然进化的多价相互作用启发,使用预先组装的DNA框架库,实现EpCAM的“抗体样多价核酸适配体”(Amap)从头进化(图2c)。通过从头定向进化避免了核酸适配体对的试错,通过DNA框架介导的Apt 1和Apt 2的多价性有效地提高核酸适配体的结合性能,此外,筛选获得的核酸适配体具有刚性的DNA-三角形框架,具有更好的结构稳定性和刚性,为快速获得高亲和力的多价核酸适配体提供了有效策略。
2 基于核酸适配体的EVs分离方法
EVs的分离富集方法通常利用EVs与体液中其他组分的物理性质差异,如差速离心法、尺寸排阻色谱、聚合物沉淀法等,但存在回收率低、纯度低、步骤繁琐、耗时长等问题。核酸适配体修饰于不同的材料或界面,基于核酸适配体与EVs表面标志物的特异、高效识别作用的亲和分离法,可有效提高EVs分离的效率及纯度(表2)。

Table 2 Summary of EV isolation methods表2 EVs分离方法总结
目前,研究者们已将核酸适配体修饰于不同的材料或界面,用于EVs的捕获,如磁珠[27]、碳布[25]、石墨烯[85]、Ti2CTxMXene膜[86]等。然而,单价的核酸适配体容易被降解,造成局部核酸适配体浓度降低,降低捕获效率。Xue等[87]利用滚环扩增在微珠表面制备长单链DNA多价核酸适配体,通过多价效应提高了核酸适配体的亲和力,从而有效提高了EVs的捕获效率。
EVs捕获通常发生于固-液界面,而溶液中的EVs与传统亲和界面上的核酸适配体之间的接触机会有限,导致EVs低捕获效率。为解决上述问题,Niu等[32]设计了一种流动纳米多孔微界面(FluidporeFace)微流控芯片,实现肿瘤来源EVs的高效捕获与灵敏检测。在微流控芯片基底构筑纳米多孔鱼骨型微阵列,并在其表面包裹一层修饰磷脂双分子层和修饰EpCAM核酸适配体。该芯片中,鱼骨型结构有效促进EVs向界面的传质,多孔结构克服界面的流体的黏滞阻力,提高EVs和界面之间的紧密接触,流动磷脂双分子层膜界面可使识别分子聚集,产生流动多价效应,与非流体界面相比,亲和力提高了83倍。该芯片对肿瘤来源EVs的检测限低至10颗粒/μl。为了便于下游分析,Niu等[33]进一步发展了一种可控去组装的流动多价磁性界面(FluidmagFace)芯片(图3a)。首先,在磁珠表面形成脂质双分子层,通过疏水作用修饰EpCAM核酸适配体形成流动界面磁珠(FluidFaceMBs)。随后,在外加磁场作用下,FluidFaceMBs被磁吸引于鱼骨形芯片基底,形成FluidmagFace。与非流动界面相比,FluidmagFace的亲和力提高105倍,分离EVs的效率提高了13.9%。基于磁控去组装,该方法可简便、高效地释放被捕获的EVs,用于EVs蛋白质组学分析。

Fig.3 Aptamer-based isolation methods for EVs图3 基于核酸适配体的EVs分离方法
核酸适配体捕获EVs时易受体液中游离蛋白质的干扰,降低捕获EVs的纯度及检测准确性。为克服这一问题,Zhang等[29]通过脂质探针和细胞程序性死亡配体1(programmed cell death ligand 1,PD-L1)核酸适配体作为输入,进行DNA逻辑计算,实现了PD-L1+EVs的特异性捕获(图3b)。通过设计能嵌入EVs膜的胆固醇DNA探针和PD-L1核酸适配体探针,只有当胆固醇DNA和PD-L1核酸适配体探针同时存在时,才能诱导生物素标记的连接器激活的DNA计算,而游离PD-L1蛋白无法激活连接器。该方法可特异性分离PD-L1+EVs,排除游离PD-L1蛋白的干扰。该方法对癌症患者的检测灵敏度和特异性达100%。EVs具有高度异质性,不同表型的EVs代表不同的来源及生物学功能,而上述方法均无法分离不同表型的EVs。Lu等[28]开发了一个模块化平台,用于分离肿瘤和非肿瘤来源PD-L1+EVs(图3c)。肿瘤来源的EVs可与EpCAM和PD-L1核酸适配体识别并诱导“AND”逻辑运算,而非肿瘤来源的PD-L1+EVs仅表达PD-L1,可诱导“NOT”逻辑运算。上述两个独立的输出可以通过串联微流控分别实现肿瘤和非肿瘤来源的PD-L1+EVs分离。该方法可用于区分癌症患者和健康人,还可以释放EVs用于下游分析。总之,EVs的高效分离是其生物学功能研究和临床应用的前提,仍需发展高效、高纯度的EVs亚型分离新方法。
3 基于核酸适配体的EVs检测方法
EVs的定性和定量分析对发展疾病诊断新方法至关重要。核酸适配体由于具有DNA可扩增,可程序化设计等优势,易于构建生物传感器用于EVs的分析。研究者们发展了一系列基于核酸适配体的EVs分析方法,根据信号输出方式的不同,可分为电化学、可视化、表面增强拉曼光谱、荧光法等(表3)。此外,为提高EVs检测灵敏度,研究者们也发展了多种基于核酸适配体的信号放大方法。

Table 3 Summary of EV analysis methods表3 EVs分析方法总结
3.1 电化学检测
基于核酸适配体的电化学检测方法,是将核酸适配体与EVs的结合转变成电信号。通过对电信号的检测,实现EVs的快速、灵敏和选择性检测[114-115]。核酸适配体作为生物识别元件通常被修饰于电极表面,其修饰方法会影响核酸适配体对EVs的识别和结合效率[114]。目前,研究者们已开发多种核酸适配体修饰电极的方法以提高检测灵敏度。
核酸适配体可以直接修饰于电极表面。例如,硫代核酸适配体可以通过Au-S键有效地固定在金电极表面,当捕获EVs时,引起电活性标签或探针的电化学性质改变从而输出电信号[116]。固定在电极表面的核酸适配体之间需有一定的间距,保证核酸适配体识别靶标并折叠后进行信号转导。可以利用巯基己醇取代金电极上非特异性吸附的核酸适配体,以提高核酸适配体的方向性,并降低核酸适配体的非特异吸附[117-118]。Zhou等[24]通过这种方法,将CD63核酸适配体固定在金电极表面,并将其集成到微流控平台中。该平台对外泌体的检出限低至1×103颗粒/μl。Pei等[119]研究表明,多聚腺嘌呤可辅助核酸适配体在金电极表面的固定,多聚腺嘌呤不仅能与Au纳米颗粒表面结合,还能有效阻断非特异性DNA-Au结合,进而精确控制金电极表面核酸适配体的定位和密度。
此外,在金电极表面修饰石墨烯基材料也是降低非特异性吸附的常用方法。Szunerits课题组[34,120]用聚乙烯亚胺/还原氧化石墨烯薄膜修饰金电极,将炔基修饰到聚乙烯亚胺/还原氧化石墨烯薄膜,通过铜催化Click反应将叠氮化核酸适配体固定在电极表面,进而用于EVs分析[34,120]。基于核酸适配体的外泌体电化学传感器大部分使用单信号输出,易受环境干扰。Sun等[89]开发了一种新型的双信号和内在自校准外泌体核酸适配体传感器,将黑磷纳米片(BPNSs)和二茂铁(Fc)掺杂的金属有机框架(ZIF-67)组装于氧化铟锡(ITO)薄片上,接着在ITO薄片上修饰亚甲基蓝(MB)标记的单链DNA适配体,构建成核酸适配体-BPNSs/Fc/ZIF-67/ITO传感器(图4a)。该传感器具有MB(标记在核酸适配体上)和Fc(掺杂至ZIF-67中)的双重氧化还原信号反应,在检测乳腺癌细胞MCF-7分泌的外泌体时,MB的氧化还原电流有规律地降低,而Fc(作为参照)的氧化还原电流几乎不变,以氧化还原峰值电流强度的双信号比(IFc/IMB)作为信号输出,实现了内在自校准,使检测限低至0.1颗粒/μl,展现出了良好的选择性和高灵敏度。固定在电极上的核酸适配体通常是无序且缠绕的,一定程度上影响了核酸适配体和EVs的结合。为了克服这一挑战,Wang等[88]采用DNA四面体为支架锚定核酸适配体,提高了核酸适配体在界面组装的方向性,提高了对外泌体的识别及捕获效率(图4b)。与传统的核酸适配体传感器相比,该方法对肝癌细胞外泌体的检测灵敏度提高了100倍。

Fig.4 Aptamer-based electrochemical detection of EVs图4 基于核酸适配体的EVs电化学检测
直接将核酸适配体固定在电极表面用于识别EVs,并产生电化学信号的方法耗时、昂贵、可控性差,易受非特异性吸附的干扰,并且核酸适配体与外泌体的识别受限于溶液-电极界面反应效率[114]。针对此问题,研究者们发展了“捕获探针-外泌体-核酸适配体”的夹心法,大大提高了检测灵敏度。例如,Feng等[90]通过水热法合成了三维立方体(AuPt DNs)/Ti3C2,并修饰CD63适配体,可用于外泌体捕获。同时将CD63修饰的氧化石墨烯固定在丝网印刷碳电极上,被捕获的外泌体与氧化石墨烯上CD63适配体识别,可引起丝网印刷碳电极上电化学信号的改变,以检测结直肠癌外泌体(图4c)。在最佳条件下,该平台的检测线性范围为100~5×105颗粒/μl。除了“捕获探针-外泌体-核酸适配体”的夹心法外,研究者们还开发了免固定的均相电化学传感器。在均相电化学传感器中,无需信号探针标记,靶标识别和信号放大过程都在均相溶液中进行,极大地提高了灵敏度。例如,Yin等[91]开发了一种基于蒽环类阿霉素信号报告和核酸外切酶III(Exo III)辅助扩增的免固定均相电化学传感平台。该传感器包括核酸适配体探针P1、触发DNA探针P2和发卡DNA探针Hp。当P1与外泌体蛋白CD63结合,释放出一个P2探针,随后,P2与另一个富含GC的Hp探针杂交,并触发Exo III切割,最终使溶液中的Hp探针数量减少。阿霉素可以与双链GC序列结合,产生电流信号。此方法检出限低至12颗粒/μl。总之,由于高灵敏度和简便性,基于核酸适配体的EVs电化学传感器有望成为临床标志物的有效分析工具,但仍需更多的研究以提升电化学方法的检测性能,拓展应用范围。
3.2 可视化检测
可视化检测方法利用肉眼可辨识的信号及信号变化检测待测物,具有快速、操作简单、仪器便携等优势,有较大的现场应用潜力。比色法通常使用不同的酶,包括天然酶、纳米酶等催化显色底物,如2,2'-氮唑[3-乙基苯并噻唑-6-磺酸]-二铵盐(ABTS)和3,3',5,5'-四甲基联苯胺(TMB)等,使其产生颜色变化信号,用于靶标的可视化检测。天然酶具有较高的催化活性和底物特异性,然而一些固有的缺点,如分离提纯难、稳定性差、昂贵,限制了其适用性。纳米酶具有成本低、可批量制备、稳定性高等优点,在生物医学领域具有广泛的应用前景[121]。自从具有酶活性的Fe3O4纳米颗粒被发现以来[122],零维纳米酶被广泛用于模拟过氧化物酶在靶标可视化检测中的应用。
Chen等[23]构建了基于Fe3O4纳米颗粒的核酸适配体传感器,用于可视化检测前列腺癌患者血浆中的外泌体。EpCAM核酸适配体非特异吸附在Fe3O4纳米颗粒上,提高Fe3O4纳米颗粒的催化活性,在反应体系中催化TMB生成蓝色的氧化产物。当外泌体存在时,核酸适配体与外泌体上EpCAM结合,脱离Fe3O4纳米颗粒,导致Fe3O4纳米颗粒的酶催化活性降低。因此,外泌体的含量与TMB颜色变化程度呈负相关。尽管零维纳米酶的结构设计取得了较大进展,但纳米颗粒易聚集并且具有有限的表面积和可及性,不利于充分发挥纳米酶的催化功能[123]。与零维纳米酶相比,二维纳米材料,如纳米片、纳米带、纳米板和纳米壁等呈片状结构,具有较大的比表面积和较高的酶活性[124],被用于构建高效比色传感平台。例如,Xia等[92]将单层石墨烯卷曲成单壁碳纳米管(s-SWCNTs),构建比色传感平台。此外,Wang等[93]以石墨氮化碳纳米片(g-C3N4NSs)作为二维纳米酶,用于EVs的检测(图5a)。将核酸适配体吸附在g-C3N4NSs上,核酸适配体与外泌体识别后从g-C3N4NSs上脱离,降低其酶催化活性,极大地提高了外泌体检测的灵敏度,实现外泌体的可视化检测。尽管二维纳米材料与零维纳米材料相比,酶催化能力有所提高,但检测灵敏度仍不能满足临床诊断需求。因此,信号放大方法,如末端脱氧核苷酸转移酶(TdT)[94]、杂交链式反应(HCR)[95]、滚圈扩增(RCA)[96]、链位移扩增(SDA)[97]、球形核酸(SNAs)[97]等被用于提高EVs比色检测的灵敏度。
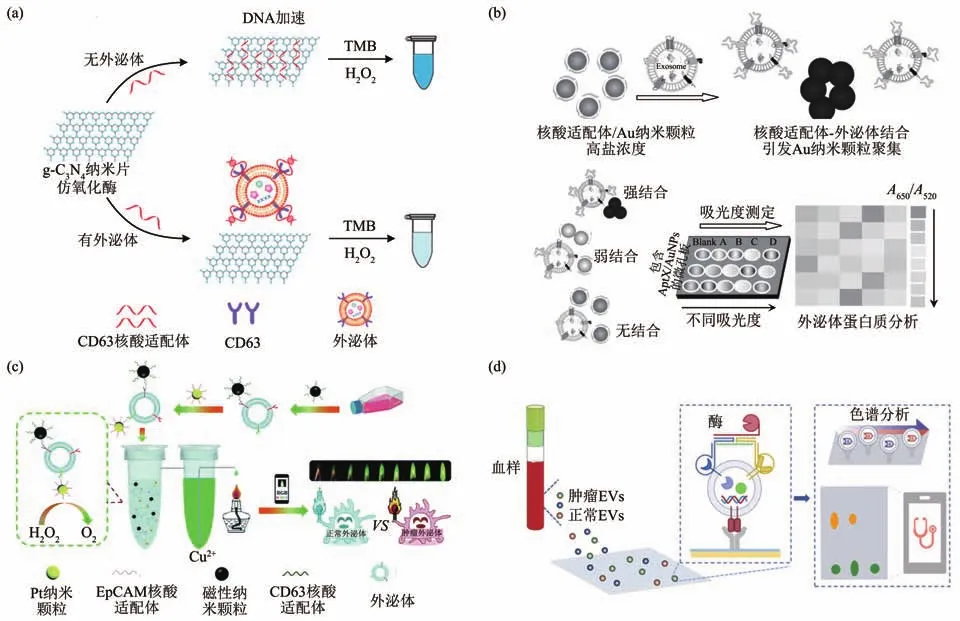
Fig.5 Aptamer-based visual detection of EVs图5 基于核酸适配体的EVs可视化检测
基于核酸适配体的外泌体可视化检测并未局限于酶催化底物显色的原理。例如,Jiang等[125]构建了仅依赖Au纳米颗粒和一组核酸适配体的外泌体可视化检测传感器(图5b)。该传感器的工作原理简单:核酸适配体与Au纳米颗粒的络合作用可防止Au纳米颗粒在高盐溶液中聚集;而核酸适配体与外泌体结合后,会从Au纳米颗粒脱离,导致Au纳米颗粒聚集从而产生颜色变化。Hu等[98]发展了气压辅助的原子火焰测定法(图5c)。在该体系中,EpCAM核酸适配体-外泌体-Pt纳米颗粒复合物产生酶催化反应,催化H2O2产生O2,O2通过密闭的装置进入装有Cu2+溶液的容器中,产生的压力将一定量的Cu2+溶液排出装置外,不同含量Cu2+溶液可产生不同颜色的原子火焰,进而对外泌体进行定量检测。Ding等[99]在便携式微孔板上构建抗体-核酸适配体夹心免疫结构,特异性识别EVs。设计的核酸适配体引物与多功能环状DNA模板(CDT)序列匹配,在EVs表面触发原位切割介导的指数滚动圆扩增(CM-ERCA),产生大量血红素/G-四联体,催化TMB的氧化,氧化的TMB具有良好的光热效应,产生热量输出信号,仅通过家用温度计的读数即可实现EVs的定量检测。Yu等[100]基于外泌体膜上CD63蛋白的核酸适配体,成功开发了以Au纳米颗粒为可视化探针的低成本侧流核酸适配体测定(LFAA)试纸条。CD63核酸适配体-Au纳米颗粒复合物与修饰于试纸条上的DNA互补配对,试纸条T线显色。外泌体与CD63核酸适配体-Au纳米颗粒复合物识别,该复合物从试纸条上脱离,T线颜色减弱,以此可视化检测外泌体。此外,Yang等[126]提出了单个EVs表面分子模式识别策略,结合单个EVs上双靶标蛋白协同识别和逻辑计算,以及酶比色信号放大,实现肿瘤EVs的可视化检测(图5d)。设计靶蛋白结合配体Apt-S1-R1,该配体包含3个结构域:特异性识别EVs表面靶蛋白的核酸适配体域、间隔域(S1)以及报告激活域(R1)。使用两种Apt-S1-R1分别识别EVs表面不同的蛋白质后,加入DNA辅助链(S2)和报告探针(R2,生物素修饰)触发“AND”逻辑运算,连接上报告探针(R2),再通过生物素-链霉亲和素相互作用在R2上连接酶,催化比色反应,结合薄层色谱(TLC),实现裸眼可见的可视化信号输出,可用于乳腺癌和前列腺癌的筛查。总之,可视化检测方法具有快速、便携的特点,适用于床旁检测以及资源有限地区的应用。然而,可视化检测方法的灵敏度需要进一步提高。
3.3 表面增强拉曼光谱检测
表面增强拉曼散射(SERS)是一种特殊的拉曼散射现象,指的是在一些特殊材料,如金属(Ag、Au)纳米颗粒表面,分子的拉曼散射光谱强度显著增强。由于较窄的光谱指纹特征,SERS与核酸适配体组合的检测平台已广泛应用于EVs的检测。
SERS的信号增强效应集中在高折射率面(即尖端和边缘)[127],因此,使用具有尖端或锋利边缘的纳米结构,如纳米金字塔和纳米星,可获得比传统的球形纳米颗粒更强的SERS信号[128]。另外,还可通过调控金属纳米粒子的组装模式来调整其等离子体特性,从而增强拉曼散射信号[127-128]。例如,Pan等[101]将Au纳米星(AuNSs)修饰于二硫化钼(MoS2)纳米片上,组成MoS2-AuNSs复合材料,将SERS信号分子ROX标记的核酸适配体组装在MoS2-AuNSs表面,捕获外泌体。通过AuNSs和MoS2纳米片的协同拉曼增强效应,获得了较强的SERS信号,外泌体的检测限达17颗粒/μl。Zhang等[102]在三角锥DNA中组装Au纳米颗粒,获得强电磁热点SERS探针(图6a)。在这种SERS探针中,Au纳米颗粒之间的连接处可出现强电磁热点,从而产生较强的SERS信号,同时,精确排列的TP-DNA纳米结构允许在三角形的特定角上组装识别DNA,避免交叉偶联事件。该方法对外泌体的检测限达1.1×102颗粒/μl。除了通过改进金属纳米颗粒的组装模式来增强检测的信号强度,多种核酸扩增技术也被广泛用于提高SERS传感器检测外泌体的灵敏度。如Cun等[103]将碱性磷酸酶诱导的SERS信号增强与HCR扩增相结合,建立一种快速检测外泌体的-SERS免疫分析法,外泌体的检出限为19颗粒/μl。

Fig.6 Aptamer-based SERS detection of EVs图6 基于核酸适配体的EVs SERS检测
非特异性吸附和金属纳米颗粒的随机聚集导致热点分布不可控,进而导致SERS检测结果重复性差。因此,减少非特异性吸附,以及精确控制颗粒间距分布是灵敏和可重复性SERS分析的必要条件。Zhu等[104]将疏水等离子体底物与纳米颗粒相结合,在没有目标外泌体的情况下阻止Au@Ag纳米立方体(Au@Ag NCs)非特异吸附SERS探针,提高结果可重复性(图6b)。此外,Wang等[105]提出了一种基于自组装金纳米棒(AuNR)垂直阵列的超灵敏外泌体检测新策略(图6c)。AuNRs表面修饰的EpCAM核酸适配体捕获外泌体后,DNA逻辑过程发生,CD63和HER2核酸适配体双识别靶外泌体形成Co-DNA-Locker复合物,通过罗丹明6G的SERS信号检测外泌体。AuNRs均匀地排列成六边形,密集的“热点”产生的“热表面”大大提高了检测的灵敏度和均匀性。
尽管SERS技术可用于外泌体的检测,但有限的样本量下实现外泌体的高效全面分析仍具有挑战性。Ning等[106]为实现肿瘤相关外泌体的多重检测,制备了3种核酸适配体修饰的磁珠(MB),以及修饰不同拉曼报告分子的3种金-银-银核-壳-壳纳米棒(GSSNT)。3种GSSNT偶联有DNA,通过碱基互补配对与核酸适配体探针杂交锚定在MB上,核酸适配体与靶外泌体特异性结合可释放GSSNT,导致SERS信号减弱,从而实现外泌体的多重检测(图6d)。SERS技术因其高灵敏度、高分辨率、快速、低背景、抵抗基质干扰以及对生物样品的无创性等优点在临床诊断中具有很大的应用前景。
3.4 荧光检测
荧光法具有灵敏度高、特异性好等优势,在EVs的检测中应用广泛。由于核酸适配体具有可编程性,可设计一系列的荧光生物传感器,用于EVs的定量以及定性分析。使用荧光标记的核酸适配体识别EVs表面蛋白质是当前EVs荧光检测的常用方法,例如,Bai等[107]利用荧光分子标记的EpCAM和PD-L1核酸适配体预先识别细胞培养基或者血清中的外泌体,通入螺旋芯片中,纳米尺度的预标记外泌体在螺旋芯片的黏弹性流体中单线聚集而被分离。实现了单颗粒水平的外泌体检测(图7a)。然而,该方法难以排除游离蛋白质的干扰,在临床诊断中的应用价值受限。Hao等[30]提出了核酸适配体-二价胆固醇锚定组装DNAzyme(ABCzyme)的策略,用于选择性检测PD-L1+EVs(图7b)。利用PD-L1核酸适配体识别EVs表面PD-L1,二价胆固醇修饰的双链DNA插入EVs的磷脂双分子层,两者在连接DNA链的作用下原位组装成ABCzyme,可切割与其杂交的荧光报告DNA链(末端标记荧光分子FAM和猝灭分子BHQ1,具有RNA切割位点),释放FAM荧光分子。通过检测溶液中FAM的荧光强度,即可反映EVs来源的PD-L1表达量,排除游离PD-L1蛋白的干扰,可用于动态监视癌症发展情况。

Fig.7 Aptamer-based fluorescence detection of EVs图7 基于核酸适配体的EVs荧光检测
在非均匀温度场的溶液中,具有不同物理性质的分子的扩散速率不同,该现象被称为热泳。热泳技术具有灵敏度高、无需预标记EVs、试剂与样品消耗量少等优势,在EVs快速分析中的应用日益广泛。Huang等[26]使用筛选获得的PD-L1核酸适配体标记外泌体,在热泳装置的热点中,利用结合在外泌体的PD-L1核酸适配体比游离的核酸适配体扩散速度慢的特点,实现PD-L1+外泌体的快速、高灵敏度分析(图7c)。Liu等[41]结合7种荧光标记的核酸适配体与热泳技术,用于6种癌症的检测和分类。Tian等[108]结合8种荧光标记核酸适配体与热泳技术,用于分析血浆EVs的癌症相关蛋白质谱,可鉴别非转移性乳腺癌、转移性乳腺癌和健康人,成功实现转移性乳腺癌的疗效预测。尽管上述方法可用于EVs的多靶标分析,但无法区分EVs的来源。Deng等[129]基于两种核酸适配体的“AND”逻辑运算,发展肿瘤来源外泌体前列腺特异性膜抗原(prostate specific membrane antibody,PSMA)的选择性检测(图7d)。EpCAM和PSMA的核酸适配体分别标记Cy3和Cy5荧光。仅当EpCAM和PSMA核酸适配体同时结合于外泌体表面EpCAM或PSMA时,Cy3和Cy5可在桥联DNA链的作用下靠近,并发生荧光共振能量转移。通过热泳检测荧光共振能量转移信号,选择性分析肿瘤来源外泌体PSMA。该方法区分前列腺癌患者与良性前列腺增生的准确度可达91%。
上述检测方法多对EVs进行定量检测或者检测其表面蛋白质。近期研究表明,EVs表面蛋白质的糖基化修饰在肿瘤发展和转移过程中有重要作用[130],因此,检测EVs蛋白糖基化对理解EVs的细胞间通讯功能具有重要意义。传统的EVs表面蛋白质糖基化检测方法有免疫印迹[131]、质谱[132]和凝集素阵列[133]等,这些方法需要将EVs裂解,纯化蛋白质。因此,难以准确探究EVs蛋白糖基化的生物学功能。为实现EVs蛋白糖基化的原位、非侵入检测,Guo等[110]通过结合局部化学重塑和定量电化学,实现MUC1末端半乳糖/N-乙酰氨基半乳糖定量检测。Wang等[109]发展了一种自助式轨道DNA行走器(STDW),以外泌体作为三维(3D)轨道,利用催化发卡组装(catalytic hairpin assembly,CHA)驱动的分体式核酸适配体识别启动行走器的自主运行,可实现外泌体N-乙酰半乳糖胺修饰蛋白的高灵敏度检测(图8a)。代谢聚糖标记是一种利用非天然单糖代谢途径标记细胞表面聚糖的方法,结合代谢聚糖标记和荧光共振能量转移,可实现蛋白糖基化的原位、非侵入检测[134]。Zhu等[135]利用Cy3标记的PD-L1核酸适配体(PD-L1-Cy3)识别外泌体表面PD-L1,代谢聚糖标记以及后续生物正交反应引入的Cy5荧光标记外泌体表面的糖,利用Cy3与Cy5的荧光共振能量转移,实现外泌体表面PD-L1糖基化的原位可视化检测(图8b)。该方法首次证实了外泌体表面PD-L1糖基化在PD-1识别和CD8+T细胞增殖抑制中的生物功能。随后,Kang等[136]利用代谢聚糖标记以及PD-L1核酸适配体标记,结合非功能表位杂交链式反应(hybridization chain reaction,HCR),将EVs表面PD-L1糖基化信号增强了7.7倍。为探究外泌体PD-L1糖基化在癌症诊断中的应用价值,Zhu等[111]发展了基于凝集素以及核酸适配体的邻位连接方法,结合实时定量PCR定量检测糖基化外泌体PD-L1,检测限达1.09 μg/L,并首次验证了糖基化外泌体PD-L1比总外泌体PD-L1具有更高的癌症诊断价值。
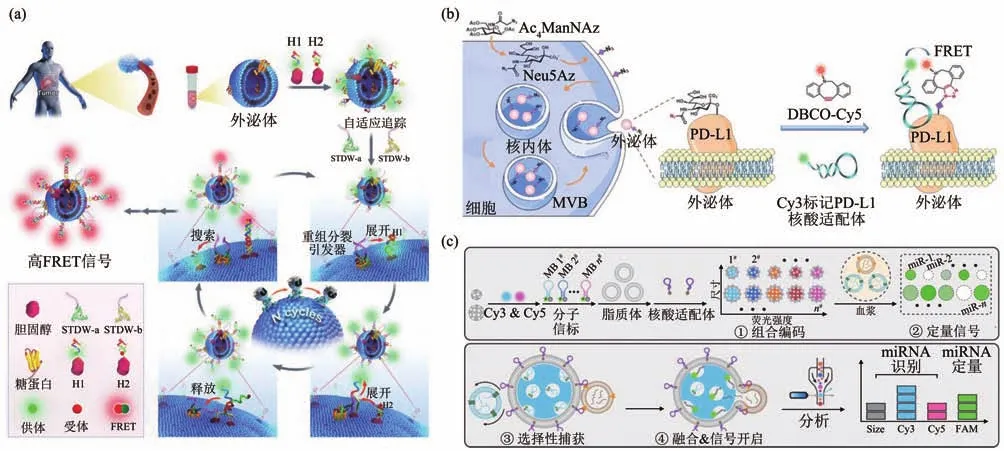
Fig.8 Aptamer-based detection of EV protein-specific glycosylation and nucleic acids图8 基于核酸适配体的EVs蛋白糖基化和核酸检测
除丰富的蛋白质外,EVs还包含有大量细胞来源的核酸分子,如DNA、RNA、miRNA等,它们在疾病发展中具有重要的作用[137]。传统EVs的miRNA分析方法包括核酸酶辅助信号放大[138],下一代测序技术[139]等,这些方法需要裂解EVs、提取核酸、逆转录等过程,步骤较为繁琐,并且易造成miRNA降解。Cui等[112]发展了一步原位分析EVs miRNA的方法。通过核酸适配体介导的脂质体与EVs的融合,脂质体中包裹的分子信标与EVs中的miRNA识别后荧光信号恢复,利用流式细胞仪即可高效分析EVs中的肿瘤来源miRNA。该方法无需裂解待测EVs,且具有特异性好、耗时短和通用性强等优势。利用该方法首次发现PD-L1+EVs中miRNA-21与患者的肿瘤负荷相关。进一步,Feng等[113]提出了一种编码融合策略,通过制备具有内置编码的膜融合载体,用于肿瘤EVs miRNA的多重检测(图8c)。以双编码多孔硅珠为载体,制备一组编码的靶向融合微珠(ETFBs),且微珠内装载有识别miRNA的分子信标。在微柱表面覆盖脂质双分子层,并修饰肿瘤EVs靶向核酸适配体,用于选择性识别和融合肿瘤EVs。融合后,微珠中分子信标与其靶向的miRNA互补配对开启报告信号,通过商品化流式细胞仪即可对肿瘤EVs的miRNA进行多重检测,用于胰腺癌的诊断。
3.5 信号放大方法
为了提高EVs的检测灵敏度,往往需对与EVs结合的核酸适配体的输出信号进行放大。核酸适配体因易组装与可程序化设计等优势,可实现与多种信号放大机制结合,以增强EVs的分析灵敏度。核酸适配体的信号扩增方法分为两种:直接信号放大以及竞争性信号放大。
直接信号放大是通过特殊的序列设计,在核酸适配体序列中增加功能性片段,利用功能性片段直接触发核酸扩增反应,实现待测信号放大。常用的核酸扩增方法有RCA、HCR、CHA等。例如,He等[140]发展了基于挂锁探针式指数RCA扩增方法(R-EPCA),用于EVs的高特异性和高灵敏荧光检测。通过挂锁探针(具有核酸内切酶切割位点)与偶联于特异性核酸适配体末端的引物序列的互补配对,引发指数RCA反应,用核酸内切酶切割R-EPCA反应产物,可产生单链DNA,用于下一轮扩增。用荧光染料SYBR Green II将R-EPCA产物染色,即可反映EVs的含量。该方法对EVs的检测限为~4.2颗粒/μl。但RCA反应操作复杂,且反应过程依赖酶催化,从而限制了其在临床诊断中的应用。HCR与CHA为无酶核酸扩增技术,在临床样本检测中的适用性更好。例如,Shen等[141]发展了一种单个EV流式分析技术,用于单个EV计数以及表型分析(图9a)。通过设计一种由CD63核酸适配体和触发结构域组成的可切换探针,用于触发HCR扩增,不仅放大了荧光信号,还将EVs的尺寸增加至500 nm以上,使用传统流式细胞仪即可检出EVs的荧光信号。Chen等[142]设计了一种可编程恒温级联式无酶报告器(PIKER),利用EpCAM和CD63核酸适配体分别标记外泌体表面对应靶标,并与CHA扩增结合,用于定量分析肿瘤患者血浆中肿瘤来源EVs和总EVs(图9b)。该方法对肿瘤来源EVs的检测限达420颗粒/μl。然而,直接信号放大方法中,核酸扩增一般在EVs表面发生。受空间位阻的影响,扩增效率有限,影响信号放大效率。

Fig.9 Signal amplification methods图9 信号放大方法
竞争性信号放大方法中,设计特殊的扩增反应引发序列,使其与EVs表面蛋白竞争核酸适配体上的序列。无EVs存在时,引发序列与核酸适配体互补配对,无法引发核酸扩增反应;而当EVs与核酸适配体结合后,释放引发序列于溶液中,在溶液中进行扩增反应。因此,核酸扩增反应产物不受空间位阻的影响,具有较高的扩增效率。例如,Zhou等[143]发展了竞争CHA扩增反应,用于肿瘤EVs的高灵敏检测(图9c)。将核酸适配体偶联于磁珠上,并与一段引发序列互补配对,EVs竞争性地与核酸适配体识别后释放引发序列,引发序列在溶液中完成CHA扩增,该方法对EVs检测灵敏度低至0.1颗粒/μl。Cheng等[144]发展了一种基于黏性末端介导的链置换反应(TMSD)的双色DNA纳米装置,用于高灵敏同时分析EVs表面CD63和MUC1蛋白(图9d)。使用CD63和MUC1核酸适配体-磁珠纳米复合物识别EVs后,释放引发序列,触发TMSD扩增,该方法对CD63+EVs和MUC1+EVs的检测限分别为 67颗粒/μl和37颗粒/μl。除此之外,也可预先完成序列扩增,再通过EVs与功能化序列竞争核酸适配体的结合位点,释放已扩增好的荧光信标,来实现信号扩增,简化操作步骤[145]。
得益于核酸适配体的易化学修饰性以及可程序设计性,以核酸适配体为识别配体可以很容易地实现EVs的灵敏、特异性检测。电化学方法具有快速、灵敏的特点,但易受环境干扰,需提高其在临床样本中的检测性能。可视化方法根据肉眼可辨识的信号检测待测物,具有快速、操作简单、仪器便携等优势。尽管可视化方法的灵敏度有待提高,其不依赖大型仪器的特点使其较适用于即时检测(POCT)。SERS具有灵敏度高、分辨率高等特点,但其对临床样本定量检测的准确度有限。荧光法利用荧光信号对EVs进行检测,荧光标记策略发展以及丰富多样的信号读出装置的开发,使其成为EVs检测最常用的方法之一。但其依赖大型仪器的特点使其不适用于现场检测。EVs的纳米尺度为其高灵敏检测提出了挑战,核酸适配体的可程序设计性使其易于与多种放大机制结合。研究者们提出多种直接信号放大以及竞争性信号放大方法,大大提高了EVs检测的灵敏度,为其临床应用提供了支撑。
4 总结与展望
EVs通过将蛋白质、核酸、代谢物等传递到受体细胞中,改变受体细胞的生物学反应,在诸多生物学过程,如免疫反应、组织修复、干细胞维持中发挥重要作用。EVs还参与调控一系列病理过程,如癌症、心血管疾病、神经退行性疾病、病原体感染等。因此,探究EVs的生物医学机制,有助于理解疾病的发生发展过程并为疾病的治疗提供指导。此外,EVs包含丰富的生物标志物,可为疾病的诊断和预后分析提供重要信息。EVs还可用作药物运送的载体,用于疾病的治疗。因此,EVs的高效分离和检测在其临床应用中具有重要意义。核酸适配体作为一种高性能的识别配体,具有易合成、易化学修饰以及可程序化设计等特点,为EVs的高效分离和分析提供有效识别工具。本综述全面概述了核酸适配体的筛选方法、基于核酸适配体的EVs分离方法、基于核酸适配体信号转导方式的EVs检测方法以及信号放大策略。
尽管EVs具有较好的临床应用潜力,基于核酸适配体的EVs的分离和检测面临诸多挑战。首先,现有的特异性识别EVs表面蛋白的高性能核酸适配体较少,并且核酸适配体在复杂体系中的结合性能通常会降低,限制了其在临床中的应用。尽管研究者们已发展多种筛选方法以及工程策略,用于加速核酸适配体的发现,及提高核酸适配体的性能,但这些识别分子或元件在复杂样本中的可靠性有待验证。其次,EVs异质性较强。除尺寸异质性,不同EVs亚群显示出不同的生物物理性质,如电荷性和刚性,蛋白质组、核酸组、糖组的差异[146],以及来源的异质性。不同的亚群的生物学功能以及与疾病的相关性不同。然而,这些异质性的EVs表达的某些蛋白质通常是重叠的,限制了不同亚群EVs的准确分离和分析。最后,现有EVs研究方法的生物学和临床意义需进一步验证。现有方法通常分离分析培养的细胞系上清或体液中的EVs,失去了组织中多种共生细胞的相互作用信息[147]。此外,将细胞分泌的EVs掺入血清或血液样品,以模拟临床样本的模型不能代表体液中EVs的真实生物状态,需要足够的临床样本评估其临床价值。
随着对EVs的生物学性质的理解深入,对EVs高效、精准分离和分析的需求将持续增长。自动化技术以及生物信息学的发展将加速高性能核酸适配体的发现;DNA纳米技术可用于构建在临床样本中性能优越的核酸适配体识别元件;结合多种核酸适配体以及其他识别分子的逻辑运算的方法可用于分离分析不同亚群的EVs。此外,随着组织中EVs研究的逐渐开展,对EVs的生物学功能的理解将更加全面。总之,基于核酸适配体的EVs分离分析的临床转化将有助于疾病的精准诊疗。
