免疫检查点抑制剂联合方案治疗转移性尿路上皮癌的研究进展
2023-09-25刘建兵 岳中瑾 尚攀峰 刘雅婷 常宏
刘建兵 岳中瑾 尚攀峰 刘雅婷 常宏
通信作者简介:岳中瑾,博士研究生,兰州大学第二医院泌尿外科首席专家、主任医师、教授、博士生导师。甘肃省泌尿系疾病临床医学中心副主任,国家自然科学基金评审专家,教育部科技项目评审专家。目前任中华医学会泌尿外科分会委员,甘肃省医学会泌尿外科分会主任委员,甘肃省抗癌协会泌尿男生殖系肿瘤专业委员会主任委员,甘肃省领军人才。主编出版《尿道狭窄》,参编《中国泌尿外科疾病诊断治疗指南》《重建泌尿外科学》《尿道外科学》《尿道修复重建外科学》等多部专著;发表学术论文80余篇;主持完成国家级课题1项,省部级课题多项。获省级科研奖项6项,其中甘肃省科学技术进步奖一等奖2项,甘肃省科学技术进步奖三等奖1项。发明国家实用新型专利4项。
【摘要】 转移性尿路上皮癌(mUC)预后差且治疗难度大。近年免疫治疗策略快速发展,mUC患者的预后得到明显改善,但单一的免疫检查点抑制剂(ICIs)疗效有限,部分ICIs单药治疗mUC的适应证也在近年被撤销。因此基于ICIs的联合方案成为治疗mUC的研究热点。目前多项ICIs联合化学治疗、抗体偶联药物以及双免疫治疗多线治疗mUC的临床研究证明了联合方案有较好的发展前景。该文总结了近期ICIs联合方案治疗mUC的相关研究进展,供临床医师实践参考。
【关键词】 转移性尿路上皮癌;免疫检查点抑制剂;联合治疗
Progress in immune checkpoint inhibitor-based combined regimens in the treatment of metastatic urothelial carcinoma Liu Jianbing, Yue Zhongjin, Shang Panfeng, Liu Yating, Chang Hong. Department of Urology, Lanzhou University Second Hospital, Lanzhou 730030,China
Correspondence author, Yue Zhongjin, E-mail: yuezj@lzu.edu.cn
【Abstract】 Metastatic urothelial carcinoma (mUC) yields poor prognosis and is difficult to treat. Immunotherapy strategies have developed rapidly in recent years, and clinical prognosis of mUC patients has been significantly improved. However, immune checkpoint inhibitors (ICIs) alone have limited efficacy, and some ICIs monotherapy indications for mUC have also been withdrawn in recent years. Therefore, combined therapy based on ICIs has become a research hotspot in the treatment of mUC. At present, multiple clinical studies of ICIs combined with chemotherapy, antibody-drug conjugates, and dual immunotherapy for multiple lines of treatment of mUC have proved that combined therapy possesses promising development prospect. In this article, latest progress in ICI-based combined treatment for mUC was reviewed, aiming to provide reference for clinicians.
【Key words】 Metastatic urothelial carcinoma; Immune checkpoint inhibitor; Combined therapy
轉移性尿路上皮癌(mUC)预后较差,5年生存率仅为6%,是导致尿路上皮癌(UC)患者快速死亡的主要原因[1]。自20世纪80年代后期以来,mUC治疗方案主要是基于顺铂的联合化学治疗方案,可将患者中位生存期延长至14个月,但复发和进展的发生率仍然很高[2]。并且30%~50%的mUC患者不适合基于顺铂的化学治疗而选用疗效较差的替代方案治疗,因此寻找更有效且安全的补充方案是非常有必要的[3]。随着近年来个体化精准治疗的发展,靶向治疗、免疫治疗等方式成为国内外研究热点。细胞程序性死亡受体-1(PD-1)及细胞程序性死亡配体1(PD-L1)的异常表达与UC的发生发展显著相关,并且近年免疫检查点抑制剂(ICIs)联合其他方案治疗mUC的效果显著[4-6]。本文对ICIs联合其他治疗方案在mUC中的治疗应用进行总结,以供临床医师实践参考。
一、ICIs药物研究进展
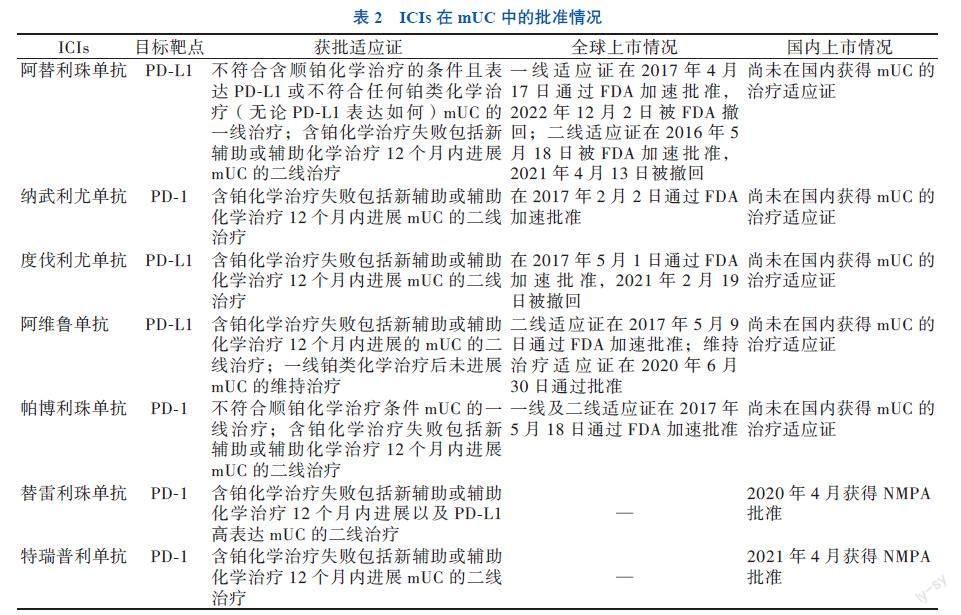
阻断PD-1/PD-L1相互作用,可以促进T淋巴细胞的抗肿瘤作用,保护T淋巴细胞抑制肿瘤细胞的能力,自2016年5月,阿替利珠单抗(atezolizumab)、纳武利尤单抗(nivolumab)、度伐利尤单抗(durvalumab)、阿维单抗(avelumab)及帕博利珠单抗(pembrolizumab)先后获得FDA对于一线及二线治疗mUC及开展相关临床试验的批准。而随着主体为亚洲患者的2项临床试验(BGB-A317-204、POLARIS-03)获得积极结果,替雷利珠单抗及特瑞普利单抗也在国内获得国家药品监督管理局(NMPA)批准用于mUC的治疗[7-8]。
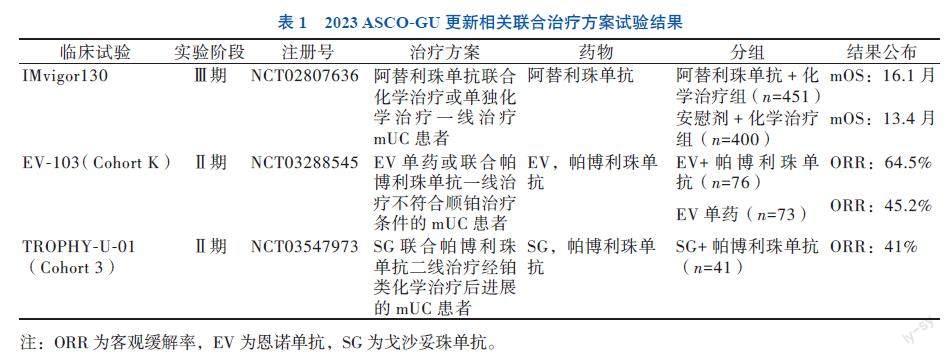
遗憾的是,度伐利尤单抗的Ⅲ期临床试验(DANUBE试验)未能达到主要终点,并未明显改善患者的总生存期(OS),其二线治疗mUC的适应证被撤回[9]。同时阿替利珠单抗Ⅲ期临床试验(IMvigor211)结果也并不理想,相比于化学治疗,阿替利珠单抗并未明显改善PD-L1高表达(IC 2/3,即肿瘤细胞或者肿瘤浸润的免疫细胞中PD-L1表达≥5%)患者中位总生存期(mOS)(11.1个月vs. 10.6个月)[10-11]。因此,阿替利珠单抗用于二线治疗接受铂类化学治疗进展的mUC的适应证在2021年3月被撤回,而为了获得一线治疗mUC患者的完全批准,一项验证性Ⅲ期IMvigor130研究开展以评估阿替利珠单抗疗效[12]。虽然该研究改善患者的无进展生存时间(PFS),但2023年美国临床肿瘤学会泌尿生殖系统癌症肿瘤研讨会(ASCO-GU)公布了OS的最终结果(表1),显示阿替利珠单抗单药及联合化学治疗与单纯化学治疗相比,入组患者的OS获益仍没有得到提高[13-14]。鉴于此次研究数据,FDA再次撤回阿替利珠单抗一线治疗不能耐受含顺铂化学治疗且PD-L1高表达或不耐受任何铂类化学治疗(无论PD-L1状态如何)mUC的适应证。目前国内外用于治疗mUC的ICIs研究进展见表2。
二、联合化学治疗
一项Ⅲ期临床试验(KEYNOTE-361)纳入
1 010例初治的mUC患者,旨在评估一线帕博利珠单抗单独或联合化学治疗(吉西他滨、顺铂或卡铂)与化学治疗对既往未经治疗的mUC患者的疗效。结果显示帕博利珠单抗联合化学治疗组与化学治疗组的PFS比较差异无统计学意义,帕博利珠单抗联合化学治疗组的mPFS为8.3个月,化学治疗组为7.1个月(P = 0.003 3,未达到阈值P = 0.001 9);帕博利珠单抗联合化学治疗组的mOS为17.0个月,而化学治疗组的mOS为14.3个月(P = 0.040 7,未达到阈值P = 0.014 2)。
在化学治疗方案中加入帕博利珠单抗并不会改善OS和PFS,基于此次研究数据,Powles等[15]也并不推荐将联合化学治疗广泛应用于晚期UC的治疗。遗憾的是,该研究中并未进行头对头的比较试验,以致无法确定帕博利珠单抗联合化学治疗与其他免疫治疗方案和化学治疗方案相比的优劣性。而评价阿替利珠单抗联合化学治疗效果的IMvigor130 Ⅲ期试验的最终OS数据也在ASCO-GU 2023大会上公布(表1),阿替利珠单抗联合化学治疗组的mOS与化学治疗组比较差异无统计学意义(16.1个月vs. 13.4个月,P = 0.023,未达到阈值P = 0.021)。该结果与KEYNOTE-361研究得到的结果(17.0个月vs. 14.3个月)非常相似,可能提示了化學治疗药物与PD-1或PD-L1抑制剂的联合效果并无差异。而关于顺铂与ICIs的结合是否比卡铂更好,从总的铂类化学治疗来观察OS,无论患者接受顺铂(HR 0.76,95%CI 0.57~1.01)还是卡铂(HR 0.89,95%CI 0.74~1.08)均未增加获益,但顺铂相较于卡铂表现得稍有优势[13]。
另外在早期的研究中,白蛋白紫杉醇对接受含铂化学治疗后进展的mUC患者显示了一定的抗肿瘤活性[16]。近期Tsung等[17]开展的一项Ⅱ期临床试验纳入了36例不耐受铂类治疗的mUC,旨在评价帕博利珠单抗联合白蛋白紫杉醇对mUC的疗效,中位随访时间为19.7个月,结果显示ORR为50%[18/36,其中完全缓解(CR)3例,部分缓解(PR)15例],结果超过了45%的主要结果阈值,达到了该研究的主要终点。而mPFS为6.8个月,mOS为18.2个月,未达到次要终点。此次对于化学免疫疗法的新探索可能为不耐受铂类化学治疗的mUC提供了一种有效的选择。但值得注意的是,该研究来自单一机构、样本量小,且大多数患者为男性,结果可能存在偏倚,后续研究应该扩大样本量以获得更有力的证据。
三、联合抗体偶联药物治疗
抗体偶联药物(ADC)是近年来肿瘤学发展最快的药物类别之一,相比于传统的化学治疗药物,ADC具有更高的靶向性和毒杀效率[18]。因此对正常细胞的损伤更小,且能够减少药物剂量和不良反应,而这些优点与ICIs也非常相似。近年来包括针对EV(Nectin-4靶点)、SG(Trop2靶点)、曲妥珠单抗[人表皮因子受体-2(HER2)靶点]以及维迪西妥单抗(HER2靶点)在内的ADC与ICIs联合方案对mUC显示出明显的疗效和较高的安全性。
1. EV
一项EV-103Ⅰb/Ⅱ期多队列研究的队列A中,纳入45例先前未经治疗的、不适用顺铂治疗的mUC患者接受了EV和帕博利珠单抗联合治疗,结果显示非常惊人,ORR为73.3%(33/45),CR为15.6%(7/45),并且所有患者均未出现明显的原发疾病进展。近90%患者第一次肿瘤评估表明反应持久,mOS和mDOR均超过2年(分别为26.1、25.6个月)[19]。近期发表了队列K中149例患者的数据,患者接受EV单药或联合帕博利珠单抗治疗,结果显示联合方案ORR达64.5%。患者发生皮肤反应及周围神经病变治疗相关不良反应发生率高(分别为67.1%、60.5%)[20]。
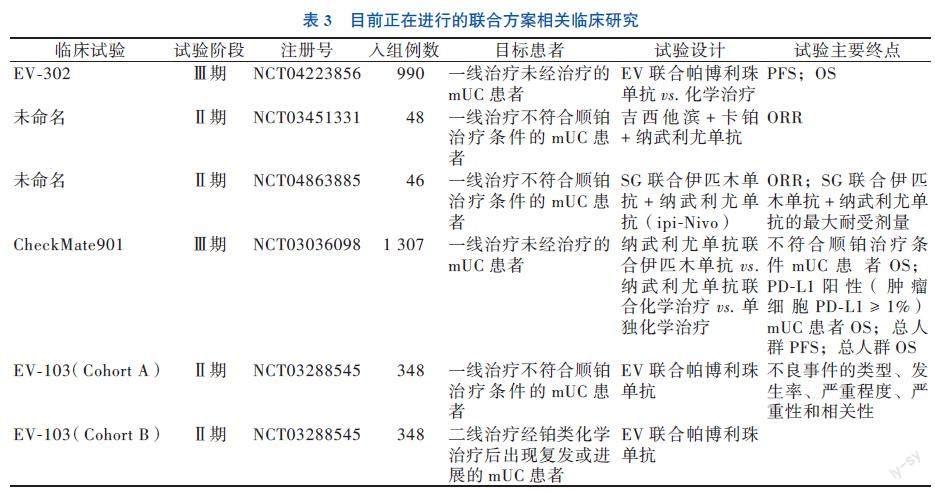
研究中的患者是符合特定纳入标准的患者,因此这些结果可能不适用于其他类型的患者,有必要进一步扩大研究范围,以确定这种组合方案的更广泛适用性和效果,且这种组合方案证明了它可能存在的高反应率、初始耐受性和毒性,而由于神经病变的发展,因此值得考虑EV的最佳治疗持续时间,相关研究(NCT03288545)对此联合方案在一线及二线治疗的不良反应评估正在进行中,见表3。联合治疗方案有望解决一线mUC中替代方案缺乏的需求,其对比化学治疗的疗效和安全性将于正在进行的临床试验(NCT04223856)中进一步评估。
2. SG
在之前的研究中(TROPHY-U-01)SG单药疗法在治疗经过铂类的化学治疗和ICIs治疗后进展的mUC患者中显示出显著的抗瘤活性和可控的安全性(ORR为27%,mOS为11个月)[21]。而该研究的队列3旨在评价SG与帕博利珠单抗联用作为二线疗法治疗mUC患者的中期疗效和安全性结果,该研究纳入了41例铂类化学治疗后在12个月内出现进展的患者,经过12.5个月(0.9~24.6个月)的随访,ORR为41%。CR为20%,mDOR为11.1个月。61%的患者出现了≥
3级的治疗相关不良反应,包括中性粒细胞减少症(37%)、腹泻(20%)、贫血(20%),无患者发生治疗相关的死亡[22]。SG联合帕博利珠单抗方案对铂类化学治疗后病情进展且初次接受免疫治疗的mUC患者有明显疗效,总体安全状况可控。与此同时,该试验存在样本量小、随访时间短的局限性,但总体数据支持进一步评估SG ICIs在mUC中的联用。此外,SG联合免疫治疗用于不符合顺铂治疗条件的mUC患者的相关试验(NCT04863885)正在进行中。
3. HER2靶点
DS8201-A-U105是一项探索曲妥珠单抗联合纳武利尤单抗用于HER2阳性的UC Ib期研究,其中队列3为30例HER2高表达[免疫组织化学染色(IHC)++~+++]的mUC患者。结果显示ORR为36.7%(其中CR 13.3%、PR 23.3%),中位缓解持续时间(mDOR)、mPFS及mOS分别为13.1、6.9及11.0个月[23]。研究证明了此种联合方案在HER2高表达的患者中有一定的疗效,但研究纳入的样本量较少且因为开放性标签的原因可能存在一些观察者偏倚及交互偏倚。另一项基于中国患者的Ⅰb/Ⅱ期研究(RC48-C014)对维迪西妥单抗联合特瑞普利单抗在mUC患者中的疗效及安全性进行评估,2022ASCO-GU更新了该研究ORR及安全性的结果。试验纳入32例mUC患者,19%的患者HER2表达呈阳性(IHC++~+++),56%的患者PD-L1 联合阳性分数(CPS)≥1。总体ORR为75%(24/32),CR为15%(5/32)。ORR在HER2(+++)患者中为100%,在HER2(++)患者中为77.8%,HER2(+)患者为66.7%,HER2(-)患者为50.0%。ORR在PD-L1 CPS≥1的患者中为97.1%,在CPS < 1的患者中为50%。在该研究中,患者最常见治疗相关不良反应为厌食(72%)、虚弱(56%)、转氨酶水平升高(56%)、周围感觉神经病变(56%)、脱发(52%)、恶心(36%)和贫血(32%),最常见的免疫相关不良反应是肺炎(20%)[24]。结果表明维迪西妥单抗联合特瑞普利单抗同样具有良好的疗效和可控的安全性。值得注意的是,联合方案在HER2(++~+++)患者中显示出更好的治疗效果。四川大学华西医院的Xu等[25]报道了1例HER2(+++)的mUC患者经维迪西妥单抗联合帕博利珠单抗三线治疗后实现完全缓解,且三线治疗期间未出现3级或4级不良事件或肾损伤加重。对于HER2阳性的mUC,HER2靶向ADC联合ICIs显示出良好的前景。在国内,维迪西妥单抗联合特瑞普利单抗已成为一线治疗mUC的推荐方案。
四、双免疫联合治疗
细胞毒性T淋巴细胞相关抗原-4(CTLA-4)会影响人体的免疫系统,削弱其杀死肿瘤细胞的能力。伊匹木单抗(ipilimumab)及曲美木单抗(tremelimumab)能有效阻滞CTLA-4的分子,从而激活免疫系统,增强免疫系统对抗肿瘤细胞的作用。其中DANUBE试验比较了度伐利尤单抗单用、度伐利尤单抗联合曲美木单抗和化学治疗这3种方案在mUC一线治疗的效果,结果显示度伐利尤单抗单用或联合曲美木单抗均未达到改善OS的主要终点[9]。这一结果也致使了前文所提的度伐利尤单抗在二线治疗mUC的适应证被撤回。2019年一项CheckMate 032的扩展队列研究纳入274例铂类化学治疗后进展的mUC患者,并将其随机分配至纳武利尤单抗单药组(3 mg/kg),或4个周期的联合治疗组(3 mg/kg 纳武利尤单抗+1 mg/kg 伊匹木单抗(Nivo3+ipi1组),或1 mg/kg 纳武利尤单抗+3 mg/kg 伊匹木单抗(Nivo1+ipi3组),之后给予纳武利尤单抗维持治疗(3 mg/kg)。随访8个月后结果显示,Nivo1+ipi3组患者的ORR为38.0%,而纳武利尤单抗单药组为25.6%,Nivo3+ipi1为26.9%。Nivo1+ipi3组相比Nivo3+ipi1组与纳武利尤单抗单药组的PFS和OS也有所改善(中位PFS分别为4.9、2.8、2.6个月,中位OS分别为15.3、9.9、7.4个月),但组间比较差异并无统计学意义。联合治疗组中,3级及以上治疗相关毒性以及严重不良事件的发生率更高,这也与早期的观点一致[26-27]。
基于前期试验发现双检查点抑制剂可使mUC患者结果得到改善,特别在使用较高剂量的伊匹木单抗时(如Nivo1+ipi3)。随后的TITAN-TCC研究旨在基于初始免疫治疗反应对后续治疗进行分层,2022ASCO-GU公布了該实验队列2的试验结果,83例既往铂类治疗失败后的mUC患者,初始应用纳武利尤单抗无效或进展的患者(8周时评估)加用伊匹木单抗 3 mg/kg,获得CR或PR的患者可继续纳武利尤单抗单药治疗[5, 28]。对初始治疗无效及进展的患者加用伊匹木单抗治疗,总体ORR为32.5%,并且PD-L1阳性(肿瘤细胞PD-L1≥1%)患者的ORR高于阴性患者(46% vs. 24%),其中纳武利尤单抗初始治疗无效的患者,加用伊匹木单抗治疗后有31%患者获得缓解,而初始进展的患者加强治疗后ORR为19%。而总研究组的mPFS为1.9个月,mOS为7.6个月,最终的疗效仍然没有取得突破[29]。但这种二线治疗的筛选策略目的是在保证免疫疗效的前提下,有效规避过量药物所导致的相关毒性反应。这也说明了对于双免疫联合治疗还需更多的相关研究对其疗效、安全性及最佳联合剂量进行验证,目前纳武利尤单抗联合伊匹木单抗对比纳武利尤单抗联合化学治疗及单独化学治疗效果的临床试验(NCT03036098)正在进行中。
五、結 语
目前对于mUC患者的治疗逐渐偏向个体化、精准化,近年ICIs相关联合方案在治疗mUC中的应用愈加常见且疗效显著,在PD-L1阳性表达的mUC患者中尤为明显。此外,不同研究PD-L1阳性表达的判定标准并不一致,这使得从ICIs治疗方案中筛选能够获益的最佳患者群体存在一定困难。ICIs治疗方案还需要大量相关研究对其疗效及目标群体进行验证,以探索mUC不同患者群体的最佳治疗方案,从而提高其生存质量。
参 考 文 献
[1] Del Bene G, Sternberg C N. Systemic chemotherapy in muscle invasive and metastatic bladder cancer: present and future. Urologia, 2017, 84(3): 130-141.
[2] Hoffman-Censits J, Maldonado L. Targeted treatment of locally advanced and metastatic urothelial cancer: enfortumab vedotin in context. OncoTargets Ther, 2022, 15: 1519-1529.
[3] Katims A B, Reisz P A, Nogueira L, et al. Targeted therapies in advanced and metastatic urothelial carcinoma. Cancers, 2022, 14(21): 5431.
[4] van Wilpe S, Gerretsen E C F, van der Heijden A G, et al. Prognostic and predictive value of tumor-infiltrating immune cells in urothelial cancer of the bladder. Cancers, 2020, 12(9): 2692.
[5] Sharma P, Retz M, Siefker-Radtke A, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol, 2017, 18(3): 312-322.
[6] Powles T, Park S H, Voog E, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N Engl J Med, 2020, 383(13): 1218-1230.
[7] Ye D, Liu J, Zhou A, et al. Tislelizumab in Asian patients with previously treated locally advanced or metastatic urothelial carcinoma. Cancer Sci, 2021, 112(1): 305-313.
[8] Sheng X, Chen H, Hu B, et al. Safety, efficacy, and biomarker analysis of toripalimab in patients with previously treated advanced urothelial carcinoma: results from a multicenter phase II trial POLARIS-03. Clin Cancer Res, 2022, 28(3): 489-497.
[9] Powles T, van der Heijden M S, Castellano D, et al. Durvalumab alone and durvalumab plus tremelimumab versus chemotherapy in previously untreated patients with unresectable, locally advanced or metastatic urothelial carcinoma (DANUBE): a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol, 2020, 21(12): 1574-1588.
[10] Powles T, Durán I, van der Heijden M S, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet, 2018, 391(10122): 748-757.
[11] van der Heijden M S, Loriot Y, Durán I, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma: a long-term overall survival and safety update from the phase 3 IMvigor211 clinical trial. Eur Urol, 2021, 80(1): 7-11.
[12] Galsky M D, Arija J Á A, Bamias A, et al. Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet, 2020, 395(10236): 1547-1557.
[13] Bamias A, Davis I, Galsky M, et al. Updated Overall Survival (OS) with atezolizumab (atezo) monotherapy vs. chemotherapy in untreated locally advanced or metastatic Urothelial Carcinoma (mUC) in the Phase III IMvigor130 study. Eur Urol Open Sci, 2021, 33: S201-S202.
[14] Galsky M D, Arija J A A, De Santis M, et al. Atezolizumab (atezo) + platinum/gemcitabine (plt/gem) vs placebo + plt/gem for first-line (1L) treatment (tx) of locally advanced or metastatic urothelial carcinoma (mUC): final OS from the randomized phase 3 IMvigor130 study. J Clin Oncol, 2023, 41(6_suppl): LBA440.
[15] Powles T, Csőszi T, Özgüroğlu M, et al. Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a randomised, open-label, phase 3 trial. Lancet Oncol, 2021, 22(7): 931-945.
[16] Tian Y, Liu Z, Wang J, et al. Nanomedicine for combination urologic cancer immunotherapy. Pharmaceutics, 2023, 15(2): 546.
[17] Tsung I, Green E, Palmbos P, et al. A phase 2 trial of nab-paclitaxel in combination with anti-PD1 therapy in advanced urothelial cancer. J Urol, 2023, 209(1): 121-130.
[18] Nagayama A, Ellisen L W, Chabner B, et al. Antibody-drug conjugates for the treatment of solid tumors: clinical experience and latest developments. Targ Oncol, 2017, 12(6): 719-739.
[19] Hoimes C J, Flaig T W, Milowsky M I, et al. Enfortumab vedotin plus pembrolizumab in previously untreated advanced urothelial cancer. J Clin Oncol, 2023, 41(1): 22-31.
[20] Milowsky M I, O’Donnell P H, Hoimes C J, et al. Patient-reported outcomes (PROs) in cisplatin-ineligible patients (pts) with locally advanced or metastatic urothelial cancer (la/mUC) treated with enfortumab vedotin (EV) alone or in combination with pembrolizumab (P) in the phase 1b/2 EV-103 Cohort K study. J Clin Oncol, 2023, 41(6 suppl): 439.
[21] Tagawa S T, Balar A V, Petrylak D P, et al. TROPHY-U-01: a phase II open-label study of sacituzumab govitecan in patients with metastatic urothelial carcinoma progressing after platinum-based chemotherapy and checkpoint inhibitors. J Clin Oncol, 2021, 39(22): 2474-2485.
[22] Grivas P, Pouessel D, Park C, et al. Primary analysis of TROPHY-U-01 cohort 3, a phase 2 study of sacituzumab govitecan (SG) in combination with pembrolizumab (Pembro) in patients (pts) with metastatic urothelial cancer (mUC) that progressed after platinum (PT)-based therapy. J Clin Oncol, 2023, 41(6_suppl): 518.
[23] Galsky M D, Del Conte G, Foti S, et al. Primary analysis from DS8201-A-U105: A phase 1b, two-part, open-label study of trastuzumab deruxtecan (T-DXd) with nivolumab (nivo) in patients (pts) with HER2-expressing urothelial carcinoma (UC). J Clin Oncol, 2022, 40(6 suppl): 438.
[24] Zhou L, Xu H, Li S M, et al. Study RC48-C014: Preliminary results of RC48-ADC combined with toripalimab in patients with locally advanced or metastatic urothelial carcinoma. J Clin Oncol, 2022, 40(6 suppl): 515.
[25] Xu Z, Ma J, Chen T, et al. Case report: the remarkable response of pembrolizumab combined with RC48 in the third-line treatment of metastatic urothelial carcinoma. Front Immunol, 2022, 13: 978266.
[26] Sharma P, Siefker-Radtke A, de Braud F, et al. Nivolumab Alone and With Ipilimumab in Previously Treated Metastatic Urothelial Carcinoma: checkmate 032 Nivolumab 1 mg/kg Plus Ipilimumab 3 mg/kg Expansion Cohort Results. J Clin Oncol, 2019, 37(19): 1608-1616.
[27] 劉光德, 吕志诚. 免疫检查点抑制剂的消化系统不良反应及其治疗. 新医学, 2019, 50(11): 809-812.
[28] Sharma P, Callahan M K, Bono P, et al. Nivolumab monotherapy in recurrent metastatic urothelial carcinoma (CheckMate 032): a multicentre, open-label, two-stage, multi-arm, phase 1/2 trial. Lancet Oncol, 2016, 17(11): 1590-1598.
[29] Grimm M O, Schmitz-Dräger B J, Zimmermann U, et al. Tailored immunotherapy approach with nivolumab in advanced transitional cell carcinoma. J Clin Oncol, 2022, 40(19): 2128-2137.
(收稿日期:2023-03-07)
(本文编辑:林燕薇)
