研究新高考真题 探秘共价键备考方向
2023-09-19刘艳影
刘艳影 董 顺
(1.安徽省涡阳县第四中学 2.安徽省砀山中学)
2023年新高考(含新教材老高考)地区是使用新教材后的首次高考,这些地区的高考真题为今后的复习备考指明了方向.2023 年高考试题的命题依据是《普通高中化学课程标准(2017 年版2020 年修订)》(以下简称“新课标”).分析2023年新高考地区涉及共价键的试题(含新课标卷),我们能够发现,试题完全依据新课标命题,具体统计如表1所示.
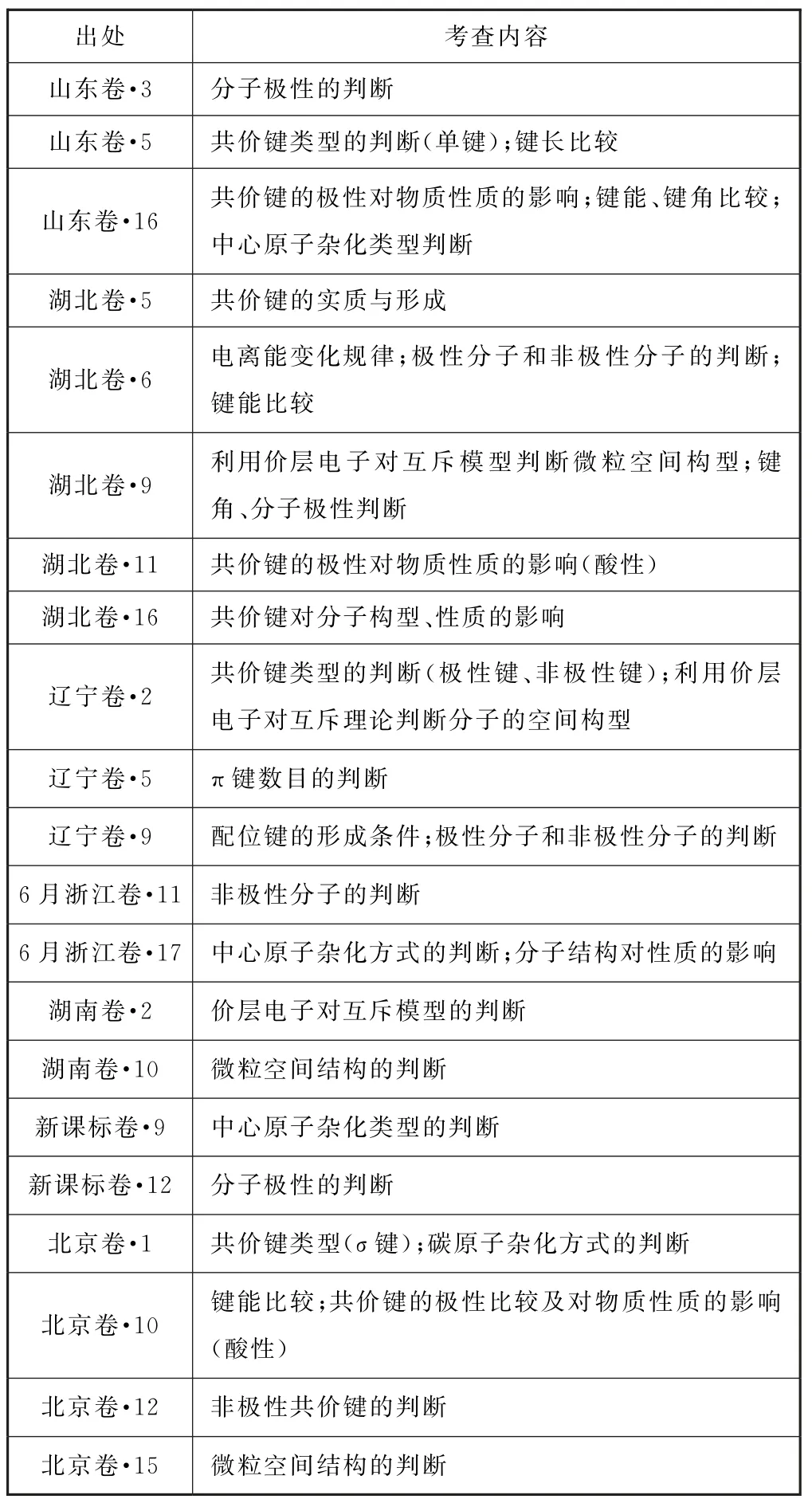
表1

表2
1 共价键的实质、形成过程及类型
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,因此可以说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了.共价键按照电子云重叠方式不同可以分为σ键(电子云通过“头碰头”方式重叠,常见的有s—sσ键、s—pσ键、p—pσ键及杂化轨道间、杂化轨道与s轨道、p轨道间形成的σ键等)和π键(电子云通过“肩并肩”方式重叠).其中,π键可以分为定域π键、大π 键(如SO2、O3中的键、、SO3中的键等)、d—pπ键(如H3PO4、H2SO4中非羟基氧原子的p轨道与中心P、S原子3d轨道形成的π键)等;按照成键两原子电负性的不同可以分为极性键和非极性键;按照共用电子对数的不同可以分为单键(均为σ键)、双键(1个为σ键,1个为π键)和三键(1个为σ键,2个为π键).
A.(湖北卷·5节选)用电子云轮廓图表示H—H的s—sσ键形成的示意图(如图1).

图1
B.(辽宁卷·5节 选)11.2 L CO2含π 键数 目为NA
C.(辽宁卷·2节选)P4中的共价键类型:非极性键
D.(北京卷·12节选)Na2O2、CaH2中均有非极性共价键
E.(湖北卷·11 节选)酸性:CF3COOH(pKa=0.23)远强于CH3COOH(pKa=4.76),结构因素是羟基极性不同
2 键参数的比较与应用
键能是指气态分子中1 mol共价键解离成气态原子所吸收的能量,键能的大小可以衡量共价键的强弱.
键长是构成共价键的2个原子的核间距.不过,分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距.成键两原子半径决定化学键的键长.原子半径越小,共价键的键长越短.对于相同的两原子形成的共价键而言,当2个原子间形成双键、三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长.一般来说,键长越短,键能越大,但也有特殊情况,比如键长:F—F<Cl—Cl,但键能也是F—F<Cl—Cl,这是由于F原子半径很小,因此F—F的键长短,2个F 原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小.
另外,键能:碳碳单键<碳碳双键<碳碳三键,但碳碳双键的键能小于碳碳单键键能的两倍,说明其中的σ键键能>π键键能,这也就解释了烯烃、炔烃性质比烷烃性质活泼的事实.
为什么N2分子不活泼呢? N2分子结构可简单地写为,即2个N 原子之间有1个σ键,2个π键.同时,每个N 原子有1对孤对电子.在N2分子中,每个N 原子有1对孤对电子,N 原子的孤对电子的电子云较集中于N≡N 分子的外侧,因而使N 原子上的有效正电荷大,所以对2 个π 键的成键电子吸引较强,造成N2分子的活性低.
键角是指在多原子分子中,2个化学键之间的夹角.CO2键角为180°,是一种直线形分子;H2O 分子中的H—O—H 键角是105°,是一种V 形(或称角形)分子.多原子分子中的键角一定,表明共价键具有方向性.
A.(山东卷·5节选)(CF)x中C—C 的键长比C—F短
B.(湖北卷·6节选)键能:N2<O2<F2
C.(湖北卷·16节选)导致SiCl4比CCl4易水解的因素有Si—Cl键键能更大,Si—Cl键极性更大
D.(北京卷·10节选)不能通过比较氟元素与氯元素的电负性解释F—F的键能小于Cl—Cl的键能
3 价层电子对互斥(VSEPR)模型及应用
1)模型要点
a)价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低.
b)孤电子对的排斥力较大,孤电子对数越多,排斥力越强,键角越小.
2)用价层电子对互斥理论推测分子的空间结构
价层电子对数包括σ键电子对数和孤电子对数,其中σ键电子对数等于中心原子结合的原子数.对于ABn型微粒,价层电子对数(中心原子价电子数+配体提供的电子数×n-微粒所带电荷数).其中,卤素原子和氢原子作配体时提供1个电子,O、S作配体时不提供电子.
A.(辽宁卷·2节选)BeCl2的空间结构:V 形
B.(湖南卷·2节选)NH3分子的VSEPR 模型:
C.(浙江6 月·2节 选)H2S 分 子 的球棍 模型:
D.(浙江6月·2节选)AlCl3的价层电子对互斥模型:
4 分子极性的判断
1)化合价法:多原子分子(ABn型).
中心原子化合价的绝对值=该元素的价电子数→该分子为非极性分子→分子的空间结构中心对称(直线形、平面三角形、正四面体形……).
常见ABn型分子的极性判断如表3所示.

表3
2)空间结构对称法(如表4).

表4
A.CS2B.NF3C.SO3D.SiF4
共价键是新高考的热点内容,共价键理论在解释元素化合物及有机化合物性质中发挥着重要的作用.学习共价键时要关注其应用,这样不仅能加深对理论的理解,还会促进对元素化合物及有机物性质的认识.在复习备考中一方面要关注新教材的变化和描述,另一方面要关注新高考地区的试题,明确高考的方向,这样会使复习备考事半功倍.
(完)
