猪传染性胃肠炎病毒基因组结构及主要基因功能研究进展
2023-09-13成伟伟容维中陈伯祥赵子惠李元新
王 佳,成伟伟,容维中,杨 明,陈伯祥,赵子惠,李元新
( 甘肃省畜牧兽医研究所,甘肃 平凉 744000 )
猪传染性胃肠炎(porcine transmissible gastroenteritis)是由猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)引起的一种急性、高度接触性传染病。1946年,Doyle等[1]确定猪传染性胃肠炎的病原体为病毒;1956 年我国首次报道后,该病在我国多省份接连发生[2]。猪传染性胃肠炎以严重腹泻、呕吐和脱水为临床特征,不同日龄的猪均易感,两周龄内仔猪病死率高达100%[3]。猪传染性胃肠炎多发于冬、春季,感染高峰期在1~2月,在新疫区暴发性流行,老疫区间歇性流行。TGEV 通过呼吸道和消化道传播,发病猪和带毒猪可通过呼气、呕吐物、粪便排出病毒,患病猪经治疗痊愈后仍会带毒。病毒经口鼻进入宿主体内,在猪的鼻黏膜和肺部繁殖,再通过消化道和血液循环至小肠黏膜上皮细胞[4]。TGEV临床中常与猪流行性腹泻病毒(PRCV)、猪轮状病毒和猪δ 冠状病毒混合感染,给养猪业造成巨大经济损失[5]。
TGEV属于冠状RNA病毒,基因组结构具有较高的突变性,虽已研究出了TGEV 各类疫苗,但该病的防控难度仍然较大。进行TGEV基因组解析有助于鉴别病毒、阐明病毒感染的作用机制,为新型疫苗和治疗药物的开发提供方向。本文阐述了近年来TGEV的病毒特点、基因结构以及编码得到的主要蛋白功能的研究进展,以期为后续TGEV防控及致病机制的相关研究提供参考。
1 TGEV病原学
TGEV 为尼多病毒目(Nidovirales)冠状病毒科(Coronavirus)冠状病毒属(Coronavirus)α 亚群成员,是具有囊膜的单股正链RNA 病毒。病毒囊膜为双层脂质结构,外形类皇冠或太阳日冕形状,为直径约90~200 nm 的圆形或椭圆形,外膜上为柄状结构连接的纤突蛋白(S),形似花瓣,大而稀疏,长约12~25 nm,末端膨大部直径约10 nm。S、膜蛋白(M)与包膜蛋白(E)镶嵌于病毒囊膜;核衣壳蛋白(N)与病毒RNA 结合,共同构成直径约9~16 nm的螺旋状核糖核蛋白(RNP),使病毒粒子获得感染力[3-4]。磷钨酸负染电镜观察,制样过程中纤突极易断裂后脱落,有时只能观察到少数花瓣状纤突或囊膜边界视野中仅有一个电子透明中心。TGEV病毒结构见图1[2,6]。

图1 TGEV病毒结构Fig.1 Virus structure of TGEV
TGEV 只存在一种血清型,与猪呼吸道冠状病毒(PRCV)具有交叉保护性,与犬冠状病毒(CCV)和猫传染性腹膜炎病毒(FIPV)具有抗原相关性,与戊型肝炎病毒(HEV)、猪流行性腹泻病毒(PEDV)无抗原相关性[3]。TGEV对温度、紫外线敏感,耐冷不耐热、对乙醚、SDS等有机试剂敏感,病毒粒子在胆汁中较稳定。此外,病毒的毒力越强,对胰酶的敏感性越低。SH株和TO株在4 ℃的条件下会凝集部分动物的红细胞,但不凝集鹅和小鼠的红细胞[7]。TGEV感染猪睾丸细胞(ST)和猪肾细胞(PK-15)时会形成双膜囊泡(DMVs),DMV是冠状病毒复制的一种标志。实验室培养常用ST 和PK-15 细胞系,其中TGEV 对ST 细胞系最为敏感,但在ST 细胞和PK-15细胞系上进行体外培养并不能完全模拟TGEV 在体内宿主细胞中的完整过程。因此,李甜甜等[8]建立了猪肠道上皮细胞系(IPEC-J2)模型,尹灵丹等[9]建立了TGEV的肠小体感染模型,均比ST和PK-15细胞系更接近体内环境。
TGEV 感染宿主细胞的主要受体为猪氨基肽酶N(pAPN)。有研究在新生仔猪的小肠绒毛上皮细胞中发现一个约200 kDa 的蛋白质,此蛋白质在3 周龄以上猪中不存在,推测该蛋白受体为TGEV 感染低龄仔猪的第二受体[10]。表皮生长因子受体(EGFR)作为辅助因子在感染早期与pAPN 协同作用[11]。辅助受体(Neu5Gc)决定TGEV的肠道趋向性,PRCV缺乏此受体,故不感染肠道器官[12]。
2 TGEV基因组结构及功能
2.1 TGEV基因组结构
TGEV基因组长度约28.5 kbp,是最大的RNA病毒,虽为单股正链不分节段RNA 病毒,但具有类似分节段RNA病毒的高重组率特点[13]。TGEV 分子量约6×103kDa,全基因组共7 个分区,其中ORF1 由ORF1a 和ORF1b 共同构成,ORF3 由ORF3a 和ORF3b 共同构成,基因组排列顺序为:5'-UTR-ORF1a-ORF1b-S-ORF3a-ORF3b-E-M-NORF7-UTR-3',5'端有帽子结构,3'端有poly(A)尾,各个基因间结构紧凑。5'端的ORF1长约20 kbp占据整个基因组的2/3,3'端的基因组约8.4 kbp 占整个基因组的1/3。不同基因之间被核心区为(CUAAAC)的转录调整序列(TRS)隔开,是转录亚基因组RNA的起始信号[14]。5'端前598 bp为病毒包装信号,3'端后494 bp对病毒包装非必需,但可提高包装效率[11]。TGEV基因组结构见图2。
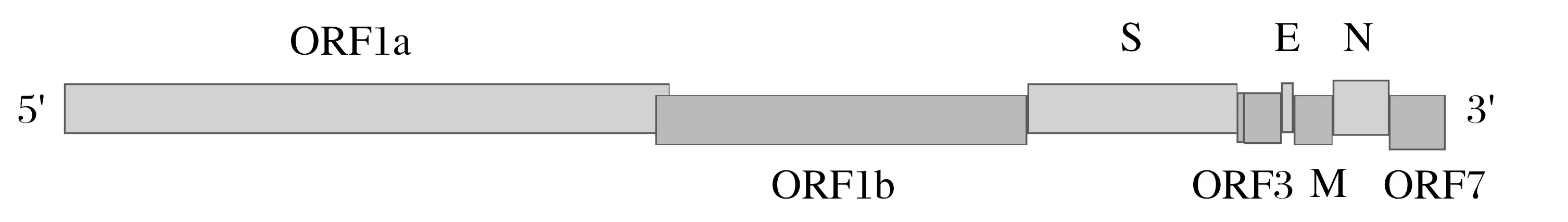
图2 TGEV基因组结构Fig.2 Genome structure of TGEV
不同毒株非编码区的长度不同,5'端非编码区(UTR)约200~400 bp,3'端UTR 约300~500 bp,5'-UTR 包含存在65~98 bp的前导序列。不同CoV 5'-UTR二级结构存在较大差异,但均存在一个约15个核苷酸组成的“茎环结构”。3'-UTR 尤其是Poly(A)附近高度保守的基因序列对TGEV 的RNA 转录具有非常重要的作用,两端UTR 中的顺势调控区域对病毒转录具有重要作用[2]。TGEV的繁殖阶段在胞质中进行,过程与其他冠状病毒相似。TGEV 基因组RNA可直接作mRNA,或作模板扩增负链,再由负链作模板扩增新的正链RNA 和亚基因组RNA,而后经过翻译、组装、释放,完成整个复制周期。
2.2 TGEV结构基因
2.2.1 S基因
S 基因长度约4.35 kbp,编码得到1 447~1 449 个氨基酸残基的前体蛋白。蛋白质糖基化对病毒抗原性具有重要作用,TGEV S 蛋白约含51 个N-糖基化修饰位点,糖基化前分子量128~160 kDa,糖基化后增加约30 kDa。蛋白质磷酸化介导蛋白质活性,增强蛋白质相互作用的能力。TGEV S 蛋白约含139 个磷酸蛋白[15]。S 蛋白是Ⅰ型跨膜糖蛋白,为一种同源三聚体。每个单体分为S1 和S2 两个区域,S1 具有S1-CTD 和S2-NTD 两个独立的功能亚域,CTD 是受体结合关键区域;S2 存在HR1 和HR2 两个重要的保守重复氨基酸序列[15]。花瓣状S1直接参与病毒、靶细胞的识别,诱导产生中和抗体,决定病毒的种属嗜性和感染特性。连接病毒囊膜与S1 部分的柄状S2 区域,固定S蛋白于囊膜上,参与病毒囊膜和宿主细胞膜融合的过程。
S蛋白氨基端在外,羧基端在内,具有膜外区、跨膜区、膜内区等3 个区域,N 端aa1~aa16 分泌信号肽。膜外区主要为冠状凸起部分,其上含有氨基肽酶N(APN)识别位点,aa522~aa744区域与pAPN发生黏附介导感染,pAPN上的aa36~aa223、aa349~aa591、aa592~aa963 可与抗pAPN 抗体结合,不同程度地阻断TGEV 感染。研究表明,敲除pAPN 的仔猪对TGEV 具有抵抗力,并且敲除该位点后不会引起宿主细胞生理功能改变。N 端存在一处血凝活性区,故与其他冠状病毒(CoV)相比,TGEV虽无血凝素蛋白(HE),但仍具有血凝活性,PRCV缺失该血凝活性区,故利用检测血凝活性可区分PRCV和TGEV。
S 蛋白从氨基端到羧基端存在为C、B、D、A 等4 个抗原位点。A 位点在aa538~aa591 内,是分布在病毒粒子表面的不连续抗原位点。aa537~aa547处有一条可部分代表A 位点的多肽,可用于病毒的区分。A 位点存在Aa、Ab、Ac等3个亚位点,核心分别位于538、591和543残基处。B位点位于aa97~aa144,具有复杂的空间结构。C 位点位于aa49~aa52,是一段连续的线状结构,对温度和pH值进行调节可影响C 位点的亲和性。PRCV 缺少C 位点,通过此位点可区分PRCV 和TGEV。D 位点位于aa382~aa385,高度保守,可能在病毒繁殖中起到一定作用。S 蛋白存在抗原位点、抗原亚位点和抗原决定簇等3种抗原层次。目前已知S蛋白的抗原决定簇共11个,与产生中和抗体相关的有5个,A、D位点诱导产生中和抗体。
2.2.2 M基因
M 基因长度约789 bp,编码得到的蛋白质前体约含262 个氨基酸残基,切除aa1~aa16 的信号肽、转膜、糖基化后得到成熟的M蛋白,携带一条富含甘露糖天冬氨肽连接的侧链[4]。M蛋白分子量约29~31 kDa,形成于宿主细胞质中粗面内质网膜上,可在病毒囊膜中多次跨膜,包埋在病毒囊膜中,含量最多,维持了病毒包膜形状。TGEV 的M蛋白1/3的C端暴露于病毒的囊膜之外,2/3的C端存在于病毒内部,是一种不同于其他冠状病毒的空间构象。膜外的C端可作为保护性抗原刺激机体产生抗体中和病毒,介导被感染细胞发生补体溶解反应。N 端6~22 氨基酸残基区具有诱导机体干扰素产生的抗原决定簇,可在体外诱导干扰素-α(INF-α)。此外,M蛋白还可以通过诱导干扰素调节因子3(IRF-3)的磷酸化和核转移激活IFN-β 信号通路,诱导干扰素-β(INF-β)的产生[16]。TGEV 的M 蛋白可同Nsp3 结合调节病毒早期复制。Ji 等[17]阐明了TGEV 内化侵入细胞的一种新机制——通过网格蛋白(clathrin)介导的内吞作用,帮助TGEV M 蛋白与HSC70 互相作用,影响病毒TGEV内化过程。
2.2.3 E基因
E 基因长度约246 bp,编码后得到的蛋白质前体含82个氨基酸,成熟的E蛋白仅含78个氨基酸。E蛋白(sM蛋白、包膜蛋白E)是一种小分子跨膜蛋白,分子量约7.9 kDa。E蛋白由一个疏水结构域和一个α螺旋结构域组成,参与病毒组装、出芽和包膜形成过程[12]。E蛋白可调控病毒粒子的装配和释放,引起内质网应激,提高白细胞介素18(IL-18)的表达[18]。虽然E蛋白缺失不影响病毒RNA合成,但对于TGEV 的复制、病毒粒子在细胞内的运输和成熟是必需的。研究发现,TGEV M 蛋白和E蛋白共表达是病毒样颗粒组装和释放的必要条件,而且M蛋白与E蛋白形成的病毒样颗粒(VLPs)能够诱导INF-α产生,可抵御TGEV的感染[19]。
2.2.4 N基因
N基因长约1 149 bp,编码得到的蛋白质前体约382个氨基酸残基。成熟的N 蛋白分子质量约45 kDa,与病毒RNA结合形成核衣壳,使病毒获得感染力[20]。N蛋白是一种序列保守的磷酸化酸性蛋白,可诱导机体产生细胞免疫应答,含有A、B、C等3个高度保守的抗原位点[20]。N蛋白可延长细胞周期的合成期,能够引起内质网应激和白细胞介素-8(IL-8)上调[18]。研究发现,N蛋白定位于核仁这一过程对核糖体优先翻译病毒亚基因组RNA和调节细胞分裂周期具有重要作用[21]。TGEV抗N蛋白血清中和全活病毒时90%以上的亚基因组mRNA合成被抑制[14]。
2.3 TGEV非结构基因
2.3.1 ORF1(Nsp1~Nsp16)
ORF1 位于基因组5'端,编码病毒复制与转录相关的酶,由ORF1a和ORF1b构成。ORF1全长约20 kbp,ORF1a约12 051 bp,ORF1b 约8 094 bp,ORF1a 的变异性明显高于ORF1b。ORF1b 有43 个碱基重叠于上游ORF1a 中,重叠部分为核糖体移码信号区。ORF1a编码多聚蛋白pp1a,ORF1a 和ORF1b 共同编码多聚蛋白pp1ab,经Nsp3 和Nsp5 切割后形成16 个非结构蛋白Nsp1~Nsp16。非结构蛋白诱导细胞产生DMVs,以此组装形成病毒的转录复合体(RTC),在RTC帮助下以不连续转录的方式合成一套具有5'端帽子结构和3'端Poly(A)尾嵌套的亚基因组RNA[22]。在ORF1 的上游117 位碱基处有一个小ORF(AUGAAAUCA),通过同源蛋白的结构和功能推断,该ORF 可能对ORF1 的翻译起到调控作用。Nsp3、Nsp4 和Nsp6 可促进DMVs 的形成;Nsp7、Nsp8、Nsp9、Nsp12 和Nsp13 相互作用形成RTC,促进RNA 序列反应,共同参与RTCs 的形成[23]。非结构蛋白在不同冠状病毒中相对保守,在病毒的生命周期中起到重要作用[22]。
α 属病毒Nsp1 不与40s 核糖体结合,也不促进宿主细胞mRNA 降解,但可在一定程度上抑制宿主蛋白质翻译,并且这种抑制具有宿主特异性[24]。TGEV Nsp1 可抑制哺乳动物细胞和海拉细胞无细胞提取物的蛋白质翻译,但不影响兔网织红细胞裂解物的翻译[25]。TGEV Nsp1 的aa85~aa102 区域磷酸化后,激活核因子κB(NF-κB),诱导Ⅲ型IFN产生[26]。Nsp1蛋白存在于α属和β属CoV中,但两个属抑制宿主基因的表达机制不同,比较Nsp1 表面静电、形成和氨基酸序列,推测同源异途进化是导致表达机制不同的原因。因此,两属病毒的Nsp1 氨基酸序列差异大也可作为区分冠状病毒属的特异性标记[2,12]。
Nsp2分子量较大,序列不保守,不是CoV复制的必需成分,但缺少Nsp2会导致病毒合成量降低[2]。Nsp2可诱导前炎性因子表达,aa1~aa120 区域可激活核因子NF-κB 信号通路[12]。Nsp3 约含1 922 个氨基酸,平均分子量200 kDa,是CoV 编码的最大的多结构域非结构蛋白。所有CoV Nsp3中均具有泛素样结构域1、泛素样结构域2、宏结构域、富含Glu 的酸性域、木瓜蛋白酶样蛋白酶2、NSP3胞外域、未知功能域Y1和CoV-Y结构域等8种结构域[24]。Nsp3 具有木瓜蛋白酶样蛋白酶活性(PLpro),包括PL1pro和PL2pro等两个水解活性位点,水解多聚蛋白获得Nsp1~Nsp4[27]。Nsp3 宏结构域在病毒复制和免疫逃避中起到作用[12]。α属冠状病毒Nsp3主要结构域[22]见图3。
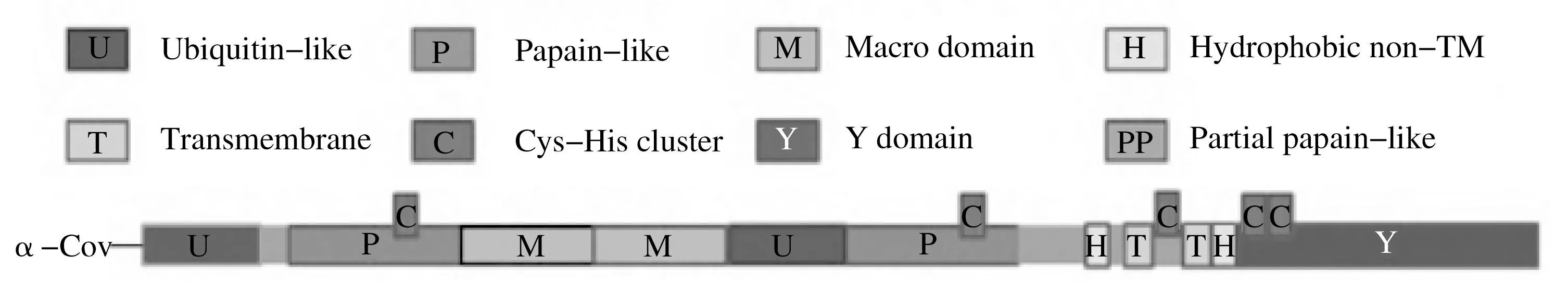
图3 α属冠状病毒Nsp3主要结构域Fig.3 Primary domain of α-coronavirus Nsp3
Nsp4是一个跨膜蛋白,包含TM1、TM2、TM3、TM4等4个预测的跨膜区域[24]。Nsp4是一种糖基化蛋白,对病毒DMVs 的形成很重要,糖基化程度与CoV 适应性相关[2]。Nsp5也称3-胰凝乳蛋白酶样蛋白酶(3CLpro),水解多聚蛋白获得Nsp5~Nsp16,是研发抗冠状病毒药物的重要靶点。研究发现,Nsp5 具有多种形态,只有二聚体形态才具有3CLpro活性[2]。
Nsp6是一个跨膜蛋白,是病毒的转录复合体的跨膜组成部分,包含6 个跨膜区和1 个保守的疏水结构域。Nsp6可诱导小直径自噬体的产生,限制了其运送病毒的能力,利于病毒感染[12]。Nsp7 定位于细胞质,对细胞周期、细胞周期蛋白A 的表达均无影响,具有使小肠上皮细胞(IEC)降低分泌IL-8 的能力[28]。晶体角度发现,Nsp7 能够与Nsp8 形成复合体[12]。Nsp8 具有RNA 聚合酶活性,但与Nsp12 相比则弱得多。有研究认为,Nsp8 是Nsp12 的潜在RNA 引物酶,可指导RNA 合成。此外,Nsp8 是复制转录复合物(RTC)相关蛋白[2]。Nsp9有核酸结合能力,与Nsp8形成二聚体,对病毒复制起到重要作用[29]。
Nsp10是一个转录调节蛋白,具有核酸结合能力,可与Nsp14、Nsp16、UTR 结合,是RNA 合成的关键调控因子。Nsp10和Nsp14作用,增加NSP14的外切核糖核酸酶活性,避免病毒复制期间的错配;与Nsp16 1∶1结合,增强Nsp16的2'-O-甲基转移酶活性,用于加帽。有研究推测,Nsp10可在病毒复制期间调节Nsp14外显子活性[30-31]。Nsp11仅13个氨基酸,相关报道很少。Nsp12分子量约102 kDa,氨基酸序列保守,具有RdRp 活性。Nsp12 单独作用仅具有较弱的RNA 聚合酶活性,但与Nsp7 或Nsp8 结合后,该活将明显提高[22]。Nsp12 与Nsp13 协同可提高病毒复制效率,与Nsp14作用则可参与病毒复制保真过程[12]。
Nsp13具有核酸解旋酶活性,依靠pH值和金属离子浓度发挥活性。氨基端aa1~aa77 区域为锌指结构域,其中14 个高度保守的半胱氨酸残基对Nsp13 的核酸解旋酶活性具有影响;aa279 到羧基端尾部为解旋酶结构域[29]。Nsp14 分子量约为60 kDa,具有外切核酸酶活性和N7-甲基转移酶活性[23]。外切核酸酶活性避免了病毒复制过程中的错配,保证病毒复制的保真性,为TGEV 远大于其他RNA 病毒的基因组长度提供了条件。Nsp14 与Nsp10 作用,其外切核酸酶活性显著增加。N7-甲基转移酶对病毒进行Cap 0 型加帽有利于病毒mRNA 的核转运、翻译和稳定性。两种酶活性功能域在结构上交错,但在功能表达上相互影响。Nsp14 外显子对Nsp12 聚合酶起上位基因作用,参与病毒复制中的矫正过程。
Nsp15 弥漫分布在整个细胞质中,不形成斑点[32]。Nsp15 具有尿苷特异性内切核糖核酸酶活性,优先切割3'尿嘧啶核苷酸,产生2'-3'环磷酸酯端。Nsp16 具有2'-O-甲基转移酶活性,与Nsp10 相互作用可增强活性。2'-O-甲基转移酶对自身RNA 进行加帽,将Cap 0 甲基化为Cap 1,甲基化修饰会稳定基因组RNA 的化学性质并且伪装RNA以进行免疫逃避[12]。
2.3.2 ORF3
ORF3 由ORF3a 和ORF3b 组成,ORF3a 编码蛋白质含71 个氨基酸,ORF3b 编码蛋白质含有254 个氨基酸,ORF3b 序列较保守,编码蛋白质分子量约27.7 kDa,糖基化后形成分子量约31 kDa 的整合膜蛋白。与TGEV 进行对比,TGEV变异株SP以及PRCV均在ORF3处有缺失,提示ORF3在病毒复制中非必需,但可能与病毒毒力相关[14]。
2.3.3 ORF7
ORF7 为α 属冠状病毒特有,编码蛋白质约含78 个氨基酸,为分子量约9.1 kDa的疏水蛋白,氨基端aa1~aa30区域为信号肽序列。ORF7蛋白表达定位于宿主细胞内的内质网,在体外合成时与微粒体、内质网、高尔基体等相关。ORF7 蛋白不直接参与病毒复制过程,但具有调控病毒复制的能力,ORF7 过表达会导致宿主细胞病变效应(CPE)程度降低,降低TGEV 的复制水平,而缺少ORF7 蛋白的TGEV毒力会增强[33]。
3 展望
猪传染性胃肠炎暂无特效药物,临床中以免疫接种为主要防治手段,但由于TGEV 高突变率的特点,传统疫苗的保护能力愈显不足,基因工程疫苗和抗病毒药物的开发为现在的主要研究方向。
TGEV 既具有冠状病毒的一部分共同特征,也有基于本属的特点,病毒结构蛋白、非结构蛋白和附属蛋白的结构功能对病毒繁殖研究具有重大意义。结构蛋白尤其是S蛋白与N蛋白是TGEV研究最多的结构部分,参与宿主细胞的识别、诱导产生中和抗体和病毒繁殖过程等,对分子诊断、疫苗研发和抗病毒药物开发等具有重大意义。非结构蛋白参与转录翻译,在指导蛋白质合成以及附属基因的表达中起到重要作用;非编码区调控病毒转录翻译,在病毒复制过程中可能起到重要作用,但目前这方面研究主要集中于冠状病毒β 属,而α 属的非结构蛋白与非编码区的研究相对较少。非结构蛋白为抗病毒药物的研发提供了多个重要靶点,是今后研究的重要方向。
