胸腔镜肺段切除术后肺部感染的特征及影响因素
2023-09-02王娇胡宝利王佳
王娇 胡宝利 王佳
(河南大学淮河医院 开封 475000)
随着工业化发展及生活水平提高,肺部疾病已成为全球关注的公共健康问题,严重危及生命健康。肺结核、非肿瘤性病变、肺癌、血气胸等均为发病率较高的肺部疾病,其中大部分肺部疾病多需要采取手术治疗。胸腔镜肺段切除术为临床治疗肺部疾病重要术式,相比开放术式具有创伤小、术后恢复快等特点,治疗效果已得到广泛认可[1]。相关研究指出,肺部感染为肺部手术后发病率较高的一种并发症,可达8%~25%[2]。胸腔镜肺段切除术会对胸腔环境造成一定影响,加之大部分肺部疾病患者存在呼吸功能差、免疫力低下等状况,自身更容易发生感染[3]。术后肺部感染会在一定程度上延长住院时间,增加经济负担,甚至引发其他并发症发生,如循环系统衰竭、急性呼吸窘迫综合征等,术后肺部感染病死率高达10%~20%,已成为肺部疾病重要的病死原因,一直以来都是胸外科研究难题。因此,积极探寻胸腔镜肺段切除术后发生肺部感染的特征及其影响因素具有重要意义。鉴于此,本研究分析胸腔镜肺段切除术后肺部感染的特征,并采用Logistic 回归分析术后肺部感染的影响因素,以期为临床防治提供参考依据。现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2021年2月至2023年2月于河南大学淮河医院接受胸腔镜肺段切除术治疗的100 例患者临床资料,其中男57 例,女43例;年龄:<60 岁56 例,≥60 岁44 例;糖尿病:合并41 例,未合并59 例;吸烟史:有36 例,无64 例;高血压:合并44 例,未合并46 例;体质量指数(BMI)21~26 kg/m2,平均BMI(23.96±1.43)kg/m2;饮酒史:有44 例,无56 例;术中失血量:≥300 ml 22 例,<300 ml 88 例;慢性阻塞性肺疾病(COPD):合并44 例,未合并56 例;术后血清前白蛋白(PA)水平80~160 mg/L,平均(132.31±17.25)mg/L。本研究经河南大学淮河医院医学伦理委员会审查批准(伦理字202100498 号)。
1.2 入组标准 (1)纳入标准:经临床检查明确诊断为肺部疾病;符合胸腔镜肺段切除术适应证;年龄<80 岁;临床资料完整。(2)排除标准:既往有胸腔手术史;术后再次行手术治疗;术后有严重心血管并发症;术前肝肾功能不全;术前1 个月服用过糖皮质激素药物。
1.3 研究方法 详细询问所有患者病史、症状,并予以全面的体格检查。记录所有患者性别(男、女)、年龄(<60 岁、≥60 岁)、BMI、饮酒史(每日饮酒量≥100 ml,且连续饮酒超出1 个月判定为有饮酒史,反之无饮酒史)、糖尿病(合并、未合并)、高血压(合并、未合并)、吸烟史(有、无,吸烟指数=每日吸烟支数×吸烟年数,将吸烟指数≥400 的患者视为有)、术中失血量(<300 ml、≥300 ml)、术后机械通气时间(<6 h,≥6 h)、COPD(合并、未合并)、术后PA 水平(术后3 d 抽取患者空腹静脉血3 ml,离心处理后取清液,采用免疫扩散法检测PA 水平)。
1.4 诊断标准 肺部感染:(1)胸部CT 检查肺部显示炎症浸润;(2)术后发热,体温>38℃,连续2 d 及以上;(3)白细胞计数>10×109/L;(4)术后有咳脓痰、咳嗽、湿性啰音症状;(5)深部痰细菌培养有致病菌。以上5 项符合任意3 项即可判定发生肺部感染,将发生肺部感染患者纳入发生组,未发生患者纳入未发生组。对于术后肺部感染的患者进行致病菌检查,以确定病原菌,分析感染特征。糖尿病:符合《2型糖尿病分级诊疗与质量管理专家共识》[4]中的相关诊断标准。高血压:符合《中国高血压防治指南(2018年修订版)》[5]中的相关诊断标准。COPD:符合《中国慢性阻塞性肺疾病急性加重中西医诊治专家共识(2021)》[6]中的相关诊断标准。
1.5 统计学方法 采用SPSS23.0 软件进行数据处理,计量资料以(±s)表示,采用独立样本t检验;计数资料以%表示,采用χ2检验;采用Logistic 回归分析胸腔镜肺段切除术后肺部感染的影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 术后肺部感染发生率及特征 100 例患者术后有23 例患者发生肺部感染(发生组),77 例未发生(未发生组),发生率为23%。23 例患者经痰细菌培养发现有11 例为肺炎链球菌,4 例为葡萄球菌,5 例为肺炎克雷伯菌、3 例为绿脓杆菌。
2.2 两组临床资料比较 两组性别、BMI、饮酒史、高血压比较,差异无统计学意义(P>0.05);发生组年龄(≥60 岁)、合并糖尿病、有吸烟史、术中失血量(≥300 ml)、合并COPD 占比均高于未发生组,术后PA 水平低于未发生组,差异有统计学意义(P<0.05)。见表1。
表1 两组临床资料比较(±s)
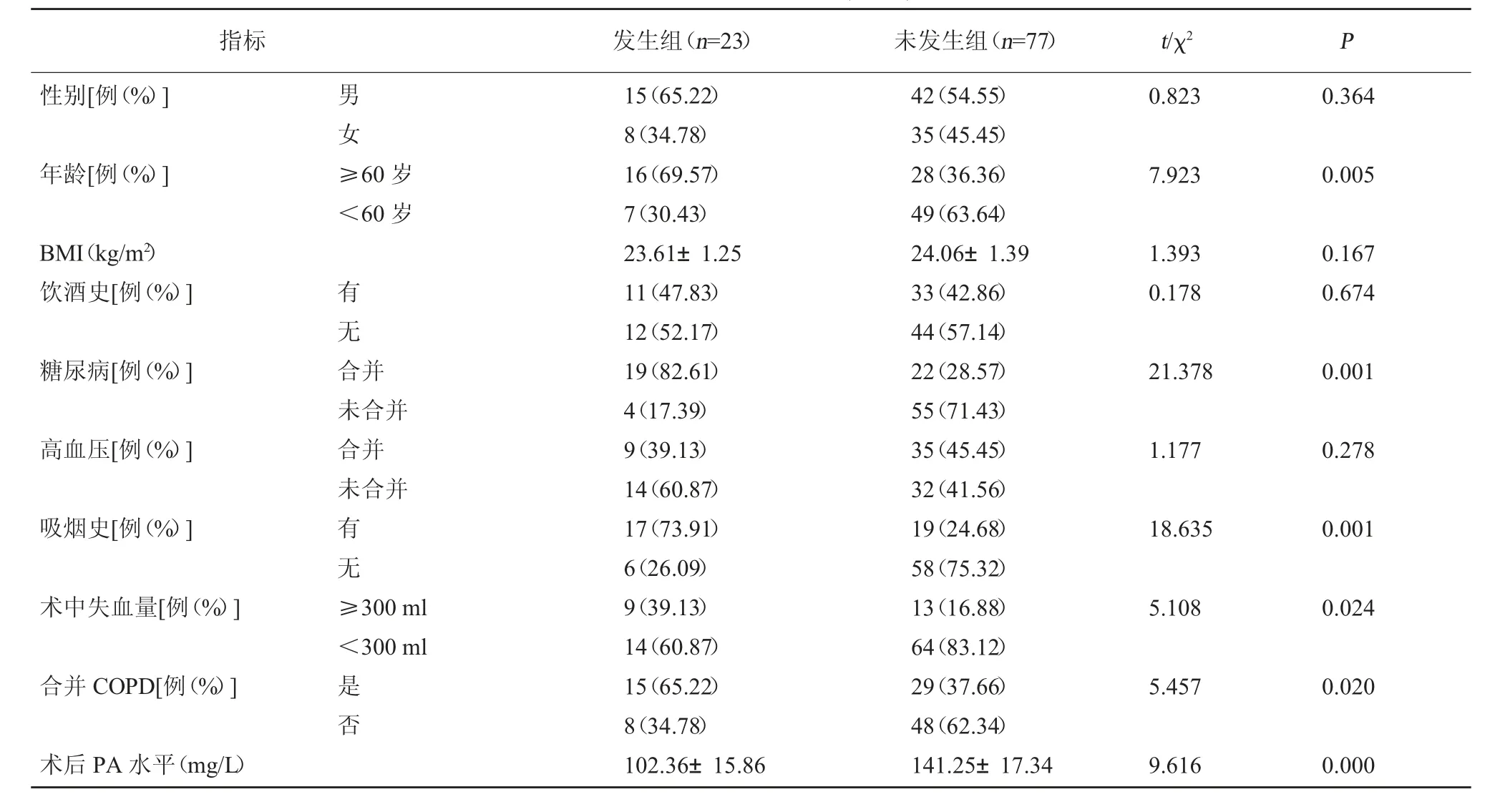
表1 两组临床资料比较(±s)
指标发生组(n=23)未发生组(n=77)t/χ2P性别[例(%)]男女0.8230.364年龄[例(%)]≥60 岁<60 岁7.9230.005 BMI(kg/m2)饮酒史[例(%)]1.3930.1780.1670.674糖尿病[例(%)]有无合并21.3780.001高血压[例(%)]未合并合并未合并1.1770.278吸烟史[例(%)]有无18.6350.001术中失血量[例(%)]≥300 ml<300 ml 5.1080.024合并COPD[例(%)]是否5.4570.020术后PA 水平(mg/L)15(65.22)8(34.78)16(69.57)7(30.43)23.61±1.2511(47.83)12(52.17)19(82.61)4(17.39)9(39.13)14(60.87)17(73.91)6(26.09)9(39.13)14(60.87)15(65.22)8(34.78)102.36±15.8642(54.55)35(45.45)28(36.36)49(63.64)24.06±1.3933(42.86)44(57.14)22(28.57)55(71.43)35(45.45)32(41.56)19(24.68)58(75.32)13(16.88)64(83.12)29(37.66)48(62.34)141.25±17.349.6160.000
2.3 胸腔镜肺段切除术后肺部感染的多因素分析将2.2 中比较,差异有统计学意义的指标(年龄、糖尿病、吸烟史、术中失血量、COPD、术后PA 水平)作为自变量并为其赋值,赋值情况见表2。将胸腔镜肺段切除术后肺部感染发生状况作为因变量(1=发生,0=未发生),经Logistic 回归分析显示年龄(≥60岁)、合并糖尿病、有吸烟史、术中失血量(≥300 ml)、合并COPD、术后PA 低水平均为胸腔镜肺段切除术后肺部感染的影响因素(OR>1,P<0.05)。见表3。

表2 自变量赋值说明
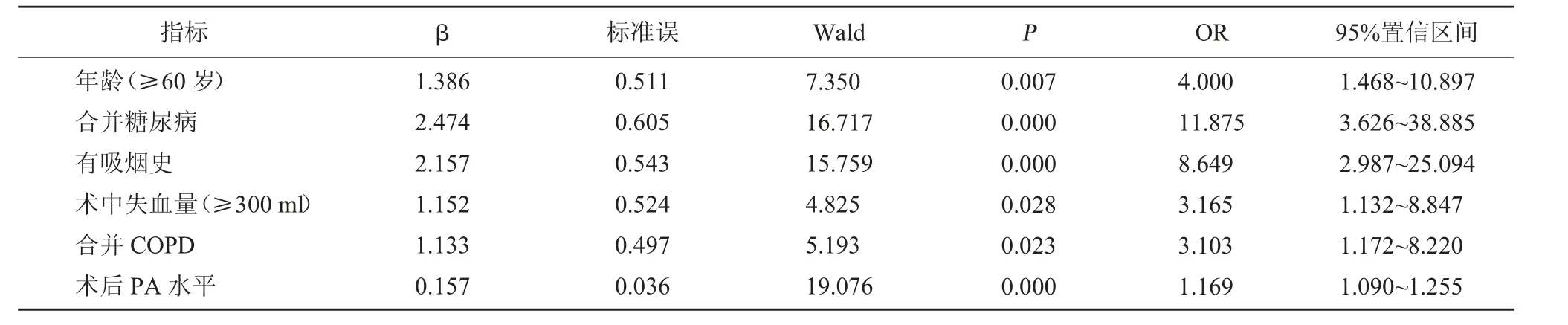
表3 胸腔镜肺段切除术后肺部感染的多因素分析
3 讨论
肺部感染已逐渐成为胸外科手术常见且严重的术后并发症,如何有效降低其发生率,应从主要发病机制及相关危险因素进行分析。肺部感染主要指肺泡、气道终末位置发生炎症反应,正常生理状态下,呼吸道具有较好的防御机制,可保持呼吸道稳定处于无菌状态[7]。而经手术治疗后,呼吸道的无菌状态会被打破,进而给致病菌侵入的机会,引发肺部感染,严重影响术后恢复。因此,对胸腔镜肺段切除术后肺部感染相关影响因素进行分析,可帮助临床有针对性、有目的的预防,从而降低发生风险。
本研究中100 例患者术后有23 例患者发生肺部感染,77 例未发生,发生率为23%。23 例患者经痰细菌培养显示多为细菌性感染,其中11 例为肺炎链球菌,4 例为葡萄球菌,5 例为肺炎克雷伯菌、3 例为绿脓杆菌。进一步经Logistic 回归分析显示,年龄(≥60 岁)、合并糖尿病、有吸烟史、术中失血量(≥300 ml)、合并COPD、术后PA 低水平均为胸腔镜肺段切除术后肺部感染的影响因素。分析其原因如下:(1)年龄:高龄患者多存在气管、细胞组织老化状况,且机体免疫力较差,本身并存肺功能障碍。采取手术治疗,术中会刺激或诱发心肺功能不全,且该类患者对细菌侵袭的耐受性低,为术后肺部感染易发人群[8]。另外,高龄患者肺活量交底,气管活动能力差,肺顺应性低,术后肺部感染发生率较高。(2)合并糖尿病:已有研究指出,合并糖尿病患者术后肺部感染发生风险性为未合并患者的5 倍左右[9]。糖尿病会使机体长时间处于高血糖状态,使机体糖代谢紊乱,降低糖酵解能力,促进机体蛋白质分解,故免疫蛋白合成不足,导致体液及细胞免疫功能下降。此外,大部分合并糖尿病手术患者会伴有微循环障碍,机体创伤愈合减缓,抗菌药物渗入能力差,增加术后肺部感染发生概率。(3)有吸烟史:烟草成分中含有多种能够损伤肺细胞的毒性因子,影响上皮细胞、间质细胞的修复功能,进而抑制细胞增殖及重塑、细胞基质生成等,甚至导致细胞衰亡。对于存在长期吸烟史的患者,会严重损伤呼吸道黏膜上皮与肺泡内巨噬细胞屏障功能,诱发炎症反应,进而刺激腺体分泌、抑制纤毛活动,导致气管痉挛,增加肺密闭容量,严重影响肺部通气及储备功能,有害细菌无法及时排出,极易引发肺部感染[10]。因此,存有吸烟史的患者术后肺部感染发生率较高。(4)术中失血量:术中失血量过多会使机体微循环系统受损、多种器官灌注不足,导致机体组织血液供应受阻,进而影响局部组织的免疫反应。并且,组织细胞含氧量会随之下降,削弱粒细胞黏附与趋化功能,导致粒细胞无法及时并有效吞噬消灭病原菌,增加肺部感染风险[11]。(5)合并COPD:合并COPD 的患者术前肺功能较差,手术治疗后气道内分泌物容易残留,严重者甚至会使小气道阻塞,进而影响肺泡内表面活性物质合成,导致通气血流比例不平衡,增大肺部感染风险[12]。且COPD潜在的感染易频繁发作,降低肺自身顺应性,减弱肺泡吞噬功能,也会增加肺部感染风险。(6)术后PA低水平:PA 相比传统白蛋白指标半衰期较短,仅1.9 d,在机体内合成快、代谢快,更易反映蛋白质代谢情况,为临床评价营养状态的常用指标。相关研究指出,营养状态可作为肺癌患者术后并发症发生的重要预测指标[13]。胸腔镜肺段切除术后需禁食禁饮,加之体液流失、出血等因素,患者多存在营养不良状况,因此,术后PA 水平呈低表达。当PA 水平较低时,表明体内缺乏蛋白,机体免疫因子及免疫球蛋白合成也会受影响,免疫细胞增殖减缓,最终导致免疫应答迟缓,降低免疫功能[14]。另外,PA 主要分布于肝脏中,自身具有免疫活性,可通过结合细菌中毒物,直接参与到免疫应答中,具有清除机体循环中有毒代谢物质作用[15]。因此,当机体发生感染过程中,PA水平会显著降低,尤其在细菌感染中较为明显。因此,术后PA 低水平可提示发生肺部感染风险较高。
根据上述影响因素,建议临床采取胸腔镜肺段切除术治疗前采取有效措施改善高龄患者免疫力,控制糖尿病患者血糖水平,指导吸烟患者合理戒烟至少2 周,对于失血量较多的患者需及时输血补充治疗,术前评估COPD 患者肺功能状况,并给予相应干预措施,术后禁食期间可补充营养液。
综上所述,胸腔镜肺段切除术后肺部感染多为细菌性感染,年龄、糖尿病、吸烟史、术中失血量、COPD、术后PA 水平均为其影响因素,临床可根据上述因素采取预防措施,以降低肺部感染发生率,改善疾病预后。
