基于CT影像组学列线图鉴别腮腺多形性腺瘤与基底细胞腺瘤的价值
2023-08-22资欣月董林娟许俊锋张承志刘新
资欣月,董林娟,许俊锋,张承志,刘新
腮腺肿瘤中约80%为良性,多形性腺瘤(pleomorphic adenoma,PA)是其中最常见的良性肿瘤[1],基底细胞腺瘤(basal cell adenoma,BCA)是较为常见的良性上皮源性肿瘤,占涎腺上皮性肿瘤的1%~7%[2]。PA与BCA的临床表现及影像学特点有诸多相似之处,鉴别诊断有一定困难。由于PA有很高的复发倾向和恶性转化发生率[3],术前准确鉴别PA和BCA对手术方法的选择以及患者的预后均具有重要意义。细针穿刺活检是一种临床常用的腮腺肿瘤术前检查方法,但也具有一定的缺点,如诊断性抽吸不充分的发生率较高,而且有继发性面神经麻痹的风险[4]。CT的优势在于其广泛的可用性、能快速完成检查且经济实惠[5]。放射组学可以从医学图像中提取高维特征,能提供更全面的肿瘤相关病理生理学信息,从而可提高对影像的术前诊准确性[6]。本研究基于CT平扫和双期(动脉期及静脉期)增强图像提取肿瘤的影像组学特征,并联合临床资料建立联合诊断模型,旨在提高对PA和BCA的鉴别诊断效能,为临床决策提供准确依据。
材料与方法
1.一般资料
回顾性分析2020年1月-2022年8月在本院就诊的腮腺肿瘤患者的临床和影像资料。纳入标准:①经病理证实腮腺肿瘤为PA或BCA ;②术前影像资料(CT平扫及增强检查)完整;③病灶最大直径>5 mm。排除标准:①图像质量不符合诊断要求;②合并其它腮腺肿瘤性病变;③临床资料不完整。最终共将117例符合研究要求的患者纳入本研究,其中PA 88例,BCA 29例。PA组患者年龄10~71岁,平均(41.2±13.1)岁 ,病灶最大直径0.8~4.2 cm,平均(2.1±0.8)cm;BCA组患者年龄20~70岁,平均(50.4±11.4)岁,病灶最大直径0.6~3.2 cm,平均(1.8±0.7)cm。按照7∶3的比例进行随机分层抽样,将全部患者分为训练集(n=81)和测试集(n=36)。
2.CT扫描方法
使用Siemens Somatom go.Top 64排螺旋CT机,所有患者行CT平扫和增强扫描。扫描参数:120 kV,层厚5 mm,层距5 mm,扫描范围为外耳道下缘至下颌角水平。行CT平扫后,经肘静脉以3.0 mL/s的流率注射对比剂碘海醇(300 mg I/mL),注射对比剂30~50 s后行增强扫描。
3.临床资料和常规CT图像分析
分析肿瘤的临床资料和CT征象,包括病灶数目、质地、部位(浅叶、深叶)、密度(囊性、实性及囊实性)最大直径、钙化及同侧淋巴结肿大(直径≥1 cm)等。在各期相(平扫、动脉期及静脉期)图像上测量病灶的CT值,感兴趣区面积25 mm2,每个病灶测量3次后取平均值;计算动脉期CT强化值(动脉期CT值-平扫期CT值)和静脉期强化值(静脉期CT值-平扫期CT值)。
4.影像组学分析
病灶分割:由2位影像科医师共同商议确定病灶边缘,当意见不一致时由上级医师最终确定。利用3D Slicer软件(https://www.slicer.org/),分别在平扫、动脉期及静脉期图像上沿病灶边缘逐层勾画二维ROI,软件即可自动融合生成病灶的三维容积感兴趣区(volume of interest,VOI),用于后续的特征提取(图1~2)。
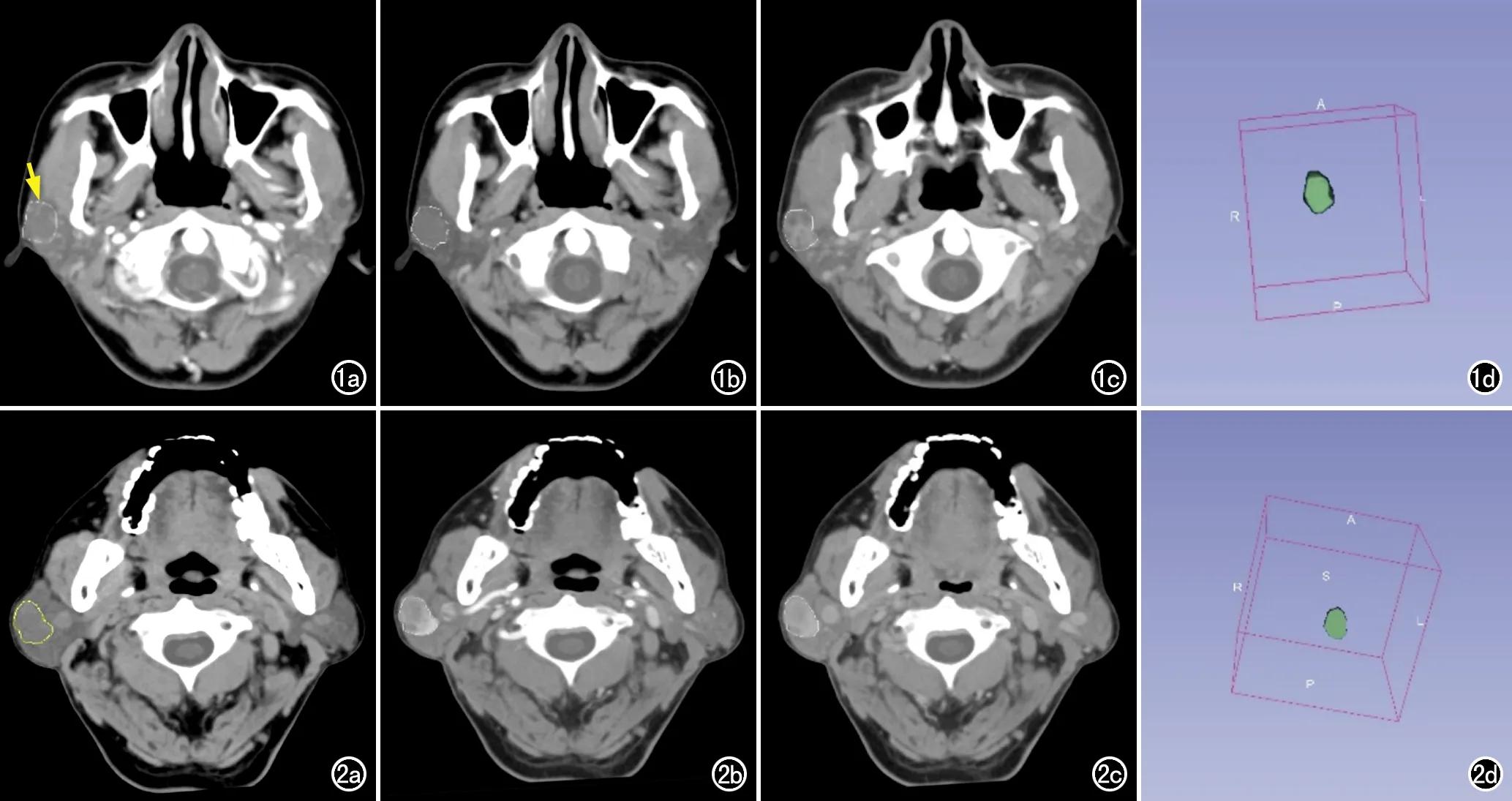
图1 PA患者,26岁,女性。a)CT平扫,示右侧腮腺内有一圆形低密度结节(黄箭),边界清晰,边缘光整,与周围结构分界清楚,沿病灶边缘勾画ROI;b)动脉期图像,示病灶无明显强化,沿病灶边缘勾画ROI;c)静脉期图像,示病灶呈不均匀轻度强化,可见斑点状无强化区,沿病灶边缘勾画ROI;d)软件自动融合生成病灶的VOI。 图2 BCA患者,67岁,男性。a)CT平扫,示右侧腮腺内有一类圆形低密度结节,边界清晰,边缘光整,与周围结构分界清楚,沿病灶边缘勾画ROI(黄线);b)动脉期,中度不均匀强化,沿病灶边缘勾画ROI;c)静脉期,强化程度高于动脉期,沿病灶边缘勾画ROI;d)软件自动融合生成病灶的VOI。
图像预处理及特征提取:利用3D Slicer软件的Pyradiomics工具包对图像进行重采样预处理,重采样体素大小为1 mm×1 mm×1 mm,并将图像标准化。提取特征时设置可提取图像类型为原始图像,提取的影像组学特征主要包括18个一阶特征、14个形态特征和75个纹理特征。
特征筛选和模型构建:采用Python 3.7软件,此过程主要包括4个步骤。首先,由于数据集类别分布不平衡,采用上采样技术对数据集进行处理来平衡数据;然后,采用Z-score法将数据进行标准化处理;第三步,使用Spearman相关性分析剔除相关性系数|r|>0.7的冗余特征;最后,将剩余特征进一步采用互信息法和递归特征消除法进行特征筛选,获得最佳影像组学特征,用于构建logstic回归影像组学模型,并计算影像组学评分(Radscore),其计算公式:Radscore=I+β1×W1+β2×W2+β3×W3+......(I表示截距,β表示筛选出的各项最佳组学特征的数值,W表示各特征对应系数)。
5.统计学分析
使用SPSS 26.0和R3.6.1软件进行统计学分析。符合正态分布的数据以均数±标准差表示,组间比较采用两独立样本t检验;计数资料采用中位数(P25,P75)来表示,组间比较采用卡方检验。
将自变量(临床资料和常规CT征象)中组间比较差异有统计学意义(P<0.05)的三项指标(年龄、动脉期强化值和静脉期强化值)纳入logistic回归分析构建临床模型。采用受试者工作特征曲线(receiver operation characteristic curve,ROC)分析各模型的诊断效能,计算曲线下面积(area under ROC curve,AUC)、敏感度、特异度、符合率、阳性和阴性预测值。采用Delong检验比较各单期相组学模型间AUC的差异,并采用连续净重分类改善度(net reclassification improvement,NRI)和综合区分改善度(integrated discrimination improvement,IDI)两项指标来两两比较各模型对分类效能的改善能力,NRI>0且IDI>0表示正向改善,筛选出最优的影像组学模型,然后与临床模型构建联合模型。基于联合模型,利用R软件的rms及survival软件包绘制其列线图,采用boostrap自助抽样法重复抽样500次,绘制列线图的校准曲线分析模型与实际情况之间的拟合效果,并绘制决策曲线评估列线图的临床应用价值。
结 果
1.临床资料和常规CT征象
训练集和测试集中患者的临床资料和常规CT征象见表1。训练集和测试集中,BCA组的患者年龄、动脉期及静脉期CT强化值均明显大于PA组,组间差异均有统计学意义(P<0.05)。
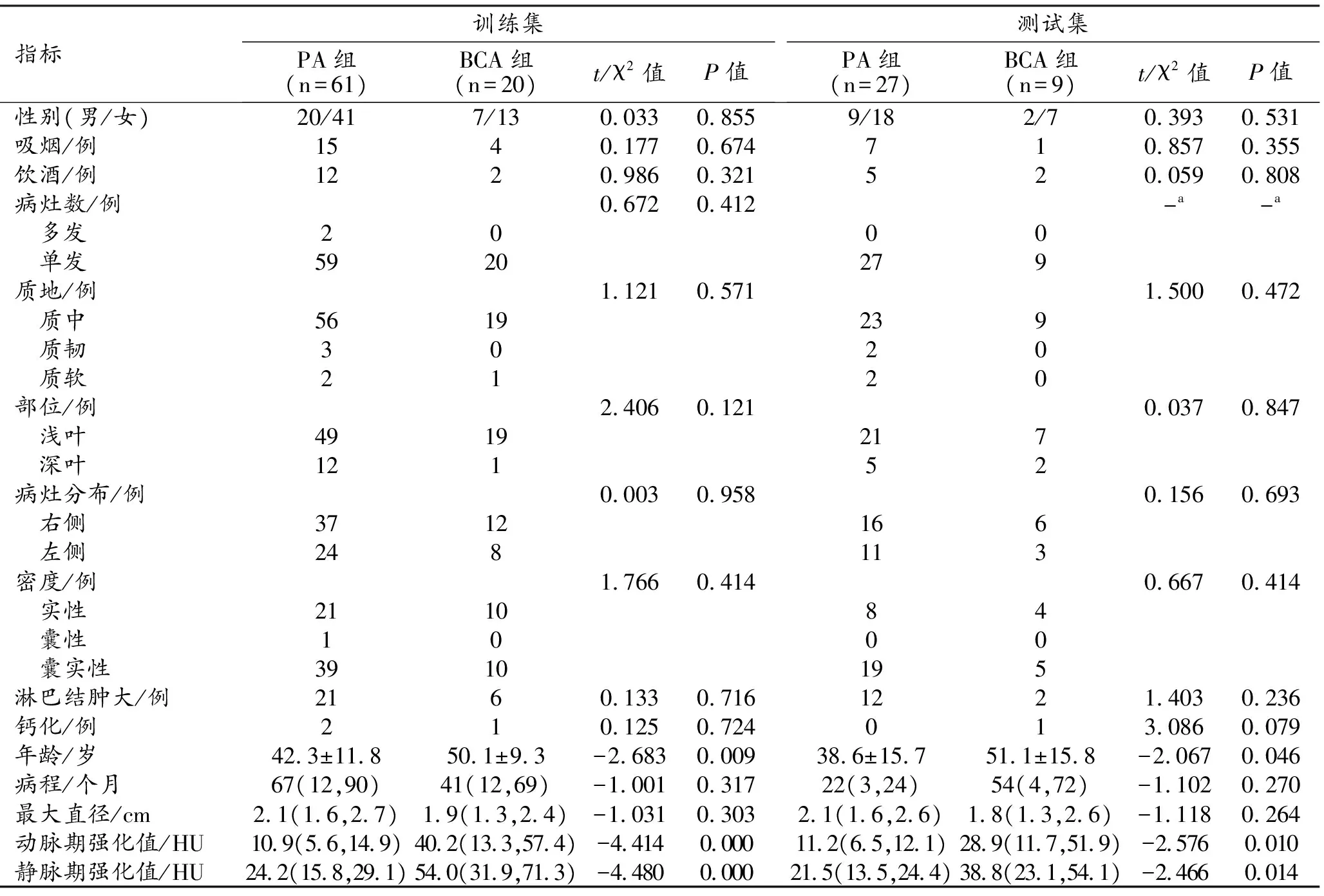
表1 训练集和测试集的临床资料和常规CT征象
2.影像组学特征筛选及模型构建
经过特征筛选,基于CT平扫、动脉期和静脉期图像分别获得了7个、8个和8个最佳组学特征,将其分别纳入逻辑回归分析,分别建立基于3期图像的影像组学回归模型并获得相应的Radscore计算公式,3个模型中截距分别为2.192、2.941和2.302,各项特征在模型中的系数详见表2。

表2 各期相最终筛选的特征及其系数
3.各模型诊断效能评估
首先,在训练集和测试集中分别根据平扫模型、动脉期模型和静脉期模型的预测概率绘制ROC曲线(图3),并计算出各模型的AUC及诊断效能指标指标值,详见表3。进一步采用Delong检验分别在训练集和测试集中比较各单期模型之间AUC值的差异,结果显示:平扫与动脉期模型(训练集:Z=1.547,P=0.1219;测试集:Z=0.857,P=0.391)、平扫与静脉期模型(训练集:Z=0.880,P=0.379;测试集:Z=0.084,P=0.932)、动脉期与静脉期模型(训练集:Z=1.350,P=0.177;测试集:Z=0.495,P=0.620)之间AUC值的差异均无统计学意义(P均>0.05)。
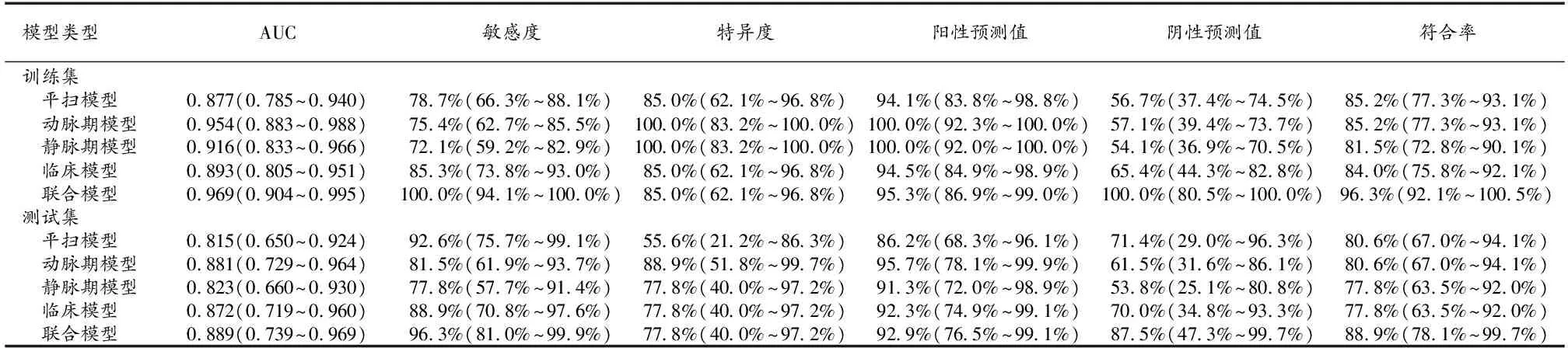
表3 各模型在训练集与测试集的鉴别诊断效能
随后,计算各单期模型的NRI及IDI,结果见表4。在训练集和测试集中动脉期模型均较平扫和静脉期模型具有正向改善力(NRI>0且IDI>0),说明动脉期模型在鉴别两种肿瘤方面较平扫及静脉期模型更有优势,故选择动脉期影像组学评分与临床模型构建联合模型。
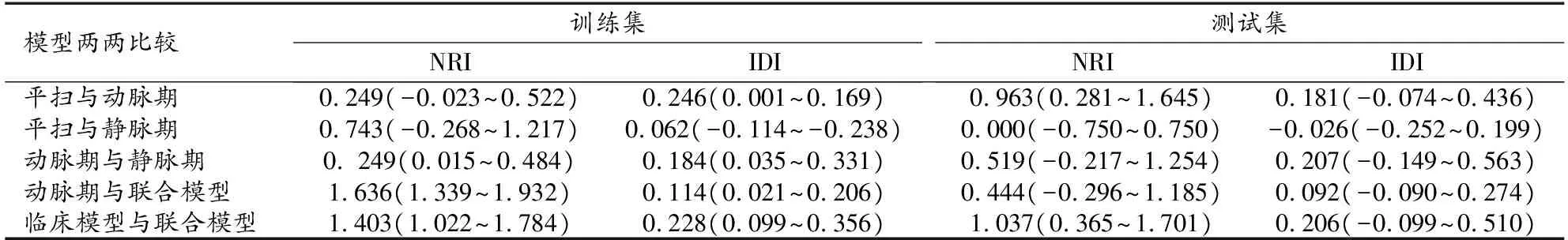
表4 各模型间诊断效能比较的NRI及IDI
联合模型和临床模型的诊断效能分析结果见图3、表3。统计分析结果显示联合模型诊断效能优于临床模型。进一步采用Delong检验对这2个模型及其与各单期影像组学模型在训练集和测试集中的AUC进行比较,结果显示,仅在训练集中联合模型与临床模型之间AUC值的差异具有统计学意义(Z=2.176,P=0.0296),其余各模型间AUC值的差异均无统计学意义(P>0.05)。NRI及IDI分析结果显示在训练集和测试集中联合模型较动脉期模型和临床模型均具有正向改善力(表4)。
绘制联合模型的列线图(图4),其校准曲线显示在训练集和测试集中的平均绝对误差分别为0.069和0.060(图5),表明列线图预测概率与病理结果间一致性较高,预测的效果良好。决策曲线显示列线图较其它模型的风险阈值范围更宽(图6),具有更高的临床净收益,表明列线图具有较好的临床应用价值。
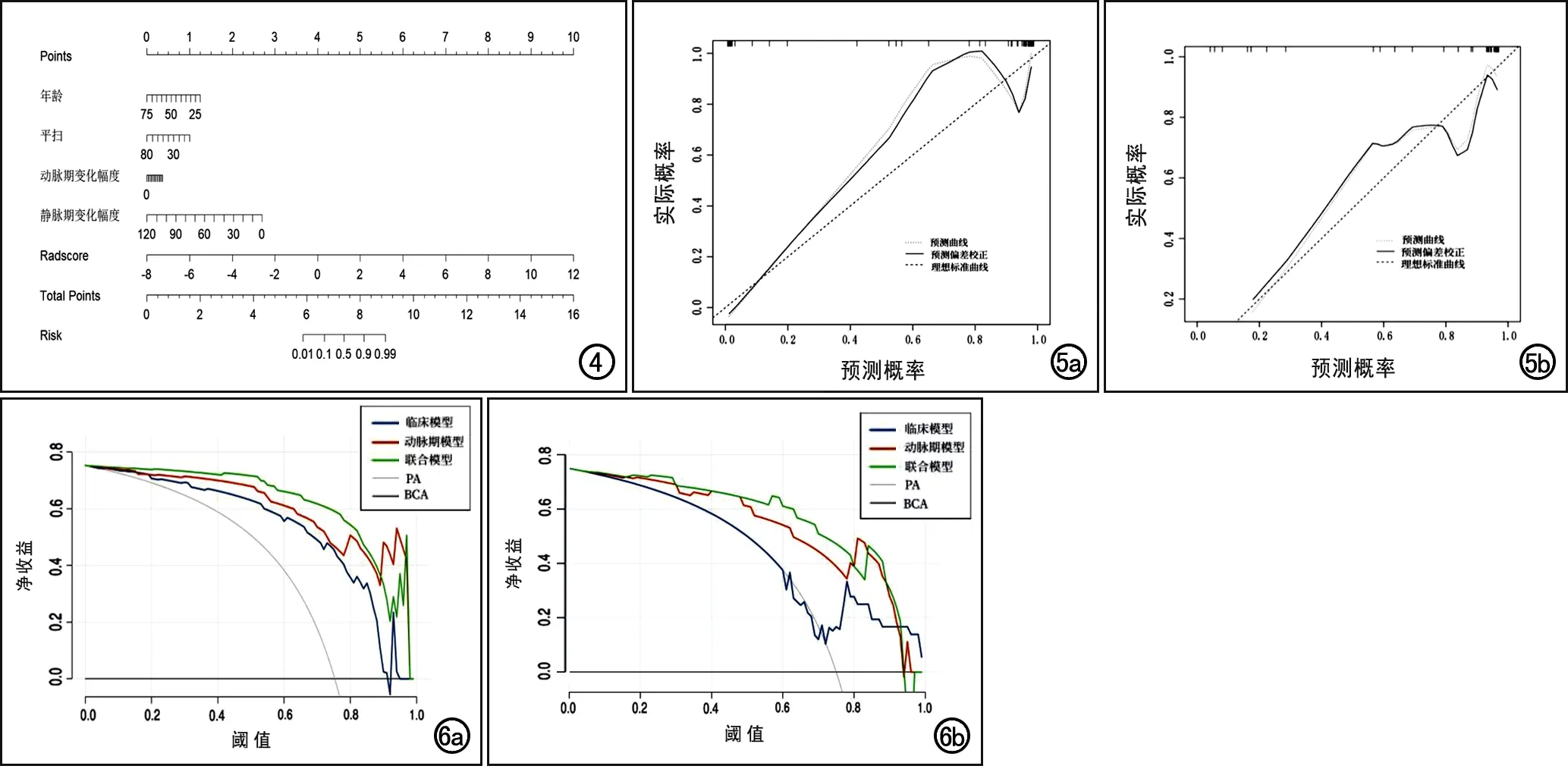
图4 联合模型鉴别诊断PA与BCA的列线图。 图5 列线图的校准曲线。a)训练集中,模型预测值与样本真实值之间的平均绝对误差为0.069,表明联合模型拟合效果较好;b)测试集,模型预测值与样本真实值之间的平均绝对误差为0.060,表明联合模型拟合效果较好。 图6 临床模型、动脉期模型及联合模型列线图的决策曲线。a)训练集中,联合模型曲线高于临床模型及动脉期模型,联合模型鉴别腮腺BCA与PA的净收益较高;b)测试集中,联合模型曲线高于临床模型及动脉期模型,联合模型对腮腺BCA与PA鉴别诊断的净收益较高。
讨 论
在临床诊疗中准确鉴别PA与BCA具有重要的临床意义,术前准确诊断对指导临床制订个体化的治疗计划和改善患者的预后具有重要作用[7]。PA具有肿瘤复发风险,高达5%~15%的病例可转化为恶性肿瘤,而BCA除了膜性亚型(组织学表现为外周细胞呈栅栏状排列,由玻璃样变的基底膜样物质围绕)外,很少复发,未见其出现恶性转化的报道[8]。PA的主要治疗方法是切除肿瘤周围的腮腺组织以及毗邻面神经的肿瘤的完整包膜[8]。与PA不同,BCA通常更易累及邻近的腮腺组织,临床上通常建议采取包膜外单纯挖除瘤体的手术方式[9]。PA与BCA的临床表现类似,均以女性患者较多见,病变进展缓慢,一般无明显临床症状,多因无意中发现腮腺区无痛性肿块而就诊[10]。有文献报道,PA患者的平均年龄为40~50岁,较BCA患者的平均年龄小10岁左右[11]。PA与BCA在CT平扫图像上均表现为腮腺良性肿瘤的特征,包括呈椭圆形或圆形肿块、边界清晰、推挤周围结构而无浸润性生长的趋势[12]。PA的密度较均匀,增强后肿瘤实质边缘强化程度高于中央区,动脉期强化程度稍低于静脉期,即呈现缓慢持续强化的特点;BCA最明显的特点是易发生出血、坏死和囊变,在平扫及增强图像上其CT值均高于PA[13]。本项研究中,BCA组动脉期强化值为40.2(13.3,57.4)HU,明显高于PA组[10.9(5.6,14.9)HU],与上述研究结果相符。
影像组学通过提取和分析高通量图像特征,能无创性反映肿瘤组织的异质性[14],为疾病的动态监测、预后预测和治疗决策提供了可能性[15]。目前的研究结果显示,就提取的影像组学特征的可重复性和稳定性而言,CT图像最有优势[5]。Jung等[16]基于CT纹理特征分析方法来鉴别PA与腺淋巴瘤,结果显示纹理参数的诊断效能与单期扫描无显著差异,但是始终优于放射科医师的视觉评估。这也说明影像组学对于腮腺肿瘤的鉴别诊断具有一定价值。
本研究中BCA组的病例数偏少,为了解决数据不平衡的问题,我们通过上采样来建立数据集,使用递归特征消除法和交互信息法来筛选特征。互信息法衡量特征与标签之间的相互依赖性,从而避免过拟合,并在训练队列中选择候选特征[14]。递归特征消除法,使用所有特征变量来训练模型,计算每个特征变量的重要性并进行排序,选择最优特征变量集合并以其构建的模型作为最终模型。有文献报道,利用递归特征消除程序执行分类任务是可行的,并且结果更可靠[17]。Wang等[18]的研究结果显示,在肺部良恶性病变的鉴别诊断中,相较于t检验、最小绝对收缩选择算子以及互信息特征选择法,递归特征消除法表现出更好的优势。
有研究结果显示,提取的影像组学特征中60%具有重复性[6]。此次研究使用Pyradiomics工具规范化提取影像组学特征。建立强大的预测模型的关键是选择有效的指标和建模方法。由于BCA与PA的强化方式各有特点,本研究中我们基于CT平扫和双期增强图像分别提取影像组学特征。经特征筛选后,保留了基于平扫图像的7个组学特征,基于动、静脉期的各8个特征。基于这些特征,分别构建了各期相的影像组学模型。Delong检验结果显示,各单期相模型之间AUC值的差异均无统计学意义(P>0.05),但NRI及IDI分析结果显示在训练集和测试集中动脉期模型较平扫和静脉期模型均具有正向改善力(NRI>0且IDI>0)。NRI更关注某个界值时两个模型的优劣,IDI考虑不同界值的情况,反映两个模型预测概率的差距,弥补了NRI的局限性,两者均较AUC等指标更敏感,现被广泛应用于两个模型诊断效能的比较。
在单相期模型中,动脉期模型最优,这可能是因为多形性腺瘤是相对乏血供的肿瘤,早期强化不明显,而基底细胞腺瘤由大量沿内皮排列的血管网(毛细血管和静脉)构成,动脉期有明显强化[19],增强扫描的强化特点有助于两者的鉴别。吴艳等[20]基于T2WI影像组学保留8个纹理特征并与病灶的临床特点建立联合模型,联合模型对PA与腺淋巴瘤的鉴别诊断价值(ROC曲线下面积)明显高于影像组学模型。本研究中将有统计学意义的临床指标(如年龄)及常规CT征象(动静脉期强化值)用于构建临床模型,并联合动脉期影像组学模型和临床模型建立联合模型,结果显示,联合模型(训练集AUC=0.969;测试集AUC=0.889)的诊断效能明显优于动脉期模型(训练集AUC=0.954;测试集AUC=0.881)及临床模型(训练集AUC=0.893;测试集AUC=0.872)。列线图将联合模型进行可视化处理,联合模型的临床净效益明显高于单相期模型和临床模型,在PA与BCA两者的鉴别诊断中更有价值。校准曲线显示在训练集及测试集中联合模型的预测概率与病理结果的一致性较高,预测效果良好。与郑韵琳等[22]研究相比,本研究有以下几点优势:①增加了动静脉期CT强化值,能更客观反映病灶的强化方式;②采用递归特征消除法及互信息法筛选特征更有优势;③利用NRI和IDI更直观地比较各模型间的诊断效能。
综上所述,各期相影像组学模型和临床模型对PA和BCA的诊断效能均较好,而联合模型的诊断效能更优,联合模型的列线图能直观、准确地对PA与BCA进行预测,对辅助临床决策具有较高的价值。
本研究存在的一定的局限性:①系单中心小样本研究,数据模型缺乏外部验证,可能会高估模型的诊断效能,后续有条件将开展多中心研究扩充样本量并进一步验证模型的效能,以期能应用于临床诊疗过程中。②影像组学特征的提取仅限于CT平扫、动脉期及静脉期图像,后续有待加入延迟期图像以及纳入更多的临床资料来组建联合模型,进一步分析联合模型的诊断价值。
