3D-ASL和APT成像鉴别高级别脑胶质瘤与脑转移瘤的临床应用
2023-08-22李双红陈玲张金环朱里铁超恩李涛
李双红,陈玲,张金环,朱里,铁超恩,李涛
脑高级别胶质瘤(high-grade gliomas,HGG)的发病率为5.8/10万,其5年病死率在全身肿瘤中仅次于胰腺癌和肺癌[1]。而恶性肿瘤患者中脑转移瘤(metastatic tumors,MT)的发生率为9%~40%[2],多继发于肺癌、乳腺癌和直肠癌等,其中单发者约占所有转移瘤的50%[3]。这两种类型的脑肿瘤在常规MRI序列上通常具有相似的影像学表现(均表现为肿块样病变呈不均匀强化,周围常伴广泛水肿),导致临床上约40%以上的病例术前定性诊断错误[4]。因此,目前临床上采用常规影像学方法来区分这两类肿瘤仍具有挑战性。随着功能和分子影像学的发展,已有不少研究者对MR波谱成像、DWI、灌注加权成像和酰胺质子转移成像等MRI新技术在区分这两类肿瘤中的应用价值进行了探讨[3-7]。其中,三维动脉自旋标记(arterial spin labeling,ASL)成像是一种利用水分子作为内在示踪剂的灌注成像技术,可用于评价肿瘤的脑血流量和微血管增殖情况;酰胺质子转移(amide proton transfer,APT)成像是一种基于化学交换饱和转移的新型分子MRI技术,能反映脑肿瘤细胞增殖过程中蛋白质合成和过表达的情况。近年来,已有国内外学者采用3D-ASL或APT技术鉴别高级别胶质瘤、淋巴瘤和转移瘤等[4-7],但是目前联合两种技术进行诊断的文献报道很少。本研究通过比较3D-ASL与APT技术在鉴别HGG及MT中的诊断价值,旨在进一步提高对脑肿瘤的影像诊断水平。
材料与方法
1.一般资料
回顾性将2021年6月-2022年10月在柳州市工人医院经手术病理证实或经临床确诊为脑高级别胶质瘤或脑转移瘤的35例患者纳入本研究,其中,HGG 17例(胶质母细胞瘤13例、间变性星形细胞瘤4例),MT 18例(原发肿瘤分别为肺癌14例、乳腺癌2例、肝癌和肾癌各1例)。患者年龄7~76岁,中位年龄57岁。
纳入标准:①术前诊断为颅脑肿瘤,且经术后病理或临床病史证实;②术前能配合完成常规序列、APT和3D-ASL MRI检查,且扫描图像清晰;③行MRI检查前无颅脑活检或手术史。
排除标准:①存在MRI扫描禁忌证,不能配合完成各序列MRI检查;②图像有严重运动伪影,质量不合格;③MRI显示有脑梗死、脑损伤或MRA显示有血管闭塞或狭窄者。
2.MRI检查方法
使用Philips Ingenia 3.0T磁共振扫描仪和32通道头颅线圈。各序列扫描参数如下。常规T1WI:TR 2000 ms,TE 20 ms,层厚5 mm,视野230 mm×187 mm,矩阵356×195;常规T2WI:TR 4000 ms,TE 122 ms,层厚5 mm,视野230 mm×187 mm,矩阵356×195;FLAIR序列:TR 10000 ms,TE 125 ms,层厚5 mm,视野230 mm×182 mm,矩阵308×168;APT序列:TR 5964 ms,TE 8.3 ms,视野230 mm×180 mm,矩阵128×100;3D-ASL成像:TR 4173 ms,TE 10 ms,视野240 mm×240 mm;对比增强T1WI:TR 266 ms,TE 4.6 ms,层厚5 mm,视野230 mm×181 mm,矩阵328×227。
3.图像分析和测量
将所有扫描序列获得的图像导入专用后处理软件IntelliSpacePortal10.1,由2位具有丰富诊断经验的影像科医师独立进行图像分析和数据测量。选取肿瘤所在的3个层面 手动勾画ROI,面积约为50 mm2,取3个层面测量值的平均值作为最终测量结果。将ROI分别放置于肿瘤实质强化区(tumor parenchymal enhancement area,TPEA)及其对侧镜像正常脑白质区(contralateral mirror area of TPEA,CMATPEA)、瘤旁区(peritumoral region, PTR;定义为水肿区,若无水肿则为实质区外周<1 cm的区域为瘤旁区)及其对侧镜像正常脑白质区,测量各ROI的脑血流量(CBF),并计算肿瘤强化区和瘤旁区的相对血流量(rCBF)[5]:
rCBF肿瘤=TPEA-CBF/CMATPEA-CBF
(1)
rCBFPTR=PTR-CBF/CMAPTR-CBF
(2)
以同样的方法获得肿瘤强化区及瘤旁区的相对APT值(rAPT)。ROI放置原则:参考T2WI和对比增强T1WI图像,避开脑室、脑沟、以及肿瘤内囊变和液化坏死区域。
4.统计学方法
使用SPSS 26.0软件对数据进行统计学分析。对于符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验;对于不符合正态分布的计量资料采用用中位数(P25,P75)表示,组间比较采用曼-惠特尼U检验。采用受试者工作特征(ROC)曲线对各项参数及联合模型的诊断效能进行分析,获得鉴别两种肿瘤的最佳阈值,并计算相应的敏感度和特异度。以P<0.05为差异具有统计学意义。
结 果
1.主要影像特征
HGG和MT的瘤内实性部分在ASL灌注成像上均表现为以高灌注为主,囊变、坏死区则表现为低灌注;HGG和MT的瘤内实性部分在APT图像上以高信号或稍高信号(红色或黄色)为主,囊变、坏死区则表现为红色高信号(图1~2)。
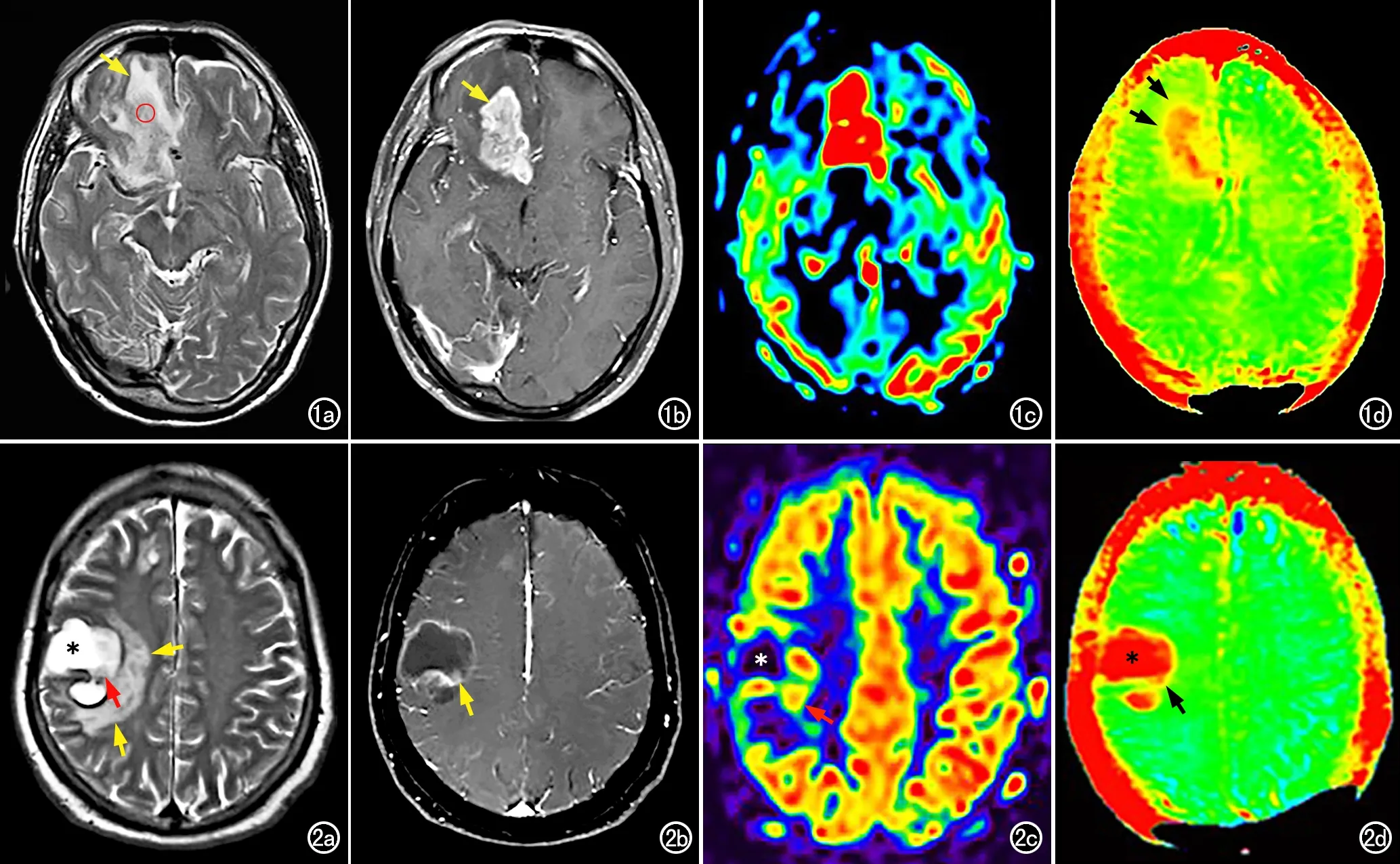
图1 男,68岁,右侧额叶胶质母细胞瘤(WHO Ⅳ级)。a)T2WI示病灶呈稍高信号(红圈),周围水肿呈高信号(黄箭);b)增强扫描示病灶呈明显不均匀强化(黄箭);c)ASL伪彩图像,显示病灶呈高灌注(红色),周围水肿无明显灌注增高;d)APT伪彩图像,显示病灶呈高信号(红色),周围水肿呈稍高信号(黄色)、边界不清(黑箭)。 图2 女,60岁,乳腺癌右侧额叶脑转移瘤。A)T2WI示病灶囊性成分呈显著高信号(星号),实性成分呈稍高信号(红箭),周围水肿呈高信号(黄箭);b)增强扫描示肿瘤内囊性成分无强化,实性成分有明显强化(黄箭);c)ASL伪彩图示囊性成分呈低灌注(星号),实性成分呈高灌注(红箭),周围水肿无明显灌注升高;d)APT伪彩图示囊性成分呈红色高信号(星号),实性成分呈黄色稍高信号(黑箭),周围水肿无明显信号增高、边界清晰。
2.定量参数值的比较
HGG组和MT组各项定量参数值及组间比较结果见表1~2。HGG组肿瘤实质强化区的rCBF值和rAPT值的中位数均较MT组高,rCBF值在2组间的差异无统计学意义(Z=-1.27,P>0.05),rAPT值的组间差异具有统计学意义(P<0.05);HGG组瘤旁区的rCBF和rAPT的均值均较MT组高,差异均具有统计学意义(P<0.05)。

表1 两组中肿瘤实质强化区的3D-ASL和APT参数值的比较
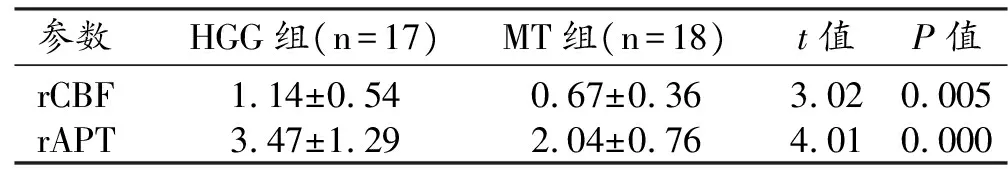
表2 两组中瘤旁区的3D-ASL和APT参数值的比较
3.定量参数的诊断效能
rCBF、rAPT及两者联合诊断模型对两种肿瘤的鉴别诊断效能进行ROC曲线分析,结果见图3。瘤旁区rCBF诊断HGG的最佳阈值为0.94,所对应的AUC为0.75、敏感度为0.65、特异度为0.78。肿瘤强化区及瘤旁区的rAPT诊断HGG的最佳阈值分别为4.32和2.98,所对应的AUC分别为0.84和0.83,敏感度分别为 0.76和0.71,特异度分别为0.83和0.89。两种检查方式的定量参数联合诊断时,AUC最大,为 0.87,敏感度为 0.82,特异度为0.83。
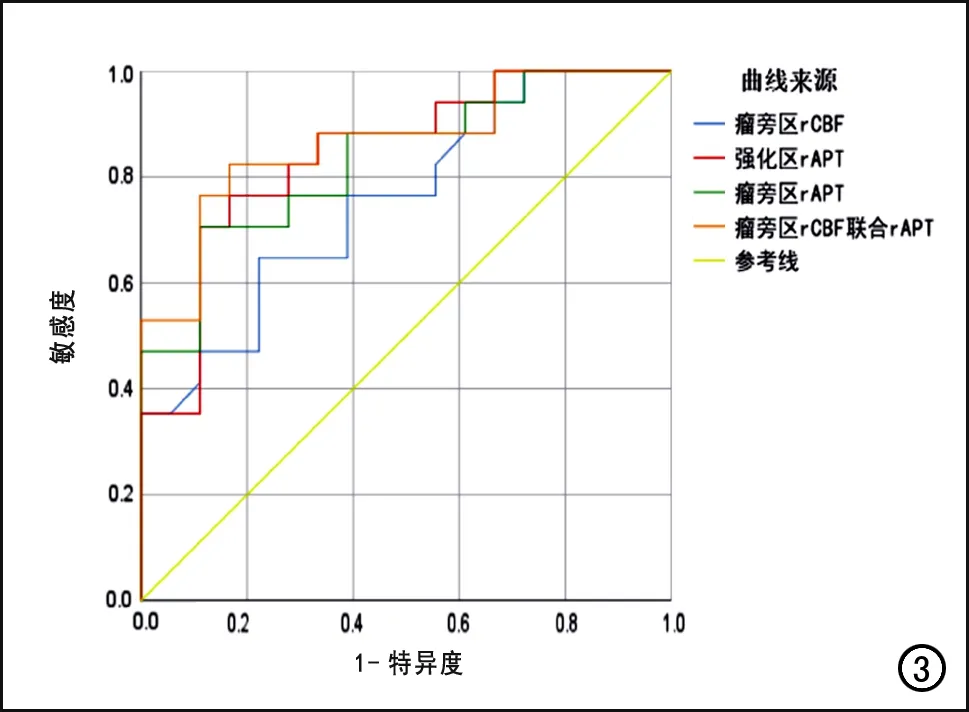
图3 肿瘤强化区和瘤旁区各项及联合定量参数的ROC曲线,显示瘤旁区rCBF联合rAPT诊断HGG的AUC较各单项参数大。
讨 论
目前,常规MRI检查序列对脑高级别胶质瘤与脑转移瘤的鉴别仍是一个亟待解决的临床问题,而且,两种肿瘤的治疗方案完全不同,因此在未对肿瘤进行活检的前提下,术前无创性鉴别两者是非常重要的。在本研究中,HGG组与MT组之间瘤内实质强化区的rCBF值的差异无统计学意义(P>0.05),这与以往的研究结果基本一致[5]。HGG的肿瘤细胞具有快速增殖的特点,使肿瘤组织内含有大量的新生血管及内皮细胞;而MT则是由原发恶性肿瘤通过血行转移进入脑组织,如肺癌、乳腺癌多是富血供肿瘤,转移灶常表现为与原发灶相似的灌注特点,即脑转移瘤内亦有大量新生毛细血管,故两种肿瘤的瘤体实质部分均表现为高灌注。此外,有文献报道,两种肿瘤周围水肿区的rCBF值有显著差异[5],与本研究结果一致。Su等[8]认为高级别胶质瘤的瘤周区域可有血管源性水肿和肿瘤浸润等病理表现,而脑转移瘤的瘤周区域通常仅存在血管源性水肿而无肿瘤浸润。故我们认为两种肿瘤瘤周水肿区域形成机制的不同导致了其瘤旁区灌注具有一定的差异,因此3D-ASL成像所获得的瘤旁水肿区的灌注参数有助于鉴别HGG和MT。
HGG与MT的rAPT值在瘤内实质强化区是否有意义仍存在争议。既往有学者采用APT技术鉴别HGG与MT,结果显示HGG的瘤体强化区的rAPT值高于MT,组间差异有统计学意义[6],与本研究结果相符;但也有研究结果显示HGG与MT之间肿瘤实质的rAPT值的差异无统计学意义[7,9]。在本研究中,HGG的在瘤内实质强化区的rAPT值高于MT,但目前对其发生机制尚不清楚。两种肿瘤内都具有很高的细胞密度,故细胞数量的差异不是原因。Yalcin等[10]研究认为神经胶质瘤中的肿瘤细胞和基质细胞均可表达腱糖蛋白C,该蛋白的高表达与肿瘤进展有关,可促进肿瘤向周围组织浸润,而APT值增高与肿瘤合成代谢活跃、内源性蛋白质及多肽含量增多有关,HGG的肿瘤细胞和基质细胞内都有蛋白质的高表达,使其rAPT值较MT高,未来可能需要在影像学和组织病理学结果之间进行对照研究来进一步明确其发生机制。另外测量方式不同也可能造成数据分析结果的差异,文献报道多选取肿瘤APT值最大层面的测量值来计算病灶的rAPT值,此法常用于脑胶质瘤的病理分级研究[11-13];而本研究中选取的是瘤体强化区来测量和计算肿瘤的rAPT值。在临床实践中,我们常可以见到恶性脑肿瘤不同层面的图像上肿瘤的APT信号高低不等,故笔者认为,在瘤体内选取多个强化区来测量APT值,取其平均值后再计算rAPT值,这样应该能更准确地反映整个肿瘤的酰胺质子转移情况。
HGG瘤旁区的rAPT值在较MT高,这一结果与两者的瘤周水肿发生机制存在差异有关。有文献报道,这两种肿瘤的瘤周水肿区的rAPT值有显著差异[7,9],与本研究结果基本一致。APT效应是指组织内可移动蛋白质中的酰胺质子与水质子进行交换[14]。在HGG中,肿瘤组织破坏血脑屏障,大量蛋白质从血管内渗透到细胞外,导致水肿区的蛋白含量增高;此外,王阳等[15]研究发现胶质瘤周围水肿区内基质金属蛋白酶和水通道蛋白较正常脑组织的表达水平升高。而MT瘤旁水肿系单纯血管源性水肿,所以我们认为MT周围水肿区的蛋白含量较HGG低,最终导致两种肿瘤的瘤旁区的APT参数值的差异。
单一成像技术(3D-ASL或APT)获得的定量指标单一,无法全面反映HGG和MT的病理生理学特性,故其鉴别诊断的效能可能不够高,而两种检查方法联合时,可同时反映脑肿瘤的血管密度和通透性以及酰胺质子的变化等生理学信息,并进一步评价肿瘤血管的新生和浸润程度,故理论上而言,联合模型的诊断效能应该优于单个参数,本研究结果亦证实了这一点:3D-ASL和与APT定量参数联合诊断时的AUC为0.87,高于单一参数的AUC,且相应的敏感度(0.82)和特异度(0.83)均较高。
本研究存在一定的局限性:首先,样本量较小,而且转移瘤中原发病灶主要为肺癌,可能存在一定的样本偏倚,更可靠的结果尚需要更大的样本量并包括更多类型的原发肿瘤。其次,本研究中未评估HGG中O6-甲基鸟嘌呤-DNA甲基转移酶的甲基化状态,有待在今后的研究中进一步探讨。因Su等[16]认为APT参数可作为影像学标记物用于预测该酶在低、高级别胶质瘤中的表达情况;Jiang等[17]报道该酶未甲基化的胶质瘤具有更高、更异质性的APT加权值。
总之,3D-ASL与APT成像所获得的定量参数(rCBF、rAPT)均有助于鉴别HGG与MT,两者联合应用可提高鉴别诊断的准确性。
