超声波辅助没食子酸对鲈鱼肌原纤维蛋白结构特性的影响
2023-08-18李颖畅师丹华赵淞民朱永丽仪淑敏励建荣
李颖畅,师丹华,赵淞民,朱永丽,邹 倩,2,仪淑敏,励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013 2 大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连 116034)
海鲈鱼(Lateolabrax japonicas),又称咸水鲈鱼,其蛋白质、不饱和脂肪酸含量丰富[1-2]。海鲈鱼肌肉中肌原纤维蛋白含量丰富,约占总蛋白的60%~70%,具有多种功能特性,如凝胶性、持水性等。同时,肌原纤维蛋白的结构及特性的变化会直接影响鱼糜制品的质地与风味,是鱼糜制品的重要成分之一[3]。
没食子酸(3,4,5-三羟基苯甲酸),具有抗氧化、抗菌、抗炎、抗过敏、抗癌等生理功效[4-5]。据报道,适量的没食子酸可以改变肌原纤维蛋白荧光特性,暴露出更多的活性基团,使得表面疏水性、巯基和溶解度增加[6]。胡熠等[7]研究没食子酸对海鳗肌原纤维蛋白氧化的抑制作用,结果表明没食子酸使肌原纤维蛋白的表面疏水性显著上升(P<0.05),二级结构发生改变,添加0.15%的没食子酸能有效抑制蛋白质氧化,并改善蛋白凝胶性能。Pan 等[8]发现添加5 μmol/g 的没食子酸使日本鲈鱼肌原纤维蛋白的储能模量急剧增加,而添加125 μmol/g 的没食子酸明显降低了储能模量。
超声波通过空化效应及机械效应改变生物大分子的结构和功能特性[9],在食品保鲜以及加工等方面的应用备受关注。常海霞等[10]研究发现,随着超声时间的延长,表面疏水性呈上升趋势,内源荧光呈下降趋势,超声波促进蛋白结构的展开。Madadlou 等[11]发现超声处理后的酪蛋白胶凝点的pH 值降低,酪蛋白的凝结点延迟,凝胶弹性增强,硬度增大,同时产生了具有更多互连结构和更小的不可区分颗粒的凝胶,当超声处理120 min 时,凝胶性能较好。李秀霞等[12]发现超声波辅助冷冻能有效降低蛋白的氧化程度,同时增加蛋白质的热稳定性,使得其在冻藏期间结构更加稳定。Liu等[13]指出超声波处理可以提高鲢鱼肌球蛋白的溶解度,使其分布更加均匀,而长时间的高强度超声处理会导致肌球蛋白的氧化和降解。Chen 等[14]研究表明,超声波使肌球蛋白的结构随应力的变化而变化,同时使肌球蛋白结构发生改变,影响其乳化性质。李可等[15]研究发现超声波处理后肌原纤维蛋白α-螺旋相对含量从22.1%降至17.7%,而β-折叠从39.4%升至43.3%,同时β-转角和无规卷曲相对含量也呈显著上升的趋势。
目前,没食子酸与超声波协同处理对鲈鱼蛋白结构特性的影响鲜有报道。本文通过拉曼光谱、差示热量扫描(DSC)、动态流变特性、荧光光谱、表面疏水性、SDS-PAGE 电泳分析,探究不同浓度的没食子酸协同超声波处理对海鲈鱼肌原纤维蛋白结构的影响,从而改善肉制品品质,对凝胶类肉制品的生产与加工具有指导意义。
1 材料与方法
1.1 材料与试剂
海鲈鱼:体质量(1 000±50)g、平均体长(30±1)cm,购自辽宁省锦州市科技路水产批发市场。冰乙酸、尿素、磷酸氢二钾、2-硝基苯甲酸、磷酸二氢钾均为分析纯级,天津市风船化学试剂科技有限公司;对苯二酚、溴酚蓝、三氯乙酸、氯化钠、Tris、盐酸胍、电泳maker 蛋白、25%戊二醛、乙二胺四乙酸二钠、β-巯基乙醇、盐酸、ATP、氯化钾、没食子酸,北京索莱宝科技有限公司。
1.2 仪器与设备
MS105DU 分析天平,上海精密科学仪器有限公司;Q2000 差示扫描量热仪,美国TA 仪器有限公司;UV-2550 紫外可见光分光光度计,上海菁华科技有限公司;LKQ-400KDE 超声波,昆山市超声仪器有限公司;Mini Protean 3 凝胶电泳仪,美国Bio-Rad 公司;abR AM HR Evolution 拉曼光谱仪,HORIBA 公司;Discovery HR-1 流变仪,美国TA 仪器有限公司;Milli-Q 超纯水系统,美国Millipore 公司;GS-800 拍照系统,英国Syngene 公司;SORVALL Stratos 冷冻高速离心机,美国赛默飞世尔科技有限公司;970 CRT 荧光分光光度计,上海菁华科技仪器有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取及浓度测定 参考李学鹏等[16]的方法,提取后蛋白浓度采用双缩脲法测定蛋白含量。
1.3.2 复合体系的制备 参考张慧芸等[17]的方法,使得体系中蛋白最终质量浓度为40 mg/mL,没食子酸的终浓度为0,1,2,4,6 mg/g。制备未超声组、400 W 超声波处理组(超声处理20 min),每一个浓度均制备10 mL。
1.3.3 拉曼光谱扫描 参考Alix 等[18]的方法,调节焦距后将蛋白样品置于载玻片上进行拉曼光谱测定。检测参数如下:激发波长514.5 nm;光栅600 g/mm;狭缝200 μm;显微物镜50 倍长焦距;激光出射功率100 mW;积分时间30 s;重复3 次。
1.3.4 内源荧光光谱扫描 准确量取1 mg/mL 的多酚-蛋白溶液2.5 mL,加入9 mL 20 mmol/L、pH 7.2 的磷酸盐缓冲液。测定条件:激发波长280 nm,发射波长扫描范围300~400 nm,灵敏度为2,狭缝均为10 nm[19]。
1.3.5 表面疏水性测定 参考Chen 等[20]方法并作修改。多酚-蛋白溶液质量浓度为5 mg/mL,取1 mL 于90 ℃水浴加热30 min,冰浴冷却10 min后,加入0.2 mL 溴酚蓝(1 mg/mL)溶液,4 000 r/min 离心15 min。空白组用1 mL 磷酸盐缓冲溶液(Tris-HCl-NaCl)替代多酚-蛋白液,其余同上。将样品组所得上清液稀释合适倍数后,于波长595 nm 处测定空白、样品的吸光度值。表面疏水性计算公式:
1.3.6 差示热量扫描(DSC) 蛋白质量浓度40 mg/mL,将样品置于不锈钢铝坩埚内,用分析天平准确记录每组样品的质量(5~10 mg),对坩埚进行压片密封,待测。测试条件:平衡时间2 min,样品以5 ℃/min 的速率从5 ℃升温到90 ℃。用仪器自带的Pyris-11 软件对焓变(ΔH)和变性温度(Td)进行分析计算[13]。
1.3.7 动态流变测定 参照Chen 等[21]的方法,并略作修改。配制5 mL 用于流变特性测定的样品,质量浓度为40 mg/mL 的多酚-蛋白溶液。取多酚-蛋白1 mL 加到流变仪的载物台上,平衡2 min,以升温速率5 ℃/min 由20 ℃升至80 ℃,流变仪设定条件:直径50 mm 平行板,狭缝200 μm,频率0.1 Hz。应变力为0.5%的条件下,在动态模量模式下测定。
1.3.8 聚丙烯酰胺凝胶电泳 参考Xiong 等[22]的方法并略作修改。取10 μL 多酚蛋白溶液电泳,电泳结束后用考马斯亮蓝染色1 h,再用脱色液(体积分数50%的甲醇,体积分数10%的冰乙酸)脱色,直至蛋白条带清晰。最后利用GS-800 系统观察蛋白条带情况并拍照。
2 结果与分析
2.1 没食子酸与超声波协同作用对鲈鱼蛋白拉曼光谱的影响
拉曼光谱可以通过峰的形状和强度等得到蛋白结构的变化[23],波数范围在1 600~1 700 cm-1酰胺I 带可分析蛋白质二级结构,其中α-螺旋波数范围为1 650~1 660 cm-1,无规则卷曲波数范围为1 660~1 665 cm-1,β-折叠波数范围为1 665~1 680 cm-1,波数1 680 cm-1附近是β-转角[24],蛋白二级结构的含量通过对应峰的峰面积进行计算。不同添加量的没食子酸协同超声处理对肌原纤维蛋白拉曼光谱图及二级结构相对含量的影响如图1、图2 所示。当没食子酸的添加量为0 mg/g 时,α-螺旋含量为52.8%,β-折叠含量为58.3%,β-转角含量为15.6%,无规则卷曲含量为10.4%。当没食子酸的添加量小于2 mg/g 时,随着没食子酸含量的增加,α-螺旋值呈上升趋势,而β-折叠等变化趋势与之相反。当没食子酸添加量为2 mg/g,α-螺旋含量最高达74.69%,此时β-折叠为4.54%。当没食子酸含量进一步增加,α-螺旋含量降低到63.7%,而无规则卷曲等含量上升。这是因为适量的没食子酸可以与蛋白质发生交联,同时能防止蛋白质过度氧化或过度交联形成醌类物质[6]。贾娜等[25]研究表明没食子酸的添加可以使氢键作用力增强,α-螺旋含量增加,维持蛋白质结构的稳定。Li 等[26]同样研究发现经表没食子儿茶素没食子酸酯(EGCG)和谷氨酰胺转氨酶(TGase)处理后,增加了α-螺旋的含量,蛋白结构变得更加有序,本文研究结果与其一致。当400 W 超声处理后,各组的α-螺旋含量分别为58.28%,69.22%,80.19%,74.69%,69.22%;β-折叠分别为17.11%,8.73%,0.32%,4.54%,8.73%,α-螺旋较未超声处理时有所上升,β-折叠较未超声处理时有所下降。李可等[15]表明450W 的超声处理会破坏氢键,使蛋白结构由有序转变为无序,本文研究结果与其不同,可能由于添加没食子酸的作用不同,以及超声波频率选择不同产生的差异。而刁小琴等[27]研究发现,在合适的超声功率下,超声波处理能引起蛋白质结构的改变,使分子内和分子间的氢键增强,本试验研究结果与之相一致。
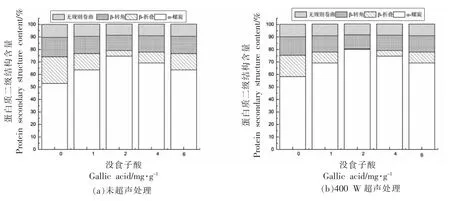
图2 没食子酸与超声波协同作用对鲈鱼蛋白酰胺I 带二级结构含量的影响Fig.2 Effect of synergistic of gallic acid and ultrasound on secondary structurefrom amide I region of Lateolabrax japonicus protein
2.2 没食子酸与超声波协同作用对鲈鱼蛋白内源荧光光谱的影响
蛋白质中内源性荧光基团色氨酸对微环境变化很敏感。当色氨酸的微环境发生变化时,最终使蛋白质的荧光强度发生猝灭或者增强,进一步表明蛋白质构象发生改变[28]。如图3 所示,随着没食子酸含量的增加,内源荧光强度降低,出现荧光猝灭,与此同时,不同质量浓度没食子酸处理的肌原纤维蛋白最大荧光峰发生了红移。有研究表明,咖啡酸使MP 的发射波长从336 nm 红移到349 nm,表明没食子酸使蛋白分子展开,色氨酸残基暴露分子表面,其所处微环境发生改变[29]。400 W超声处理后,2,4,6 mg 没食子酸组的荧光强度有所增加,可能是因为蛋白中某些色氨酸残基由于聚合、聚集或肽-肽缔合,导致相对荧光强度增加[30]。Huang 等[31]研究发现经过超声波处理的类萌发素蛋白样品的荧光强度增加。Ma 等[32]报道在80 W,20 kHz 下,超声处理碱性蛋白酶4 min 后,其荧光强度增加。
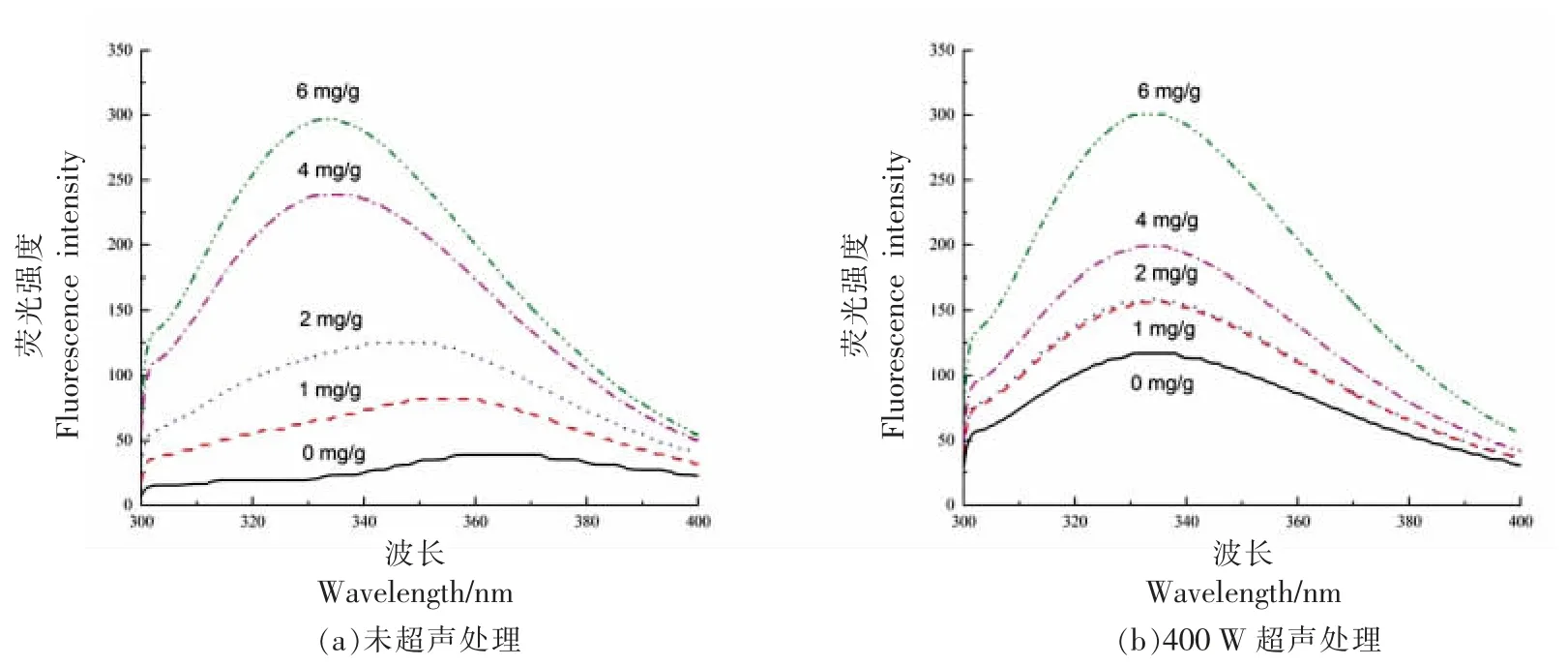
图3 没食子酸与超声波协同作用对鲈鱼蛋白荧光强度的影响Fig.3 Effect of synergistic of gallic acid and ultrasound on fluorescence intensity of Lateolabrax japonicus protein
2.3 没食子酸与超声波协同作用对鲈鱼蛋白表面疏水性的影响
疏水性对蛋白质构象与功能特性起关键作用[20]。没食子酸添加量和超声处理对肌原纤维蛋白表面疏水性的影响如图4 所示,随着没食子酸质量浓度的增加,使得蛋白质的疏水性氨基酸暴露,与溴酚蓝结合的更多,表面疏水性显著增强(P<0.05),同时内源荧光光谱的猝灭进一步表明蛋白结构改变,使得包埋于蛋白内部的氨基酸暴露在表面。Cao 等[19]研究不同浓度的绿原酸(0,6,30,150 μmol/g pro)对猪肉肌原纤维蛋白结构的影响,发现绿原酸的添加可以显著增加蛋白的表面疏水性。本研究结果与其一致。Kroll 等[33]也发现蛋白与多酚作用后,表面疏水性增加。超声400 W处理时,表面疏水性高于未超声组。有研究发现,高强度超声使得埋藏于蛋白质内部疏水基团内卷程度降低,基团暴露到表面,表面疏水性增强,表明超声波能促进蛋白质的展开[34]。Hu 等[35]用超声波处理大豆分离蛋白后,表面疏水性增加,Shen等[36]通过超声处理热聚集后的乳清蛋白,也证实了相同的结果。
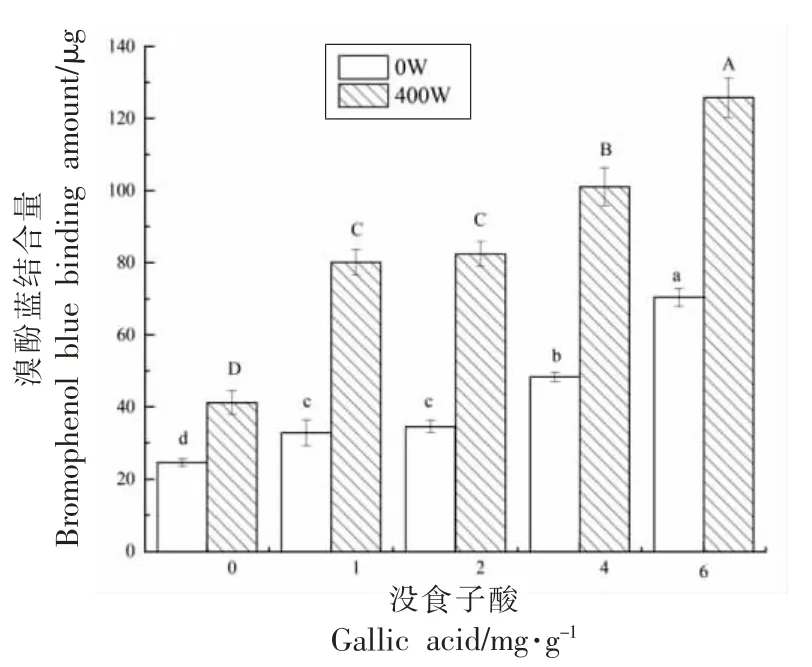
图4 没食子酸与超声波协同作用对鲈鱼蛋白表面疏水性的影响Fig.4 Effect of synergistic of gallic acid and ultrasound on surface hydrophobicity of Lateolabrax japonicus protein
2.4 没食子酸与超声波协同作用对鲈鱼蛋白差示热量扫描(DSC)的影响
DSC 可以反映蛋白质结构稳定性,在蛋白质热变性的研究中应用广泛。蛋白质在吸热过程中,分子间作用力被破坏,蛋白质变性,当达到变性温度时,就会出现对应吸收峰,因此DSC 中点温度(Tmax)和焓变值(ΔH)的变化可以反映蛋白质结构的变化,Tmax和ΔH越高,则蛋白质的热稳定性越强[37]。图5 为超声波辅助下海鲈鱼肌原纤维蛋白DSC 扫描曲线图,表1、表2 是肌原纤维蛋白的热变性温度(Tmax)和焓变值(ΔH)变化。由图5 及表1、2 可知,超声处理前、后,随着没食子酸含量的增加,蛋白热变性温度和焓变值呈先上升后降低的趋势,当没食子酸的添加量为2 mg/g 时,Tmax与ΔH值最大,说明此时蛋白质结构最稳定,与α-螺旋的变化趋势一致。有研究表明热变性温度的改变是由蛋白质侧链基团修饰、交联及其与酚类化合物的相互作用引起的[38]。经超声波辅助处理后,没食子酸的添加量为1,2 mg/g 时,热变性温度有所上升,当没食子酸的添加量大于2 mg/g 时,焓变值有所上升,说明超声处理能加速蛋白质的变性和聚集,改变蛋白质结构的稳定性,从而改变肌原纤维蛋白变性所需要的温度和能量。蔡路昀等[1]发现超声波辅助解冻处理会加速鱼肉肌球蛋白的变性,本文结果与其相一致。
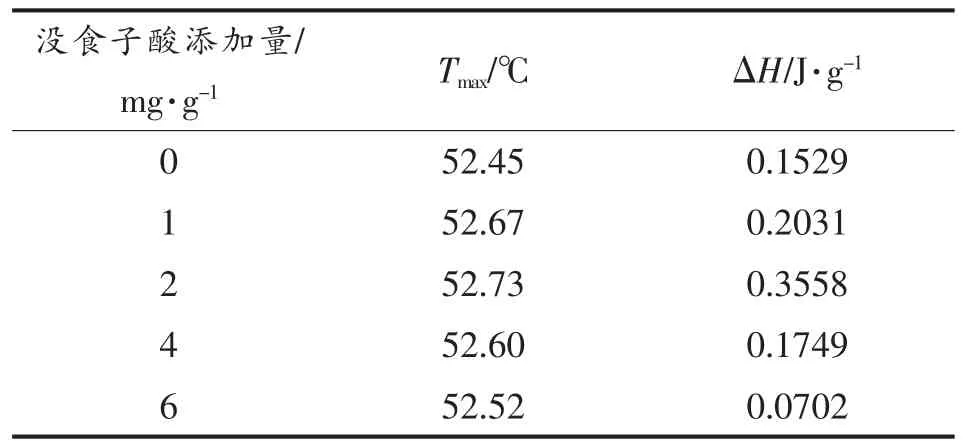
表1 未超声处理鲈鱼蛋白热变性中点温度和焓变Table 1 Thermal denaturation midpoint temperature and enthalpy of Lateolabrax japonicus protein without ultrasound treatment
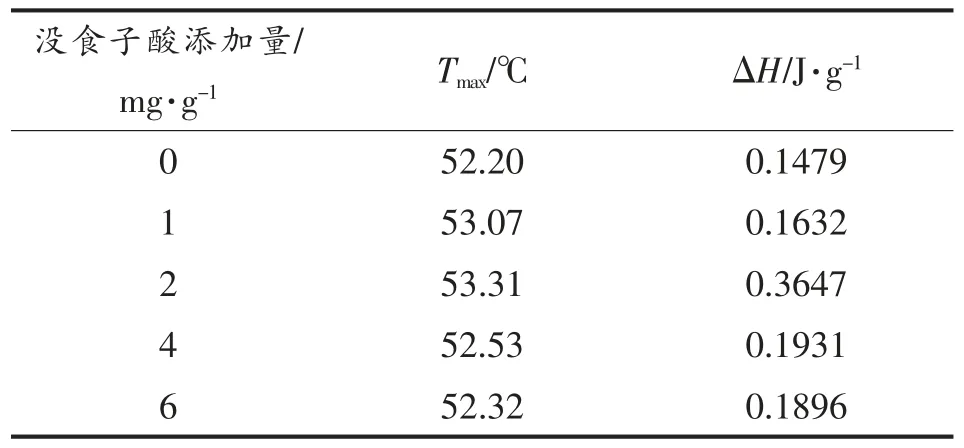
表2 400 W 超声辅助处理鲈鱼蛋白热变性中点温度和焓变Table 2 Thermal denaturation midpoint temperature and enthalpy of Lateolabrax japonicus protein on 400 W ultrasound
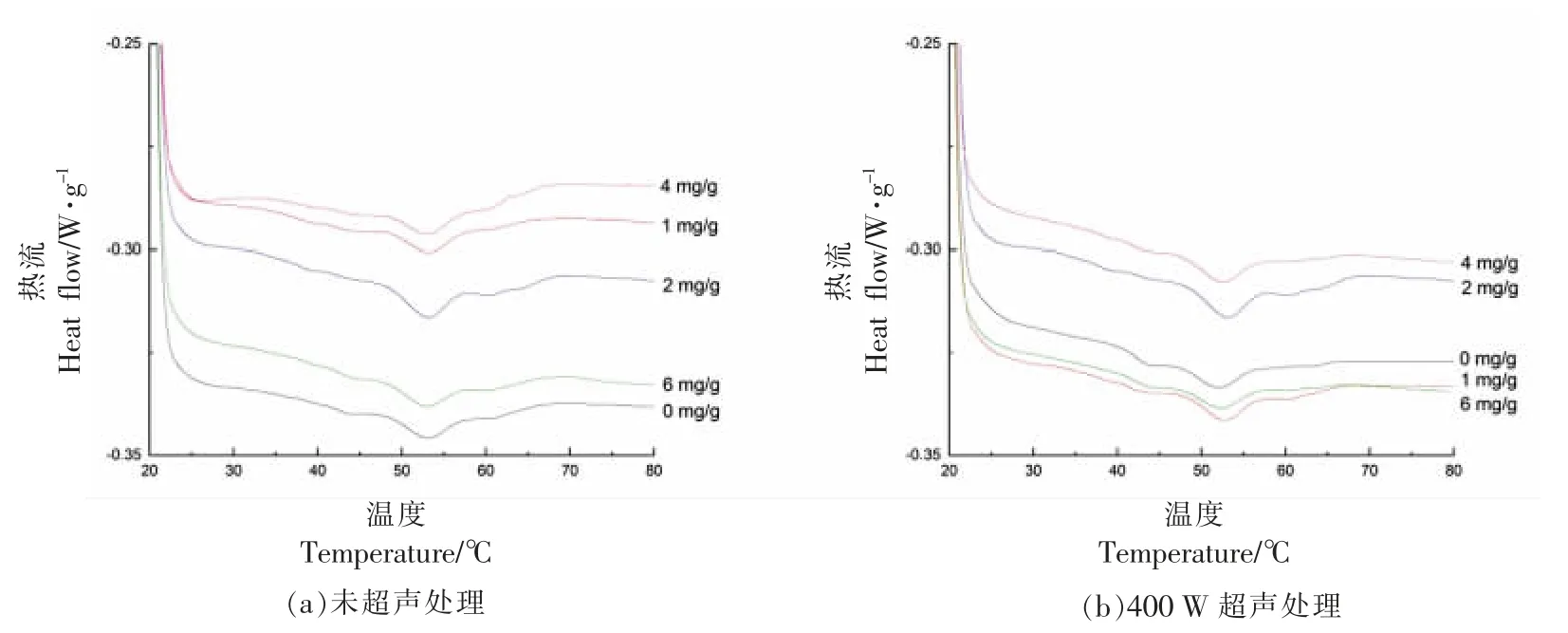
图5 没食子酸与超声波协同作用对鲈鱼蛋白DSC 的影响Fig.5 Effect of synergistic of gallic acid and ultrasound on DSC of Lateolabrax japonicus protein
2.5 没食子酸与超声波协同作用对鲈鱼蛋白动态流变的影响
没食子酸与超声波协同作用对鲈鱼蛋白动态流变的影响如图6 所示。通过对20 ℃到80 ℃储能模量G′与损耗模量G″变化趋势的分析,评定肌原纤维蛋白在形成凝胶过程中弹性与黏性性能的变化[39]。由图6 可知,温度对流变性能的影响经历了3 个阶段,当温度在35~40 ℃之间,G′随着温度的升高而升高,在40 ℃达到第1 个峰值,这可能是因为肌球蛋白头部结构变性后聚集,形成了凝胶结构[40]。当温度在50~55 ℃之间,由于肌球蛋白的尾与尾的相互作用出现凝胶劣化,使得G′随温度升高而降低。当温度大于55 ℃时,G′随温度升高而升高并且逐渐趋于平缓,这是因为此阶段大多数的蛋白质结构已经展开,分子间进一步交联形成二硫键,形成了稳定且具有弹性的凝胶网络结构[41]。损耗模量G″随温度的变化趋势与储能模量G′变化趋势基本一致。在整个变化过程中,不同浓度没食子酸处理组储能模量G′始终高于未添加没食子酸组,说明不同浓度没食子酸的添加有助于蛋白凝胶的形成。Li 等[26]发现EGCG 与TG酶可以提高肌原纤维蛋白的储能模量,使得凝胶更具有弹性。400 W 超声波处理后,所有处理组的储能模量的变化更加有序,对没食子酸的剂量依赖性更小。这可能是因为超声处理使得蛋白质结构展开,粒径减小,从而促进加热过程中的进一步交联,改善流变性能,形成弹性更好的凝胶网络结构[9]。王静宇等[42]研究表明200 W 超声处理可以改善蛋白的流变性能。

图6 没食子酸与超声波协同作用对鲈鱼蛋白流变特性的影响Fig.6 Effect of synergistic of gallic acid and ultrasound on dynamics rheological properties of Lateolabrax japonicus protein
2.6 没食子酸与超声波协同作用对鲈鱼蛋白SDS-PAGE 电泳的影响
从SDS-PAGE 电泳图能够观察到蛋白质之间交联、聚集与降解等情况。未超声处理和超声波处理下,没食子酸对肌原纤维蛋白SDS-PAGE 电泳图谱的影响如图7 所示,图中MP 显示肌球蛋白重链(MHC,200 ku)和肌动蛋白(Actin,45 ku)等主要亚基的典型图谱。当没食子酸添加量从0 到2 mg/g 时,肌球蛋白重链(MHC)和肌动蛋白(Actin)条带颜色变浅,这是因为适量的没食子酸能促进二硫键的形成,增加蛋白结合[43]。有研究表明,二硫键是低浓度的多酚诱导聚集的主要作用力,当多酚浓度过高时,MP 形成的作用力由二硫键转变为多酚介导的共价交联[44]。当没食子酸的含量继续增加时,条带颜色变深,可能是因为没食子酸与蛋白过度交联形成醌类物质[6],使得堆积在顶部的醌类聚合物增多,对蛋白结构产生不利影响,Cao 等[38]的研究表明蛋白与多酚具有剂量依赖性关系,本文结果与其相一致。400 W 超声波处理后条带颜色加深变宽,并且浓缩胶及分离胶顶部大分子聚合物也明显增多。说明超声波处理后,加速蛋白质结构的展开,暴露出更多的基团,增加蛋白之间发生交联,使得蛋白质分子质量发生改变,本文结果与Pan 等[8]研究发现超声波处理可增加MP 的聚集和交联一致。

图7 没食子酸与超声波协同作用对鲈鱼蛋白SDS-PAGE 电泳图谱的影响Fig.7 Effect of synergistic of gallic acid and ultrasound on SDS-PAGE of Lateolabrax japonicus protein
3 结论
通过分析拉曼光谱、荧光光谱、表面疏水性、蛋白热稳定性、流变学特性、SDS-PAGE 电泳指标,研究没食子酸协同超声波处理对海鲈鱼肌原纤维蛋白结构的影响。超声处理前、后,当没食子酸的添加量为0 mg/g,α-螺旋含量为52.8%,β-折叠含量为58.3%,β-转角含量为15.6%,无规则卷曲含量为10.4%。随着没食子酸含量的增加,α-螺旋值上升到74.69%后出现降低的趋势,而β-折叠等变化趋势与之相反。超声处理后,α-螺旋转化为无规则卷曲与β-折叠,其含量呈先升高后下降的趋势,β-折叠与α-螺旋变化趋势相反,当没食子酸的添加量为2 mg/g 时,α-螺旋含量最高。内源荧光光谱、表面疏水性的结果表明,肌原纤维蛋白的三级结构发生改变,随着没食子酸含量的增加,荧光强度增强,表面疏水性显著增加(P<0.05)。DSC、流变以及电泳图谱表明肌原纤维蛋白凝胶特性发生改变,随着没食子酸含量的增加,蛋白的热变性温度提高,蛋白热稳定性增强,当没食子酸的添加量为2 mg/g 时,热稳定性最高,焓变值最大。流变学特性显示蛋白储能模量提高,形成的凝胶网络更具有黏弹性,使得肌原纤维蛋白凝胶性能得到提高。
