益生菌在发酵乳中的氨基酸代谢特征、发酵特性和贮藏特性
2023-08-18王记成张和平
杨 阳,郭 帅,武 婷,冯 超,徐 盛,王记成,张和平
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室内蒙古乳品生物技术与工程重点实验室 呼和浩特 010018)
发酵乳是以生牛乳或复原乳为原料,经巴氏杀菌后添加发酵剂,在一定条件下发酵制得对人体有益的凝乳状产品。在发酵过程中,乳酸菌可产生如乳酸、有机酸、氨基酸、B 族维生素及酶类等对人体具有潜在健康作用的代谢物质[1]。益生菌(Probiotics)是一类可促进宿主肠道内微生物菌群生态平衡,且对宿主健康或生理功能产生有益作用的活性微生物[2],又被称为活菌制剂、生态制剂和微生态调节剂。目前益生菌主要有两大类,即乳杆菌类和双歧杆菌类[3]。
发酵乳作为益生菌发挥健康作用的理想载体,展示出发酵乳和益生菌的双重益生功效[4]。益生菌发酵乳(本文指发酵菌种不含嗜热链球菌和保加利亚乳杆菌)不仅在益生菌数量上保持较高水平,而且含有更多的生物活性物质[5]。此外,能显著改善肠道微生态平衡,调节机体免疫力,降低血清中胆固醇含量,提高机体抗氧化能力,延缓衰老等[5]。
本试验所选菌株为乳双歧杆菌V9(Bifidobacterium animalissubsp.V9(V9)、副干酪乳杆菌PC-01(Lacticaseibacillus paracaseiPC-01(PC-01)和植物乳杆菌P-8(Lactiplantibacillus plantarumP-8(P-8)。其中,V9 分离自内蒙古自治区健康蒙古族儿童肠道[6];PC-01 分离自西藏拉萨地区当雄县龙仁乡自然发酵酸牦牛奶[7];P-8 分离自内蒙古自治区草原牧民家庭中的自然发酵酸牛乳[8]。所述菌种对酸和胆盐均具有较强的耐受性,同时具有抗菌、抗氧化和免疫调节作用,是益生菌发酵乳开发的理想菌株[6-8]。将上述3 株益生菌应用于复合益生菌发酵牛乳中,对其发酵特性、贮藏特性进行评价,为益生菌发酵乳制品工业生产提供数据支持。
1 材料与方法
1.1 材料和设备
1.1.1 试验菌株 试验所用V9、PC-01 和P-8 直投式发酵剂均由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。对照发酵剂,科汉森(中国)有限公司,含保加利亚乳杆菌和嗜热链球菌,依推荐量添加。
1.1.2 试验材料 试验材料见表1。

表1 试验原料表Table 1 List of test materials
1.1.3 试验仪器与设备 FE28 型pH 计,梅特勒(上海)有限公司;Brookfield DV-2T 型黏度计,美国Brookfield 公司;微流变仪Rheolaser Master,法国Formulaction 公司;NSC-II A-1200 型无菌工作台,苏州苏净有限公司;SRH60-70 型高压均质机,上海申鹿均质机有限公司;电热恒温水浴锅,天津知署科技有限公司;恒温培养箱,上海恒科技仪器有限公司;日立L-8900 高速氨基酸分析仪,北京华旭世纪科技有限公司。
1.2 试验方法
1.2.1 发酵乳的制备 以牛乳和白砂糖为基料制备发酵乳,将牛乳(94%,V/V)通过水浴的方式预热至65 ℃后,添加白砂糖(60 g/L),65 ℃搅拌15 min 直至完全溶解,于65 ℃,20 Mpa 条件下均质,95 ℃杀菌5 min,冷却至(37±0.5)℃接种发酵,发酵完成后进行无菌灌装,放置于10 ℃条件下储存28 d,每隔7 d 检测相关指标。试验分为2 组,以商业发酵剂为对照组(Fermented milk,FM),试验组为益生菌发酵乳(PFM),具体接种量见表2。

表2 菌种接种量Table 2 Inoculation amount of strains
1.2.2 微流变学参数变化测定 利用光学微流变仪检测发酵乳发酵期间的凝胶体系稳定性。将20 mL 样品转移至灭菌玻璃瓶中,移至测定槽中观测发酵过程中弹性因子(Elastic index,EI)、流动因子(Fluidity index,FI)、宏观黏度因子(Macroscopic viscosity index,MVI)以及固液平衡值(Solid liquid balance,SLB)随时间的变化情况。设置流变仪温度为37 ℃,每隔1 min 采集1 次数据,样品发酵结束后停止测定,根据仪器自带分析软件获取相关流变学参数,综合评价发酵乳微流变特性[9]。
1.2.3 活菌数的测定 将制备好的发酵乳于10℃条件下贮藏28 d,分别在1,7,14,21,28 d 参照国标GB 4789.2-94[10]进行活菌计数,使用选择性培养基,分别计算菌落总数。
1.2.4 酸度的测定 pH 值采用梅特勒FE20 型pH 计测定,每个样品测定3 次平行并计算平均值;滴定酸度(TA)按照国家标准GB 5009.239-2016 中规定的“酚酞指示剂法”进行检测[11]。具体方法:取5.0 g 发酵乳样品,加40 mL 蒸馏水,滴2~3 滴酚酞指示剂(0.5%),充分摇匀后,用0.1 mol/L 的NaOH 标准溶液滴定至微红色,30 s 内不褪色。记录消耗NaOH 标准溶液的毫升数,每个样品测定3 次平行并计算平均值。
1.2.5 持水力和黏度的测定 持水力:准确称取20.0 g 发酵乳样品,置于有滤纸的漏斗中,室温静置2 h 后收集滤液并称重[12],按如下公式计算持水力:
黏度采用BROOKFIELD DV-1 VISCOMETER 型黏度计4# 转子在常温下测定,转子转速100 r/min,扭矩10%~100%,测定时间30 s。每个样品测定3 次平行并计算平均值。
1.2.6 发酵乳中游离氨基酸检测 使用日立L-8900 高速氨基酸分析仪进行监测,色谱柱:2622#pH 离子交换色谱柱4.5 mm×60 mm。进样量:20 μL,柱温:57 ℃,流速:衍生试剂0.35 mL/min。缓冲液:0.4 mL/min。
准确称取3 g 样品于15 mL 离心管中,加0.02 mol/L 的盐酸5 mL,旋涡混匀5 min,超声提取5 min,避光静置2 h,4 000×g 离心10 min,准确取1 mL 上清液,加入1 mL 6%~8%磺基水杨酸,涡旋1 min,避光静置1 h,15 000×g 离心15 min,取上清液用0.22 μm 的滤膜过滤上机测定。
1.2.7 感官评价 采用评分测验法,选择评价指标为气味、滋味、质地色泽、口感,对PFM 组和FM组进行对比评价。请10 位有品尝经验、不同性别的专业人员进行评价,按照样品摆放的顺序从左至右评价员依次品尝样品后打分,将所有数据求平均值。

表3 感官评价表Table 3 Sensory tasting table
1.2.8 数据分析 微流变数据采用Rheolaser Master 型光学法微流变分析仪自带的Smart 软件进行分析;偏最小二乘判别分析(PLS-DA)使用MetaboAnalyst 5.0(https://www.MetaboAnalyst.ca)进行分析;游离氨基酸分析、活菌数、酸度、黏度和持水力的结果用“平均值±标准差”表示,采用Origin 2020 软件作图。
2 结果与分析
2.1 发酵乳发酵过程的微流变学变化
MS-DWS 微流变技术主要根据发酵乳中微粒运动和体积变化来研究其胶凝机理[5,13]。由于发酵乳在发酵过程中,内部环境酸度会逐渐下降,导致发酵乳中固有的聚集体出现不同变化,酪蛋白颗粒结构发生改变,最终形成以酪蛋白胶粒为基础的凝胶结构[14-15]。由图1 可知,各组发酵乳的SLB、EI、MVI 和FI 变化趋势相同,而各组发酵乳的这些流变学特性之间存在一定差异。
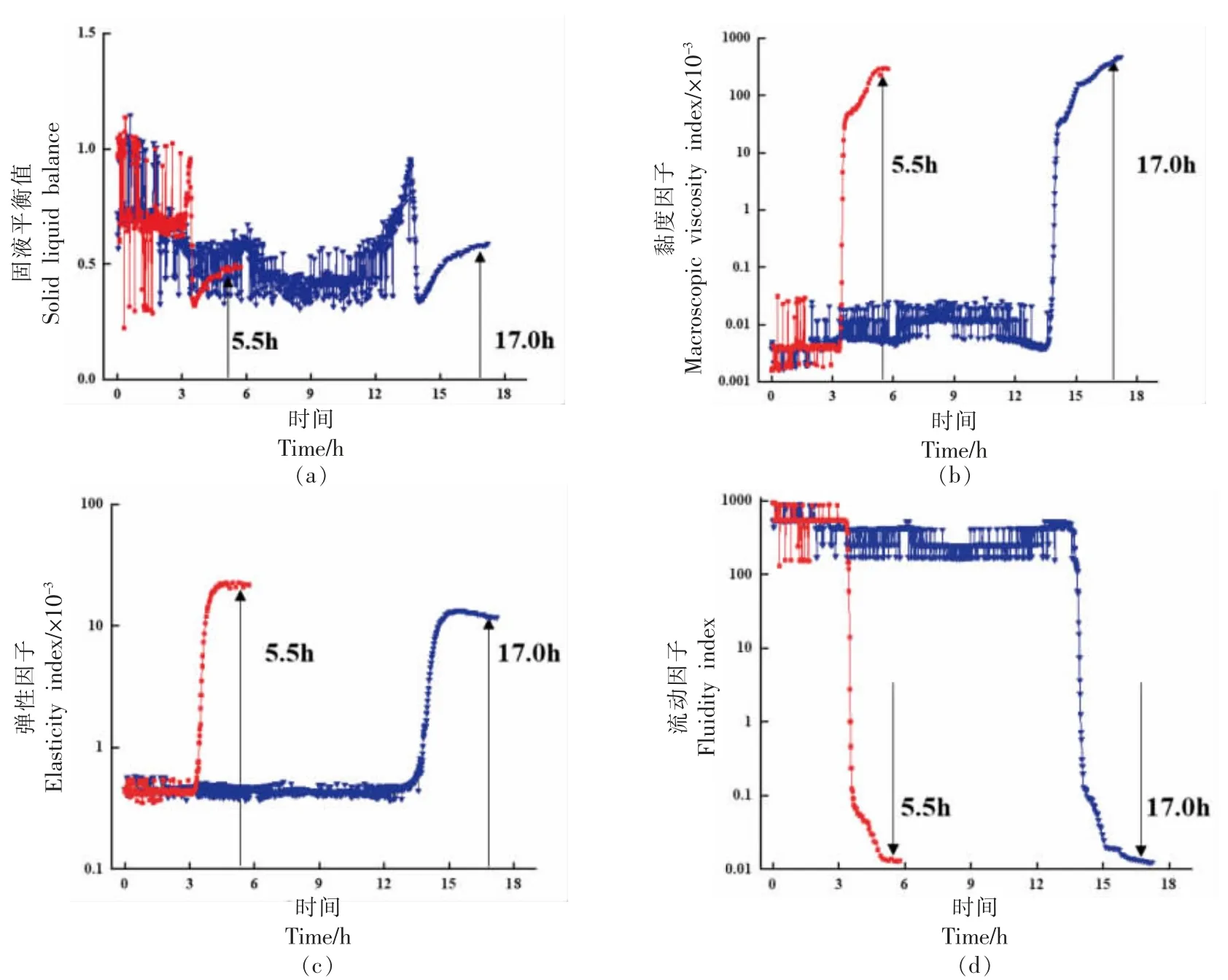
图1 发酵过程的微流变学变化Fig.1 Microrheological changes during fermentation
SLB 表示产品偏向固态或液态的与时间对应的函数关系。当发酵乳的SLB 变化范围在0~0.5之间,表现出弹性模量,偏向于固态质地;在0.5~1.0 之间,则表现出黏性模量,偏向于液态质地[16-17]。如图1 所示,PMF 组和FM 组的SLB 最初起伏较大,PMF 组在发酵前期SLB 处于波动状态,13.5 h后SLB 恢复为较低值并出现拐点,随后逐渐增加直至发酵结束,结束时间为17 h,其弹性模量偏向于液态;FM 组的SLB 在发酵前期3.5 h 恢复为较低值,随后逐渐增加直至发酵结束,结束时间为5.5 h,其弹性模量偏向于固态。PMF 组的SLBpH=4.6略高于FM 组,且达到凝胶点(SLB=0.5)所需时间更长。
MVI 作为直接反映黏性模量的时间函数,可以显示出发酵乳的黏度变化[16-17]。由图1 可知,PMF 组和FM 组的MVI 变化趋势是一个多级过程,PMF 组发酵前期13 h 和FM 组发酵前期3.5 h 时样品黏度无明显变化,处于低黏度的初始停滞阶段;随发酵时间延长,样品黏度迅速上升,进入黏度快速变化阶段;随后,各发酵乳样品MVI分别在17 h 和5.5 h 时上升至最大值,进入高黏度阶段,此时的发酵乳形成了较为稳定的凝胶体系[15]。而PMF 组在发酵结束时,相比于FM 组具有更稳定的凝胶体系。
EI 作为直接反映弹性模量的时间函数,可以快速、简便地表征一个样品的凝胶硬度。EI 值与凝胶弹性变化呈正比,EI 值越大,凝胶结构越强,样品越稳定[18-19]。如图1 所示,随着发酵时间的延长,PMF 组和FM 组的EI 值明显升高,PMF 组在发酵0~13 h 内保持稳定,FM 组在发酵0~3 h 内保持稳定,两者均无明显差异,此时酸乳中酪蛋白还未形成凝胶的网状结构。当PMF 组发酵13 h,FM 组发酵3 h 后,EI 值出现拐点,达到凝胶点;由于发酵乳中酪蛋白完全解离并迅速聚集形成凝胶结构,EI 值明显升高且达到最大值[20]。随后,二者的EI值略微下降,而FM 组的EI 值最大,说明添加益生菌后的发酵乳其弹性有一定程度的下降。
FI 变化能表征发酵乳的流动性,反映发酵乳中微观粒子的运动快慢,FI 值越大则样品流动性越强[21]。其中高流动因子(约10 Hz)为液态性质,低流动因子(约10-2Hz)为固态性质。结合图1 中流动因子的变化趋势可知,在发酵过程中,发酵乳样品的FI 变化可以分为3 个阶段。PMF 组在发酵前期(0~13 h),FI 值处于波动状态,样品处于相对稳定的高流动性状态;随后出现拐点,流动性快速下降,发酵乳初步形成较为稳定的凝胶结构,进入低流动性阶段。而FM 组与PMF 组流动因子的变化趋势相同,且FM 组从相对稳定的高流动性状态变为低流动状态所需时间为5.5 h。
综上所述,在发酵终点时,PFM 组的MVI 值大于FM 组,表现出高黏性因子的特征,有利于益生菌发酵乳形成稳定的凝胶结构;PFM 组的SLB值大于FM 组,表现出高固液平衡值的特征,说明添加益生菌后的发酵乳黏弹性更大,有利于产品的稳定;PFM 组的EI 值小于PFM 组,表现出低弹性因子的特征,说明益生菌发酵乳的弹性较低;PFM 组的FI 值小于FM 组,表现出低流动状态的特征,说明益生菌发酵乳具有更高的黏性液体特征。
2.2 发酵结束时游离氨基酸的含量
在PFM 组和发酵初始(0 h)共检测出14 种游离氨基酸,分别是苏氨酸(THR)、异亮氨酸(ILE)、亮氨酸(LEU)、赖氨酸(LYS)、苯丙氨酸(PHE)、缬氨酸(VAL)、天门冬氨酸(ASP)、丝氨酸(SER)、丙氨酸(ALA)、脯氨酸(PRO)、谷氨酸(GLU)、甘氨酸(GLY)、酪氨酸(TYR)和精氨酸(ARG)。对其进行总体分析,生成了游离氨基酸聚类热图(图2)。PFM 组相比于原奶,其THR、ILE、LEU、LYS、PHE、VAL、ASP、SER、ALA、PRO 和ARG 的含量均显著升高;而GLU、GLY 和TYR 的含量均下降。
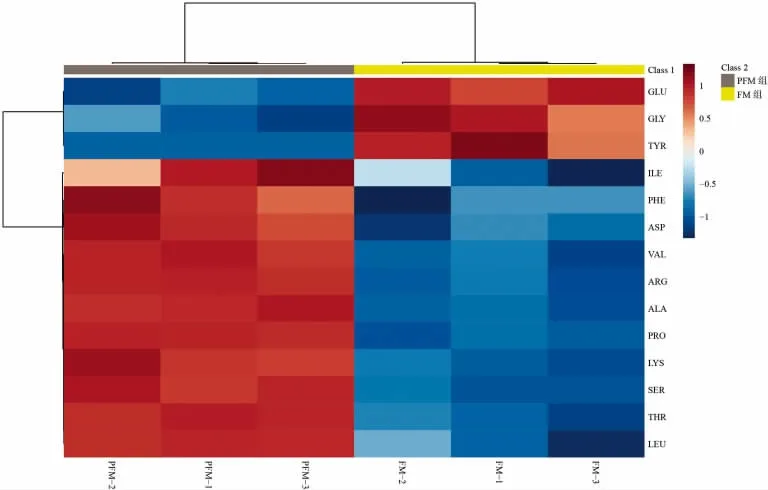
图2 聚类分析样品中游离氨基酸代谢物差异Fig.2 Cluster analysis of free amino acid metabolites in samples
如图3 所示,利用PLS-DA 对其差异代谢物进行区分。R2Y 和Q2 分别为拟合优度和预测能力参数,验证PLS-DA 模型的准确性和可预测性。R2Y 定义为模型解释的数据中方差的比例,表示拟合的优度;Q2 定义为模型可预测数据中的方差比例,表示预测能力。R2Y 和Q2 大于或等于0.5的模型被认为适合于识别分析。该模型中R2Y 和Q2 值分别为0.997 和0.994,表明该模型具有较好的准确性和可预测性。结果显示,共有9 种游离氨基酸同时满足P 值<0.05 和VIP 值>1。PFM 组游离氨基酸含量显著升高的有PHE 为0.93 mg/kg,VAL 为3.3 mg/kg,ALA 为22.6 mg/kg,LYS 为12.6 mg/kg,THR 为3.8 mg/kg,SER 为3.5 mg/kg,PRO为35.4 mg/kg,LEU 为5.4 mg/kg;游离氨基酸含量显著下降的有TYR,FM 组含量为0.6 mg/kg,PFM组含量为0.06 mg/kg。
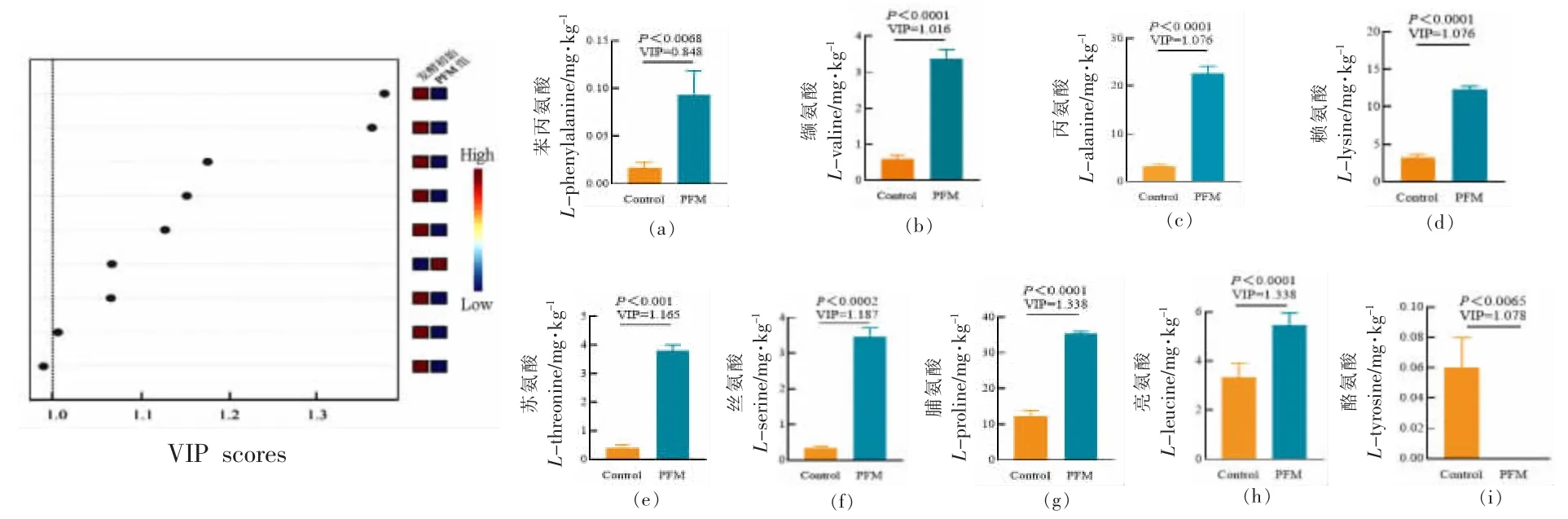
图3 VIP 游离氨基酸的PLS-DA 图Fig.3 The PLS-DA diagram of VIP free amino acids
氨基酸是构成蛋白质的基本单位,其种类和数量是考察食品营养价值的重要指标之一。氨基酸类型与含量是影响发酵乳风味的因素之一[22],进而影响人体健康,其主要来源于发酵乳发酵过程中蛋白质分解[23]、三羧酸循环(TCA 循环)[24]以及糖酵解途径(EMP 途径)[25]。根据图4 可知,蛋白质分解为多肽,在肽酶的作用下分解为LEU、VAL和PHE。LEU、VAL 属于支链氨基酸,LEU 能更快的分解,转化为葡萄糖,防止肌肉损伤[26],而VAL作为肌肉代谢和协调所必需,在保持身体氮平衡上具有重要的作用[27];PHE 属于芳香族氨基酸,对发酵乳滋味具有重要的作用,使得发酵乳的香味更加浓郁[28]。PRO 通过TCA 循环,由α-酮戊二酸催化还原形成;LYS 和THR 通过TCA 循环,以草酰乙酸为碳架合成。PRO 产生的代谢物具有花香,与发酵乳风味密切相关[29];LYS 作为人体的必需氨基酸之一,起到调节人体代谢平衡,增进食欲,促进幼儿发育等作用[30];THR 能够促进血红蛋白合成,增进食欲,促进生长[31]。ALA 通过糖酵解途径,由丙酮酸衍生而来,可为机体提供碳骨架、氮,以及能量等[32];而SER 在糖酵解途径中,以3-磷酸甘油酸为碳架合成,作为一种功能性氨基酸,在调控机体免疫功能、微生态平衡等方面发挥重要作用[33]。
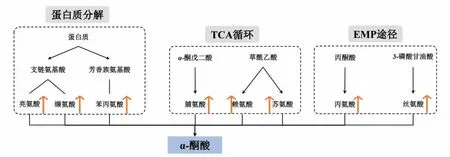
图4 差异氨基酸代谢途径Fig.4 The metabolism pathway of amino acids
2.3 发酵乳贮藏过程的活菌数变化
乳酸菌活菌数可直接影响发酵乳的品质、特性及口感[34]。如图5 所示,PFM 组乳酸杆菌和双歧杆菌活菌数均有所下降,28 d 结束时乳酸杆菌活菌数达2.4×108CFU/mL(P<0.05)、双歧杆菌活菌数达3.9×107CFU/mL(P<0.01)。总体分析,PFM 组活菌数下降可能是由于发酵乳酸度升高抑制乳酸菌生长,使乳酸菌总数减少。国家标准GB 19302-2010 规定[35],发酵乳中乳酸菌活菌数应在106CFU/mL 以上,而本试验菌株在贮藏期间活菌数均维持在108CFU/mL 以上。

图5 贮藏过程的活菌数变化Fig.5 Changes of viable cell counts during storage
2.4 发酵乳贮藏过程的酸度变化
发酵乳酸度的变化由图6 可知,在贮藏前期(1~7 d),PFM 组和FM 组pH 值均明显下降,滴定酸度的变化趋势与之相反。这是由于在贮藏初期,菌种生长代谢能力旺盛,在α-半乳糖苷酶作用下,继续分解剩余碳水化合物产酸,导致酸度增加幅度较大[36],随贮藏期的延长,菌种代谢受到抑制,pH 值和TA 值变化趋势逐渐平缓[37]。PMF 组pH 值在7 d 内由贮藏1 d 的4.46 下降到4.15,随后保持在4.0 左右,28 d 达3.97;FM 组pH 值在7 d 内由贮藏1 d 的4.28 下降到4.04,随后保持在4.0 左右,28 d 达3.96。各组发酵乳滴定酸度在贮藏期间均呈上升趋势,在贮藏1~7 d,PMF 组滴定酸度由84°T 上升到110°T,ΔpH=26°T;FM 组由91°T 上升到100°T,ΔTA=9°T;贮藏后期二者趋于平稳,最终都保持在108°T 左右,组间无显著差异。
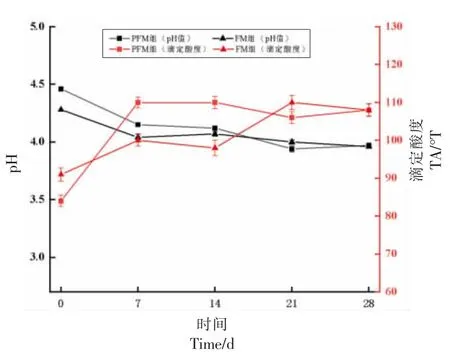
图6 贮藏过程的酸度变化Fig.6 Changes of acidity during storage
2.5 发酵乳贮藏过程的黏度和持水力变化
黏度的产生是由于发酵乳中菌体持续产酸使pH 值下降到酪蛋白凝固点,同时菌体不断分泌黏多糖,最终使发酵乳呈现均一黏稠状态[38]。如图7所示,在28 d 贮藏期间内黏度变化趋势为PFM 组先增大后减小,14 d 时达到最大值726 mPa·s,这可能与所选益生菌完成发酵后依旧保持较高活性,胞外多糖继续积累所致[39]。随着贮藏期继续延长,PFM 组黏度开始下降,可能是由于贮藏过程中,菌体持续产酸,导致发酵乳中乳酸含量增加到一定浓度时,使菌体代谢受到抑制,乳酸生成速度下降,限制黏度继续上升[40];而FM 组则呈持续下降趋势,由1 d 的1 002 mPa·s,下降到260 mPa·s。
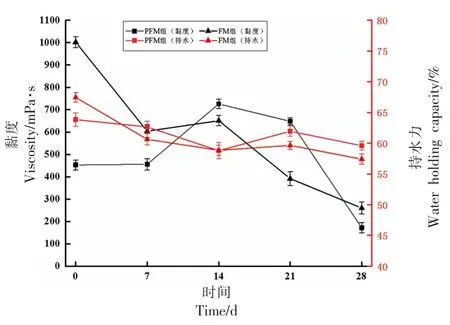
图7 贮藏过程的黏度和持水力变化Fig.7 Changes of viscosity and water holding capacity during storage
持水力是评价发酵乳产品品质的重要指标,持水能力的强弱,乳清析出的多少以及发酵乳的组织状态都影响产品感官及风味保留[41]。如图7所示,在28 d 的贮藏期内,PFM 组和FM 组持水力均呈现下降趋势。这可能是因为在发酵乳贮藏期间菌种不断代谢需要水的参与[42],也可能与发酵乳贮藏过程中,较低的pH 值破坏了凝胶体的结构有关。在贮藏期间1~14 d 内两组持水力下降幅度最快,PFM 组由1 d 的63.85%下降至58.8%,FM 组由1 d 的67.45%下降至58.85%,随后二者有所回升。在贮藏28 d 后,PFM 组持水力下降至59.6%,FM 组下降至57.42%。总体分析,PFM 组在贮藏期间内持水力普遍高于FM 组,组间无显著差异。
2.6 发酵乳贮藏过程的感官品质变化
分别将PFM 组和FM 组样品在1,7,14,21,28 d 时进行感官评价,评分结果如图8 所示:两组在贮藏期间其感官评价得分均有显著下降(P<0.01)。贮藏开始时,PFM 组相比于FM 组得分较高(P<0.05),状态光滑细腻,香气浓郁,具有醇香的酸奶味;在10 ℃,1~7 d 贮藏期间,两组样品得分呈上升趋势,这可能是由于在此期间样品黏度较高,持水力较好,有利于发酵乳样品风味保留。在7~28 d 两组样品感官评分整体出现下降趋势,贮藏结束时PFM 组得分87.0 分,FM 组得分84.1分。整体上,PFM 组在10 ℃,28 d 的贮藏期间内滋味、气味、质地、色泽以及口感均优于FM 组。

图8 贮藏期间感官评分结果Fig.8 Sensory score results during storage
3 结论
益生菌乳双歧杆菌V9(Bifidobacterium animalis subsp.V9)、副干酪乳杆菌(Lacticaseibacillus paracaseiPC-01)和植物乳杆菌P-8(Lactiplantibacillus plantarumP-8)复合发酵牛乳具有较好的流变学特性,利于发酵乳形成紧密的凝胶网络。发酵乳中游离PHE、VAL、ALA、LYS、THR、SER、PRO 和LEU 含量显著升高,各检测指标在10 ℃期间均有较好的稳定性,全贮藏期内活菌数高于108CFU/mL,具有组织状态细腻和感官得分高的特点。因此,所述研究可为益生菌发酵乳产品开发提供思路,对益生菌在功能性乳制品中的应用具有重要意义。
