双镜联合技术在治疗困难部位胃间质瘤的临床效果研究
2023-08-14张津瑜尹磊邬仲鑫蔡炜龙汪伟民魏云海
张津瑜,尹磊,邬仲鑫,蔡炜龙,汪伟民,魏云海
双镜联合技术在治疗困难部位胃间质瘤的临床效果研究
张津瑜,尹磊,邬仲鑫,蔡炜龙,汪伟民,魏云海
湖州市中心医院胃肠外科,浙江湖州 313000
探讨双镜联合技术治疗困难部位胃间质瘤的安全性、临床效果及预后情况。回顾性分析2015年1月至2021年12月湖州市中心医院收治的85例胃间质瘤患者的临床资料,根据手术方式的不同将其分为双镜联合组(43例)和开腹手术组(42例)。比较两组患者的围手术期相关指标、术后并发症发生情况及随访情况。双镜联合组患者的术中出血量显著少于开腹手术组,术后疼痛评分显著低于开腹手术组,术后首次排气时间、术后进流食时间及总住院时间均显著短于开腹手术组(<0.05);两组患者的手术时间比较差异无统计学意义(>0.05);双镜联合组患者的总并发症发生率显著低于开腹手术组(2=4.435,=0.035)。随访10~73个月,两组患者均未见复发、远处转移及死亡。双镜联合技术应用于困难部位胃间质瘤手术安全、有效,可减少术中出血和术后并发症,缩短患者的恢复时间,值得临床推广应用。
双镜联合;胃间质瘤;困难部位;围手术期
胃肠间质瘤是消化道间叶源性的常见肿瘤之一,其中部分肿瘤具有恶性的生物学行为。对原发且能完整切除的间质瘤而言,手术彻底切除是其最主要的治愈手段。传统手术方式创伤大,术中失血量多,无疑给患者术后恢复带来诸多不利影响[1-2]。随着微创技术的不断创新与普及,加速康复观念深入人心,腹腔镜和内镜在消化道肿瘤的诊断和治疗中扮演着越来越重要的角色。腹腔镜手术有着创伤小、术后恢复快等优势,部分指南推荐对位于有利部位的≤5cm的胃间质瘤可采取腹腔镜手术治疗[3]。在胃间质瘤的诊断中,内镜及超声内镜是非常重要的检查项目,部分直径小且腔内生长的瘤体也可通过内镜进行切除。研究表明,将腹腔镜和内镜联合运用于胃肠间质瘤的治疗可取得更满意的效果[4-5],但对困难部位的胃间质瘤运用双镜联合技术进行治疗的安全性及有效性尚存在争议。因此,本研究回顾性分析85例胃间质瘤患者的临床资料,拟评估该技术在治疗困难部位胃间质瘤中的应用价值,现将结果报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月至2021年12月湖州市中心医院收治的85例胃间质瘤患者的临床资料。纳入标准:①经评估为原发性肿瘤,可切除,内镜、超声内镜、腹部CT或经病理证实为胃间质瘤,瘤体最大直径为2~5cm;②瘤体位于胃困难解剖部位,即肿瘤位于胃底/胃体后壁、胃食管结合部、胃小弯侧及幽门部;③年龄20~80岁;④术前未接受任何的分子靶向药物治疗;⑤患者手术意愿强烈。排除标准:①瘤体最大直径<2cm或>5cm,或肿瘤转移无法达到R0切除标准;②胃其他部位或其他消化道部位的间质瘤;③年龄<20岁或患者超高龄,存在手术相关禁忌证或凝血功能异常者;④具有腹部手术病史或因肿瘤出血或穿孔行急诊手术者。根据患者采用的手术方式将其分为双镜联合组(43例)和开腹手术组(42例)。患者均自愿签署知情同意书,本研究经湖州市中心医院伦理委员会批准(伦理审批号:20201205-02)。
1.2 手术方式
两组患者常规术前宣教,手术前6h禁饮食,术前半小时预防性静滴抗生素,术中全身麻醉,气管插管,规范手术操作,术后给予常规抗感染、抑酸护胃、营养支持及肢体功能锻炼等干预措施。双镜联合组患者人字位,常规五孔法,胃镜下定位肿瘤部位,若瘤体位于胃体胃底后壁,超声刀游离胃大弯侧网膜血管,将胃翻起,使用直线切割闭合器将肿瘤连同周边1cm左右正常胃壁组织一并切除,若如此操作困难,也可将胃前壁打开,于胃腔内将瘤体完整切除后,再将胃前壁切口关闭。如果瘤体生长于胃小弯侧、近贲门或幽门处,先胃镜下定位瘤体,内镜直视下,腹腔镜行胃楔形切除或切开胃壁行肿瘤切除后再缝合关闭胃壁切口,注意避免导致食管括约肌损伤及贲门或幽门狭窄,观察创面有无渗血,必要时间断缝合加固止血。若此法无法完整切除肿瘤,则需要行近端胃、远端胃甚至是全胃切除术。切除标本均装入标本袋从绕脐小切口取出。开腹手术组患者进行常规开腹手术,剑突下正中切口,长10~15cm,进腹后切口保护器保护手术切口,依据瘤体位置及其生长的方式采用相应术式(如胃楔形切除,近端胃、远端胃或全胃切除等)进行肿瘤切除,术中常规探查腹腔、盆腔有无转移情况。
1.3 观察指标
分别记录两组患者的术中出血量、手术时间、术后疼痛评分、术后首次排气时间、进流食时间及总住院时间。记录两组患者的术后并发症发生情况,如肺部感染、切口感染、消化道瘘及出血、下肢静脉血栓形成、肺栓塞、粘连性肠梗阻等。通过微信群或拨打电话的方式进行随访,复查的相关指标包括血常规、肝肾功能、腹部彩超或CT。术后第1年每3个月进行一次全面复查,术后第2年则每半年进行一次全面复查,术后第3年及以后每年进行一次复查。
1.4 统计学方法

2 结果
2.1 两组患者的一般临床资料比较
两组患者的年龄、性别、肿瘤最大直径、改良美国国立卫生研究院(National Institutes of Health,NIH)危险度分级、肿瘤部位比较,差异均无统计学意义(>0.05),具有可比性,见表1。
2.2 两组患者的围手术期相关指标比较
两组患者均顺利完成手术,手术过程中均未发生瘤体破裂,双镜联合组患者术中无中转开腹手术。双镜联合组患者的术中出血量显著少于开腹手术组,术后疼痛评分显著低于开腹手术组,术后首次排气时间、术后进流食时间及总住院时间均显著短于开腹手术组(<0.05),两组患者的手术时间比较差异无统计学意义(>0.05),见表2。
2.3 两组患者的术后并发症发生情况比较
双镜联合组患者的总并发症发生率显著低于开腹手术组(2=4.435,=0.035),见表3。
2.4 两组患者的随访结果及复发转移情况比较
两组患者均接受10~73个月的随访,均未见复发、远处转移及死亡。
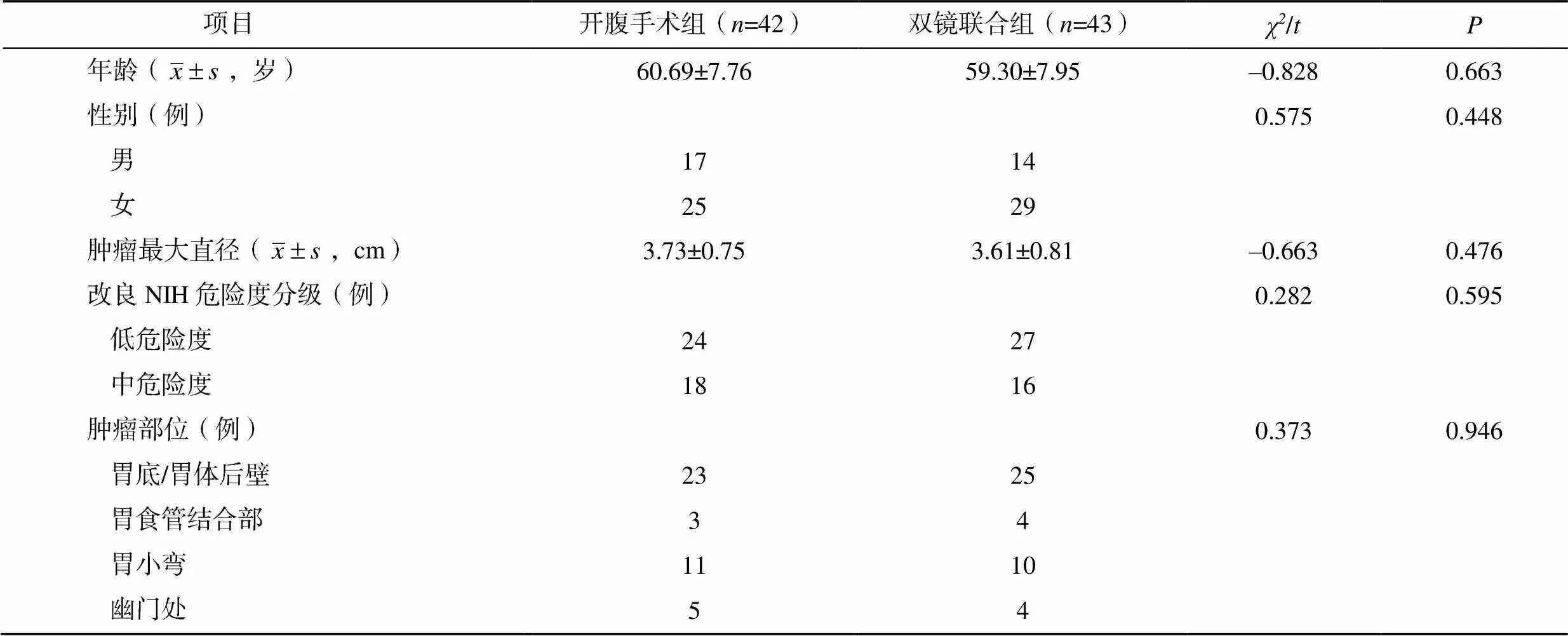
表1 两组患者的一般临床资料比较

表2 两组患者的围手术期相关指标比较()
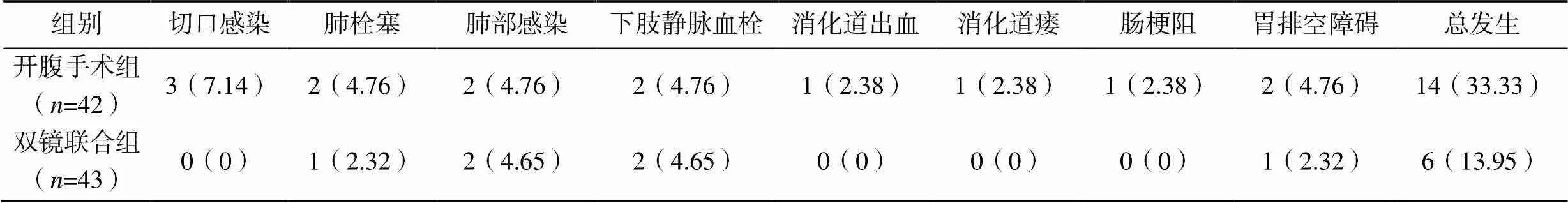
表3 两组患者的术后并发症发生情况比较[n(%)]
3 讨论
胃肠间质瘤是消化系统最常见的间叶源性肿瘤,而胃则是间质瘤好发部位之一,占该病的60%左右[6]。胃肠间质瘤的生物学行为复杂,可从良性到恶性,免疫组织化学常显示CD117和DOG1阳性表达及Cajal细胞分化,且大多数病例同时具有c-kit或PDGFRA基因的活化突变,还有少数病例涉及SDHX、BRAF、K/N-RAS等相关基因突变[7-8]。胃肠间质瘤对放化疗不敏感,虽然近年来分子靶向药物对复发转移的胃肠间质瘤的治疗效果显著提升,但对原发性可切除的胃肠间质瘤而言,手术R0切除仍是其最主要的治愈方式。传统开腹手术虽然操作相对简单,但存在创伤大、出血多、术后恢复慢等不足,加重患者和家属的经济及精神负担。
随着腔镜技术的发展,腹腔镜及内镜已广泛应用于胃肠间质瘤的诊断及治疗中。内镜下胃黏膜剥除可在明视下对胃间质瘤进行黏膜下剔除或电圈切除,有利于完整切除肿瘤,减少瘤体残留风险,且因其不进入腹腔,患者所受创伤小,术后恢复明显加快[9-10]。但胃间质瘤内镜下切除也存在一定的局限性,内镜切除主要适用于腔内生长的小间质瘤,一般建议<2cm的间质瘤可行内镜下切除;由于无法观察到患者腹腔内情况,内镜下切除时出血及穿孔的风险无法避免,且一旦发生,内镜下处理十分棘手,常需要外科干预。与开腹手术相比,腹腔镜手术创伤小,解剖更精细,术中失血量少,可加快患者术后恢复,因此腹腔镜手术被广泛运用于胃癌、结直肠癌等消化道恶性肿瘤的诊治中。但胃肠间质瘤血供丰富,瘤体质脆易发生破裂,尤其是直径较大的间质瘤,包膜张力大,若术者对肿瘤特性不熟悉,在手术时易造成瘤体破裂而增加医源性肿瘤播散的风险,因此,早期的临床指南并未推荐腹腔镜手术作为胃肠间质瘤的常规治疗方式。但随着腹腔镜技术的发展和进步,已有大量临床研究证实应用腹腔镜行胃肠间质瘤手术同样可取得良好的治疗效果,且术后恢复更快。《中国胃肠间质瘤诊断治疗共识(2017年版)》指出,对生长于胃大弯侧或胃底胃体前壁且直径≤5cm的胃间质瘤可考虑使用腹腔镜手术[3],国外亦有研究报道腹腔镜手术适用于瘤体最大直径>5cm的胃间质瘤。自2010年后,美国国家综合癌症网络指南已不再将瘤体体积大小作为腹腔镜手术的禁忌证[11]。国内外研究表明,腹腔镜手术治疗胃肠间质瘤不应受到肿瘤生长部位的限制,只要术者能够合理掌握其适应证,对困难部位的胃肠间质瘤行腔镜手术亦是安全有效且可行的[12-13]。
虽然内镜和腔镜技术治疗胃肠间质瘤的疗效已得到认可,但单独运用其中一项技术对胃肠间质瘤进行治疗,仍具有一定的局限性。内镜仅适用于小的腔内生长的间质瘤,且术中出血及穿孔风险大;腹腔镜在行肿瘤切除时瘤体定位困难,完整切除腔内生长型肿瘤瘤体较为困难,切除后无法观察胃切缘黏膜侧的出血情况。当瘤体生长于贲门、幽门或胃体小弯侧等位置时,腔镜手术易损伤食管括约肌,导致患者术后出现反流或消化道梗阻。因此,双镜联合技术运用于胃肠间质瘤的治疗能为术者提供更开阔而清晰的手术视野,不仅减少病灶遗漏风险,提高完整切除率,还可减少术后并发症的发生[14-15]。
本研究发现,双镜联合组在减少术中失血量、降低术后疼痛评分、缩短术后首次排气时间、进食流质时间、总住院时间及降低手术后并发症发生率等方面显著优于开腹手术组,说明双镜联合操作视野更清晰,解剖层次更清楚,可减少不必要的组织损伤,术中出血更少,更利于患者术后恢复,与国内外既往研究结果相似[16-17]。两组患者的手术时间比较无明显差异,分析原因可能与双镜联合技术开展的时间还较短、术中操作的熟练程度及外科医生与内镜医生配合的默契程度有关[18]。本研究两组患者在随访过程中均未见复发、远处转移及死亡病例,可能与本研究患者肿瘤危险度分级相对较低有关。
综上所述,腹腔镜与内镜联合手术治疗生长于胃困难部位的间质瘤是安全有效的,可减少术中出血量及损伤,加速患者术后康复,具有一定的临床推广价值。
[1] XIANG Y Y, LI Y Y, YE L, et al. Clinical evaluation of endoscopic resection for treatment of large gastric stromal tumors[J]. World J Clin Cases, 2019, 7(7): 830–838.
[2] 叶颖江, 王杉. 胃肠间质瘤微创手术——舍本逐末抑或精益求精[J]. 中华胃肠外科杂志, 2019, 22(9): 820–825.
[3] 中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2017年版)[J]. 肿瘤综合治疗电子杂志, 2018, 4(1): 31–43.
[4] LI L, CRISTOFARO S, ZHOU X, et al. Endoscopic submucosal resection: A novel technique for resection of a small gastric stromal tumor from the muscularis propria[J]. Am J Gastroenterol, 2017, 112(5): 679.
[5] TSUJI R, KOMATSU S, KUMANO T, et al. Laparoscopy and endoscopy cooperative surgery (LECS) -Assisted open partial gastrectomy for a high-risk gastrointestinal stromal tumor[J]. Gan To Kagaku Ryoho, 2019, 46(1): 172–174.
[6] NEMUNAITIS J, BAUER S, BLAY J Y, et al. Intrigue: phase Ⅲ study of ripretinib versus sunitinib in advanced gastrointestinal stromal tumor after imatinib[J]. Future Oncol, 2020, 16(1): 4251–4264.
[7] SERRANO C, GEORGE S. Gastrointestinal stromal tumor: Challenges and opportunities for a new decade[J]. Clin Cancer Res, 2020, 26(19): 5078–5085.
[8] MANTESE G. Gastrointestinal stromal tumor: Epidemiology, diagnosis, and treatment[J]. Curr Opin Gastroenterol, 2019, 35(6): 555–559.
[9] YIN X, YIN Y, CHEN H, et al. Comparison analysis of three different types of minimally invasive procedures for gastrointestinal stromal tumors ≤5cm[J]. J Laparoendosc Adv Surg Tech A, 2018, 28(1): 58–64.
[10] 朱兰平, 惠洋洋, 李变霞, 等. 胃小间质瘤行内镜下切除治疗的临床价值[J]. 中华消化内镜杂志, 2018, 35(12): 905–909.
[11] HE B, YAN S, LI R, et al. A comparative study of treatment of gastrointestinal stromal tumors with laparoscopic surgery: A retrospective study[J]. J BUON, 2018, 23(3): 820–825.
[12] 许芸芸, 徐晓武, 牟一平, 等. 直径大于5cm胃间质瘤腹腔镜切除的临床分析[J]. 中华普通外科杂志, 2018, 33(9): 734–736.
[13] SHI F, LI Y, PAN Y, et al. Clinical feasibility and safety of third space robotic and endoscopic cooperative surgery for gastric gastrointestinal stromal tumors dissection : A new surgical technique for treating gastric GISTs[J]. Surg Endosc, 2019, 33(12): 4192–4200.
[14] HUANG J L, ZHENG Z H, WEI H B, et al. Endoscopy- assisted laparoscopic resections for gastric gastrointestinal stromal tumors: A retrospective study[J]. J Laparoendosc Adv Surg Tech A, 2017, 27(2): 110–114.
[15] OJIMA T, NAKAMORI M, NAKAMURA M, et al. Laparoscopic and endoscopic cooperative surgery versus endoscopic submucosal dissection for the treatment of low-risk tumors of the duodenum[J]. J Gastrointest Surg, 2018, 22(5): 935–940.
[16] CUI J X, GAO Y H, XI H Q, et al. Comparison between laparoscopic and open surgery for large gastrointestinal stromal tumors: A Meta-analysis[J]. World J Gastrointest Oncol, 2018, 10(1): 48–55.
[17] PARK S H, LEE H J, KIM M C, et al. Early experience of laparoscopic resection and comparison with open surgery for gastric gastrointestinal stromal tumor: A multicenter retrospective study[J]. Sci Rep, 2022, 12(1): 2290.
[18] 张李, 王昕宇, 王鹏亮, 等. 腹腔镜对比开腹手术治疗胃部胃肠间质瘤的疗效研究[J]. 肿瘤学杂志, 2021, 27(6): 450–454.
Clinical effect of laparoscopic and endoscopic cooperative surgery in the treatment of gastric stromal tumors in difficult positions
Department of Gastrointestinal Surgery, Huzhou Central Hospital, Huzhou 313000, Zhejiang, China
To investigate the safety, clinical effect and prognosis of laparoscopic and endoscopic cooperative surgery in the treatment of gastric stromal tumors in difficult positions.The clinical data of 85 patients with gastric stromal tumor admitted to Huzhou Central Hospital from January 2015 to December 2021 were retrospectively analyzed. They were divided into laparoscopic and endoscopic cooperative surgery group (43 cases) and laparotomy group (42 cases) according to different surgical methods. The perioperative indexes, postoperative complications and follow-up were compared between the two groups.The intraoperative blood loss in laparoscopic and endoscopic cooperative surgery group was significantly less than that in laparotomy group, postoperative pain score was significantly lower than that in laparotomy group, first postoperative exhaust time, postoperative liquid feeding time and total hospital stay were significantly shorter than those in laparotomy group (<0.05). There was no significant difference in operation time between the two groups (>0.05). The total complication rate of patients in laparoscopic and endoscopic cooperative surgery group was significantly lower than that in laparotomy group (2=4.435,=0.035). After 10 to 73 months of follow-up, no recurrence, distant metastasis and death were observed in both groups.The laparoscopic and endoscopic cooperative surgery is safe and effective for gastric stromal tumors in difficult positions. It can reduce the amount of intraoperative blood loss and the incidence of postoperative complications, and also shorten the postoperative recovery time of patients, which has a certain promotion value.
Laparoscopic and endoscopic cooperative surgery; Gastric stromal tumor; Difficult position; Perioperative
R735.2
A
10.3969/j.issn.1673-9701.2023.22.010
浙江省湖州市科技局重点项目(2020GZ39)
魏云海,电子信箱:wyh665716@126.com
(2022–11–09)
(2023–07–17)
