精准备考突破物质结构模块中的不同类型的共价键
2023-08-08金敖然
金敖然
(广西南宁市第三中学)
共价键是物质结构模块的重要知识,也是高考考查的重要内容。分值在结构化学考点中占比较高,考查的内容包括共价键的极性、σ键与π键、配位键及相关知识、大π键、物质结构式中涉及的d-p 反馈π键等。考查的角度越来越新颖,考查内容也不断深入。那么高三学子在面对有关化学键复杂多变的题型时如何才能做到应对自如呢?本文中,笔者总结归纳了共价键的相关知识,做到精准备考突破物质结构模块中的共价键问题。
一、近三年部分真题卷中有关共价键考点的统计
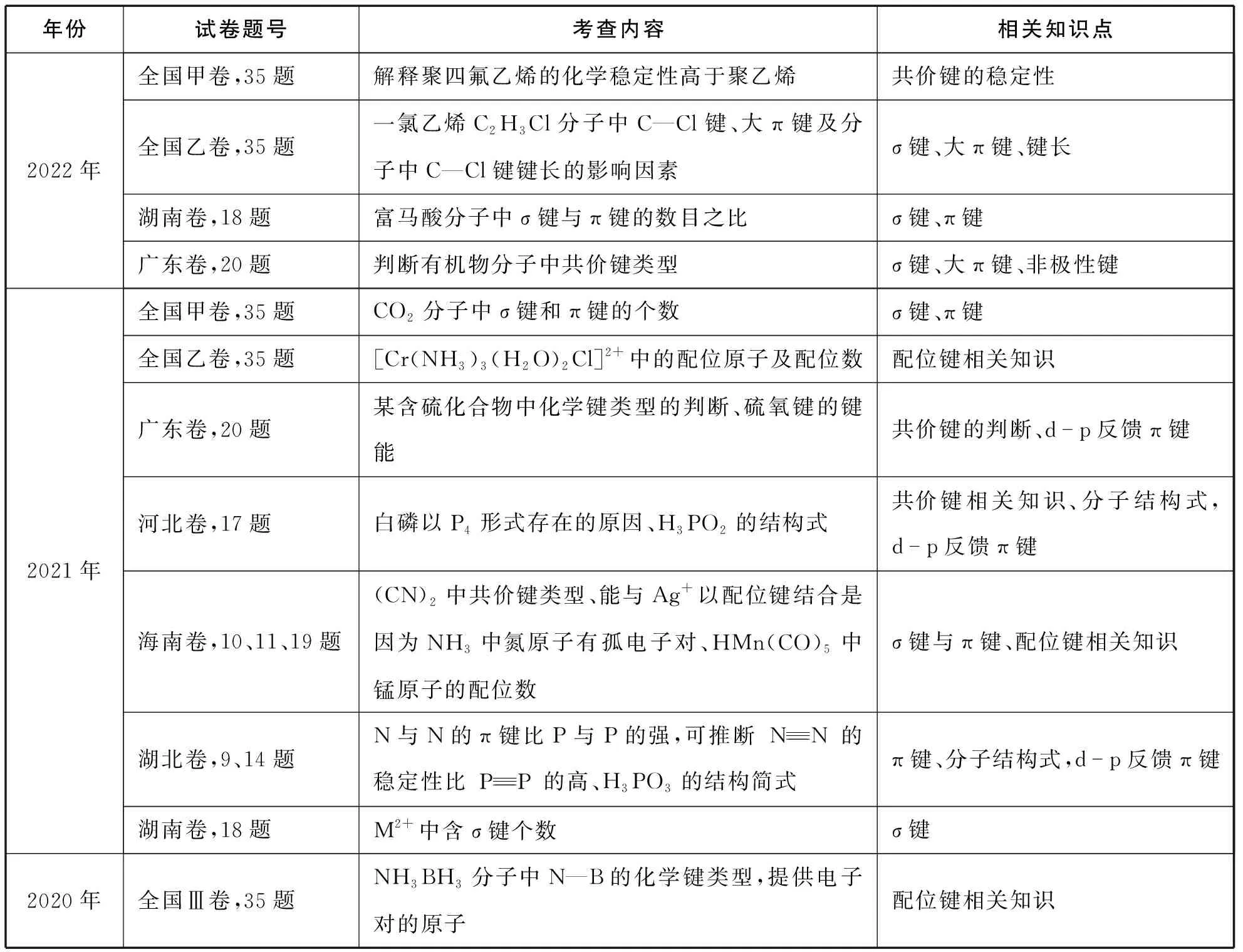
表1
二、极性共价键与非极性共价键
根据经典的共价键理论,原子与原子是通过两个自旋方向相反的电子组成“电子对”吸引在一起的,我们把这种“电子对”称作共用电子对、共价键。成键原子间的“电子对”或者说电子云,由于受成键原子的吸引力的大小不同,会发生偏移。当成键原子相同时,他们对“电子对”的吸引力相同,那么电子对就不发生偏移,成键原子不显电性,此时该种作用力被称作非极性共价键简称非极性键。相反,当成键原子不同时,他们对电子对的吸引力也不同,这就导致共用电子对发生偏移,成键原子带相反电荷,这就是极性共价键简称极性键。简单讲,同种原子间形成非极性键,不同原子间形成极性键。
由于分子内电荷分布不均匀,正负电荷中心不重合,导致分子“两端”分别出现正电性δ+和负电性δ-,这样的分子称作极性分子,相反就是非极性分子。那么如何判断分子的极性呢?方法有三种。
(一)化合价法
对于ABn型分子,中心原子A的化合价的绝对值或成键数等于其价电子数,则该分子为非极性分子,如:BF3、CH4、PCl5等。相反为极性分子如:CO、SO2、PCl3等。
(二)力的合成法
对于已知空间构型的分子,利用力的向量加减,若合力为0,则为非极性分子,反之为极性分子。一般分子采用直线形、平面正三角形、正四面体形、三角双锥形、正八面体形等分子构型,就是非极性分子。如:CO2、SO3、SF6等。
(三)绝大多数单质都是非极性分子
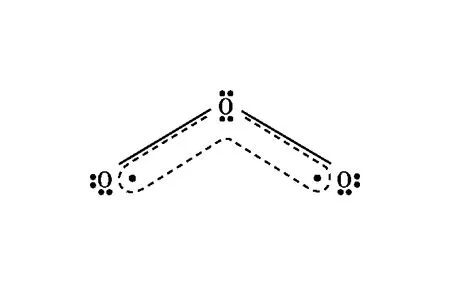
图1
三、σ键与π键
分子的量子化模型认为,共价键是由不同原子的电子云重叠形成的。如果电子云或原子轨道采用“头碰头”重叠,那么这种共价键就叫σ键,一般σ键成键电子云密度较高,相对比较稳定,对称方式为轴对称,因此成键原子可以绕轴旋转。若电子云采用“肩并肩”重叠,那么这种化学键叫作π键,π键电子云空间重叠相对较少,稳定性不如σ键,容易发生断裂,常见于有机反应中的加成、加聚反应。π键的空间对称属于镜面对称,故双键、三键不能旋转。
关于σ键与π键的判断比较简单。共价单键都是σ键,共价双键中分别为一个σ键和一个π键,三键中包括一个σ键和两个π键。
【例1】(2022年湖南卷,18题节选)(2)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图2所示:
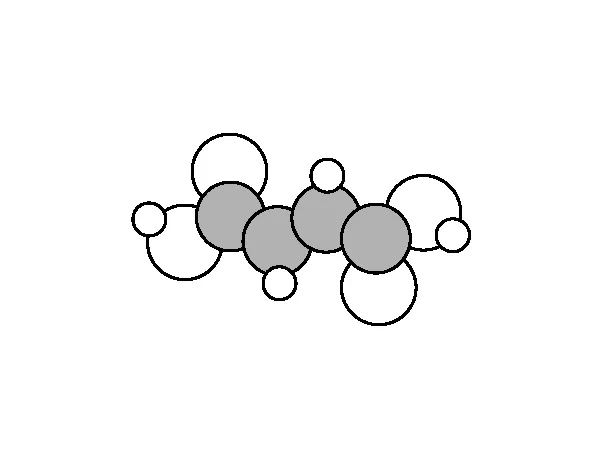
图2
①富马酸分子中σ键与π键的数目比为________。
【答案】11∶3

四、配位键

由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。配合物结构中中心原子或离子提供空轨道,配原子提供孤电子对。
【例2】(2020年全国Ⅲ卷,35题节选)(2)NH3BH3分子中,N—B化学键称为________键,其电子对由________提供。
【答案】配位;N
【解析】NH3BH3分子中,B最外层3个电子,分别与3个H成键,空出一个空轨道,而分子中N与3个H原子成键后,多出一对孤对电子,故 N—B 化学键为配位键,其电子对由N提供。
五、大π键
大π键的判断相对比较复杂。一共三条规则:
1.分子结构为平面形结构,即中心原子采用sp或sp2杂化。
2.参与形成大π键的原子必须存在垂直平面、相互平行的p轨道。
3.中心原子未参与杂化的电子与周围的配原子的一个p轨道上的电子共同形成大π键,大π键的电子数小于轨道数的两倍。
【例3】请表示出下列粒子中的大π键。

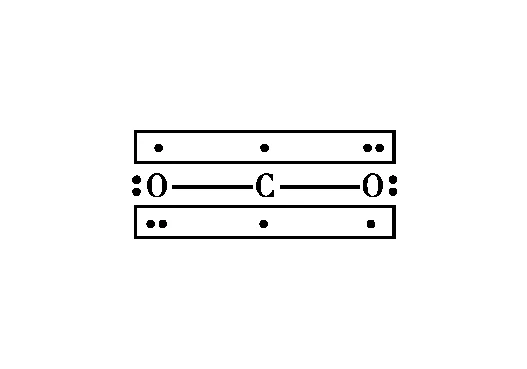
图3 CO2分子中2个的电子排布情况
【例4】(2022年全国乙卷,35题节选)(2)②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是
____________________,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强:(ⅱ)____________________,。
【答案】一氯乙烷>一氯乙烯>一氯乙炔 Cl参与形成的大π键越多,形成的C—Cl键的键长越短
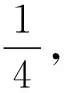
在学习H2SO4分子结构的时候,我们了解到中心原子S采用sp3杂化,形成4个σ键连接4个O原子,4个S—O键完全相同,但是实际上4个S—O键有长短之分,如图4所示。
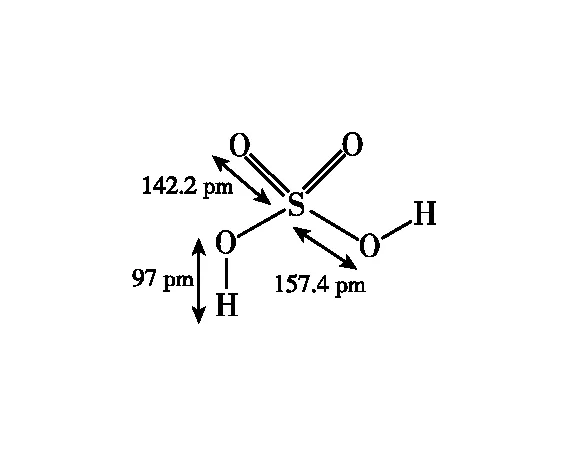
图4
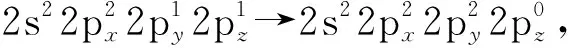
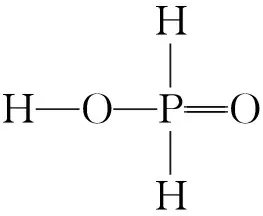
【例5】(2021年河北卷,17题节选)KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为____________________________________。