IL-35表达对小鼠脾脏CD4+和CD8+T淋巴细胞亚群分化的影响*
2023-08-05张志强杨鲁宁王朝霞张晓宁
张志强,杨鲁宁,刘 恒,王朝霞,张晓宁△
[1.天津市南开医院病理科 300100;2.中国人民武装警察部队山东总队泰安支队卫生队,山东泰安 271000;3.山东第一医科大学(山东省医学科学院)临床与基础医学院(基础医学研究所),济南 250000]
调节性T淋巴细胞(regulatory T cells,Tregs)是一类特殊的T淋巴细胞群,能够有效抑制T淋巴细胞对自体或异体抗原的免疫反应,是治疗自身免疫性疾病和器官移植免疫排斥反应的首选[1-5],其中CD4+叉头/翅膀状螺旋转录因子3+Tregs(CD4+Foxp3+Tregs)的研究和应用最为广泛[6]。研究表明,CD4+Foxp3+Tregs的免疫抑制作用可依赖于白细胞介素(interleukin,IL)-35的参与[7-8]。IL-35是继转化生长因子(transforming growth factor,TGF)-β、和IL-10之后发现的抑制性细胞因子,由两个亚基组成[α链IL-12A/p35和β链EB病毒诱导基因3(Ebi3)],与IL-12、IL-23、IL-27共同构成了IL-12细胞因子家族[9-10],最早发现由天然Tregs分泌,能够促进Tregs的体外增殖[7,11]。本研究将构建小鼠IL-35基因表达质粒,通过尾静脉注射到小鼠体内,探讨IL-35表达对小鼠脾脏中CD4+和CD8+T淋巴细胞亚群分化的影响,为IL-35基因应用于体内免疫治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物
健康雄性无特殊病原体(SPF)级C57BL/6J小鼠(8~12周龄)9只,体重18~22 g,购自北京军事医学科学院实验动物中心,饲养于天津医科大学SPF级实验动物中心,小动物护理及实验方案经天津医科大学实验动物伦理委员会批准。
1.1.2实验试剂
基因表达载体为鼠干细胞病毒载体(pMSCV-GFP),小鼠IL-35基因来自质粒pcDNA3.1-IL-35,均由天津医科大学刘义老师惠赠。1×磷酸盐缓冲液(PBS)、红细胞裂解液购自北京索莱宝科技有限公司,TRIzol购自美国Invitrogen公司,逆转录试剂HiScript Ⅱ Q Select RT SuperMix for qPCR(+gDNA wiper)、实时荧光定量PCR(quantitative real-time PCR,qPCR)试剂AceQ qPCR SYBR Green Master Mix购自南京诺唯赞生物科技有限公司。流式标记荧光抗体:异硫氰酸荧光素(FITC)标记的抗小鼠CD4抗体、FITC标记的抗小鼠CD4抗体、藻红蛋白(PE)标记的抗小鼠CD8抗体、PE标记的抗小鼠CD25抗体购自美国eBioscience公司。qPCR检测所用的引物、内参基因3-磷酸甘油醛脱氰酶(GAPDH)引物(货号:B661304)由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1小鼠IL-35基因表达载体(pMSCV-IL-35-GFP)的构建
采用PCR法扩增获得小鼠IL-35基因全长片段,将该片段连入pMSCV-GFP多克隆位点区,获得携带IL-35基因的质粒载体pMSCV-IL-35-GFP,测序验证重组载体无碱基突变。
1.2.2pMSCV-IL-35-GFP质粒注射
将9只雄性C57BL/6J小鼠随机分为3组:PBS组、pMSCV组和pMSCV-IL-35组,每组3只,3组小鼠的体重及活跃状态没有明显区别。分别向3组小鼠尾静脉注射PBS、pMSCV-GFP空载质粒和pMSCV-IL-35-GFP质粒。72 h后分离每只小鼠脾脏。
1.2.3小鼠脾脏Ebi3、IL-12a mRNA相对表达水平的检测
采用TRIzol法抽提每只小鼠脾脏总RNA,超微量分光光度计检测RNA的浓度和纯度,RNA浓度>200 ng/μL,260、280 nm处吸光度值比值(A260/A280)为1.8~2.2,说明提取的总RNA质量合格。采用实时荧光定量逆转录PCR(reverse transcription-quantitative real-time PCR,RT-qPCR)检测小鼠脾脏Ebi3和IL-12a mRNA相对表达水平,GAPDH为基因表达内参,每个样品设3次重复。检测Ebi3、IL-12a mRNA所用的引物序列见表1。

表1 引物序列
1.2.4流式细胞术检测小鼠脾脏CD4+和CD8+T淋巴细胞亚群
摘取每只小鼠的脾脏并剪碎,在200目细胞筛上研磨得到细胞悬液,用红细胞裂解液处理,PBS洗涤后离心获得淋巴细胞。按每管2×105个细胞分成4组:第1组加入FITC标记的抗小鼠CD4抗体;第2组加入PE标记的抗小鼠CD8抗体;第3组加入FITC标记的抗小鼠CD4抗体和PE标记的抗小鼠CD25抗体,4 ℃避光孵育30 min,用PBS清洗1次,用流式细胞仪进行检测;第4组未标记抗体的细胞作为对照。
1.2.5小鼠脾脏颗粒酶B(Gzmb)、Foxp3 mRNA相对表达水平的检测
为进一步验证流式细胞术所检测的CD4+和CD8+T淋巴细胞亚群分化情况,采用RT-qPCR检测CD8+T淋巴细胞免疫功能分子Gzmb[12]及Treg细胞特异转录因子Foxp3[6]mRNA相对表达水平,GAPDH为基因表达内参,每个样品设3次重复。检测Gzmb、Foxp3 mRNA所用的引物序列见表1。
1.3 统计学处理
2 结 果
2.1 小鼠脾脏Ebi3和IL-12a基因的表达水平
与PBS组或pMSCV组比较,pMSCV-IL-35组小鼠脾脏Ebi3和IL-12a mRNA相对表达水平明显升高(P<0.001),见表2。
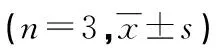
表2 3组小鼠脾脏Ebi3和IL-12a mRNA相对表达水平比较
2.2 IL-35表达对脾脏T淋巴细胞分型的影响
与PBS组或pMSCV组比较,pMSCV-IL-35组小鼠脾脏CD8+T淋巴细胞百分比明显降低(P<0.001),CD4+CD25+Tregs百分比则明显升高(P<0.001),见图1~3、表3。

图2 流式细胞术检测脾脏总CD8+T淋巴细胞的百分比

图3 流式细胞术检测脾脏CD4+CD25+Tregs百分比

表3 3组小鼠脾脏细胞分化百分比比较
2.3 IL-35表达对脾脏CD8+T淋巴细胞Gzmb基因和CD4+CD25+Tregs Foxp3基因表达的影响
进一步验证CD4+和CD8+T淋巴细胞亚群分化情况,结果显示:与PBS组或pMSCV组比较,pMSCV-IL-35组Gzmb mRNA表达水平明显降低(P<0.01),而Foxp3 mRNA表达水平明显升高(P<0.01),见表4。
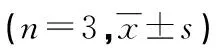
表4 3组小鼠脾脏Gzmb和Foxp3 mRNA相对表达水平比较
3 讨 论
IL-12家族有4个成员:IL-12、IL-23、IL-27和IL-35[13-14]。这4个成员有着相似的配体和结构特征,但是与其他3个成员不同的是,IL-35具有独特的免疫调节功能[15-16]。IL-12、IL-23和IL-27主要由巨噬细胞、单核细胞和树突状细胞等抗原提呈细胞(antigen presenting cells,APCs)在被病原体特异性模式识别激活后产生[17]。IL-35是IL-12细胞因子家族的新成员,是由α链p35和β链Ebi3组成的异源二聚体,主要由CD4+Foxp3+Tregs合成并分泌[10]。Ebi3是Foxp3的下游靶点,COLLISON等[11]研究报道,将Tregs与效应性T淋巴细胞(Teffs)共培养时,Ebi3和IL-12a mRNA水平明显上调,表明后者可能是免疫调节过程的积极参与者,并促进了IL-35的产生,这也解释了Tregs表达IL-35的原因。反过来,IL-35的存在也会诱导T淋巴细胞向Tregs分化[18]。这种特殊的免疫调节作用使得IL-35被广泛应用于各种免疫性疾病与器官移植免疫排斥反应的治疗中[19-20]。作者前期分别利用大肠杆菌为肠道固有菌株及尾静脉注射的间充质干细胞易于在肺部滞留的特性,通过灌胃IL-35修饰的大肠杆菌治疗葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠溃疡性结肠炎,另通过尾静脉注射IL-35修饰的间充质干细胞治疗脂多糖(lipopolysaccharides,LPS)诱导的小鼠急性肺损伤,探讨IL-35表达在上述两种炎症模型中的应用。结果发现,IL-35的表达可减轻两种疾病小鼠体内炎性损伤及炎性细胞的浸润,促进Tregs增殖分泌,减少辅助性T淋巴细胞17(Th17)的数量[21-22],为炎症相关疾病的治疗提供了新的思路和方法。但现有的结果主要来自疾病模型,在没有抗原刺激的情况下IL-35是否会影响T淋巴细胞亚群的分化尚不明确,因此本研究对此进行探索。
本研究将一种可以在体内表达IL-35的载体(Ebi3和IL-12a融合基因表达载体)通过尾静脉注射到小鼠体内,观察IL-35表达对T淋巴细胞亚群分化的影响。72 h后取小鼠脾脏,RT-qPCR检测IL-35两个亚基Ebi3和IL-12a mRNA的表达水平。结果显示,pMSCV-IL-35组的小鼠脾脏Ebi3和IL-12a mRNA表达水平较PBS组、pMSCV组明显升高,说明在接受pMSCV-IL-35-GFP质粒的小鼠中可观察到Ebi3和IL-12p35的高表达。进一步通过流式细胞术检测表达的IL-35对小鼠脾脏T淋巴细胞(包括总CD4+、CD8+T淋巴细胞和CD4+CD25+Tregs)分型的影响,结果显示,与PBS组、pMSCV组相比,pMSCV-IL-35组小鼠CD4+T淋巴细胞百分比无明显变化,CD8+T淋巴细胞百分比明显降低,而CD4+CD25+Tregs百分比明显升高;另外,CD8+T淋巴细胞免疫功能分子Gzmb mRNA相对表达水平明显降低,而Tregs特异性转录因子Foxp3 mRNA相对表达水平明显升高。这说明表达产生的IL-35可以影响T淋巴细胞分化,一方面可抑制杀伤性T淋巴细胞的活性,另一方面可诱导Tregs产生。杀伤性T淋巴细胞是以CD8+分子为主要标记的一类Teffs,具有细胞毒活性[23-24];而Tregs则是以CD4+CD25+Foxp3+为主要特征且被研究者普遍认为具有免疫抑制特性的细胞亚群[6,25-26],提示IL-35对Teffs具有免疫抑制作用,而它的存在促进T淋巴细胞向Tregs方向分化[11]。IL-35的免疫抑制能力已经在部分疾病模型中得到了说明[27-30],这里列出的基于正常健康小鼠的数据可以在一定程度上帮助理解IL-35对正常机体的影响及潜在的疾病防治机制,并为IL-35基因应用于体内免疫治疗提供理论依据。但是,本研究是在正常动物中进行的,结果可能与病理条件下有所不同,如与PBS组相比,pMSCV组小鼠体内CD4+CD25+Tregs百分比一定程度增加,可能是由于外源性pMSCV质粒使小鼠产生了一定程度的免疫应激现象,并进一步激活了机体自身对免疫应答的调节功能,诱导了Tregs的分化。
综上所述,IL-35作为IL-12家族中发挥免疫抑制作用的细胞因子,其从正常及疾病状态下对免疫系统的调节潜能为炎症性疾病和免疫性疾病的治疗奠定了理论基础。但IL-35的受体及相应下游信号通路也暂未完全阐明,目前相关临床和基础研究的数据也十分有限,有待深入探究。
