PRC1在肝内胆管细胞癌中的表达与作用机制研究
2023-08-02戴龙飞
戴龙飞
(山东第一医科大学附属省立医院,山东 济南 250000)
胆管癌是仅次于肝细胞性肝癌的第二常见肝脏恶性肿瘤,过去几十年,其发病率不断上升[1]。大多数胆管癌患者早期无显著的临床症状,被发现时已属于晚期,失去了手术机会[2]。因此,探究胆管细胞癌的生物学特征,寻找新的预警分子,提高胆管癌患者的检出率尤为重要。细胞分裂失败导致非整倍体可能是导致肿瘤发展的一个重要因素。作为细胞分裂的重要调节因子,胞质分裂蛋白调节因子1(protein regulator of cytokinesis 1,PRC1)调节反平行微管交联,促进微管结构的形成,支持细胞形态和调节胞质分裂[3]。PRC1的表达失调促进了染色体的不稳定,在肿瘤的发生、发展中起重要作用[4]。目前,已有多项研究报道PRC1在肿瘤中表达升高,如肝癌[3]、胃癌[5]、结肠癌[6]、前列腺癌[7]和口腔鳞状细胞癌[8]等,且与患者的预后相关。然而,PRC1在肿瘤发生、发展中的分子机制,尤其是在胆管细胞癌中仍然知之甚少。在本研究中,首先探究了PRC1在正常胆管细胞与肝内胆管细胞癌中的表达情况,进一步研究了PRC1在肝内胆管细胞癌中对其生物学功能的影响,并探讨其可能的分子机制。
1 材料与方法
1.1 细胞培养和转染 ICC细胞系(CCLP-1)来自卫生部多器官联合移植重点实验室的馈赠,并在含10%胎牛血清(Gibco,USA)和青霉素/链霉素的1640完全培养基中培养。小干扰RNA的转染是将细胞接种在生长至40%的6孔组织培养板上。第2天,使用Lipofectamine 2000试剂(Invitrogen)根据制造商的说明书用靶向人PRC1或对照 siRNA(OriGene,USA)的100 nmol/L siRNA转染细胞。对于PRC1的siRNA 的靶编码序列为5'AGCGCUGCAAUUAGAAGUGGAUCGG 3'和5'CCGAUCCACUUCUAAUUGCAGCGCU 3'。所有患者均知情同意,患者均签署知情同意书,本研究已获得我院伦理委员会的批准。
1.2 蛋白质印迹分析 培养细胞后,将其裂解并超声处理以获得可溶性蛋白裂解物。蛋白质浓度采用Bradford法(Bio-Rad)测定。将等量的蛋白加入到10% NuPAGE Bis-Tris凝胶(Invitrogen)上并进行电泳。然后,将裂解物转移到PVDF膜上(根据目标蛋白的分子量不同,转膜时间60~90 min)。用5%脱脂牛奶封闭细胞膜后,将其与相关一抗在4 ℃下孵育过夜。用含有0.05%TWEEN-20的Tris 缓冲盐水洗涤膜3次,每次洗涤10 min,用 SuperSignal West Pico 化学发光底物(Pierce)检测信号。使用 Wayne Rasband(National Institutes of Health,Bethesda,MD,USA)的 ImageJ 1.44软件对波段信号进行量化。使用 GAPDH 作为加载对照。
1.3 免疫组化 将ICC患者的石蜡包埋组织标本切成4 μm厚的切片。切片在二甲苯中脱石蜡,并在一系列分级酒精稀释液中再水化。所有切片均用微波炉加热进行抗原修复。然后将切片与3% H2O2孵育10 min,10%正常山羊血清在室温下孵育15 min,以阻断内源性过氧化物酶和非特异性抗原。使用以下一抗在4 ℃下对组织切片进行免疫染色:抗PRC1抗体(H70)(1∶50,santa cruz)。用 PBS冲洗3次后,将切片与辣根过氧化物酶标记的第二抗体在室温下孵育30 min。最后用3,3-二氨基联苯胺(DAB)观察颜色的发展,然后用苏木精复染切片。同时,研究小组的两位独立研究者使用 ImagePro Plus 6.0软件评估免疫反应密度,且对病理数据不知情。石蜡切片半定量评分如下:0级,0%免疫反应细胞;1级,≤10%免疫反应细胞;2级,>10%~50%免疫反应细胞;3级,≥50免疫反应细胞。为了统计学的目的,0级和1级的病例被分类为低表达,而2级和3级的病例被分类为高表达。
1.4 细胞增殖能力测定 对于增殖测定,首先将ICC细胞以1 000个细胞/孔接种于96孔板中,通过细胞计数试剂盒(CCK-8,Dojindo)来测定细胞活力和生长,根据制造商的说明书在450 nm处读取吸光度。EdU细胞增殖检测根据试剂商说明书来操作(锐博生物),并在荧光显微镜下测定。
1.5 Transwell迁移和侵袭实验 根据制造商的说明,在 BD Falcon 24孔插入系统(BD Biosciences,San Jose,CA)中进行迁移和侵入测定。对于迁移测定,将无血清培养基中的细胞接种在上腔中,并且没有包被膜。对于侵袭测定,用35 μL含有基质胶(BD Biosciences,USA)和 RPMI 1640的溶液以1∶7的比例预涂覆过滤器2 h。2个实验均将5×104个ICC细胞接种于上室,下室加入含10% FBS 的培养基。细胞培养24 h(迁移试验)和48 h(侵袭试验)。非迁移性或非侵袭性细胞从过滤器上表面移除。用Wright-Giemsa染色试剂盒(南京建成生物工程研究所,中国)对膜下表面的细胞进行染色。在光学显微镜下计数细胞数目。每个实验至少重复3次。
1.6 细胞凋亡检测 细胞凋亡是用Annexin V来测定的。细胞死亡的百分比计算为总细胞群中Annexin V阳性/碘化丙啶(PI)阴性细胞(经历细胞凋亡的早期阶段)和Annexin V 阳性/碘化丙啶阳性(经历细胞凋亡的晚期阶段)的百分比的总和。细胞在6孔板上培养24 h后,加入顺铂1.5 μg/mL来诱导细胞凋亡,用Annexin V/PI流式细胞术检测细胞凋亡。
1.7 统计学分析 采用SPSS 25.0软件(SPSS)进行统计学分析。两组之间的差异采用t检验进行检验。P<0.05提示差异有统计学意义。
2 结果
2.1 PRC1在人ICC组织中表达升高 为探讨PRC1在ICC中的表达,研究通过免疫组织化学测量了30对ICC和非癌组织中的PRC1表达,结果显示与相邻胆管组织中的表达相比,ICC肿瘤中的PRC1表达上调(图1)。与邻近组织相比,共有73.3%(22/30)的肿瘤组织显示PRC1呈过表达。

图1 PRC1在肝内胆管细胞癌组织中表达升高。免疫组织化学染色(IHC)检测30例肝内胆管细胞癌和癌旁组织中PRC1的表达(红色箭头指向正常胆管)
2.2 敲低PRC1后抑制ICC细胞的增殖 为了进一步探究PRC1在ICC细胞中的生物学功能,本研究用小干扰RNA敲低了PRC1的表达,而Westernblot证实本研究敲低PRC1成功(图2A)。接下来用CCK-8法检测了细胞的增殖情况,结果显示,敲低PRC1后,会抑制CCLP-1细胞的增殖(图2B)。通过EdU检测试剂盒进一步验证PRC1对增殖的影响,结果同样显示,敲低PRC1后,会抑制CCLP-1细胞的增殖(图2C)。

图2 敲低PRC1会抑制肝内胆管细胞癌的表达
2.3 敲低PRC1后抑制ICC细胞的迁移和侵袭 转移也是肿瘤进展的重要因素,远处转移可严重影响患者的预后。因此,本文研究了敲低PRC1对ICC细胞侵袭和迁移能力的影响。Transwell测定的结果显示敲低PRC1后抑制了CCLP-1细胞的侵袭和迁移能力(二者均P<0.05,图3)。
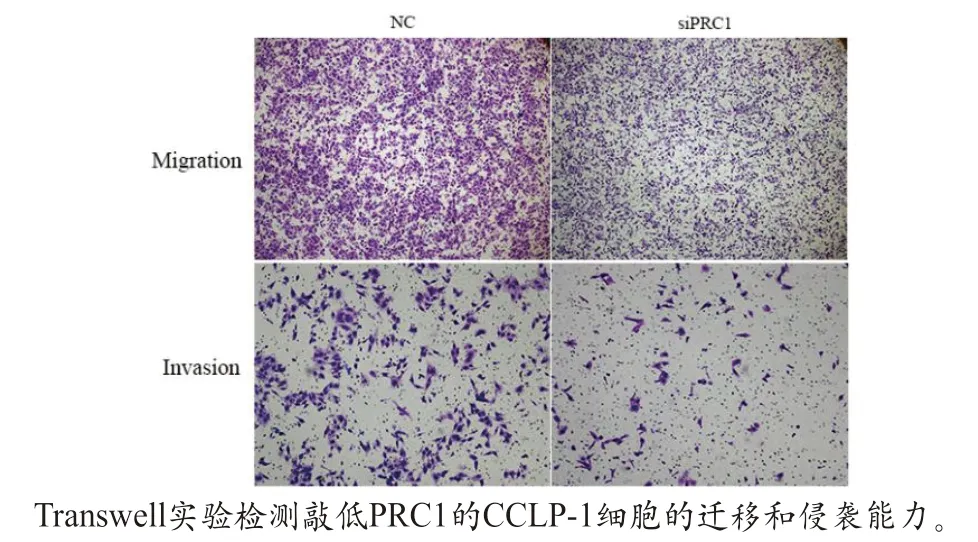
图3 敲低PRC1会抑制肝内胆管细胞癌的迁移和侵袭
2.4 敲低PRC1后ICC细胞的凋亡增加及凋亡相关蛋白表达改变情况 为了进一步探究PRC1影响增殖的原因,本研究使用Annexin V-FITC/PI细胞凋亡检测试剂盒通过流式细胞仪检测了CCLP-1的凋亡情况。结果显示,敲低PRC1后,ICC细胞的凋亡增加(图4A)。而对凋亡相关蛋白的测定发现,敲低PRC1后,活化的cle-caspase8、cle-caspase9与BAX表达升高(图4B)。

图4 敲低PRC1会促进肝内胆管细胞癌的凋亡
3 讨 论
肝内胆管细胞癌(ICC)是肝脏第二原发肿瘤,且近年来发病率逐年升高,其与多种胆道或肝脏疾病有关,如原发性硬化性胆管炎、卡罗里病、肝内胆管结石、乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、肝吸虫感染、炎症性肠病、暴露于有机溶剂等。此外,肥胖、非酒精性脂肪肝和非酒精性脂肪性肝炎可能是导致其发病率不断上升的原因[9]。ICC患者的临床症状往往是非特异性的,大部分患者在发现时已处于肿瘤晚期,仅有约20%的ICC患者尚有手术的可能,并且术后5年的生存率仅为30%[10]。因此,寻找新的肿瘤标志物,提高ICC患者的检出率,探究肝内胆管细胞癌的作用机制,制定有效的诊断和治疗策略尤为重要。
众所周知,适当的胞质分裂是基因组稳定所必需的,而胞质分裂失败可能导致染色体的非整倍体出现而促进癌症发展[11]。PRC1对胞质分裂和正常细胞分裂至关重要。PRC1是细胞裂解所必需的有丝分裂纺锤体相关微管结合蛋白,PRC1失调导致胞质分裂缺陷,从而促进染色体不稳定性,进而促进肿瘤异质性和癌症进化[12]。PRC1在多种肿瘤中被证实存在表达异常,并且与预后相关。最新的研究发现,PRC1的表达异常与肝细胞肝癌的临床分期相关,PRC1的表达升高预示着患者的预后更差[13]。而本文研究发现,在肝内胆管细胞癌中,PRC1表达较癌旁的正常组织升高,提示其可能在ICC发生、发展中发挥作用。因此本研究推测,进一步探讨PRC1在ICC发生、发展中的作用及具体机制有重要的临床意义。
Xu等[5]发现,沉默PRC1可抑制结肠癌细胞的活力,并促进结肠癌细胞凋亡。Liu等[14]研究表明,降低PRC1表达可抑制肝癌细胞增殖,并通过p53通路增强肝癌细胞对紫杉醇的敏感性。Zhang等[6]研究发现,PRC1在胃癌组织中异常表达,并与胃癌患者的预后相关。敲低PRC1促进细胞周期阻滞和凋亡,阻碍胃癌细胞的迁移和侵袭。本研究结果发现,敲低PRC1的表达后,会抑制ICC细胞的增殖、迁移与侵袭,并增加细胞的凋亡。为进一步探究其对细胞凋亡的影响,本文又研究了凋亡相关蛋白的表达。
细胞凋亡是第一个被发现的程序性细胞死亡过程,在肿瘤的化学治疗中已被广泛研究[15]。细胞凋亡是一种程序性的细胞死亡,在基因水平上受到精细调控,细胞凋亡的机制是复杂的,涉及许多信号通路。细胞凋亡可以通过caspase介导的外在途径或内在途径触发。这两种途径汇聚在一起激活效应因子凋亡caspases,最终导致细胞形态和生化发生改变[16]本研究发现,敲低PRC1后,会使凋亡启动因子即活化的cle-caspase8和cle-caspase9升高,同时促凋亡蛋白 BAX的表达也升高。这些研究发现,PRC1参与了ICC的凋亡过程,从而影响了肿瘤细胞的活性。
总之,本研究表明PRC1在肝内胆管细胞癌中表达升高,并且PRC1能够促进肝内胆管细胞癌的增殖,促进ICC的迁移和侵袭。同时,敲低PRC1后会促进ICC的凋亡。因此,本研究推测PRC1通过抑制ICC细胞的凋亡进而影响肿瘤细胞的活性。因此,PRC1的表达可能为提高ICC患者的检出率提供一个新的可能。
