肝癌细胞DNA损伤时三结构域蛋白28磷酸化对肝癌细胞生存能力的影响
2023-08-02戴庆福王玉霞曹慧敏
戴庆福 王玉霞 曹慧敏
(福建医科大学附属龙岩第一医院检验科,福建 龙岩 364000)
肝癌是最常见的恶性肿瘤之一,病死率极高。有研究表明,全球每年至少有610 000死亡病例,而其中约半数病例发生在中国[1]。因此,研究肝癌发生、发展和药物作用过程中的分子机制以进一步认识此类肿瘤,发展针对肝癌的早期诊断技术以有效提高患者生存率具有十分重要的现实意义[2]。肿瘤的发生、发展是多种生物活性分子共同作用的结果。这些重要的活性分子既包括DNA、RNA、蛋白质等生物大分子,又包括各种金属离子、自由基、激素等各种小分子。在肝癌发生、发展和浸润转移过程中,细胞内这些物质或者相互转化,或者相互影响、协同作用,共同参与细胞内各种化学反应和信号通路[3]。另外,当存在某些外界刺激或药物作用时,多种分子参与的信号通路会被抑制甚至阻断,或者产生新的信号通路,进而导致肿瘤细胞功能损伤乃至凋亡[4]。在多种肿瘤的发生、发展及预后中,三结构域蛋白28(Trim28)磷酸化发挥着极为重要的作用[5]。有研究表明[6],细胞异染色质DNA损伤修复和Trim28磷酸化相关,这一特性会将一些肿瘤对化疗的敏感性降低。本研究探讨了Trim28磷酸化在肝癌细胞DNA损伤时对肝癌细胞生存能力的影响,现将结果报道如下。
1 材料与方法
1.1 材料 购买美国Biolegend公司生产的鼠β-肌动蛋白(β-actin)单克隆抗体、鼠Trim 28单克隆抗体以及鼠Trim 28 phosphorylase S473单克隆抗体,美国Arigobio公司生产的辣根过氧化物酶(HRP)羊抗鼠多克隆IgG,上海Absin公司生产的SB203580,广州安邦生物公司生产的其他主要试剂及材料,美国Spectrolinker公司生产的紫外交联仪×11000,美国Biotek公司生产的酶标仪。
1.2 方法
1.2.1 细胞培养 依据处理措施分为对照组、sb203580组、UV组、sb203580+UV组4组。购买武汉普诺赛公司生产的人肝癌Hepg2细胞,细胞使用德国赛默飞公司生产的0.5%双抗+10%胎牛血清+RPMI1640培养基配置成的培养液,置于二氧化碳温箱中进行培养(条件:37 ℃、5%),细胞密度达90%时消化道离心传代,消化过程中将0.25%胰酶充分利用起来。
1.2.2 Western blot试验
1.2.2.1 分组 将4组细胞随机设置出来,在6 cm2培养皿中使各组细胞生长融合达90%以上,将3组细胞随机选取出来,在100 μJ/cm2紫外线下放置照射,照射后2 h、12 h、24 h分别将细胞蛋白提取出来。另将对照组设置出来,仅将细胞蛋白提取出来,并不做任何处理。
1.2.2.2 处理 在6 cm2培养皿中sb203580+UV组Hepg2细胞生长融合达90%以上时,将含10 μmol/L sb203580培养液加入试验组细胞中,在37 ℃的温度下孵育1 h,然后和UV组细胞在100 μJ/cm2紫外线下同时放置照射,将10 μmol/L sb203580培养液加入sb203580+UV组细胞,将正常培养液加入UV组细胞,在37 ℃的温度下继续孵育2 h后将蛋白提取出来。另将对照组细胞设置出来,不做任何处理,相同孵育时间后将蛋白提取出来。
1.2.2.3 蛋白提取 对细胞滴注RIPA裂解液进行裂解,用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白质量浓度;同时采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)仪进行分离、转膜,并于室温下用5%的牛血清白蛋白(BSA)封闭1 h,之后在4 ℃温度下孵育1∶500鼠β-actin单克隆抗体、1∶500鼠Trim 28 phosphorylase S473单克隆抗体、1∶1 000鼠Trim 28单克隆抗体过夜。常规洗膜后加入RP标记的羊抗鼠免疫球蛋白二抗(1∶5 000稀释),室温下孵育2 h。用增强型化学发光试剂(ECL)试剂盒对蛋白显色。
1.2.2.4 图像分析 采用Image J软件进行蛋白表达量的半定量检测分析,用灰度值表示,并计算目的蛋白的相对表达水平,即目的蛋白灰度值与内参蛋白灰度值的比值,重复3次。
1.2.3 MTT试验
1.2.3.1 细胞培养 种板6 cm2培养皿中细胞生长融合达90%时常规消化,离心3 min,半径、速率分别为16 cm、1 000 r/min,计数细胞。依据计数结果,在96孔板上接种悬液,每孔200 μL,细胞数为4 000个左右。
1.2.3.2 细胞处理 细胞贴壁后1 d处理细胞,组别的划分与Western blot试验相同,依据处理措施分为对照组、sb203580组、UV组、sb203580+UV组4组,每组6孔,分别不做处理、将含10 μmol/L sb203580培养液加入、10 μJ/cm2紫外线照射处理、将含10 μmol/L sb203580培养液加入并10 μJ/cm2紫外线照射处理。
1.2.3.3 细胞生存率 处理后1 d、2 d、3 d分别将MTT加入到各组细胞中,孵育4 h后将二甲基亚砜(DMSO)加入,每孔100 μL。采用酶标仪对各孔570 nm波长处吸光度(A)值进行测定。比较对照组和sb203580组同时间点的A值,细胞生存率=UA组和sb203580+UV组与对照组A值比值。
1.4 统计学分析 采用SPSS 21.0对数据进行处理,计量资料(符合正态分布)用()来描述,组间行t检验,P<0.05有统计学意义。
2 结果
2.1 紫外线照射Hepg2细胞后不同时间点p-Trim28表达比较 UV组紫外线照射Hepg2细胞后2 h、12 h、24 h的p-Trim28表达逐渐降低(P<0.05),照射后2 h、12 h的p-Trim28表达量均高于对照组(P<0.05),但照射后24 h的p-Trim28表达量和对照组之间的差异不显著(P>0.05)。见表1。
表1 紫外线照射Hepg2细胞后不同时间点p-Trim28表达比较()

表1 紫外线照射Hepg2细胞后不同时间点p-Trim28表达比较()
2.2 不同处理条件下Trim28表达比较 对照组、UV组和sb203580+UV组Trim28表达量之间的差异均不显著(P>0.05)。见表2。
表2 不同处理条件下Trim28表达比较()
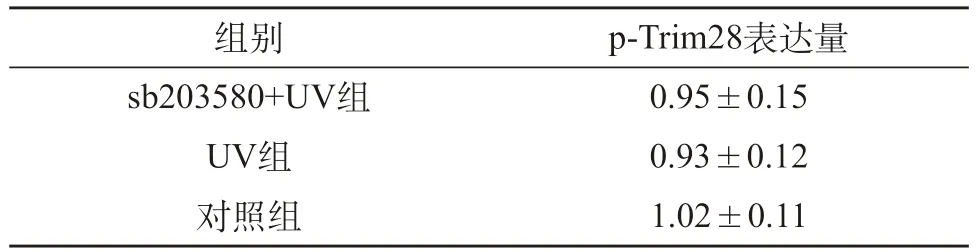
表2 不同处理条件下Trim28表达比较()
2.3 不同处理条件下p-Trim28(ser473)表达比较 UV组p-Trim28(ser473)表达量高于sb203580+UV组、对照组(P<0.05),但sb203580+UV组、对照组p-Trim28(ser473)表达量之间的差异不显著(P>0.05)。见表3。
表3 不同处理条件下p-Trim28(ser473)表达比较()

表3 不同处理条件下p-Trim28(ser473)表达比较()
2.4 Trim28(ser473)磷酸化在Hepg2细胞DNA损伤时对细胞生存能力的影响分析 sb203580组、对照组处理后1 d、2 d、3 d的A值均逐渐升高(P<0.05);处理后1 d、2 d、3 d,sb203580组、对照组A值之间的差异均不显著(P>0.05)。sb203580+UV组、UV组照射后1 d、2 d、3 d的细胞存活率均逐渐降低(P<0.05);照射后1 d、2 d、3 d,sb203580+UV组细胞存活率均低于UV组(P<0.05)。见表4、表5。
表4 sb203580对细胞生存能力的影响分析()

表4 sb203580对细胞生存能力的影响分析()
表5 sb203580抑制Trim28(ser473)磷酸化在Hepg2细胞DNA损伤时对细胞存活率的影响分析()

表5 sb203580抑制Trim28(ser473)磷酸化在Hepg2细胞DNA损伤时对细胞存活率的影响分析()
3 讨 论
目前,细胞内活性分子的检测很多是基于细胞匀浆,这种检测不能得到分子在细胞内的空间信息,而且在进行多组测定时无法针对同一个样品或者同一个细胞,因此同一生物过程中多种分子之间精准的关联会被群体细胞的平均信息所掩盖。活细胞荧光成像技术为观察及认识细胞内多种活性分子参与的生物过程提供了重要工具。它可以实时原位的观察细胞内某一分子的含量、分布及其随时间的变化。如果对细胞内多种生物分子实现同时荧光标记和成像,不仅能对细胞异质性有所认识,更重要的是可以在同一细胞内对多种分子的相互作用进行研究,进而获取群体细胞研究所掩盖的真实精准的多分子间关联信息[7]。针对细胞内多种生物分子荧光标记,研究人员已设计开发了多种多样的荧光探针,如基于靶标识别产生荧光信号变化的有机小分子探针已被广泛用于细胞内活性氧簇、金属离子、巯基化合物、NO和H2S等气体分子的荧光成像;基于基因转染技术的多色荧光蛋白被用于细胞内蛋白质的标记和成像研究,该技术也因其对化学、生物学和医学研究的卓越贡献而获得了2008年的诺贝尔化学奖;此外,基于纳米材料和多种组装技术的纳米荧光探针因为其优异的发光性能和灵活多样的组装形式也被广泛应用于细胞内分子的标记和荧光检测。这些探针通过与靶标分子的特异性作用,不断点亮细胞内的各种分子,使研究者看见了大量分子在细胞内的含量和时空变化,并且不断认识了它们的生物功能[8]。然而,不管是对肝癌细胞内信号通路研究还是对其进行早期诊断,所涉及的多种生物分子浓度差异很大,当研究者用这些探针直接标记含量较低的分子时,发现所得到的荧光信号往往很弱或者难以与背景区分。当某种条件下这些分子浓度产生下调时,就更加难以获取它们的荧光信号[9]。因此,发展基于信号放大的肝癌细胞内多种活性分子同时高灵敏荧光成像方法具有十分重要的意义。
以DNA与目标分子的特异性相互作用构建生物分子的检测方法已得到国内外研究人员的广泛关注和研究。此类方法可通过DNA碱基互补反应、序列切割及构型变换等实现多种类型生物分子的特异性识别[10]。如通过碱基互补原则设计可得到针对DNA、mRNA及miRNA的靶向探针,通过体外筛选技术(SELEX技术)可分别得到与不同蛋白质、肽、激素等分子特异性结合的核酸适配体Aptamer或对金属离子特异性识别的DNAzyme;利用细胞内某些离子可引发特定DNA产生构型变化。以此为基础,通过对DNA探针的进一步改造,使其除了能对目标分子实现靶向识别外,还能够参与后续各种DNA扩增反应如滚环扩增(RCA),杂交链式反应(HCR)等。这些反应可以使目标分子信号产生线性或者指数放大,提高检测的灵敏度。由此可以看出,DNA探针和以此为基础的各种DNA扩增反应用于细胞内多种类型生物分子的特异性识别、信号放大具有很大的优势和潜力[11]。但是目前此类信号扩增的检测方法大多是基于细胞匀浆的检测,而在活细胞水平上进行生物分子成像的研究则报道较少。这主要是因为链状结构的DNA难以直接被细胞摄取,而且一些DNA的扩增反应涉及很多酶类分子,这些大分子也很难以直接进入细胞,造成细胞对探针的有效摄取困难;另外,即使探针能够借助某些方法进入细胞,探针的细胞穿膜过程及定位,探针在细胞内稳定性和传感过程是否对细胞功能造成损伤等问题仍需详细探究;当对细胞内多组分进行成像时,多个荧光信号光谱分辨问题及其输出时间、强度差异性问题也是目前面临的重大挑战[12]。因此,针对以上问题和挑战,构建新型的基于DNA扩增反应的细胞内生物分子信号放大和多组分同时荧光成像新方法,在活细胞水平上监控肝癌细胞内多种生物分子尤其是低浓度生物分子的浓度、时空变化和相互关联信息,对进一步研究此类疾病发生、发展的信号通路,药物治疗相关的分子机制以及进行精准的早期诊疗具有重要的应用价值。
有文献显示,Trim28的过度表达与肝癌的发生发展密切相关[13]。目前,临床还没有完全弄清楚其机制[14]。Trim28是一种促癌因子,其异染色质蛋白(HP1)结合域正常情况下可结合异染色质,并形成异染色体固缩状态,有利于保持基因组及转录的稳定性,在细胞DNA双链损伤时,ser473(在HP1结合域分布)磷酸化会在激酶及ATM/Chkl/Chk2、p38/丝裂原活化蛋白激酶(MAPK)/MK2等因子作用下松解异染色质,暴露受损的DNA双链,ATM对TopBP1、BRCA1等DNA修复蛋白进行招募,修复DNA损伤,如在黑素瘤中MAGE C2和Trim28蛋白复合物形成,引发Trim28磷酸化,进而对凋亡的肿瘤细胞进行修复,从而为肿瘤发展提供有利条件[15]。本研究结果表明,UV组紫外线照射Hepg2细胞后2 h、12 h、24 h的p-Trim28表达逐渐降低,照射后2 h、12 h的p-Trim28表达量均高于对照组。UV组p-Trim28(ser473)表达量高于sb203580+UV组、对照组。sb203580组、对照组处理后1 d、2 d、3 d的A值均逐渐升高。sb203580+UV组、UV组照射后1 d、2 d、3 d的细胞存活率均逐渐降低;照射后1 d、2 d、3 d,sb203580+UV组细胞存活率均低于UV组,说明在肝癌细胞DNA损伤修复过程中,Trim28磷酸化可能参与其中,从而降低肝癌细胞对DNA损伤的敏感性。证实Trim28(set473)磷酸化在肝癌细胞Hep92细胞DNA损伤的情况下可能在DNA损伤修复中介入,对其进行抑制能够将细胞的生存率进一步降低。
综上所述,对Trim28磷酸化进行抑制,在肝癌细胞DNA损伤时可降低肝癌细胞的生存能力,值得重视。
