松油烯-4-醇与α-红没药醇对金黄色葡萄球菌和痤疮丙酸杆菌协同抑菌作用研究
2023-08-01孟昭成王丽欣吕雅琳江水李振兴陈官芝
孟昭成 王丽欣 吕雅琳 江水 李振兴 陈官芝
(1 青岛大学附属医院皮肤科,山东 青岛 266003; 2 中国海洋大学食品安全实验室)
金黄色葡萄球菌(S.aureus)是人类皮肤细菌感染的主要致病菌[1-3],痤疮丙酸杆菌(C.acnes)与痤疮发病机制的多个环节密切相关[4]。目前治疗细菌感染的常规方法是使用抗生素,但随着细菌对抗生素耐药性的增加[5],抗生素的替代治疗逐渐引起临床上的重视。植物精油提取自芳香植物中,具有抗菌、抗炎、抗病毒等药理活性,其抗菌特性不易导致细菌耐药,在特定领域具有替代抗生素的潜力[6]。松油烯-4-醇(T4O)为茶树油的主要化合物,在茶树油中的含量占比超过35%,具有很强的抗菌和抗炎活性,是茶树油治疗寻常痤疮的重要作用成分[7-9]。α-红没药醇(Bis)最初提取于洋甘菊中,因其具有舒缓皮肤作用,被应用到许多化妆品配方中[10]。此外,Bis还具有抗炎及促进伤口愈合的作用[11],以及与抗生素诺氟沙星联合治疗S.aureus感染时具有协同作用[12]。目前T4O和Bis均被应用在皮肤外用制剂中,但有关T4O、Bis联用的抑菌作用则未见报道。本研究通过测定T4O、Bis联用对S.aureus及C.acnes的抑菌作用,为开发新型抑菌产品成分配方提供理论基础。
1 材料与方法
1.1 主要试剂与仪器
T4O购自上海皓鸿生物医药科技有限公司,Bis购自上海麦克林生化科技有限公司,吐温80、2,3,5-三苯基四氮唑购自北京索莱宝有限公司,盐酸米诺环素购买于浙江海正辉瑞制药有限公司,金黄色葡萄球菌(ATCC 43300)、痤疮丙酸杆菌(ATCC 11827)购自北纳创联生物技术有限公司,MH肉汤培养基(MHB)、营养琼脂培养基、液体硫乙醇酸盐培养基(FT)、哥伦比亚血平板购自青岛海博生物有限公司。
Sigma3K15离心机购自曦玛离心机(上海)有限公司,Zetasizer Nano ZS90纳米粒度电位仪购自英国Malvern公司,NanoDropTMOne微量UV-Vis分光光度计、全自动酶标仪购自美国赛默飞公司。
1.2 S.aureus和C.acnes的培养
将S.aureus菌液在营养琼脂培养基上画线接种,于37 ℃恒温箱中过夜培养,挑取单菌落至装有MHB的试管中,37 ℃下于200 r/min的摇床中培养至对数生长期以后备用。将C.acnes菌液在哥伦比亚血平板上画线接种,37 ℃下于厌氧箱中培养48 h,挑取单菌落至装有FT的试管中, 37 ℃下于厌氧箱中静置培养至对数生长期后备用。
1.3 T4O与Bis对两种实验菌株的最小抑菌浓度(MIC)的测定和部分抑菌浓度指数(FICI)的计算
将对数生长期的两种细菌用MHB(S.aureus)和FT(C.acnes)分别稀释为浓度每升约1×109个菌落形成单位(CFU)的菌悬液。参考BELLIO等[13]的方法,在无菌96微孔板中用MHB将Bis从1~11列进行二倍梯度稀释,每孔溶液体积为100 μL,使质量浓度分别达到25.00、12.50、6.25、3.12、1.56、0.78、0.39、0.20、0.10、0.05和0.02 g/L;用MHB将T4O从A~G行进行二倍梯度稀释,使终质量浓度达到10.00、5.00、2.50、1.25、0.62、0.31和0.16 g/L;在上述各孔中添加100 μLS.aureus悬液,于37 ℃恒温静置培养24 h。另外取一块无菌96微孔板重复上述操作,在各孔中添加100 μLC.acnes悬液,37 ℃下于恒温静置厌氧培养48 h。在上述浓度梯度中,肉眼可观察到的无实验菌株生长的最低药物浓度即为MIC。将0.2 mg/g盐酸米诺环素作为质控药物,重复上述操作,实验菌株的MIC在0.05~0.20 mg/L之间,则认为上述实验测定结果可信。采用FICI判断T4O与Bis联用的效果,其计算方法为FICI=MICT4O(联用)/MICT4O(单用)+MICBis(联用)/MICBis(单用)。FICI≤0.5为协同作用,0.5~1为相加作用,1~4为无相互作用,≥4为拮抗作用[14]。
1.4 绘制T4O与Bis联用对两种实验菌株时间-杀菌曲线
将对数生长阶段的S.aureus用MHB稀释至1×109CFU/L,取15 mL菌液4 ℃ 6 000 r/min离心10 min,去除上清液以后加入12 mL MHB并吹打均匀,分别平均分装至3个无菌试管中,标记为MIC1、2×MIC1及阴性对照1组。另取对数生长阶段的C.acnes以FT稀释至1×109CFU/L后重复上述操作。于S.aureus的MIC1组试管中加入3.13 mg T4O及1 mg Bis,2×MIC1组试管中加入6.25 mg T4O及1 mg Bis;于C.acnes的MIC1组试管中加入1.56 mg T4O及1 mg Bis,2×MIC1组试管中加入3.13 mg T4O及1 mg Bis;两种菌株的阴性对照1组中均加入7.2 μL生理盐水。最后所有组中各加入50 μL吐温80,再用每种菌株对应的培养基补充至总体积均为5 mL,充分振荡混匀。S.aureus的各组在37 ℃下于200 r/min摇床中培养,C.acnes各组37 ℃下于厌氧箱中静置培养,每2 h以平板涂布计数法测量一次CFU,观察24 h并绘制时间-杀菌曲线。实验重复3次,数据取均值。
1.5 T4O与Bis联用对两种实验菌株表面Zeta电位(ZP)的影响
将对数生长阶段的两种菌悬液用MHB(S.aureus)和FT(C.acnes)稀释至1×109CFU/L,使用1.4中方法进行分组,每种菌株均分为MIC2、2×MIC2及阴性对照2组,4 h后每组分别取1 mL菌液,于4 ℃下6 500 r/min离心15 min后。收集菌体用无菌PBS重悬、洗涤2次,用Zetasizer Nano ZS90纳米粒度电位仪检测两种实验菌株表面ZP。
1.6 T4O与Bis联用对两种实验菌株细胞内核酸和蛋白质泄漏的影响
将1.5中各组培养4 h后的两种菌株分别取1 mL,于4 ℃下6 500 r/min离心5 min,取上清液,使用微量UV-Vis分光光度计测定各组上清液在波长260、280 nm处的吸光度(A)值,分别代表菌株细胞内核酸及蛋白质的含量。
1.7 T4O与Bis联用对S.aureus呼吸链脱氢酶活性的影响
参考NING等[15]的方法检测呼吸链脱氢酶活性。按1.4中方法制备S.aureus的MIC3、2×MIC3及阴性对照3组的菌液,每组取2 mL菌液后均依次加入0.05 mol/L pH 8.6的Tris-HCl缓冲液以及0.1 mol/L葡萄糖溶液和1 g/L 2,3,5-三苯基四氮唑溶液各4 mL, 37 ℃下于200 r/min摇床振荡4 h后,各组中均加入200 μL浓硫酸终止反应;最后均加入5 mL正丁醇混匀,静置5 min后6 500 r/min离心5 min,取上清液。使用酶标仪测定各组上清液在波长490 nm处吸光度值;吸光度值越高,代表S.aureus呼吸链脱氢酶的活性越高。
1.8 透射电镜观察T4O与Bis联用对两种实验菌株形态的影响
将1.5中各组培养4 h后的两种菌株分别取1 mL,于4 ℃下以6 500 r/min离心5 min,用无菌PBS洗涤菌体2次,后加入1 mL 25 g/L的戊二醛固定,置于4 ℃冰箱6 h后,使用负染法染色,用透射电镜观察菌株形态并拍照。
1.9 T4O与Bis联用对两种实验菌株细菌生物膜的破坏作用
将对数生长阶段的两种菌悬液分别加到两块无菌96微孔板的1~3列中,每孔200 μL,S.aureus在37 ℃下于培养箱中静置培养72 h后,C.acnes在37 ℃下于厌氧培养箱中静置培养96 h后,仔细去除菌液后冲洗培养孔3次,去除多余的水分。将T4O与Bis用质量浓度5 g/L的吐温80-生理盐水缓冲液按1.4中方法配置,每种菌株均分为MIC4、2×MIC4及阴性对照4组,将各组分别加至上述1~3列微孔中,每孔200 μL, 37 ℃下于恒温培养箱中静置24 h。去除微孔中液体,生理盐水冲洗3次后室温干燥,向每孔中加入200 μL质量浓度0.1 g/L的结晶紫溶液,于室温下染色30 min后小心去除染色液并用蒸馏水清洗3次,37 ℃下放置30 min后加入200 μL无水乙醇,用酶标仪测定两板1~3列在波长595 nm处的吸光度值;吸光度值越高,代表微孔中残留生物膜越多。
1.10 统计学处理
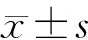
2 结 果
2.1 T4O与Bis单独及联用时对两种实验菌株的抗菌作用
T4O单独用药时对两种实验菌株的MIC均为2.5 g/L,联用时对S.aureus的MIC降至0.62 g/L,对C.acnes的MIC降至0.31 g/L;Bis单独用药时对两种实验菌株的MIC均>12.5 g/L,联用时对两种实验菌株的MIC降至0.39~1.56 g/L。T4O、Bis联用时对S.aureus和C.acnes的FICI值均<0.5,表明T4O与Bis联用对两种实验菌株表现为协同抑制作用。
2.2 T4O与Bis联用对两种实验菌株的抑制作用
双因素方差分析结果显示,组别(药物浓度)、时间、组别与时间交互作用对于S.aureus和C.acnes的抑制有明显影响(F组别=208.06、215.92,F时间=56.31、66.23,F组别*时间=63.52、76.15,P<0.01)。Tukey法结果显示,S.aureus自2 h时及其后各时间点的菌落浓度三组间比较均具有显著差异(F=25.56~598.17,P<0.05),C.acnes自2 h时及其后各时间点的菌落浓度三组间比较也具有显著差异(F=39.84~617.08,P<0.05)。见图1。
2.3 T4O与Bis联用时对两种实验菌株表面ZP的影响
S.aureus的MIC2、2×MIC2组和阴性对照2组菌株表面ZP分别为(-1.060±0.032)、(-1.167±0.072)、(-0.804±0.132)mV,三组间比较差异有显著性(F=26.57,P<0.01);C.acnes的MIC2、2×MIC2组以及阴性对照2组菌株表面的ZP分别为(-1.223±0.093)、(-1.360±0.185)、(-0.760±0.076)mV,三组间比较差异有显著性(F=18.29,P<0.05)。
2.4 T4O与Bis联用对实验菌株细胞内核酸及蛋白类泄漏的影响
S.aureus的MIC2、2×MIC2组和阴性对照2组A260值分别为0.990±0.147、1.157±0.092、0.687±0.087,A280值分别为1.270±0.076、1.340±0.070、0.963±0.040,三组间A260、A280值比较差异均有显著性(F=13.50、29.53,P<0.05);C.acnes的MIC2组以及2×MIC2组与阴性对照2组A260值分别为1.155±0.145、1.268±0.170、0.775±0.068,A280值分别为0.930±0.082、1.253±0.076、0.627±0.153,三组间A260、A280值差异均具有显著性(F=14.67、24.71,P<0.05)。
2.5 T4O与Bis联用对S.aureus呼吸链脱氢酶活性的影响
S.aureus的MIC3、2×MIC3组和阴性对照3组A490值分别为0.167±0.040、0.109±0.025、0.761±0.087,三组之间A490值比较差异具有显著性(F=120.80,P<0.01)。
2.6 透射电镜观察T4O与Bis联用对两种实验菌株形态的影响
S.aureus的阴性对照2组菌株可见细胞完整,胞质均匀;MIC2组处理4 h后,可见细菌细胞中央凹陷,颜色变淡,说明细胞膜遭到破坏,胞内物质外流。C.acnes的阴性对照2组菌株可见细胞完整,胞膜清晰;MIC2组处理4 h后,可见细菌细胞边界模糊,菌体粗细不均匀。见图2。

图2 经T4O和Bis联合处理的S.aureus及C.acnes透射电镜图像
2.7 T4O与Bis联用对于实验菌株生物膜的破坏作用
S.aureus的MIC4、2×MIC4组与阴性对照4组生物膜染色液A595值分别为0.272±0.032、0.229±0.023、0.426±0.037,三组间A595值进行比较差异有显著意义(F=44.41,P<0.01);C.acnes的MIC4、2×MIC4组与阴性对照4组生物膜染色液A595值分别为0.333±0.081、0.310±0.073、0.466±0.069,三组之间A595值进行比较差异具有显著性(F=5.12,P<0.05)。
3 讨 论
已有报道指出,T4O对S.aureus和C.acnes具有明确的抑制作用[16-18],文献关于T4O抗S.aureus作用的MIC为1.25~2.50 g/L[19],与本研究结果相符。本研究T4O与Bis联用时,T4O对S.aureus以及C.acnes的MIC分别为0.62、0.31 g/L。Bis为0.39、0.78、1.56 g/L三个浓度时对两种菌株均产生抑制作用,其余浓度对两种菌株均无抑制作用,因此Bis的MIC为0.39~1.56 g/L,即药物浓度过高或者过低均会降低两药的协同抑菌效果,并且Bis的抗炎作用也有类似的最佳浓度范围[20]。综合两种实验菌株的时间-杀菌曲线可发现,T4O与Bis联用时对两种菌株抑制效果与药物浓度呈现剂量依赖关系,二者在MIC时对两种实验菌均有抑菌及部分杀菌作用,2倍MIC时对C.acnes有完全杀菌作用,但不能完全杀灭S.aureus。虽然两药联用时2倍MIC的抑菌效果更佳,但是MIC也可提供长达24 h的持续抑菌作用,故本研究透射电镜只观察两药浓度为MIC时对两种细菌抑制作用的影响。
细菌表面电位是维持最佳细胞功能的关键物理特征,ZP测量技术可被视为计算细菌表面电位的间接工具。本研究发现,T4O与Bis联用通过降低两种实验菌的ZP发挥抑制作用,CUTRO等[21]同样发现精油能够降低细菌的ZP值。呼吸链是细菌能量代谢的重要环节,2,3,5-三苯基四氮唑可以与细菌中呼吸链脱氢酶发生还原反应,转变为最大吸收峰在波长490 nm处的红色物质,故认为A490值与呼吸链脱氢酶活性呈正相关[22]。且由于C.acnes为厌氧菌,体内缺乏呼吸链脱氢酶,故本研究仅针对S.aureus进行了呼吸链脱氢酶活性的检测。本研究结果显示MIC3组A490值较阴性对照3组显著降低,说明两药联用且浓度为MIC时即可抑制S.aureus呼吸链脱氢酶活性。
周静等[18]使用形态学观察法直观地发现T4O可使S.aureus及C.acnes干瘪皱缩、出现畸形,从而达到抑制作用。本研究通过透射电镜观察,发现T4O、Bis联用后两种菌体结构相对完整,但其内容物减少,结合MIC2组A260、A280值较阴性对照2组显著升高,说明MIC2组两种菌株细胞内核酸、蛋白泄漏增加,推测这种改变可能是由于细菌膜变得渗透性更高导致。使用结晶紫对微量滴定板孔内形成的生物膜染色是分析生物膜形成、抑制或根除的最常用定量方法,本研究中MIC4组A595值较阴性对照4组显著降低,表明对应的微孔内生物膜含量明显减少,可以推断两药联用且浓度为MIC时即可明显破坏两种细菌的生物膜。
目前研究发现,S.aureus及C.acnes抗药性的机制主要为发生基因突变和形成生物膜等[23]。本研究验证的T4O联合Bis的协同抗菌作用机制与其他植物精油单体成分的抑菌机制类似,均可破坏细菌细胞膜结构和生物膜,从而减少细菌耐药性的产生。本实验所用菌株S.aureus标准菌株ATCC 43300是耐甲氧西林的S.aureus,而C.acnes标准菌株ATCC 11827并非耐药株,并且缺少在临床患者皮损中分离耐药菌株的进一步验证,但从联用抑菌机制上推测,对临床分离的耐药株也应有类似的抑制作用。FORRER等[24]报道口臭相关的细菌摩尔梭杆菌对茶树油和Bis联用敏感,认为该化合物组合可以开发口腔保健产品。综上所述,本研究发现T4O与Bis联用的抑菌潜力,两者或有望成为针对皮肤S.aureus及C.acnes感染治疗产品的配方组合成分。
作者声明:孟昭成、李振兴、吕雅琳参与了研究设计;孟昭成、陈官芝、王丽欣、江水参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
