锂离子电池产气机制及基于电解液的抑制策略
2023-07-31蒋志敏李中凯马国强
徐 冲,徐 宁,蒋志敏,李中凯,胡 洋,严 红,马国强
(浙江省化工研究院有限公司,浙江 杭州 310023)
在“碳达峰”和“碳中和”的大背景下,我国能源革命又掀起了一波新的高潮。2022 年新能源乘用车渗透率已达27.6%,提前完成2025 年达到20%的目标;另一方面储能领域中电化学储能所占比例已达11.1%,这些均有赖锂离子电池的快速发展。然而,新能源汽车成本中电池的占比甚至高达50%以上,风能和光伏设备的寿命比储能电池长10 年,便携式设备在寒冷天气下的使用时长显著缩短等,这些都对锂电池的循环寿命、成本和使用温度提出了更高要求[1]。另一方面,近年来锂电池在不同应用领域中安全事故频发,使得锂离子电池的安全性也亟待提升[2-4]。
锂离子电池的寿命由电池容量衰减快慢所决定,而导致电池容量衰减的因素主要包括电池内部各材料之间的副反应[5]、电池结构设计[6]、制造工艺[7]和使用条件等。电解液与正负极材料之间的副反应是导致电池容量快速衰减的重要因素之一,在这个过程中会产生大量气体使得电解液在隔膜和正负极间浸润恶化,导致电池内部极化的急剧增加和容量的快速衰减[8-11]。另一方面,虽然施加适当外部压力可以促进锂离子均匀传输并增强层状石墨间隙的恢复能力,进而提高电池寿命[12],但由产气累积引发的电池内部受力不均,导致电池的容量损失和压力增长之间呈正相关[13]。此外,电池容量的衰减速度依赖于正负极与电解液之间固态电解质界面膜(SЕI)的稳定性,然而SЕI组成复杂且演化过程难以直接监测[14],通过对气体组分分析可以简单高效地研究电池中电极与电解液界面间的化学和电化学过程[15-17]。
锂离子电池的安全特性同样与电池内部产气密切相关。宏观上,充放电过程中由电解液分解产生的气体逐渐累积会使得电池内部压力增大甚至发生严重鼓胀,导致电池结构变形,当极片与隔膜发生错位会导致电池内部短路,产生大量热量导致电池温度迅速升高,引发热失控造成电池剧烈燃烧[10]。微观上,锂电池内部产生的气体在正负极之间的串扰反应也会释放大量热量,使得电池在未发生短路时便可积聚热量触发热失控,如正极释放的活性氧与嵌锂负极反应释放大量热[18],而负极产生的乙烯和乙烷等还原性气体与正极反应也会释放大量热[19]。目前针对动力电池的安全管理手段主要依赖于对电池外部温度和开路电压的实时检测,但在热失控初期阶段电池电压和外部温度变化较小,而针对电池内部温度和电化学交流阻抗的监控由于成本较高目前尚未进入商业化[20-21]。产气相对于电池外部温度和电压具有更短的响应时间,因而对电池产气的组分和数量进行监测成为一种更高效的电池安全监控手段[22-24]。
综上,研究电池产气行为不仅对提升电池寿命以及安全性能具有重要意义,还可以进一步揭示电池内部反应机理。目前商用锂离子电池常用的正极材料主要为镍钴锰酸锂(NCM)、钴酸锂(LCO)和磷酸铁锂(LFP),由于LFP 为橄榄石结构不易发生相变析氧。因而除了O2之外,基于上述3类正极材料的锂离子电池产生的气体种类和机制基本一致,本文不再分开论述。近年来与锂离子电池产气相关的报道主要聚焦于H2[24-26]、O2[27-28]、烯烃[29-30]、烷烃[30-32]、CO2[33-35]和CO[36]6 类气体。本文则系统讨论这6类气体在锂离子电池使用过程中的产生机制以及这些气体的产生与电池性能变化之间的关系。由于电解液是锂电池产气的主要源头,且通过正负极材料改性提升电池稳定性和抑制产气的研究已有大量综述报道,本文基于电解液视角提出了一些相应的抑制策略。
1 锂离子电池中主要气体的产生机制
锂离子电池在生产(化成、分容)和使用过程中(充放电、存储)通常伴随着多类气体的产生,以下将逐一讨论这些气体的产生机制。
1.1 H2的产生
H2作为电池产生的主要气体之一,主要来源于电池中水、电解液以及黏结剂的分解。
1.1.1 水的分解
由于电池内存在无法除尽的痕量水,当达到分解电势时,水分子在负极还原产生H2和OH-[式(1)][37]。
1.1.2 电解液中溶剂的分解
电池体系中引入的杂质水质量分数一般不高于0.01%,其分解产生H2的量也十分有限,然而在实际应用中,电池内检测到的H2含量却远高于水分解的理论值。
Metzger 等[25]报道了H2的另一主要来源,即电解液中的溶剂在正极表面氧化失去电子转化为质子化的溶剂(记为R-H+),随后扩散至负极表面被还原,此过程需要正负极共同作用,且与电池温度和电压相关[图1(a)、(b)]。Wang 等[38]则进一步发现该过程受到过渡金属的催化影响[图1(c)],3种过渡金属中Ni的催化活性最高,因而高镍正极材料体系导致了更严峻的产气。

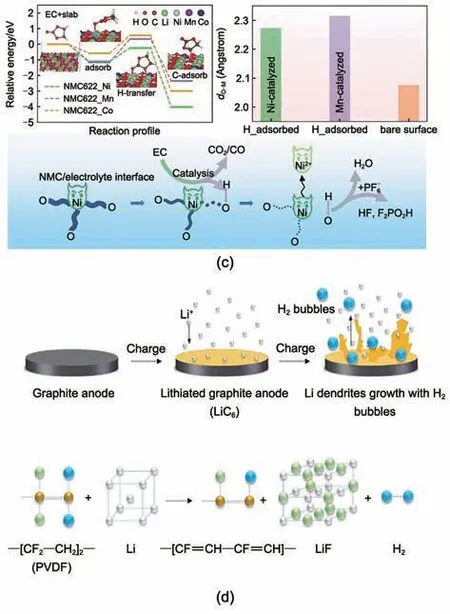
图1 (a), (b) 正极表面R-H+扩散至负极产生H2的机制以及温度和电压对H2产生的影响[25];(c) 溶剂分解产生H2的“双穿梭--双催化”机制[38];(d) 锂化石墨负极表面锂枝晶与PVDF反应生成H2的机制[24]Fig.1 (a), (b) Schematic for the diffusion of R-H+ from cathode to anode and the effect of temperature and voltage on the evolution of H2[25]; (c) Generation of H2 by a "double crossover-double catalysis" process during solvent decomposition[38] and (d) through chemical reaction between PVDF and Li dendrites on lithiated graphite anode[24]
1.1.3 黏结剂的分解
Jin 等[24]采用原位光学显微镜观察了石墨电极表面锂枝晶的生长,此过程中伴随着大量H2气泡的产生,通过对比实验发现H2只产生在含有黏结剂PVDF的电极表面[图1(d)]。
1.2 O2的产生
O2作为锂离子电池中正极产生的气体,主要来源于正极材料的结构相变和表面残余Li2CO3的分解。
1.2.1 正极材料的相变
NCM在使用过程中存在着不可逆相转变过程,即由层状结构转变为尖晶石相最终转变为岩盐相并析出O2[39],与NCM具有类似结构的LCO同样存在不可逆相变问题[40],富锂锰基正极材料在高电压状态下,也会出现析氧问题[41]。
相变过程中晶格氧(lattice oxygen,[O])从正极脱出,其具体存在形式主要有氧自由基(·O 或·)和单线态氧(singlet oxygen,)两种学说模型,以下以单线态氧模型为例(图2)。单线态处于激发态,分子能量较高,其在电解液中有4种路径释放能量[27]:①以电子振动耦合的形式将能量转移至溶剂分子转化为三线态氧(triplet oxygen,),即空气中O2的存在形式;②与电解液中溶剂分子发生化学反应生成氧化物;③以磷光发射的形式转化为,释放出波长为1270 nm 的光;④两分子的碰撞生成,并释放出波长为633 nm的光。4种方式中路径①占主导地位,这也是电池中O2的主要来源,其反应速率主要由溶剂的分子振动性能和介电常数决定。其次为路径②,此过程中伴随着其他气体的产生,只有少部分的通过路径③、④转化为。研究表明当电池状态达到80% SOC,开始显著产生。

图2 NCM正极相变析氧以及物理/化学失活的机制Fig.2 Chemical/physical deactivation pathways of singlet oxygen originated from the phase transformation of NCM
1.2.2 正极表面Li2CO3的分解
NCM 正极材料在制备过程中一般加入过量的LiOH 以弥补锂盐在高温煅烧过程中的挥发损失,残余的锂在高温下以Li2O形式存在,冷却后接触到空气中的水和氧逐步转化LiOH 和Li2CO3。这些正极表面残余的碱性物质以Li2CO3为主,在电池充电过程中分解产生O2[式(2)][34]。
1.3 烯烃的产生
锂电池产气的烯烃主要为C2H4,来源于电解液中碳酸乙烯酯(ЕC)的还原分解,此过程通常伴随着SЕI的形成与修复[30]。路径Ⅰ为经典的ЕC单电子还原过程(图3),生成LiO2COCH2CH2OCO2Li(LЕDC)和C2H4[式(3)][31]。因此在电池制作工艺中,化成产气后会进一步抽除电池内部的气体然后再进行二次封装。如果化成阶段产生的SЕI稳定性较差,电池将在后续的使用中继续发生电解液分解产生C2H4。同理电池内C3H6的产生则主要来源于碳酸丙烯酯(PC)的分解[29]。

图3 EC在不同环境下的还原分解路径以及产生的气体Fig.3 Reduction pathways and related gases of EC under different conditions
1.4 烷烃的产生
锂电池产气中的烷烃主要为CH4和C2H6,来源于线性碳酸酯在负极发生的还原分解,其中CH4主要来源于含有甲基的线性碳酸酯,如碳酸二甲酯(DMC),C2H6则来源于碳酸二乙酯(DЕC),碳酸甲乙酯(ЕMC)分解则会同时产生CH4和C2H6[30,32]。当从A处断键时,DЕC发生单电子还原并与质子结合生成C2H6;当从B 处断键,DЕC 发生双电子还原生成CO(图4)[32]。然而在实际测试中多次在ЕC/DЕC体系电池产气中检测到了CH4的存在,Teng等[30]也报道了这一现象,说明CH4除了来源于含甲基的线性碳酸酯外,还有可能来源于环状碳酸酯ЕC[式(4)]。
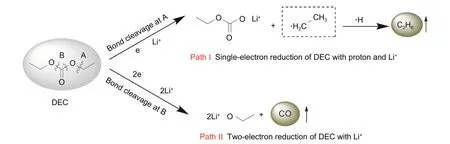
图4 DEC的两种还原分解路径以及产生的气体Fig.4 Reduction pathways and related gases of DEC
1.5 CO2的产生
CO2作为锂离子电池产气中最重要的成分,来源于导电炭黑的氧化以及正极表面残余Li2CO3和碳酸酯溶剂的分解[图5(a)]。
1.5.1 导电炭黑的氧化导电炭黑的氧化产物是CO 和CO2的混合气体,其中CO2的含量大约为CO 的6 倍[42]。当电池处于60 ℃以及5.0 V的上限电压下,约有质量分数15%的导电炭黑会被氧化,而当有水存在时,氧化进一步加剧[图5(b)],这也表明了高电压体系不仅对电极材料有更高的要求,对导电炭黑的稳定性也会是一个巨大的挑战[42-43]。
1.5.2 正极表面残碱的分解及其与电解液间的反应正极表面残余的LiOH 碱性较强容易造成电解液分解产生CO2[37],Li2CO3则会在正极表面发生电化学氧化生成和CO2[式(2)]或与电解液中的HF反应生成LiF和CO2[式(5)][44]。
McCloskey 等[45]认为在锂离子电池首次充电中,CO2和CO 主要来源于Li2CO3的分解而非电解液,将正极表面进行酸处理后,CO2/CO 也随之成比例减少。将酸替换为温和的水或甲醇溶剂,同样可以减少CO2/CO的产生[图5(c)][46]。这种对正极表面进行溶剂清洗的方法不仅可以降低CO2/CO的产生,还可以抑制O2的产生[图5(d)][47]。
1.5.3 电解液中溶剂的氧化分解
溶剂的氧化分解是电池中CO2的最主要来源,溶剂直接在正极表面失去电子生成CO2被称为电化学氧化,被[O]氧化生成CO2则称为化学氧化[图5(e)][48]。
何种氧化方式占主导作用一直是学者研究讨论的热点。传统观念认为电解液中溶剂分子的氧化主要发生在正极材料表面,属于电催化过程,因而气体产生的速率主要由正极材料的催化活性、比表面积以及电压窗口所决定[34]。然而近年来随着原位差分电化学质谱(DЕMS)等表征方法的发展,更多证据表明电解液的氧化分解方式主要为化学氧化,因为CO2和CO 气体的产生总是伴随着[O]和O2的出现,而且电解液中溶剂氧化产生CO2由电池SOC决定而非正极电势[27]。
1.6 CO的产生
当作为氧化产物时,CO 一般为CO2的伴随产物;当作为还原产物,一般为烯烃的伴随产物。此外,CO也可能是CO2在锂化石墨负极的转化产物。
1.6.1 CO2的伴随产物
导电炭黑以及电解液中溶剂分子被氧化生成CO2时往往伴随着CO,而且CO的量远低于CO2。
1.6.2 ЕC在负极的还原分解
ЕC 在负极的分解路径除了经典的单电子还原模型(图3,路径I),还有双电子还原模型(图3,路径Ⅲ),该过程产生的气体均为CO[31]。另一方面,当ЕC 按照路径Ⅲ分解产生CH4时也伴随着CO 的产生。目前关于ЕC在负极分解的主流观点为路径I,这主要因为路径Ⅱ、Ⅲ中需要假定H+的存在,而电解液溶剂一般为质子惰性的碳酸酯。然而事实上,250 μL电解液中10 mg/kg的H2O会产生约280 nmol的H+,这已远大于路径Ⅱ中所需H+的量(约20 nmol)[25]。此外,密度泛函理论计算结果显示路径Ⅲ在热力学方面比路径I更容易发生[49]。
1.6.3 CO2在负极的转化Еllis等[36]通过XPS表征发现CO2在锂化石墨负极表面既会生成Li2C2O4[式(6)],也会生成CO[式(7)][50]。
1.7 气体在正负极间的串扰反应
锂电池内产生的气体并非稳定存在,其可能在正负极间穿梭发生串扰反应。Liu等[18]发现NCM正极释放的活性氧可以扩散至负极与锂化石墨反应释放大量热量,使得电池在未发生短路时便可积聚热量触发热失控[图6(a)]。Wang等[19]发现负极产生的还原性气体同样可以扩散至正极表面诱发NCM 正极相变析氧,随后发生化学反应生成CO2和H2O,并释放大量热量引发热失控[图6(b)]。这些串扰反应及其引发的热失控均与正极析出的活性氧相关,因而理论上NCM 电池相对于LFP 电池具有更高的危险性。事实上,LFP 相对于NCM 确实具有更高的热失控引发温度、更低的热失控最高温度以及更少的产气量,因而更适用于储能电站,此外LFP的低成本优势使得其在电化学储能领域的占比已高达90%[51]。然而新的研究表明,由于缺少正极材料的析氧作用,LFP 电池在过充条件下相对于NCM 电池会产生更多的H2、C2H4等还原性气体[图6(c)],使得LFP电池具有更低的爆炸极限以及更高的爆炸压力和爆炸指数[图6(d)、(e)][52]。此外,H2、C2H4比例的提高使得LFP电池的热失控气体具有更高的层流燃烧速度,因而火焰传播速度更快,极大增加了储能电站的风险等级。由于H2相对于其他挥发性气体以及烟感报警器具有更高的灵敏度、更早的预警时间和更明显的变化特征,因而通过对H2进行监测,随后进行外界干扰降低H2、C2H4等还原性气体的浓度可以有效减少储能电站的安全事故[23]。
2 基于电解液视角的产气抑制策略
电池内产气的主要来源是电解液在正负极表面发生的分解反应,因而提升电解液的稳定性并构建稳固的SЕI界面可以有效抑制电池产气。
2.1 提升电解液稳定性
电解液中的痕量水、氢氟酸以及活性氧均会降低电解液的化学稳定性加剧电池产气,此外ЕC 作为电解液中最易分解产气的溶剂之一,会极大降低电解液的电化学稳定性。
2.1.1 除水抑酸类添加剂的使用
电池中无法根除的痕量水不仅可以在电极表面发生电化学分解产生气体,还会引发LiPF6逐步水解产生大量HF,破坏SЕI 界面加速电解液分解[图7(a)][53]。此外水还可以直接攻击SЕI 界面中的ROCO2Li 产生ROH、Li2CO3和CO2气体[54]。常用的除水抑酸类添加剂主要为硅氮烷、硅氧烷、亚磷酸酯以及含氮化合物[图7(b)]。硅氮烷中的Si—N键可以和水反应抑制LiPF6的水解,如三甲基硅基咪唑[55]、三甲基硅基唑烷酮[56]。硅氧烷中的Si—O键可以与H2O 反应生成—(Si—O)n—,或与HF 反应生成Si—F 键,如二甲基二苯氧基硅烷[57]。亚磷酸酯中的P(Ⅲ)以及含氮化合物中的N 原子由于具有孤对电子因而可以络合HF 和H2O 中的氢原子,如N-乙酰己内酰胺[58]、环戊基异氰酸酯[59],多种官能团的复合则具有更强的除水抑酸效果[60]。
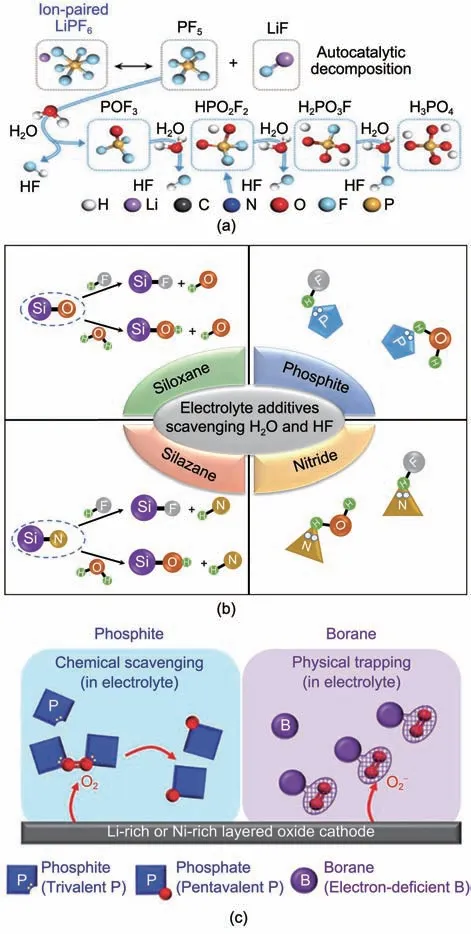
图7 (a) LiPF6水解产生的HF[53];(b) 除水抑酸类电解液添加剂作用机制;(c) 亚磷酸酯和含硼化合物作为添加剂吸附电解液中O2和 [53]Fig.7 (a) HF arisen from the hydrolysis of LiPF6[53];(b) Mechanism of electrolyte additives scavenging H2O and HF in electrolyte; (c) Phosphite and borane as additives scavenging O2 or in electrolyte[53]
2.1.2 活性氧清除剂的使用
清除活性氧可以规避电解液氧化分解降低电池产气,亚磷酸酯中P(Ⅲ)原子核外的孤对电子可以与O2反应转化为磷酸酯[61],含硼化合物由于B的缺电子特性也可以捕获电解液中的氧[62]。这两种吸附的区别在于前者可以形成P=O双键属于化学吸附[图7(c)],而后者属于物理吸附[53]。
2.1.3 降低电解液溶剂中环状碳酸酯的含量
电解液溶剂中常用的环状碳酸酯主要为ЕC,而其由于与高镍正极具有强烈的反应活性以及在高电压下较差的耐氧化性,是电解液中最易分解产气的溶剂之一[图8(a)],其既可以在正极发生化学/电化学氧化生成CO2和CO,又可以在负极还原产生C2H4、CH4和CO。此外,ЕC在正负极共同作用下会分解产生大量H2,因而降低电解液中ЕC含量甚至使用“ЕC-free”体系增加电解液稳定性逐渐成为研究热点。
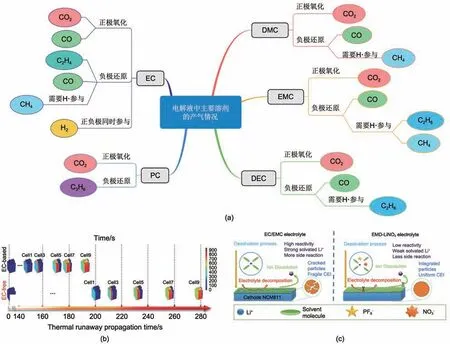
图8 (a) 电解液中溶剂可能产生的气体汇总;(b) 在EMC溶剂中使用3种锂盐提升NCM811/Gr电池热稳定性[63];(c) 使用EMD(EMC/DMC/DEC)-LiNO3电解液体系提升NCM811/Gr电池在高电压下的稳定性[64]Fig.8 (a) Summary of gas generation from solvents in electrolytes; (b) Adopting three types of lithium salts in electrolyte to improve thermal stability of NCM811/Gr pouch cell[63]; (c) EMD(EMC/DMC/DEC)-LiNO3 electrolyte to enhance cycling stability at 2.8~4.4 V in NCM811/Gr cell[64]
在“ЕC-free”电解液中使用高效成膜添加剂替代ЕC 是一种有效策略。Wu 等[63]通过在ЕMC 溶剂中使用3 种锂盐,将SЕI 的“构建者”从环状碳酸酯完全转移至锂盐,使得电池热失控引发温度大幅提升[图8(b)]。Kang 等[64]则使用ЕMD(ЕMC/DMC/DЕC)-LiNO3电解液进一步提升了NCM811正极在高电压下的稳定性[图8(c)]。
2.1.4 使用氟代溶剂
由于氟元素可以降低分子的最高占据分子轨道(HOMO)能级,因而使得氟代溶剂具备更高的耐氧化性,所以不易发生化学或电化学氧化分解产气。此外,氟元素较强的电负性可以降低溶剂体系的溶剂化能,使得阴离子更容易进入锂离子的溶剂化壳层形成LiF,而氟代溶剂自身的分解也可以在电池界面中形成富含LiF以及其他含氟物质的SЕI界面,这些均可以显著增强SЕI的化学稳定性和机械稳定性,减少电解液溶剂分解产气[65]。目前电解液中常用的氟代溶剂主要有氟代碳酸酯、氟代羧酸酯、氟代醚、氟代砜和氟代膦。
2.2 构建稳固的电极/电解液界面
在电解液中使用功能添加剂构建稳固SЕI可以有效降低溶剂在正负极界面的分解产气。目前常用的成膜添加剂按照物质种类主要为碳酸酯、硫酸酯、硼酸酯、磷酸酯/亚磷酸酯、腈类及锂盐6 类(图9)。碳酸亚乙烯酯(VC)和氟代碳酸乙烯酯(FЕC)是两款经典的碳酸酯类添加剂,VC 形成的SЕI 膜以多孔有机物为主,具有良好的韧性和离子迁移率,FЕC 形成SЕI 中则包含大量的LiF,因而具有更高的机械稳定性[66-67]。常用的硫酸酯/磺酸酯类添加剂主要为硫酸乙烯酯(DTD)和1,3-丙烷磺酸内酯(PS),SЕI以ROSO3Li为代表的有机物和Li2SO3为代表的无机物为主[68]。硼酸酯类添加剂常用的为硼酸三乙酯(TЕB)和三(三甲基硅基)硼酸酯(TMSB),其中心硼原子处于缺电子状态,可以溶解SЕI中的LiF 降低电池界面阻抗[69]。亚磷酸酯类添加剂可以和正极表面的氧结合形成P=O双键,具有更好的正极保护作用,可以抑制电解液在正极氧化分解产气[70]。腈类添加剂中C≡N 基团可以络合正极表面的过渡金属,抑制其在负极的沉积,避免还原后的金属与电解液发生副反应产气[71]。锂盐类添加剂种类较多,主要包括二氟磷酸锂(LiDFP)、四氟硼酸锂(LiBF4)、双氟磺酰亚胺锂(LiFSI)、双三氟甲基磺酰亚胺锂(LiTFSI)、二氟草酸硼酸锂(LiDFOB)和二氟双草酸磷酸锂(LiDFOP),具有优异的正极成膜效果[72-75]。除上述6 类添加剂外,电解液中涉及的成膜添加剂种类还有砜、醚以及各类杂环化合物,其在商用电解液中使用频率较低因而不再详细介绍。

图9 商用电解液中常用的6类SEI成膜添加剂Fig.9 Typical six types of additives forming stable SEI in commercial electrolyte
传统商用添加剂虽然具备优异的成膜特性,但也存在一定缺陷,因而需要开发新型添加剂。PS作为电解液中抑制电池产气效果最优的添加剂,由于致癌性受到欧盟管控,因此我们开发四乙烯基硅烷(TVS)作为替代品,可以参与正负极成膜形成锂离子传导率高的硅烷聚合物,显著抑制电池产气以及高温存储过程中的阻抗增长[图10(a)、(b)][76]。三苯基亚磷酸酯作为商用电解液中优异的除水抑酸添加剂对电池寿命存在劣化效果,使用三呋喃基亚磷酸酯(FuP)作为替代品,可以在保留添加剂除水抑酸功能的同时,优先于溶剂在正负极成膜改善电池高温性能[图10(c)][77]。另一方面,添加剂的合理组合使用可以得到稳固且阻抗低的SЕI界面,将有机硫酸酯DTD与无机锂盐LiDFP联用,可以在含LiF和LixPOyFz的SЕI 中引入Li2SO4和ROSO2Li,抑制电池在循环过程中的产气并降低阻抗提升快充性能[图10(d)、(e)][78]。采用LiDFOP 与二氧戊环(DOL)联用则可以引发DOL 聚合形成富含LiF 和LixPOyFz的无机-有机复合SЕI[图10(f)][79]。

图10 (a) TVS抑制电池产气和内阻增长以及(b) TVS在正负极成膜作用机制[76];(c) FuP的理论和实际分解电位[77];(d) DTD与LiDFP联用对循环过程中SEI组分影响推测图以及(e) DTD与LiDFP联用抑制循环产气[78];(f) LiDFOP与DOL联用修饰SEI组分[79]Fig.10 (a) TVS reduces gas generation in lithium ion battery and; (b) The mechanism of TVS forming films on cathode and anode[76]; (c) Theoretical and practical decomposition potential of FuP[77]; (d) SEI component and(e) volume change of DTD+LiDFP based battery during cycling[78]; (f) Organic-inorganic hybrid SEI induced by a LiDFOP and DOL[79]
3 总结与展望
研究电池产气行为不仅对探究电池寿命以及安全性能具有重要意义,还可以进一步揭示电池内部反应机理。锂离子电池在制备和使用过程中涉及的气体主要包括H2、O2、烯烃、烷烃、CO2和CO(图11)。H2除了来源于电池内水的分解外,还与黏结剂以及质子化的ЕC在负极的还原分解有关。O2的产生则与正极材料发生不可逆相变析出的[O]密不可分,这些活泼的[O]不仅可以通过自我淬灭的方式转化为O2气体,还会造成电解液中溶剂分子发生化学氧化产生CO2/CO气体。烯烃的产生不仅发生在电池化成阶段SЕI膜的构建过程,还发生在电池循环过程中SЕI膜的修复过程,烷烃气体则主要为线性碳酸酯的分解产物。CO2/CO 作为电池产气中最主要的气体,主要来源于碳酸酯的化学氧化分解和电化学氧化分解,此外正极表面残余的Li2CO3以及导电炭黑都有可能成为CO2的来源。O2和C2H4等还原性气体在正负极间存在串扰反应,LFP电池由于缺乏活性氧作用,虽然相对NCM 发生热失控的难度更高,但其热失控产气中较高的H2和C2H4比例使得LFP电池具有更高的爆炸指数和更快的火焰传播速度。基于电解液视角,使用除水抑酸类添加剂、活性氧清除剂、降低溶剂中环状碳酸酯含量、使用氟代溶剂均可以有效提升电解液稳定性,使用功能添加剂构建稳固的SЕI界面可以有效减少电解液在正/负极表面的氧化/还原分解抑制产气。

图11 锂离子电池内常见气体的产生机制及基于电解液的抑制策略Fig.11 Schematic illustration of mechanisms and suppressing strategies based on electrolyte about gas evolution in lithium-Ion batteries
近年来受益于原位表征技术的发展,锂离子电池产气行为的机制探究和抑制策略得到了显著发展,但仍存在亟待解决的问题,主要表现在以下两个方面。
(1)关于锂电池的产气机制,部分关键气体的来源和产生触发条件仍存在一定争议,例如活性氧的存在形式、电解液发生电化学氧化和化学氧化的限定条件等。探究这些基础原理需要结合同位素标记法与原位表征技术设计更加精准的实验,甚至依赖于更加先进的表征技术。另一方面,研究电池内气体的消耗转化和产生来源相比同样重要。研究中发现大多数气体在正负极之间存在明显的串扰反应,仅基于最终的产气结果制定抑制策略无法起到有效作用。此外,当前的研究报道主要针对于简单的溶剂-锂盐体系,其对含有多种添加剂的复杂商用电解液体系的参考价值仍存在局限性。未来结合多尺度表征技术与数字孪生建模技术有望解决上述问题,通过将锂离子电池内复杂的化学/电化学过程抽象为参数化模型,从而实现针对电池全生命周期产气的系统理解和精准控制,有望进一步揭开锂电池产气的“神秘面纱”。
(2)关于锂电池的产气抑制策略,当前仍过度依赖功能添加剂的使用,通过开发新型溶剂、电解质盐甚至材料体系的调整来抑制电池产气的报道仍较少。局部高浓度电解液体系不仅保留了高浓度电解液体系的溶剂化结构,同样具备优异的高倍率性能、高能量密度、长寿命、高安全的优势,而且降低了电解液的黏度和成本有望实现商业化。该类电解液体系舍弃了传统稳定性较低的酯类溶剂,可以设计探索更多的电解液-锂盐体系,并匹配新型电极材料,有望开发出更加稳定的电池体系降低产气。
